Антибактериальный иммунитет механизмы врожденного и адаптивного иммунитета

Общие положения
Определение 1
Врожденный, или неспецифический иммунитет является более ранним механизмом защиты организма, как по времени ответа, так и в эволюционном плане.
Иммунный ответ при врожденном иммунитете развивается в первые несколько часов или дней после контакта с патогенным антигеном. Большая часть патогенов запускают механизмы врожденного иммунитета до развития иммунного ответа с присутствием лимфоцитов.
Организм-хозяин обладает различными механизмами врожденного иммунитета, эффективность которого при повторном контакте с возбудителем инфекции не возрастает.
Основную роль в механизмах неспецифической защиты организма играют:
- система комплемента,
- первичные рецепторы для патогенов,
- фагоцитоз, интерфероны (факторы защиты от вирусов),
- пептиды-антибиотики.
Барьеры против инфекций
От внедрения болезнетворных микроорганизмов, чужеродных клеток, организм защищают:
- кожа,
- секрет слизистых оболочек,
- движение ресничек эпителия,
- смывающий эффект и антибактериальное действие выделяемых жидкостей,
- нормальная микрофлора.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Бактерия, внедрившаяся в организм, разрушается под действием лизоцима и подвергается дальнейшему фагоцитозу с последующим уничтожением фагоцитарными клетками.
К основным фагоцитарным клеткам относятся:
- полиморфноядерные нейтрофилы,
- мононуклеарные макрофаги.
Фагоцитарные клетки имеют рецепторы, способные распознавать на поверхности клеток патогенных микроорганизмов определенные молекулярные структуры. Вследствие этого фагоцит может связываться с микробной клеткой.
Компоненты микробных клеток распознают трансмембранные белки $TLR$ (Toll-подобные рецепторы. Их активация инициирует секрецию провоспалительных цитокинов.
По завершении фагоцитоза в действие вступают разнообразные бактерицидные механизмы:
- образуются реакционноспособные метаболиты кислорода;
- из гранул высвобождаются многочисленные кислород-независимые факторы;
- синтезируется оксид азота.
Привлечению фагоцитов к микробным клеткам и осуществлению фагоцитоза способствует активация по каскадному механизму многокомпонентной системы комплемента.
Комплемент выполняет ряд функций:
- микроорганизмы, покрытые белком $C_3b$, связываются с рецептором для $C_3b$ ($CR_1$) на оверхности фагоцитарных клеток, что способствует фагоцитозу;
- белок $C_5a$ оказывает активирующее и хемотаксическое воздействие на нейтрофилы, аналогично белки $C_3a$ и $C_5a$ воздействуют на эозинофилы, эти белки значительно повышают проницаемость капилляров;
- встраивание ЛМК в мембрану микробной клетки вызывает ее лизис;
- фрагмент $C_3b$ способствует продукции антител В-клетками.
Острая воспалительная реакция с участием комплемента
Активация комплемента участвует в следующих процессах:
- обеспечивает привлечение и стимуляцию нейтрофилов; приток полиморфноядерных лейкоцитов и повышение сосудистой проницаемости приводят к развитию острой воспалительной реакции, которая способна оказывать сильный антимикробный эффект;
- индуцирует экспрессию молекул адгезии на эндотелиах клетках, которые обеспечивают адгезию лейкоцитов и способствуют их проникновению между эндотелиальными клетками в очаг воспаления;
- активированные пептидом $C_5a$ фагоцитарные клетки, поглощают и уничтожают внедрившиеся в организм микробы;
- активированные пептидом $C_5a$ или компонентами микробных клеток тканевые макрофаги также могут инициировать воспаление, например, эндотоксином.
Гуморальные механизмы защиты
Гуморальные механизмы обеспечивают вторую линию защиты.
К факторам гуморальной защиты относятся:
- лизоцим;
- дефензины;
- система комплемента;
- белки острой фазы (С-реактивный белок, манносвязывающий лиганд);
- интерфероны (их регулярный эффект приводит к подавлению размножения вирусов);
- коллектины связываются с углеводными структурами на поверхности микробных клеток и с рецепторами фагоцитарных клеток, способствуя фагоцитозу.
Внеклеточное уничтожение микробов
Замечание 1
Клетки-киллеры (НК-клетки) обладают рецепторами, активирующими их цитотоксическую функцию, а также доминантными ингибиторными рецепторами, распознающими молекулы главного комплекса гистосовместимости класса I на поверхности не инфицированных и не измененных клеток.
НК-клетки разрушают инфицированные вирусами клетки. Вызывая запрограммированную клеточную гибель – апоптоз. Апоптоз может быть индуцирован или цитотоксическим эффектом перфорина и гранзимов, или взаимодействием лиганда Fas клеток-киллеров с рецептором Fas клеток-мишеней.
Внеклеточное уничтожение паразитов осуществляют эозинофилы, связываясь через свои $C_3b$-рецепторы с их поверхностью, покрытой $C_3b.$ Благодаря этому многие крупные паразиты, инвазирующие потенциально восприимчивый организм-хозяин, не вызывают заболевания.
Источник
 Противомикробный иммунитет: механизмы развития
Противомикробный иммунитет: механизмы развития
 Современная иммунология вышла из недр науки об инфекциях Immunitas (лат. ) –– свободный от чего-либо
Современная иммунология вышла из недр науки об инфекциях Immunitas (лат. ) –– свободный от чего-либо
 Развитию инфекции препятствуют две формы иммунного реагирования: — Неспецифический (врожденный) иммунитет – бактериальные свойства кожи, слизистых, фагоцитоз, NK- клетки, комплемент и т. д. – ранний этап инфекционного процесса — Специфический (адаптивный или приобретенный) иммунитет – эффекторные клетки, молекулы, иммунологическая память – второй этап инфекционного процесса
Развитию инфекции препятствуют две формы иммунного реагирования: — Неспецифический (врожденный) иммунитет – бактериальные свойства кожи, слизистых, фагоцитоз, NK- клетки, комплемент и т. д. – ранний этап инфекционного процесса — Специфический (адаптивный или приобретенный) иммунитет – эффекторные клетки, молекулы, иммунологическая память – второй этап инфекционного процесса
 Причиной инфекционных заболеваний человека могут быть : • Вирусы (ДНК- и РНК-) • Бактерии (Гр+, Гр- кокки и бациллы, спирохеты, риккетсии, хламидии, микоплазмы, микобактерии) • Грибы • Простейшие ( лейшмания, трипаносома, токсоплазма и др. ) • Гельминты паразит ыы
Причиной инфекционных заболеваний человека могут быть : • Вирусы (ДНК- и РНК-) • Бактерии (Гр+, Гр- кокки и бациллы, спирохеты, риккетсии, хламидии, микоплазмы, микобактерии) • Грибы • Простейшие ( лейшмания, трипаносома, токсоплазма и др. ) • Гельминты паразит ыы
 Преобладающие механизмы иммунного ответа против инфекций зависят от: 1. Путей поступления инфекционных агентов в организм (основное поступление через слизистые оболочки дыхательной, пищеварительной и мочеполовой систем); 2. Внутри- ( вирусы, микобактерии, большинство простейших и др. ) или внеклеточной ( большинство бактерий, грибы, крупные паразиты) локализации инфекционного агента при размножении; 3. Компонентов патогена, модифицирующих активность иммунной системы: — эндотоксин (ЛПС) — экзотоксин — пептидогликаны бактериальной стенки — компоненты микроорганизмов, влияющие на фагоцитоз 4. Особенностей антигенной структуры микроорганизмов
Преобладающие механизмы иммунного ответа против инфекций зависят от: 1. Путей поступления инфекционных агентов в организм (основное поступление через слизистые оболочки дыхательной, пищеварительной и мочеполовой систем); 2. Внутри- ( вирусы, микобактерии, большинство простейших и др. ) или внеклеточной ( большинство бактерий, грибы, крупные паразиты) локализации инфекционного агента при размножении; 3. Компонентов патогена, модифицирующих активность иммунной системы: — эндотоксин (ЛПС) — экзотоксин — пептидогликаны бактериальной стенки — компоненты микроорганизмов, влияющие на фагоцитоз 4. Особенностей антигенной структуры микроорганизмов
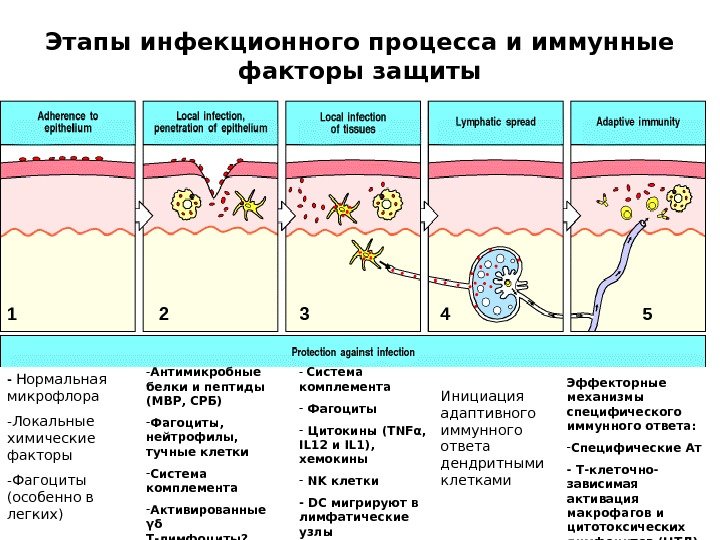 Этапы инфекционного процесса и иммунные факторы защиты — Нормальная микрофлора — Локальные химические факторы — Фагоциты (особенно в легких) — Антимикробные белки и пептиды (МВР, СРБ) — Фагоциты, нейтрофилы, тучные клетки — Система комплемента — Активированные γδ Т-лимфоциты? — Система комплемента — Фагоциты — Цитокины (TNF α , IL 12 и IL 1), хемокины — NK клетки — DC мигрируют в лимфатические узлы Инициация адаптивного иммунного ответа дендритными клетками Эффекторные механизмы специфического иммунного ответа: — Специфические Ат — Т-клеточно- зависимая активация макрофагов и цитотоксических лимфоцитов (ЦТЛ)
Этапы инфекционного процесса и иммунные факторы защиты — Нормальная микрофлора — Локальные химические факторы — Фагоциты (особенно в легких) — Антимикробные белки и пептиды (МВР, СРБ) — Фагоциты, нейтрофилы, тучные клетки — Система комплемента — Активированные γδ Т-лимфоциты? — Система комплемента — Фагоциты — Цитокины (TNF α , IL 12 и IL 1), хемокины — NK клетки — DC мигрируют в лимфатические узлы Инициация адаптивного иммунного ответа дендритными клетками Эффекторные механизмы специфического иммунного ответа: — Специфические Ат — Т-клеточно- зависимая активация макрофагов и цитотоксических лимфоцитов (ЦТЛ)
 Локализация инфекционных агентов внутри ( Th 1 — зависимый иммунный ответ ) или вне клетки ( Th 2 — зависимый иммунный ответ ) является ключевым фактором для определения типа иммунного ответа
Локализация инфекционных агентов внутри ( Th 1 — зависимый иммунный ответ ) или вне клетки ( Th 2 — зависимый иммунный ответ ) является ключевым фактором для определения типа иммунного ответа
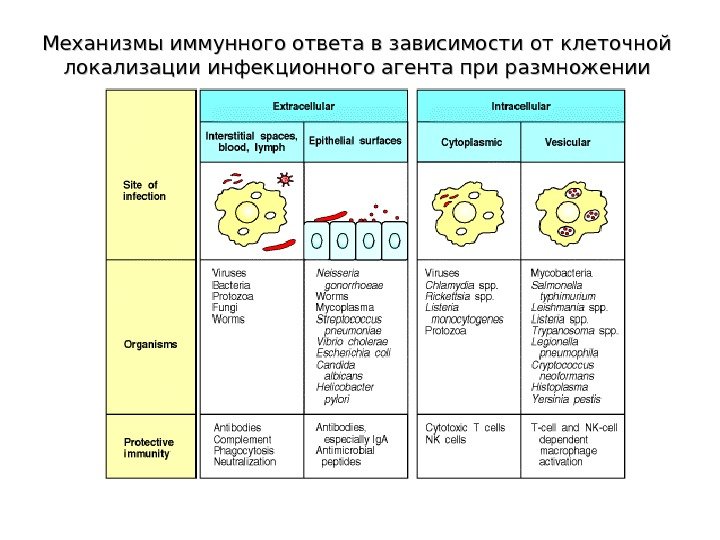 Механизмы иммунного ответа в зависимости от клеточной локализации инфекционного агента при размножении
Механизмы иммунного ответа в зависимости от клеточной локализации инфекционного агента при размножении
 Микроорганизмы способны вызывать различные заболевания, а иммунный ответ на инфекцию, в некоторых случаях, может привести к значительным тканевым повреждениям и развитию иммунно — обусловленной патологии
Микроорганизмы способны вызывать различные заболевания, а иммунный ответ на инфекцию, в некоторых случаях, может привести к значительным тканевым повреждениям и развитию иммунно — обусловленной патологии
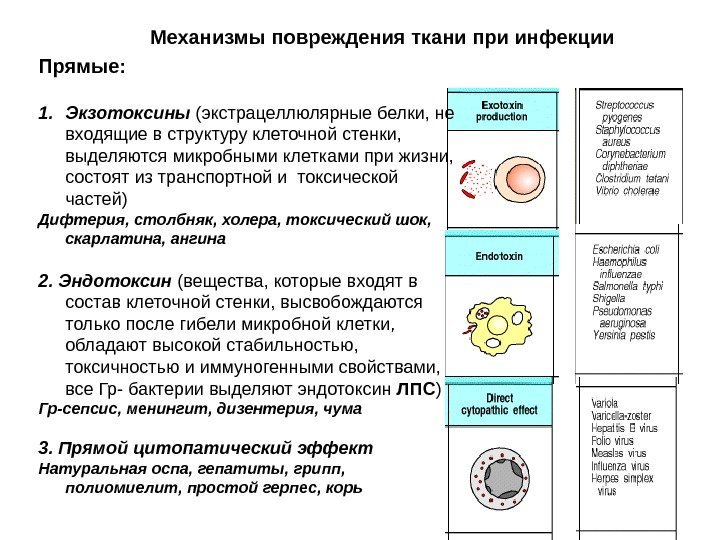 Механизмы повреждения ткани при инфекции Прямые: 1. Экзотоксины (экстрацеллюлярные белки, не входящие в структуру клеточной стенки, выделяются микробными клетками при жизни, состоят из транспортной и токсической частей) Дифтерия, столбняк, холера, токсический шок, скарлатина, ангина 2. Эндотоксин (вещества, которые входят в состав клеточной стенки, высвобождаются только после гибели микробной клетки, обладают высокой стабильностью, токсичностью и иммуногенными свойствами, все Гр- бактерии выделяют эндотоксин ЛПС ) Гр-сепсис, менингит, дизентерия, чума 3. Прямой цитопатический эффект Натуральная оспа, гепатиты, грипп, полиомиелит, простой герпес, корь
Механизмы повреждения ткани при инфекции Прямые: 1. Экзотоксины (экстрацеллюлярные белки, не входящие в структуру клеточной стенки, выделяются микробными клетками при жизни, состоят из транспортной и токсической частей) Дифтерия, столбняк, холера, токсический шок, скарлатина, ангина 2. Эндотоксин (вещества, которые входят в состав клеточной стенки, высвобождаются только после гибели микробной клетки, обладают высокой стабильностью, токсичностью и иммуногенными свойствами, все Гр- бактерии выделяют эндотоксин ЛПС ) Гр-сепсис, менингит, дизентерия, чума 3. Прямой цитопатический эффект Натуральная оспа, гепатиты, грипп, полиомиелит, простой герпес, корь
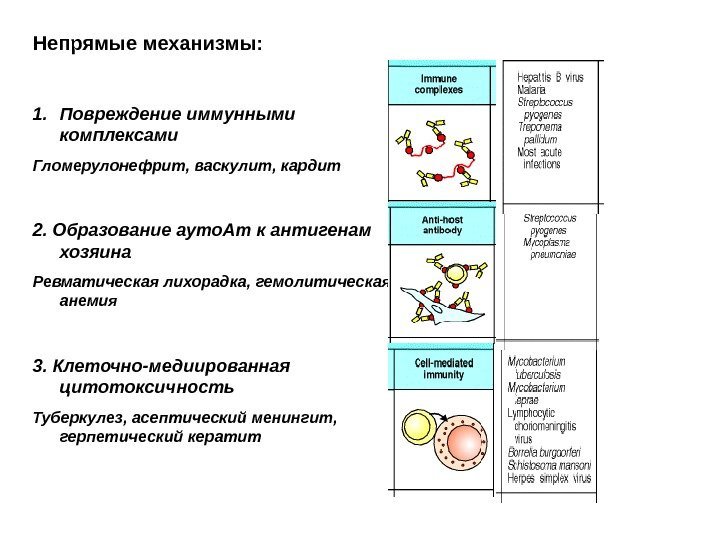 Непрямые механизмы: 1. Повреждение иммунными комплексами Гломерулонефрит, васкулит, кардит 2. Образование ауто. Ат к антигенам хозяина Ревматическая лихорадка, гемолитическая анемия 3. Клеточно-медиированная цитотоксичность Туберкулез, асептический менингит, герпетический кератит
Непрямые механизмы: 1. Повреждение иммунными комплексами Гломерулонефрит, васкулит, кардит 2. Образование ауто. Ат к антигенам хозяина Ревматическая лихорадка, гемолитическая анемия 3. Клеточно-медиированная цитотоксичность Туберкулез, асептический менингит, герпетический кератит
 Противовирусный иммунитет обусловлен своеобразием строения и биологии вируса. Участвуют гуморальные и клеточные факторы. Иммунитет направлен на нейтрализацию и удаление из организма вируса, его антигенов и зараженных вирусом клеток.
Противовирусный иммунитет обусловлен своеобразием строения и биологии вируса. Участвуют гуморальные и клеточные факторы. Иммунитет направлен на нейтрализацию и удаление из организма вируса, его антигенов и зараженных вирусом клеток.
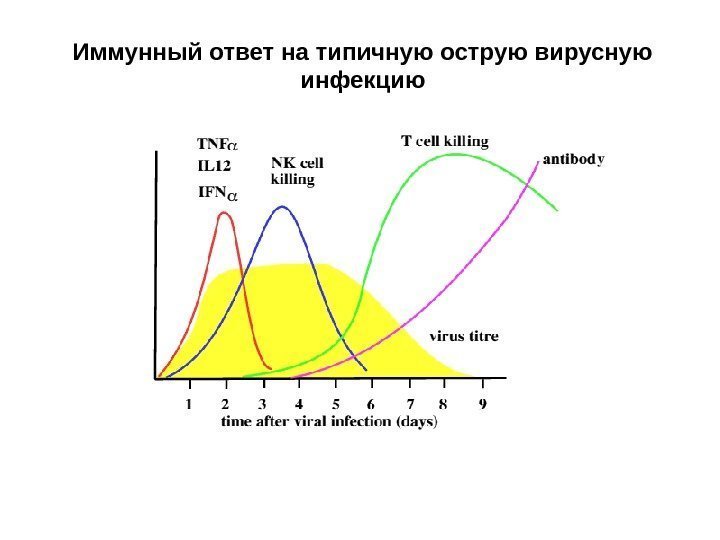 Иммунный ответ на типичную острую вирусную инфекцию
Иммунный ответ на типичную острую вирусную инфекцию
 Механизмы специфического гуморального и клеточно-медиированного иммунного ответа при вирусной инфекции Тип иммунного ответа Эффекторные молекулы или клетки Эффект Гуморальный Антитела (особенно, секреторный Ig. A) Ig. G, Ig. M, Ig. A Ig. G и Ig. M Комплемент, активированный Ig. G или Ig. M Блокируют связывание вируса с клеткой Блокируют слияние вирусной оболочки с плазматической мембраной клеток Усиливают фагоцитоз вирусных частиц (опсонизация) Агглютинируют вирусные частицы Опсонизация (С 3 b ) и лизис вирусных частиц и вирус-инфицрованных клеток (МАК)
Механизмы специфического гуморального и клеточно-медиированного иммунного ответа при вирусной инфекции Тип иммунного ответа Эффекторные молекулы или клетки Эффект Гуморальный Антитела (особенно, секреторный Ig. A) Ig. G, Ig. M, Ig. A Ig. G и Ig. M Комплемент, активированный Ig. G или Ig. M Блокируют связывание вируса с клеткой Блокируют слияние вирусной оболочки с плазматической мембраной клеток Усиливают фагоцитоз вирусных частиц (опсонизация) Агглютинируют вирусные частицы Опсонизация (С 3 b ) и лизис вирусных частиц и вирус-инфицрованных клеток (МАК)
 Выделяют 2 основные формы участия антител в развитии противовирусного иммунитета 1. Нейтрализация вируса антителами 2. Иммунный лизис инфицированной клетки с участием антител а) Комплементзависимая цитотоксичность б) АЗКЦ
Выделяют 2 основные формы участия антител в развитии противовирусного иммунитета 1. Нейтрализация вируса антителами 2. Иммунный лизис инфицированной клетки с участием антител а) Комплементзависимая цитотоксичность б) АЗКЦ
 Механизмы специфического гуморального и клеточно-медиированного иммунного ответа при вирусной инфекции Тип иммунного ответа Эффекторные молекулы или клетки Эффект Гуморальный Антитела (особенно, секреторный Ig. A) Ig. G, Ig. M, Ig. A Ig. G и Ig. M Комплемент, активированный Ig. G или Ig. M Блокируют связывание вируса с клеткой Блокируют слияние вирусной оболочки с плазматической мембраной клеток Усиливают фагоцитоз вирусных частиц (опсонизация) Агглютинируют вирусные частицы Опсонизация (С 3 b ) и лизис вирусных частиц и вирус-инфицрованных клеток (МАК) Клеточно-медии рованный IFN-γ Цитотоксические Т-лимфоциты (ЦТЛ) N К клетки и макрофаги Активирует макрофаги, повышает экспрессию МНС I и II классов, обладает прямой антивирусной активностью Уничтожают вирус-инфицированные клетки (АЗКЦ)
Механизмы специфического гуморального и клеточно-медиированного иммунного ответа при вирусной инфекции Тип иммунного ответа Эффекторные молекулы или клетки Эффект Гуморальный Антитела (особенно, секреторный Ig. A) Ig. G, Ig. M, Ig. A Ig. G и Ig. M Комплемент, активированный Ig. G или Ig. M Блокируют связывание вируса с клеткой Блокируют слияние вирусной оболочки с плазматической мембраной клеток Усиливают фагоцитоз вирусных частиц (опсонизация) Агглютинируют вирусные частицы Опсонизация (С 3 b ) и лизис вирусных частиц и вирус-инфицрованных клеток (МАК) Клеточно-медии рованный IFN-γ Цитотоксические Т-лимфоциты (ЦТЛ) N К клетки и макрофаги Активирует макрофаги, повышает экспрессию МНС I и II классов, обладает прямой антивирусной активностью Уничтожают вирус-инфицированные клетки (АЗКЦ)
 Механизмы защиты вирусов от иммунного распознавания 1. Антигенная изменчивость (ВИЧ, грипп) 2. Ингибиция интерферонов (ВЭБ, аденовирусы) 3. Ингибиция экспрессии МНС- I класса (аденовирусы, ЦМВ) 4. Синтез и выделение растворимых форм рецепторов к IL-1 β , ФНО- α и ИНФ (ВЭБ, вирус миксомы) 5. Персистенция вирусов без репликации, латентная форма (вирус простого герпеса)
Механизмы защиты вирусов от иммунного распознавания 1. Антигенная изменчивость (ВИЧ, грипп) 2. Ингибиция интерферонов (ВЭБ, аденовирусы) 3. Ингибиция экспрессии МНС- I класса (аденовирусы, ЦМВ) 4. Синтез и выделение растворимых форм рецепторов к IL-1 β , ФНО- α и ИНФ (ВЭБ, вирус миксомы) 5. Персистенция вирусов без репликации, латентная форма (вирус простого герпеса)
 Иммунопатология при вирусной инфекции 1. Образование иммунных комплексов и развитие иммунокомплексных заболеваний/осложнений (вир. гепатита В, вир. лимфоцитарного хориоменингита) 2. Цитопатический эффект вследствие реализации эффекторных функций ЦТЛ по отношению к вирус-инфицированным клеткам 3. Инфицирование клеток иммунной системы и развитие вторичных ИД (ВИЧ) 4. Индукция развития аутоиммунных заболеваний вследствие: — молекулярной мимикрии, — цитопатического эффекта, — изменение собственных антигенов вирусами и т. д.
Иммунопатология при вирусной инфекции 1. Образование иммунных комплексов и развитие иммунокомплексных заболеваний/осложнений (вир. гепатита В, вир. лимфоцитарного хориоменингита) 2. Цитопатический эффект вследствие реализации эффекторных функций ЦТЛ по отношению к вирус-инфицированным клеткам 3. Инфицирование клеток иммунной системы и развитие вторичных ИД (ВИЧ) 4. Индукция развития аутоиммунных заболеваний вследствие: — молекулярной мимикрии, — цитопатического эффекта, — изменение собственных антигенов вирусами и т. д.
 Антибактериальный иммунитет Особое значение ( для внеклеточно размножающихся бактерий – Staph. , Str. ) имеет: • Уровень циркулирующих антител (опосредованная Ат защита организма от бактериальной инфекции) • С • Функциональное состояние лейкоцитов (нейтрофилов) – фагоцитоз !!!
Антибактериальный иммунитет Особое значение ( для внеклеточно размножающихся бактерий – Staph. , Str. ) имеет: • Уровень циркулирующих антител (опосредованная Ат защита организма от бактериальной инфекции) • С • Функциональное состояние лейкоцитов (нейтрофилов) – фагоцитоз !!!
 Клеточный антибактериальный иммунитет является основой устойчивости против большой группы инфекций, возбудители которых имеют внутриклеточный путь размножения (туберкулез, сальмонеллез, туляремия и др. ). Характерно появление гранулематозных изменений в инфицированной ране и развитие ГЗТ.
Клеточный антибактериальный иммунитет является основой устойчивости против большой группы инфекций, возбудители которых имеют внутриклеточный путь размножения (туберкулез, сальмонеллез, туляремия и др. ). Характерно появление гранулематозных изменений в инфицированной ране и развитие ГЗТ.
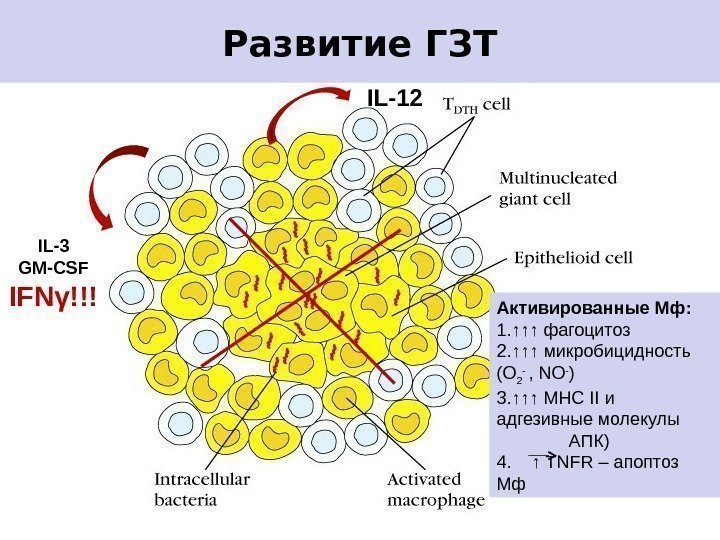 Развитие ГЗТ IL-3 GM-CSF IFN γ !!! Активированные Мф: 1. ↑↑↑ фагоцитоз 2. ↑↑↑ микробицидность (О 2 — , NO — ) 3. ↑↑↑ МНС II и адгезивные молекулы АПК) 4. ↑ TNFR – апоптоз Мф. IL-
Развитие ГЗТ IL-3 GM-CSF IFN γ !!! Активированные Мф: 1. ↑↑↑ фагоцитоз 2. ↑↑↑ микробицидность (О 2 — , NO — ) 3. ↑↑↑ МНС II и адгезивные молекулы АПК) 4. ↑ TNFR – апоптоз Мф. IL-
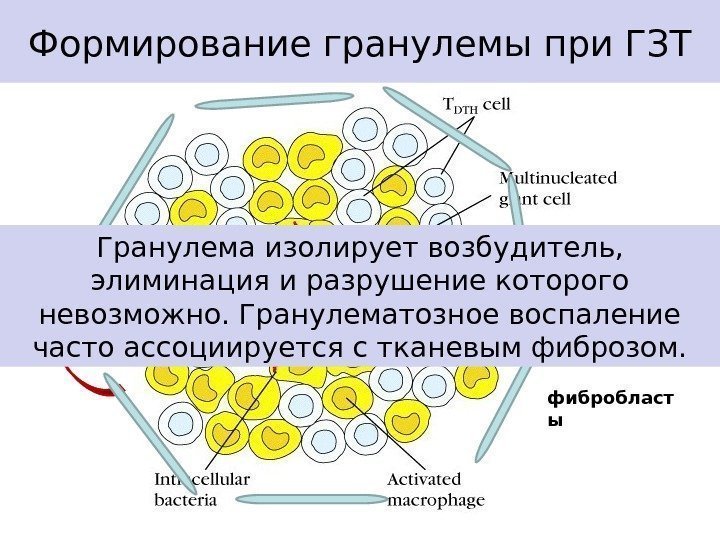 Формирование гранулемы при ГЗТ TNF- α IL-1 β фибробласт ы. Гранулема изолирует возбудитель, элиминация и разрушение которого невозможно. Гранулематозное воспаление часто ассоциируется с тканевым фиброзом.
Формирование гранулемы при ГЗТ TNF- α IL-1 β фибробласт ы. Гранулема изолирует возбудитель, элиминация и разрушение которого невозможно. Гранулематозное воспаление часто ассоциируется с тканевым фиброзом.
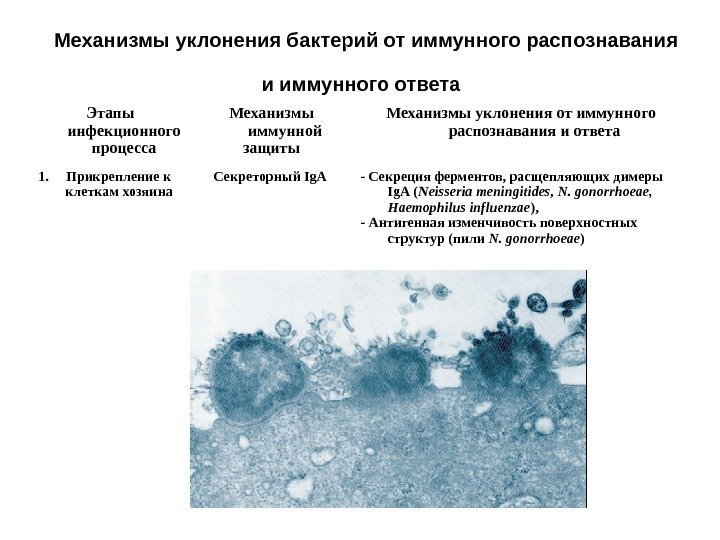 Механизмы уклонения бактерий от иммунного распознавания и иммунного ответа Этапы инфекционного процесса Механизмы иммунной защиты Механизмы уклонения от иммунного распознавания и ответа 1. Прикрепление к клеткам хозяина Секреторный Ig. A — Секреция ферментов, расщепляющих димеры Ig. A ( Neisseria meningitides , N. gonorrhoeae , Haemophilus influenzae ), — Антигенная изменчивость поверхностных структур (пили N. gonorrhoeae )
Механизмы уклонения бактерий от иммунного распознавания и иммунного ответа Этапы инфекционного процесса Механизмы иммунной защиты Механизмы уклонения от иммунного распознавания и ответа 1. Прикрепление к клеткам хозяина Секреторный Ig. A — Секреция ферментов, расщепляющих димеры Ig. A ( Neisseria meningitides , N. gonorrhoeae , Haemophilus influenzae ), — Антигенная изменчивость поверхностных структур (пили N. gonorrhoeae )
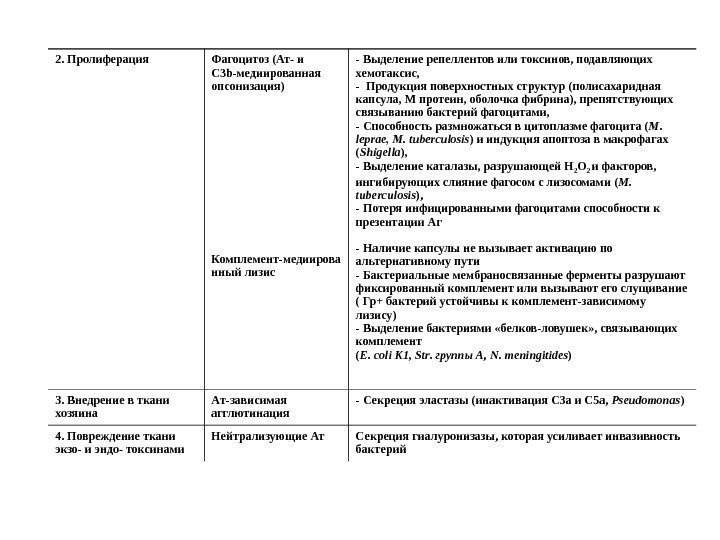 2. Пролиферация Фагоцитоз (Ат- и C 3 b -медиированная опсонизация) Комплемент-медиирова нный лизис — Выделение репеллентов или токсинов, подавляющих хемотаксис, — Продукция поверхностных структур (полисахаридная капсула, М протеин, оболочка фибрина), препятствующих связыванию бактерий фагоцитами, — Способность размножаться в цитоплазме фагоцита ( M. leprae , M. tuberculosis ) и индукция апоптоза в макрофагах ( Shigella ), — Выделение каталазы, разрушающей Н 2 О 2 и факторов, ингибирующих слияние фагосом с лизосомами ( M. tuberculosis ), — Потеря инфицированными фагоцитами способности к презентации Аг — Наличие капсулы не вызывает активацию по альтернативному пути — Бактериальные мембраносвязанные ферменты разрушают фиксированный комплемент или вызывают его слущивание ( Гр+ бактерий устойчивы к комплемент-зависимому лизису) — Выделение бактериями «белков-ловушек» , связывающих комплемент ( E. coli K 1, Str. группы А, N. meningitides ) 3. Внедрение в ткани хозяина A т-зависимая агглютинация — Секреция эластазы (инактивация С 3 а и С 5 а, Pseudomonas ) 4. Повреждение ткани экзо- и эндо- токсинами Нейтрализующие Ат Секреция гиалуронизазы, которая усиливает инвазивность бактерий
2. Пролиферация Фагоцитоз (Ат- и C 3 b -медиированная опсонизация) Комплемент-медиирова нный лизис — Выделение репеллентов или токсинов, подавляющих хемотаксис, — Продукция поверхностных структур (полисахаридная капсула, М протеин, оболочка фибрина), препятствующих связыванию бактерий фагоцитами, — Способность размножаться в цитоплазме фагоцита ( M. leprae , M. tuberculosis ) и индукция апоптоза в макрофагах ( Shigella ), — Выделение каталазы, разрушающей Н 2 О 2 и факторов, ингибирующих слияние фагосом с лизосомами ( M. tuberculosis ), — Потеря инфицированными фагоцитами способности к презентации Аг — Наличие капсулы не вызывает активацию по альтернативному пути — Бактериальные мембраносвязанные ферменты разрушают фиксированный комплемент или вызывают его слущивание ( Гр+ бактерий устойчивы к комплемент-зависимому лизису) — Выделение бактериями «белков-ловушек» , связывающих комплемент ( E. coli K 1, Str. группы А, N. meningitides ) 3. Внедрение в ткани хозяина A т-зависимая агглютинация — Секреция эластазы (инактивация С 3 а и С 5 а, Pseudomonas ) 4. Повреждение ткани экзо- и эндо- токсинами Нейтрализующие Ат Секреция гиалуронизазы, которая усиливает инвазивность бактерий
 Иммунопатология при бактериальной инфекции 1. Чрезмерный выброс цитокинов может привести к эндотоксическому шоку (ЛПС) 2. Иммунокомплексные болезни/осложнения (постстрептококковый гломерулонефрит, кардит) 3. Индукция аутоиммунных заболеваний вследствие антигенной мимикрии и кросреактивности
Иммунопатология при бактериальной инфекции 1. Чрезмерный выброс цитокинов может привести к эндотоксическому шоку (ЛПС) 2. Иммунокомплексные болезни/осложнения (постстрептококковый гломерулонефрит, кардит) 3. Индукция аутоиммунных заболеваний вследствие антигенной мимикрии и кросреактивности
 Противопаразитарный иммунитет Особенности паразитов (простейшие и гельминты): — Крупнее бактерий и вирусов с большим количеством антигенов; — Характерна антигенная изменчивость; — Паразитируют в клетках и тканях человека (кишечник, кровь, печень, селезенка, мышцы, лимфатические сосуды, внутри эритроцитов, макрофагов и т. д. )
Противопаразитарный иммунитет Особенности паразитов (простейшие и гельминты): — Крупнее бактерий и вирусов с большим количеством антигенов; — Характерна антигенная изменчивость; — Паразитируют в клетках и тканях человека (кишечник, кровь, печень, селезенка, мышцы, лимфатические сосуды, внутри эритроцитов, макрофагов и т. д. )
 Противопаразитарный иммунитет (эффекторные механизмы): 1. Врожденный иммунитет: — система комплемента (альтернативный путь), — Макрофаги: а) фагоцитоз мелких паразитов и продукция цитотоксических факторов, уничтожающих паразитов без их поглощения, б) АЗКЦ (через Ig. G и Ig. E ), в) продукция ФНО-альфа и ИЛ-1 (устойчивость гепатоцитов), — Эозинофилы – эффективны при гельминтозах (реагируют на Ig. E -зависимые реакции тучных клеток), — Нейтрофилы – уничтожают крупных и мелких паразитов
Противопаразитарный иммунитет (эффекторные механизмы): 1. Врожденный иммунитет: — система комплемента (альтернативный путь), — Макрофаги: а) фагоцитоз мелких паразитов и продукция цитотоксических факторов, уничтожающих паразитов без их поглощения, б) АЗКЦ (через Ig. G и Ig. E ), в) продукция ФНО-альфа и ИЛ-1 (устойчивость гепатоцитов), — Эозинофилы – эффективны при гельминтозах (реагируют на Ig. E -зависимые реакции тучных клеток), — Нейтрофилы – уничтожают крупных и мелких паразитов
 Противопаразитарный иммунитет (эффекторные механизмы): 2. Т – клеточный ответ – основная роль. Тип ответа варьирует в зависимости от природы паразита и стадии заболевания: — Th 1 – эффективны при внутриклеточно паразитирующих простейших, — Th 2 – эффективны при изгнании кишечных гельминтов.
Противопаразитарный иммунитет (эффекторные механизмы): 2. Т – клеточный ответ – основная роль. Тип ответа варьирует в зависимости от природы паразита и стадии заболевания: — Th 1 – эффективны при внутриклеточно паразитирующих простейших, — Th 2 – эффективны при изгнании кишечных гельминтов.
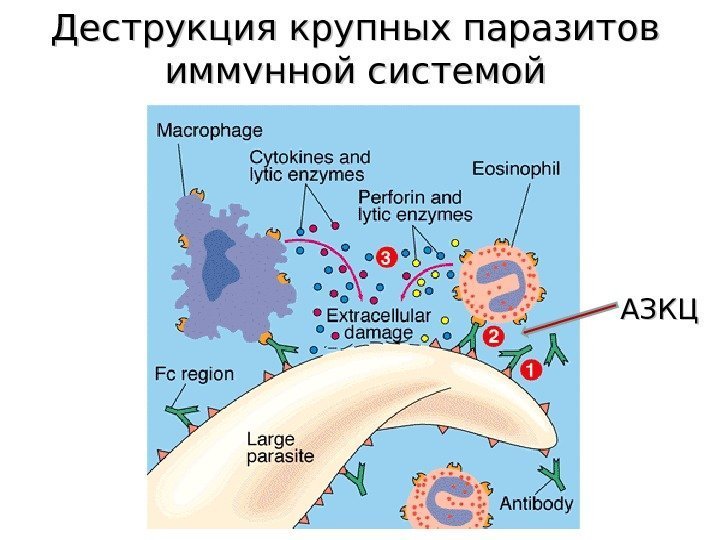 Деструкция крупных паразитов иммунной системой АЗКЦ
Деструкция крупных паразитов иммунной системой АЗКЦ
 Механизмы защиты паразитов от иммунного ответа: 1. Поверхностные гликопротеины могут инактивировать белки системы комплемента 2. Ингибирование действия лизосомальных ферментов Мф, снижение экспрессии МНС- II ( лейшмания, токсоплазма) 3. Антигенная изменчивость и маскировка (шистосомы) 4. Размножение в неблагоприятных участках организма (недоступны для клеток иммунной системы) 5. Иммуносупрессия вследствие выделения растворимых антигенов паразитов: — блокирование Ат — блокирование эффекторных клеток иммунной системы — индукция Т- и В- клеточной толерантности — неспецифическая активация Т- и В- лимфоцитов — подавление воспалительных реакций (ПГ, ИЛ-10, TGF- β )
Механизмы защиты паразитов от иммунного ответа: 1. Поверхностные гликопротеины могут инактивировать белки системы комплемента 2. Ингибирование действия лизосомальных ферментов Мф, снижение экспрессии МНС- II ( лейшмания, токсоплазма) 3. Антигенная изменчивость и маскировка (шистосомы) 4. Размножение в неблагоприятных участках организма (недоступны для клеток иммунной системы) 5. Иммуносупрессия вследствие выделения растворимых антигенов паразитов: — блокирование Ат — блокирование эффекторных клеток иммунной системы — индукция Т- и В- клеточной толерантности — неспецифическая активация Т- и В- лимфоцитов — подавление воспалительных реакций (ПГ, ИЛ-10, TGF- β )
 Иммунопатологические последствия паразитарной инфекции: 1. Увеличение органов (печень, селезенка) вследствие увеличения количества макрофагов (малярия, трипаносомы, лейшманиоз) 2. Иммунокомплексные осложнения 3. Увеличение Ig. E при гельминтозах служит причиной тяжелых последствий для организма хозяина в результате высвобождения медиаторов тучных клеток 4. Образование ауто. Ат (эритроциты, лимфоциты, ДНК) 5. Повышение чувствительности в бактериальным и вирусным инфекциям
Иммунопатологические последствия паразитарной инфекции: 1. Увеличение органов (печень, селезенка) вследствие увеличения количества макрофагов (малярия, трипаносомы, лейшманиоз) 2. Иммунокомплексные осложнения 3. Увеличение Ig. E при гельминтозах служит причиной тяжелых последствий для организма хозяина в результате высвобождения медиаторов тучных клеток 4. Образование ауто. Ат (эритроциты, лимфоциты, ДНК) 5. Повышение чувствительности в бактериальным и вирусным инфекциям
Источник
Глава 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Иммунитет — особое биологическое свойство многоклеточных организмов, направленное на защиту от генетически чужеродных факторов: микроорганизмов (бактерий, вирусов, простейших, грибов), инородных молекул и др. Иммунитет также обеспечивает невосприимчивость организма к инфекции при повторной встрече с патогеном. В медицинском смысле этот термин употребляли ещё до нашей эры в значениях: неприкосновенный, чистый, не затронутый заболеванием, невредимый, находящийся под хорошей защитой, устойчивый к заразной болезни.
Совокупность органных, тканевых, клеточных и молекулярных компонентов, функцией которых является осуществление иммунной защиты, называется иммунной системой. Иммунология — наука о строении и функциях иммунной системы как в норме, так и при различных патологических состояниях, в том числе и при нарушениях самой иммунной системы — иммунопатологиях.
Иммунную защиту обеспечивают два механизма: врождённый и адаптивный.
Врождённый иммунитет является присущей каждому организму с рождения, генетически закреплённой способностью противостоять инфекции. Это передовая линия обороны организма против патогенов, пытающихся проникнуть или уже проникших в покровные ткани или внутреннюю среду. Врождённый иммунитет срабатывает мгновенно или в течение первых нескольких часов после контакта с патогеном (возбудители, выделяемые ими токсины и другие чужеродные молекулы). Он включает четыре основных уровня защиты: анатомический, физиологический, фагоцитарный и воспалительный — покровные ткани, фагоциты, микробоцидные гуморальные вещества (протеазы, сильные окислители и свободные радикалы, продуцируемые фагоцитами, эндогенные противомикробные пептиды и др.), сосудистые реакции. Первичные рецепторы врождённого иммунитета — это молекулы многоклеточных, позволяющие «считывать» эволюционную память — информацию о том, чем отличаются микроорганизмы от собственных клеток.
Эти рецепторы способны распознавать консервативные молекулярные структуры — РАМР (Pathogen-Associated Molecular Patterns), характерные для групп сходных микроорганизмов. В настоящее время постоянно открывают новые патогенраспознающие рецепторы врождённого иммунитета. К ним относят мембраносвязанные паттернраспознающие рецепторы (Pattern Recognition Receptors, PRR), а также растворимые рецепторы — ряд белков сыворотки крови: C-реактивный белок (СРБ), маннозосвязывающий лектин (MBL — Mannose-Binding Lectin), компоненты комплемента.
Собственные возможности клеток врождённого иммунитета санировать организм от проникшего патогена часто недостаточны. Множество патогенов приспособилось выживать в присутствии факторов врождённой резистентности к инфекциям. Именно поэтому в процессе эволюции, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный иммунитет — специфический. Материальные носители адаптивного иммунитета — лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток — способность распознавать почти неограниченное (1018) разнообразие молекулярных объектов — антигенов. Лимфоциты характеризуются экспрессией Т-клеточных (TCR) или В-клеточных (BCR) рецепторов, распознающих только одну антигенную детерминанту либо небольшое число структурно очень близких детерминант, и поэтому, в отличие от PRR, обладающих высокой специфичностью (рис. 1-1).
Адаптивный (приобретённый) иммунитет формируется в течение жизни индивидуума. Активно приобретённый иммунитет — состояние невосприимчивости к инфекции после перенесённого инфекционного заболевания или после вакцинации (сам организм вырабатывает соответствующие антитела). Пассивно приобретённый иммунитет — состояние невосприимчивости к инфекции в результате поступления в организм уже готовых антител от матери или в результате инъекции (сам организм эти антитела не вырабатывает).
ИММУННЫЙ ОТВЕТ
Врождённая и адаптивная системы защиты организма включают клеточный и гуморальный компоненты и активно взаимодействуют друг с другом в процессе иммунного ответа. Иммунный ответ — многоэтапный процесс, заключающийся в распознавании и деструкции патогена и повреждённых им тканей. В его основе лежит уникальное свойство иммун-

Рис. 1-1. Сравнение врождённого и адаптивного иммунитета
ной системы отличать «свое» («sef») от «чужого» («nonself») и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно — иммунные реакции. Распознавание множества чужеродных антигенов происходит благодаря наличию в организме огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов главного комплекса гистосовместимости (MHC) классов I и II. Нейтрализацию «чужого» осуществляют цирку-
лирующие в жидкостях организма антитела (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет).
Таким образом, основными характеристиками адаптивного иммунного ответа являются умение различать собственные антигены от чужеродных, специфичность и иммунная память.
• Различение «своего» и «чужого» выражается в дифференциации компонентов собственных тканей организма и чужеродных молекул. Специфическую неотвечаемость организма на собственные антигены обозначают как иммунную толерантность. Если же организм воспринимает собственные компоненты как чужеродные, развивается аутоиммунный ответ.
• Специфичность иммунного ответа проявляется в том, что иммунитет, сформировавшийся в результате контакта с определённым антигеном, будет обеспечивать защиту только против этого антигена.
• Иммунная память формируется в результате адаптивного иммунного ответа против конкретного возбудителя и сохраняется, как правило, в течение всей последующей жизни организма, защищая его от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к «запоминанию» антигенных детерминант патогена за счёт образования клеток иммунной памяти. Наличие иммунной памяти обусловливает развитие ускоренного и усиленного ответа (вторичный иммунный ответ) при повторном контакте с антигеном. Формирование иммунной памяти является основной целью вакцинации, т.е. процесса естественного или искусственного формирования иммунной защиты против определённой инфекции.
Схема развития иммунного ответа представлена на рис. 1-2. Содержание отдельных этапов иммунного ответа раскрыто ниже.
• Воспаление: участвуют клетки, поглощающие антигены (фагоциты, антигенпрезентирующие клетки) — в частности, дендритные клетки (ДК), макрофаги, эндотелиальные и другие клетки. Выделяются провоспалительные цитокины и хемокины.
• Переработка антигена (процессинг). После поглощения антигена антигенпрезентирующей клеткой (АПК) происходит его процессинг (расщепление и встраивание в молекулы MHC) и презентация на поверхности клетки. Это необходимо для распознавания антигена Т-лимфоцитами.
• Распознавание антигена происходит в периферических лимфоидных органах. Начало специфического иммунного ответа — про-

