Антиэндотоксиновый иммунитет что это такое
Копаенко А.И., к. мед. н.
Крымский государственный медицинский университет им. С.И. Георгиевского, Симферополь, УкраинаПередние эндогенные увеиты (иридоциклиты) часто приводят к нетрудоспособности и безвозвратной потери зрения у больных молодого трудоспособного возраста [8, 13]. Причем для воспаления переднего сегмента глаза довольно типично вторичное повышение внутриглазного давления (ВГД), которое обычно развивается в связи с блокадой каналов трабекулярного оттока воспалительным детритом [9]. По современным данным большинство передних увеитов составляют: инициированные воздействием вирусов (прежде всего герпетической группы), HLA-B27-ассоциированные (развиваются у больных с серонегативным спондилоартритом) и невыясненной этиологии [3, 7, 13]. В настоящее время некоторыми учеными отмечается роль грамотрицательной кишечной микрофлоры в патогенезе воспалительных заболеваний глаза [2, 3].
Клинические проявления воспалительных процессов, вызываемых грамотрицательной микрофлорой, связаны с наличием у этой группы микроорганизмов особой высокомолекулярной субстанции, локализующейся в клеточной стенке и называемой липополисахаридом (ЛПС) или эндотоксином. ЛПС обладает исключительно высокой биологической активностью и относится к числу наиболее сильных экзогенных модуляторов иммунологической реактивности. Посредством индукции синтеза широкого спектра провоспалительных медиаторов клетками миеломоноцитарного ряда, ЛПС может воздействовать практически на все ткани и системы организма. Вследствие прямой или непрямой ЛПС-зависимой активации эндотелиоциты сосудов резко повышают уровень продукции молекул межклеточной адгезии, колониестимулирующих/ростовых факторов, цитокинов и хемоаттрактантов. [2, 11]. Экспериментальные исследования зарубежных ученых свидетельствуют о том, что эндотоксин хорошо проникает через гематоофтальмический барьер [12].
В нейтрализации биологической активности и клиренсе ЛПС существенную роль играют естественные антиэндотоксиновые антитела. Очевидно, что относительное содержание сывороточных антиэндотоксиновых антител разных классов у больных увеитами, во-первых, будет характеризовать протективный потенциал гуморального звена иммунитета по отношению к ЛПС, и, во-вторых, указывать на интенсивность транслокации ЛПС из кишечника [10]. ЛПС-связывающие рецепторы нейтрофилов способны эффективно связывать агрегированные молекулы эндотоксина, поэтому определение относительного количества нейтрофилов несущих ЛПС-связывающие рецепторы, которые находятся в функционально активном состоянии и не заняты лигандом, имеет большое значение для оценки ЛПС-связывающей емкости нейтрофилов [5].
В связи с этим целью данной работы являлось изучение содержания антиэндотоксиновых антител (гуморального звена антиэндотоксинового иммунитета), относительного количества нейтрофилов несущих ЛПС-связывающие рецепторы (клеточного звена антиэндотоксинового иммунитета), а также анализ взаимосвязи этих показателей у больных с гипертензионными увеитами. Эти аспекты, которые ранее не освещались в литературе, позволят расширить представления о роли иммунной системы в развитии эндогенных увеитов, а также разработать на этой основе комплексный подход к лечению данной патологии.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 23 больных передними гипертензионными увеитами, из них у 10 больных (11 глаз) был иридоциклит герпес-вирусного происхождения, у 6 больных (6 глаз) — передний увеит, сочетанный с серонегативным спондилоартритом, у 7 пациентов (7 глаз) — иридоциклит неясного генеза. Возраст пациентов колебался от 20 до 64 лет. Мужчин было 15 (62 %), женщин — 8 (38 %).
Офтальмологическое обследование больных проводили с помощью визометрии, периметрии, тонометрии, тонографии, биомикроскопии, гониоскопии, офтальмоскопии, биомикроофтальмоскопии. В дополнение к общепринятым лабораторным методам обследования больным проводилось определение методом твердофазного иммуноферментного анализа уровней сывороточных антиэндотоксиновых антител классов А, M и G (соответственно анти-ЛПС-IgА, анти-ЛПС-IgМ и анти-ЛПС-IgG) [4, 6]. Сыворотку крови получали общепринятым способом и хранили при +4°С в присутствии 0,05% азида натрия. В качестве антигена при определении антиэндотоксиновых антител использовали ЛПС Escherichia coli K30 (О9:К30:Н12). Уровни анти-ЛПС-антител выражали в условных единицах оптической плотности конечного продукта ферментативной реакции для разведения тестируемой сыворотки крови 1:50. Концентрацию общих иммуноглобулинов (IgG, IgM и IgA) определяли микротурбидиметрическим методом [6]. Для определения относительного количества нейтрофилов периферической крови, несущих ЛПС — связывающие рецепторы, как флуоресцентный зонд использовали флуоресцентное производное эндотоксина — ЛПС — флуоресцеинизотиоцианат (ЛПС-ФИТЦ). Взаимодействие коньюгата ЛПС-ФИТЦ с нейтрофилами изучали методом проточной лазерной цитофлуориметрии [5]. В качестве контрольных исследовали пробы сывороток крови 50 практически здоровых лиц. Статистическую обработку результатов проводили с помощью программы «Statistic 5.0 for Windows».
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
У пациентов с передним гипертензионным увеитом клинически наблюдались выраженные проявления воспалительного процесса в сосудистой оболочке: отмечался отек радужки, «стушеванность» ее рисунка, сужение зрачка, выраженная перикорнеальная инъекция глазного яблока, опалесценция влаги передней камеры. Из-за повышения ВГД определялся отек роговицы. Корригированная острота зрения колебалась от 0,08 до 0,7 и в среднем составляла 0,3 ± 0,12. ВГД было от 28 до 39 мм.рт. ст., в среднем — 32,5±3,2 мм рт.ст.
У группах больных иридоциклитами при спондилоартритах и передними увеитами неясной этиологии определено достоверное повышение среднего содержания анти-ЛПС-IgА, по сравнению, с контрольной группой в 1,7 раза (р < 0,05). У пациентов с иридоциклитами герпес-вирусного происхождения также имелась тенденция к повышению уровня анти-ЛПС-IgА, однако отличия от контрольной группы были статистически недостоверными. Повышенный уровень анти-ЛПС-IgA у данной категории больных может указывать на увеличение антигенной нагрузки вследствие избыточной транслокации эндотоксина в системный кровоток [10].
У пациентов с передним увеитом всех групп отмечалось снижение содержания анти-ЛПС-IgM, в сравнении, с показателями контрольной группы. Так, уровень анти-ЛПС-IgM у пациентов с передними увеитами вирусной этиологии, иридоциклитами при спондилоартритах и передними увеитами невыясненной этиологии был, соответственно, в 2; 2,2 и 1,9 раза меньше (р < 0,05), чем в контрольной группе. Учитывая, что наиболее выраженным протективным эффектом по отношению к эндотоксину, который преодолел иммунный бартер кишечника и попал в системный кровоток, обладают именно антиэндотоксиновые антитела класса М [15], пониженное содержание анти-ЛПС-IgM можно рассматривать как неблагоприятный фактор для развития передних увеитов. Содержание анти-ЛПС-IgG у больных передним увеитом всех групп в среднем достоверно не отличалось от показателей контрольной группы. Однако у большинства больных (87%) уровень анти-ЛПС-IgG отличался в большую или меньшую сторону от среднего показателя контрольной группы более чем на 30 %.
Для сравнительной оценки состояния гуморального звена иммунитета у больных увеитами были определены общие IgA, IgМ и IgG в сыворотке крови исследуемых пациентов (табл. 2). Ряд исследователей считает, что у больных с эндогенными уветами определяется рост общих IgA и IgМ [1], такая же тенденция отмечена в группах больных и в нашем исследовании. Во всех группах больных обнаружена отрицательная связь (корреляция r = — 0,7) между общим IgМ и анти-ЛПС-IgМ, что указывает на наличие селективного иммунодефицита по антиэндотоксиновым антителам класса М у больных гипертензионными иридоциклитами.
У больных передними увеитами вирусной этиологии, иридоциклитами при спондилоартритах и передними увеитами невыясненной этиологии наблюдалось снижение относительного количества клеток, несущих ЛПС-связывающие рецепторы (табл. 2) соответственно на 11,8 %, 11,05 % (р<0,05) и на 3,85 % (р>0,05) меньше, в сравнении со средними показателями в контрольной группе, что свидетельствует о снижении потенциала нейтрофилов у этих больных связывать ЛПС. Если учитывать, что у пациентов этих групп отмечалось снижение антиэндотоксиновых антител класса M, то можно утверждать, что у больных с гипертензионными иридоциклитами имеются нарушения в системе детоксикации и клиренса эндотоксина, что в свою очередь может усугублять течение переднего эндогенного увеита или даже являться инициирующим фактором его развития.
Полученные данные подтверждают теорию некоторых исследователей [2, 3], о возможном участии эндотоксиновой агрессии в инициации воспалительного процесса (в том числе и вирусного происхождения) в сосудистой оболочке глаза.
Выводы
1. У больных передними эндогенными гипертензионными увеитами обнаружены выраженные нарушения гуморального и клеточного антиэндотоксинового иммунного статуса.
2. Наиболее высокий уровень анти-ЛПС-IgA выявлен у пациентов с гипертензионными иридоциклитами сочетанными со спондилоартритами и неясной этиологии. У пациентов всех групп определено снижение содержания анти-ЛПС-IgМ. Во всех группах больных обнаружена отрицательная связь (корреляция r = — 0,7) между общим IgМ и анти-ЛПС-IgМ.
3. Во всех группах больных наблюдалось снижение относительного количества клеток, несущих ЛПС-связывающие рецепторы.
4. Полученные данные указывают на возможное участие эндотоксина в патогенезе эндогенных увеитов и необходимость разработки методов коррекции избыточной транслокации эндотоксина в системный кровоток и дисбаланса антиэндотоксинового иммунитета в комплексном лечения воспалительных заболеваний глаз.
ЛИТЕРАТУРА
1. Бездетко П.А., Бачук Н.Ю. Состояние Т- и В- иммунитета при рецидивирующих эндогенных увеитах // Офтальмологический журнал. — 2001. — №3. — С. 29-32.
2. Вышегуров Я. Х., Аниховская И. А., Батманов Ю. Е., Яковлев М. Ю. Кишечный эндотоксин в патогенезе воспалительной патологии глаз и антиэндотоксиновая составляющая ее лечения // Патологическая физиология и экспериментальная терапия. — 2007. — №1. — С.12-14.
3. Вышегуров Я.Х., Аниховская И.А., Расческов А.Ю., Усов И.А., Яковлев М.Ю. эндотоксиновая агрессия как облигатный фактор патогенеза иридоциклитов различного происхождения и ее этиология // Физиология человека. — 2006. — Т.32, — № 6. — С. 109-113.
4. Гордиенко А.И., Бакова А.А., Химич Н.В., Белоглазов В.А. Уровни естественных антител к липополисахаридам энтеробактерий у постоянных доноров республики Крым // Iмунологiя та алергологiя. — 2003. — № 4. — С. 31-36.
5. Гордиенко Ан.И., Исакова Л.М., Гордиенко Ал.И. Белоглазов В.А. Использование липополисахарида, меченного флуоресцеинизотиоцианатом, в качестве флуоресцентного зонда для выявления липополисахарид-связывающих рецепторов на клетках крови // Український журнал гематології та трансфузіології. — 2003. — Т. 3, № 3. С. 16-21.
6. Гордиенко А.А., Притуло О.А., Белоглазов В.А., Бакова А.А., Химич Н.В. Взаимосвязь между уровнями антител к липополисахариду и аутоантител к ДНК у больных вульгарной пузырчаткой // Iмунологiя та алергологiя. — 2002. — № 4. — С. 67-72.
7. Клиническая офтальмология / Е.Е. Сомов — М.: МЕДпресс-информ, 2005. — 392 с.
8. Коновалова Н. В., Наріцина Н. І., Серебріна Т. М. и др. Спосіб комбінованого застосування флоксалу та індоколіру у лікуванні запальних захворювань переднього та заднього відділів ока // Офтальмологический журнал. — 2007. — № 2. — С. 43-45.
9. Увеиты / Н.С. Зайцева, Л.А. Канцельсон — М.: Медицина, 1984. — 318 с.
10. Barclay G.R. Endogenous endotoxin-core antibody (EndoCAb) as a marker of endotoxin exposure and a prognostic indicator: a review // Prog. Clin. Biol. Res. — 1995. — 392. — P. 263-272.
11. Heine H., Rietschel E.T., Ulmer A.J. The biology of endotoxin // Mol. Biotechnol. — 2001. — № 3. — P. 279-296.
12. Kozhich A.T., Chan C.C., Gery I., Whitcup M. Recurrent intraocular inflammation in endotoxin-induced uveitis // Invest. Ophthal. Vis. Sci. — 2000. — V. 41 № 7. — P. 1823.
13. Peter J McCluskey, Hamish M. A. Towler, Susan Lightman Management of chronic uveitis // British Medical Journal. — 2000. — Vol. 320 — P. 555-558.
14. Smith J. R. HLA-B27-associated uveitis // Ophthalmol. Clin. North. Am. — 2002. — Sep;15(3) — P. 297-307.
15. Trautmann M., Held T.K., Susa M., Karajan M.A. et al. Bacterial lipopolysaccharide (LPS)-specific antibodies in commercial human immunoglobulin preparations: superior antibody content of an IgM-enriched product // Clin. Exp. Immunol. — 1998. — 111, №1. — P. 81-90.
Источник
Результаты проведенных исследований.
Л. Ф. Притуло
Крымский государственный медицинский университет им. С. И. Георгиевского, г. Симферополь
Резюме: Обследованы 34 ребенка, у которых диагностирован синдром системного воспалительного ответа (ССВО). У 16 детей проведена патогенетически обоснованная иммунокорекция с использованием плазмы доноров, обогащенной антителами (АТ) к эндотоксину (ЭТ); у 18 детей — общепринятая комплексная терапия. При наличии грамотрицательной инфекции у детей с ССВО выявляют активацию врожденных неспецифических факторов (LBP, sCD14) и специфических низкоаффинных АТ (анти—ЭТ—IgM, анти—ЭT—IgA) антиэндотоксинового иммунитета в сочетании с селективным иммунодефицитом анти—ЭT—IgG. При использовании плазмы доноров, обогащенной АТ к ЭТ, титр анти—ЭТ— IgG, анти—ЭТ—IgM, анти—ЭТ—IgA и LBP достигал нормальных значений и не отличался от такового в контроле на 14—е сутки.
Ключевые слова: эндотоксин; иммунитет; синдром системного воспалительного ответа; иммунокоррекция.
За последние 50 лет летальность, обусловленная сепсисом, снизилась незначительно и составляет 30 — 85%. В США ежегодно выявляют более 500 000 больных с сепсисом, из них умирают до 200 000. В Германии от сепсиса в течение года умирают 75 000 пациентов. Аналогичная смертность зарегистрирована от инфаркта миокарда [1].
Сепсис предполагает в большинстве ситуаций местный процесс (септический очаг). Ведущую роль в патогенезе сепсиса играют медиаторы воспаления, которые образуются в организме в ответ на воздействие токсигенных факторов, продуцируемых микроорганизмами [1].
В настоящее время сепсис определяют как патологический процесс, в основе которого лежит ответная системная воспалительная реакция организма на инфекцию.
Возбудителями большинства инфекций, которые обусловливают возникновение септического процесса, являются грамотрицательные энтеробактерии (E. coli, Klebsiella, Pseudomonas aeruginosa). Инфекцию, обусловленную грамотрицательными микроорганизмами, выявляют в 30 — 80% наблюдений септического процесса, положительными — в 6 — 24%.
«Пусковым» агентом возникновения сепсиса у грамотрицательных бактерий является ЭТ, или липополисахарид (ЛПС).
В большинстве наблюдений при возникновении септического процесса наличие бактериемии или эндотоксинемии не может быть установлено напрямую [2, 3].
Иммунный ответ на ЭТ грамотрицательной микрофлоры сопровождается активацией выделения провоспалительных цитокинов: фактора некроза опухолей—α (ФНО—α), интерлейкинов (ИЛ), в том числе ИЛ—1, ИЛ—6 [4].
Связывание ЭТ с белком плазмы, который обладает высоким аффинитетом к липиду А, опосредует взаимодействие ЭТ с мембраносвязывающим рецептором CD14 и TLR4 (toll—like receptor 4) на клетках моноцитарно—макрофагального ряда и потенцирует выработку этими клетками провоспалительных цитокинов [5, 6].
CD14 — паттерн, распознающий рецептор, который играет ведущую иммуномоделирующую роль в передаче сигналов в реакциях на разнообразные лиганды, особенно ЭТ [7, 8].
Эндотелиальные клетки испытывают недостаток в мембранных формах СD14 (mСD14) и отвечают на ЭТ прежде всего посредством растворимой формы (sCD14) этого рецептора [9].
К гуморальным механизмам деактивации ЭТ можно отнести естественные АТ к ЭТ. Важную роль в клиренсе ЛПС как непосредственно в слизистой оболочке, так и в кровотоке играют АТ к ЭТ [10].
Первый альтернативный способ лечения сепсиса был предложен в виде препаратов АТ к ЛПС. Использовали 3 препарата IgM против липида: А, HA—1А и E5, а также поликлональную антисыворотку к ЛПС клеточной стенки E. сoli J5. Человеческая сыворотка анти—E. сoli J5 (Rc—LPS) впервые применена для лечения небольшой группы пациентов с септическим шоком. Использование этой кросс—реактивной антисыворотки способствовало значительному улучшению прогноза септического шока, но не позволило точно установить, что именно обеспечило защиту — АТ или другие компоненты (например, воспалительные медиаторы) доноров [11]. Применение E5 значительно снижало смертность в первом испытании, но не доказало своей эффективности в последующих [12, 13]. HA—1A (Centoxin) оказал защитное действие в первом исследовании, но не проявил эффекта во втором, в третьем исследовании отмечена тенденция к увеличению смертности пациентов [14 — 16]. Очень мало известно о защитном механизме этих АТ. Хотя изначально считали, что HA—1А АТ специфически распознают липид А, в дальнейшем было установлено, что они связываются преимущественно неспецифически с гидрофобными компонентами [14].
До недавнего времени среди клиницистов не было консенсуса относительно определения понятия «сепсис» у детей. Использовали определения, основанные на решениях согласительной конференции ACCP/SCCM (1991 г.) [17] с различными вариациями критических пороговых значений ССВО. Появление согласованного определения сепсиса и органной дисфункции в детском возрасте связано с решениями Международной консенсусной конференции по сепсису у детей (IPSCC, 2005 г.) [18].
В литературе практически не раскрыты механизмы влияния специфической, пассивной иммунокоррекции, направленной на элиминацию ЭТ у детей с ССВО.
В связи с этим целью работы стало изучение влияния патогенетически обоснованной иммунокоррекции на состояние антиэндотоксинового иммунитета у детей с ССВО, обусловленным грамотрицательной микрофлорой.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследованы 34 ребенка, госпитализированных в хирургическое отделение Республиканской детской клинической больницы г. Симферополя.
В соответствии с клиническим диагнозом обследованы 19 детей с острой гнойно-деструктивной пневмонией (ОГДП), 4 — с острым гематогенным остеомиелитом, 11 — с перитонитом.
Для оценки эффективности патогенетически обоснованной иммунокоррекции пациенты распределены путем случайной выборки на две группы. В 1—ю группу вошли 16 детей, у которых для патогенетически обоснованной иммунокоррекции использовали плазму доноров, обогащенную АТ к ЭТ; во 2—ю группу — 18 детей, у которых проводили общепринятое комплексное лечение.
Комплексное лечение включало: хирургическое пособие, антибактериальную терапию, интенсивную терапию, реабилитацию. Иммунокоррекцию проводили на 2 — 3—и сутки с использованием регионального банка плазмы постоянных доноров, обогащенной АТ к ЭТ. Заготовка, транспортировка и методы введения плазмы соответствовали рекомендациям МЗ Украины и АМН Украины.
Контрольную группу составили 110 условно здоровых детей того же возраста и пола.
Для оценки ССВО использовали классификацию, принятую на конференции IPSСC (2005 г.) [18].
Основными критериями для установления диагноза ССВО были: наличие, по крайней мере, двух из следующих четырех критериев, один из которых обязателен — аномальная температура тела или количество лейкоцитов.
Температура тела выше 38,5°С или ниже 36,0°С. Тахикардия, определяемая как средняя частота сокращений сердца, превышающая 2 квадратичных отклонения от возрастной нормы, в отсутствие внешних стимулов, длительного применения лекарственных средств, болевого стимула или иного необъяснимого увеличения в течение более чем 0,5 — 4 ч; для детей до 1 года — брадикардия, определяемая как средняя частота сокращений сердца менее 10 возрастных перцентилей в отсутствие внешнего вагусного стимула, или врожденных пороков сердца, назначения β—блокаторов.
Средняя частота дыхания, превышающая 2 квадратичных отклонения от возрастной нормы, или необходимость проведения искусственной вентиляции легких при остром процессе, не связанном с нейромышечными заболеваниями либо воздействием общей анестезии.
Количество лейкоцитов увеличено или уменьшено по сравнению с возрастной нормой (кроме вторичной индуцированной химиотерапией лейкопении) или менее 10% незрелых нейтрофильных гранулоцитов.
Уровень АТ к ЭТ классов А, М, G (соответственно анти—ЭТ—IgA, анти—ЭТ—IgM и анти—ЭТ—IgG) определяли методом твердофазного иммуноферментного анализа [19, 20]. В качестве антигена использовали ЛПС грамотрицательной энтеробактерии E. coli K30 (O9:K30:H12), выделенной из бактериальной биомассы методом водно—фенольной экстракции и дополнительно очищенной от примесей РНК путем обработки цетавлоном (Serva, Германия).
Титр анти—ЭТ—IgA, анти—ЭТ—IgM и анти—ЭТ— IgG выражали в условных единицах оптической плотности конечного продукта ферментной реакции для разведения тестируемой сыворотки крови 1:50 (для анти—ЭТ—IgA, анти—ЭТ—IgM) и 1:200 (для анти—ЭТ—IgG).
Для исследования LBP и sCD14 использовали тест—системы «Hbt Human LBP ELISA Kit, Product Number: HK315 и Hbt Human sCD14 ELISA Kit, Product Number: HK320» производства «Hycult biotechnology» (Голландия). Образцы и стандартные растворы инкубировали в титрационном микропланшете, покрытом АТ к LBP или sCD14. Во время инкубации LBP или sCD14 связывались с АТ, несвязанный материал извлекали путем вымывания. Биотинированные вторые АТ к LBP или sCD14 добавляли в микропланшеты, после чего проводили вторичное отмывание. Стрептовидин—пероксидазный конъюгат добавляли в образцы, после чего остаток удаляли путем повторного вымывания, реакцию останавливали путем добавления лимонной кислоты.
Оптическую плотность определяли с помощью анализатора «StatFox 2100» при длине волны 450 нм [21]. Содержание LBP и sCD14 выражали в милиграммах на милилитр.
Все результаты подвергнуты статистической обработке для параметрических и непараметрических критериев с использованием программы «MedStat» (серийный № MS0011) ДНПП ООО «Альфа» (г. Донецк).
При анализе для проверки распределения на нормальность использовали χ2 и критерий Шапиро — Уилка, сравнение центральных тенденций двух независимых выборок с использованием W— критерия Вилкоксона и средних двух независимых выборок по критерию Стьюдента. Для множественного сравнения использовали ранговый однофакторный анализ Крускала — Уоллиса и критерий Дана [22].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
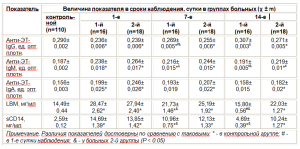
Результаты показателей антиэндотоксинового иммунитета представлены в таблице.
В 1—е сутки у детей обеих групп наблюдали достоверное (P < 0,05) повышение уровня LBP, sCD14, титра анти—ЭТ—IgM и анти—ЭТ—IgA по сравнению с таковыми в контрольной группе; титр анти—ЭТ— IgG был достоверно (P < 0,01) ниже при аналогичном анализе. В свою очередь, эти показатели достоверно в группах 1 и 2 не различались (P > 0,05).
Таким образом, анализируя состояние антиэндотоксинового иммунитета в 1—е сутки, мы пришли к заключению, что грамотрицательная микрофлора у детей с ССВО способствует активации врожденных неспецифических факторов (LBP, sCD14) и специфических низкоаффинных АТ (анти—ЭТ—IgM, анти— ЭТ—IgA), но при этом наблюдают снижение уровня высокоэффективных специфических анти—ЭТ—IgG. Такие изменения, очевидно, обусловлены супрессией цитокинов Т—хелперов 2 типа.
Таблица. Показатели антиэндотоксинового иммунитета в зависимости от метода лечения у детей с ССВО

При анализе этих показателей на 7—е сутки у детей группы 2 их изменения были аналогичны таковым в 1—е сутки; у детей группы 1 все показатели также отличались от таковых в контроле, за исключением титра анти—ЭТ—IgA. При анализе между группами титр анти—ЭТ—IgG был достоверно (P <0,05) выше в группе 1 по сравнению с таковым в группе 2, а титр анти—ЭТ—IgM, уровень LBP и sCD14 — достоверно (P < 0,05) ниже.
На 14—е сутки в группе 1 показатели анти—ЭТ— IgG, анти—ЭТ—IgM, анти—ЭТ—IgA и LBP достигли нормальных значений и не отличались от таковых в контроле (P > 0,05); в группе 2 все показатели сохранили тенденцию 1—х и 7—х суток. Результаты межгруппового анализа были аналогичны таковым на 7—е сутки.
Анализируя в целом полученные результаты, мы пришли к заключению, что у детей с ССВО ЭТ грамотрицательных микроорганизмов обусловливает значительный дисбаланс в системе врожденного и приобретенного антиэндотоксинового иммунитета. Очень важен факт селективного иммунодефицита анти—ЭТ—IgG, наблюдаемого в 1—е сутки, который, очевидно, связан с массивным поступлением ЭТ в кровоток и неспособностью специфических В—лимфоцитов переключиться на синтез высокоаффинных АТ класса G.
Высокий уровень LBP и sCD14 способствует активации ЭТ клеток миелоцитарно—моноцитарного звена с последующей массивной секрецией провоспалительных медиаторов.
При использовании плазмы доноров, обогащенной АТ к ЭТ, наблюдали положительную динамику показателей на 7—е сутки с их последующей нормализацией на 14—е сутки.
ВЫВОДЫ
1. Грамотрицательная микрофлора у детей с ССВО способствует активации врожденных неспецифических факторов (LBP, sCD14) и специфических низкоаффинных АТ (анти—ЭТ— IgM, анти—ЭТ—IgA) антиэндотоксинового иммунитета в сочетании с селективным иммунодефицитом анти—ЭТ—IgG.
2. При использовании плазмы доноров, обогащенной АТ к ЭТ, титр анти—ЭТ—IgG, анти— ЭТ—IgM, анти—ЭТ—IgA, а также уровень LBP достигли нормальных величин и не отличались от таковых в контроле на 14—е сутки.
Перспективы дальнейших исследований. С учетом полученных данных о реагировании антиэндотоксинового иммунитета при инфекции, вызванной грамотрицательными микроорганизмами, и влиянии иммунокоррекции с использованием плазмы доноров, обогащенной АТ к ЭТ у детей с ССВО, планируется изучение клинической эффективности этого метода лечения.
ЛИТЕРАТУРА
1. Septic shock: pathogenesis / M. P. Glauser, G. Zanetti, J. D. Baumgartner, J. Cohen // Lancet. —1991. — Vol. 338. — P. 732 — 736.
2. Bone R. C. Why new definitions of sepsis are needed / R. C. Bone // Am. J. Med. — 1993. —Vol. 95. — P. 348 — 350.
3. Endotoxaemia in patients with severe sepsis or septic shock / C. Venet, F. Zeni, A. Viallon [et al.] // Intens. Care Med. — 2000. — Vol. 26. — P. 538— 544.
4. Sriskandan S. Gram—positive sepsis. Mechanisms and differences from gram—negative sepsis/ S. Sriskandan, J. Cohen. // Inf. Dis. Clin. N. Am.— 1999. — Vol. 13. — P. 397 — 412.
5. Bacterial endotoxin stimulates macrophages to release HMGB1 partly through CD14— and TNF— dependent mechanisms / G. Chen, J. Li, M. Ochani [et al.] // J. Leukoc. Biol. — 2004. — Vol.76, N 5. — P. 994 — 1001.
6. Regulation of interactions of endotoxin with host cells / T. L. Gioannini, A. Teghanemt, K. A. Zarember, J. P. Weiss // J. Endotox. Res. —2003.— Vol. 9, N 6. — P. 401 — 408.
7. Antal—Szalmas P. Evaluation of CD14 in host defense / P. Antal—Szalmas // Eur. J. Clin. Invest. —2000. — Vol. 30. — P. 167 — 179.
8. CD14 is a pattern recognition receptor / J. Pugin, I.D. Heumann, A. Tomasz [et al.] // Immunity. —1994. — N 1. — P. 509 — 516.
9. Soluble CD14 participates in the response of cells to lipopolysaccharide / E. A. Frey, D. S. Miller, T. G. Jahr [et al.] // J. Exp. Med. — 1992. — Vol. 176.— P. 1665 — 1671.
10. Уровни естественных антител к липополисахаридам энтеробактерий у постоянных доноров республики Крым / А. И. Гордиенко, А. А. Бакова, Н. В. Химич, В. А. Белоглазов // Імунологія та алергологія. — 2003. — № 4. — С. 31 — 36.
11. Treatment of Gram—negative bacteremia and shock with human antiserum to a mutant Escherichia coli / E. J. Ziegler, J. A. McCutchan, J. Fierer [et al.] // New Engl. J. Med. — 1982. — Vol. 307.— P. 1225 — 1230.
12. E5 Study Investigators. E5 murine monoclonal antiendotoxin antibody in gram—negative sepsis: a randomized controlled trial / D. C. Angus, M. C. Birmingham, R. A. Balk [et al.] // J. A. M. A. —2000. — Vol. 283. — P. 1723 — 1730.
13. A controlled clinical trial of E5 murine monoclonal IgM antibody to endotoxin in the treatment of gram—negative sepsis / R. L. Greenman, R. M. H. Schein, M. A. Martin [et al.] // Ibid. — 1991. — Vol.266. — P.1097 — 1102.
14. Baumgartner J. D. Monoclonal anti—endotoxin antibodies for the treatment of Gram—negative bacteremia and septic shock / J. D. Baumgartner // Eur. J. Clin. Microbiol. Inf. Dis. — 1990. — Vol. 9.— P. 711 — 716.
15. Immunotherapie met de antiendotoxine—antistof HA—1A (Centoxin) bij patienten met het sepsissyndroom: matige resultaten na geprotocolleerde selectie van patienten / L. G. Costongs, P. Speelman, J. J. Van Lieshout [et al.] // Ned. Tijdschr. Geneeskd. — 1993. — Vol. 137. — P. 355 — 360.
16. De introductie van immuuntherapeutica in de kliniek: de stand van zaken betreffende de anti— endotoxine—antist of HA—1A bij de bestrijding van sepsis / S. J. H. Van Deventer, C. J. Van Der Linden, J. J. Roord [et al.] // Ibid. — P. 334 — 336.
17. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference Committee. Definition for sepsis and multiple organ failure and guidelines for the use of innovative therapies in sepsis // Crit. Care Med. — 1992. — Vol. 20. — P. 864 — 874.
18. International pediatric sepsis consensus conference: Definitions for sepsis and organ dysfunction in pediatrics / B. Goldstein, B. Giroir, A. Randolph [et al.] // Pediatr. Crit. Care Med. — 2005. — Vol. 6. — P. 2 — 8.
19. Пат. 70193 А Україна, МПК 7 А61К31/01. Спосіб визначення антитіл до диполісахаридів грамнегативних бактерій / А. І. Гордієнко, В. О. Білоглазов (Україна). — Завл. 29.12.03; Опубл.15.09.04. Бюл. № 9.
20. Гордиенко А. И. Микротурбидиметрический метод определения IgG, IgM, IgA человека / А. И.Гордиенко, В. А. Белоглазов, А.И. Гордиенко //Iмунологiя та алергологiя. — 2000. — № 1. — С.12 — 15.
21. Novel enzyme immunoassay utilizing lipopolysaccharide— binding protein as a capture molecule for the measurement of chlamydial lipopolysaccharide in serum / T. Tiirola, A. Jaakkola, A. Bloigu [et al.] // Diagn. Microbiol. Inf. Dis. — 2006. — Vol.54, N 1. — P. 7 — 12.
22. Лапач С.Н. Статистические методы в медико—биологических исследованиях / С. Н. Лапач, А. В. Чубенко, П. Н. Бабич. — К.: Морион, 2000. —319 с.
Источник: журнал «Клінічна хірургія», № 5, 2009.
Источник
