Апоптоз и его роль в иммунитете
Апоптоз играет важную роль при становлении и функционировании иммунной системы. Эта форма гибели клеток сопровождает развитие клеток иммунной системы, особенно лимфоцитов, на этапе их селекции. С помощью механизма апоптоза происходит гибель клеток-мишеней кил- лерных лимфоцитов. При дальнейшем изложении материала апоптоз будет неоднократно упоминаться в связи с самыми разнообразными иммунологическими процессами. Именно потому, что апоптоз широко распространен при развитии лимфоцитов в центральных лимфоидных органах, этот процесс рассматривается в настоящем разделе.
Выделяют 2 основных варианта гибели клеток — некроз и апоптоз (табл. 3.19). Гибель, вызванная прямым повреждением или разрушением клеточной мембраны, называют некрозом. Другой вариант гибели клеток — апоптоз (от греч. алолтостгст — опадание листьев) или программированная гибель — реализуется в ответ на действие физиологических сигналов или в процессе срабатывания генетической программы клетки и служит необходимым условием существования многоклеточных организмов. Понятие «апоптоз» ввели в 1972 г. Дж. Керр (J.F. Kerr) и соавт. в связи с описанием формы гибели лимфоцитов при действии глюкокортикоидов.
Таблица 3.19. Сравнительная характеристика апоптоза и некроза клеток
| Показатель | Апоптоз | Некроз |
| Пусковой фактор | Повышение проницаемости мембран митохондрий или сигнал, воспринимаемый мембранными рецепторами | Неадекватные условия среды, токсические агенты |
| Скорость развития | 1-4 ч | lt; 1 ч |
| Причины гибели клетки | Нарушение функционирования энергетической системы клетки, деградация ДНК | Нарушение целостности мембраны, осмотические процессы |
| Изменение размера клетки | Уменьшение (сморщивание) | Увеличение (набухание) |
| Изменения ядра | Конденсация хроматина, пикноз, фрагментация | Набухание |
Окончание табл. 3.19
| Показатель | Апоптоз | Некроз |
| Изменения в цитоплазме | Конденсация цитоплазмы, уплотнение гранул | Лизис гранул |
| Изменения клеточной мембраны | Потеря микроворсинок, образование вздутий, уплотнение | Нарушение целостности |
| Состояние ДНК | Упорядоченная (межнук- леосомная) деградация | Неупорядоченная деградация |
| Энергозависимость | Зависит | Не зависит |
| Зависимость от синтеза макромолекул | Часто зависит | Не зависит |
| Примеры проявления | Гибель клеток при метаморфозе, отрицательной селекции лимфоцитов, гормонозависимой атрофии, интерфазной радиационной гибели лимфоцитов, гибели клеток-мишеней киллерных клеток | Гибель клеток от гипоксии, действия токсинов, вирусном цитолизе, комплементзависимом цитолизе |
Некроз происходит при нарушении целостности клеточной мембраны и проявляется набуханием клетки, лизисом гранул и ядра, неупорядоченной деградацией ДНК. Проявлениями апоптоза служат, наоборот, сморщивание клетки, уменьшение ее размеров, уплотнение наружной и внутриклеточных мембран (при сохранении их целостности) с деполяризацией, утратой микроворсинок и формированием вздутий, а также уменьшение размеров, уплотнение и фрагментация ядра. При этом происходят разрывы ДНК между нуклеосомами, в результате чего образуются фрагменты протяженностью, кратной 180—190 пар оснований (размер нуклеосомы). От клетки, подвергшейся апоптозу, отшнуровываются «апоптотические тельца» — фрагменты ядра, окруженные мембраной. Уже в процессе апоптоза гибнущие клетки подвергаются фагоцитозу. В результате продукты распада клеток не поступают в межклеточное пространство и не вызывают воспалительной реакции, которая обычно сопутствует некрозу клеток. Апоптоз развивается более медленно (1 ч и более), чем некроз (практически сразу после действия повреждающих факторов).
Механизмы апоптоза детально изучены на клетках нематоды Caenorhabditis elegans, у которой было идентифицировано 14 генов, контролирующих 4 фазы развития апоптоза. Обнаруженные у млекопитающих гомологи некоторых из этих генов также участвуют в развитии апоптоза. Выделяют 3 фазы развития апоптоза — включение пусковых механизмов, активацию каспаз и реализацию гибели. Апоптоз может быть запущен по двум механизмам — рецепторному и митохондриальному (табл. 3.20; рис. 3.65, 3.66).



Рис. 3.66. Митохондриальный механизм запуска апоптоза
Рецепторный механизм запуска апоптоза реализуется с участием мебран- ных рецепторных молекул, цитоплазматическая часть которых представлена доменом смерти (death domain), содержащим около 80 остатков. Эти молекулы относят к семейству рецепторов TNFa. Известно 6 таких рецепторов: Fas-рецептор (АРО-1, CD95, DR2), TNF-R1 (р55, CD120а, DR1), DR3, DR4, DR5, DR6. Их лиганды — Fas-лиганд (FasL, CD178 — для Fas-рецептора), цитокин TNFa (для TNFR1), TRAIL (TNF-related apoptosis-inducing ligand — для DR4 и DR5), TL1A (для DR3 и DR6) (табл. 3.20). Все лиганды организованы в виде тримеров. Их взаимодействие с рецепторами приводит к тримеризации последних, что запукает сигнальный каскад. При этом домены смерти приобретают способность взаимодействовать с аналогичными доменами адапторных белков FADD (Fas-associated death domain) и TRADD (TNF-receptor death domain). FADD распознает домены смерти в составе про- каспазы 8 и, взаимодействуя с ними, вызывает активацию каспазы 8 (см. далее). Результат действия TRADD аналогичен, но он реализуется посредством FADD. Формирующиеся в результате указанных взаимодействий молекулярные комплексы называют DISC (Death-inducing signaling complex).
Митохондриальный механизм запуска апоптоза реализуется при повреждении функций митохондрий, приводящем к нарушению проницаемости их мембраны. Решающую роль в этом пути запуска апоптоза играют белки семейства Bcl-2. Их разделяют на проапототические (Bid, Bax, Bak, Bcl-XS и др.) и антиапоптотические (Bcl-2, Bcl-XL, Mcl-1 и др.). Запуск сигналов к апоптозу связан с проапоптотическими белками, содержащими 1 домен ВН (Bcl-2 homology) — BH3. Белки этой группы блокируют анти-
апоптотические факторы типа Bcl-2, образуя с ними димеры. Кроме того, в результате олигомеризации Вах и Bak они формируют трансмембранные поры. В норме олигомеризация этих факторов подавляется антиапоптоти- ческими факторами. Через поры в мембране митохондрий в цитозоль выходят цитохром с и фактор Apaf-1 (Apoptose protease activation factor 1). Аpaf-1 и цитохром с в присутствии АТФ образуют комплекс с неактивной каспазой — прокаспазой 9. Этот комплекс называют апоптосомой. В ней происходит активация каспазы 9.
Рецепторный механизм апоптоза может быть прерван активацией ингибиторов каспазы 8. Митохондриальный механизм блокируется антиапопто- тическими факторами Bcl-2 и Bcl-XL связывающими проапоптотические факторы. Пути запуска апоптоза не являются изолированными. Так, рецепторный механизм приводит к активации митохондриального фактора Bid, что обусловливает подключение митохондриального механизма апоптоза.
Необходимо упомянуть также о механизме контроля за балансом пролиферации и апоптоза, осуществляемого метаболитами сфингомиелина. Из них роль проапоптотического фактора играет церамид, действующий через механизмы митохондриального (через фактор Bax) и рецепторного (через Fas-рецептор) путей.

Оба пути запуска апоптоза приводят к активации каспаз (рис. 3.67). Каспазы — группа цистеиных протеаз, расщепляющих полипептидную
связь после остатков аспарагиновой кислоты. Как уже отмечалось, рецепторный путь приводит к активации каспазы 8, митохондриальный — к активации каспазы 9. Эти ферменты относят к группе инициаторных каспаз. Их активация — результат агрегации вследствие взаимодействия с адаптерными белками (FADD, Apaf-1). При агрегации происходит аутокаталитическое отщепление длинного N-концевого участка каспазы с последующим формированием активного гетеродимера. После активации инициаторных каспаз процесс апоптоза становится необратимым.
Инициаторные каспазы вызывают частичный протеолиз (отщепление короткого продомена) и вследствие этого активацию исполнительных, или эффекторных каспаз — каспазы 3, реже — каспазы 6 и каспазы 7. Известно до 280 молекул-мишеней исполнительных каспаз, локализованных преимущественно в ядре. Расщепление молекул-мишеней определяет все проявления апоптоза. Действие каспаз на фактор ретинобластомы (Rb) и 5-изоформу протеинкиназы С обусловливает нарушение контроля клеточного цикла. Расщепление киназ МЕКК-1 и FAK приводит к изменениям, вызывающим ослабление адгезионной способности клетки, а расщепление гельсолина и киназы РАК определяет характерные изменения клеточной морфологии. Расщепление той же каспазой ядерных ферментов PARP (Poly-ADP-ribose polymerase — поли-АДФ-рибоза полимераза), а также ДНК-зависимой протеинкиназы нарушает процесс репарации ДНК. Одна из главных мишеней каспазы 3 — нейтральная эндонуклеаза CAD (Caspase- activated DNase), ответственная за межнуклеосомную фрагментацию ДНК в апоптотических клетках. Показана причинная связь гибели клетки с фрагментацией ДНК: введение в клетку гена, кодирующего активную форму CAD, вызывают ее гибель. Среди других причин апоптотической гибели клетки называют исчерпание ее энергетических ресурсов вследствие нарушения функций митохондрий и неконтролируемых расходов энергии на репарацию ДНК.
Фагоцитозу апоптотических клеток способствует экспрессия на их поверхности молекул, служащих для фагоцитов источником сигналов типа «съешь меня». Так, при апоптозе нарушается асимметрия мембраны, и фосфатидилсерин, в норме локализующийся на внутренней поверхности мембраны, оказывается экспонированным снаружи (выявление его экспрессии по связыванию с меченным аннексином V используют для идентификации апоптотических клеток). Появляющиеся на поверхности фосфатидилсерин, а также тромбоспондин и десиалированные остатки мембранных гликоконъюгатов распознаются рецепторами фагоцитов (как профессиональных, так и факультативных), что обеспечивает быстрый фагоцитоз апоптотических клеток. Такое завершение апоптоза чрезвычайно важно для организма, поскольку предотвращает поступление внутриклеточных компонентов, включая ДНК, в межклеточное пространство и последующее развитие воспаления и аутоиммунных процессов. В то же время чрезмерно интенсивное поглощение фрагментов ДНК может активировать (через внутриклеточные TLR) патологические процессы, ведущие к развитию системной аутоиммунной патологии, например, системной красной волчанки (СКВ).
Апоптозу принадлежит важная роль не только в селекции лимфоцитов, но и в других процессах, связанных с развитием лимфоцитов, морфогенезом лимфоидных органов, а также проявлением активности клеток иммунной системы, прежде всего в контактном цитолизе (табл. 3.21).
Таблица 3.21. Участие апоптоза в формировании иммунной системы и реализации иммунологических процессов
| Этапы развития и функционирования клеток иммунной системы | События | Проявления апоптоза (в скобках — механизмы) |
| Формирование популяций лимфоцитов | Ранние этапы формирования популяций | Гибель избыточных клеток (вследствие дефицита факторов выживания) |
| Формирование антигенрас- познающих рецепторов | Выбраковка клеток с дефектами реаранжировки рецепторных генов (отсутствие сигналов от стромальных клеток) | |
| Селекция клонов | Гибель клеток, не распознающих аутологичные комплексы MHC—пептид (апоптоз «по умолчанию»), при положительной селекции и гибель аутоспецифических клеток (активационный апоптоз) при отрицательной селекции | |
| Дифференцировка субпопуляций | Апоптоз Т-клеток при несоответствии специфичности рецептора и корецептора | |
| Зрелые покоящиеся клетки | Гомеостатический контроль численности зрелых клеток | Гибель избыточных клеток (дефицит гомеостатических факторов выживания) |
| Элиминация старых клеток | Апоптоз старых клеток (вероятно включение эндогенной программы апоптоза) | |
| Иммунный ответ | Активация и пролиферация лимфоцитов | Активационный апоптоз (передача сигнала через мембранные рецепторы) |
| Созревание аффинности антител | Гибель низкоаффинных клонов В-клеток (конкуренция за антиген и помощь Т-хелперов) | |
| Элиминация эффекторных клеток | Апоптоз отработавших клеток (вероятно включение эндогенной программы апоптоза) | |
| Реализация цитотоксического эффекта лимфоцитов | Гибель клеток-мишеней цитотоксических лимфоцитов (передача апоптотического сигнала по перфорин/гран- зимному и рецепторному механизмам) |
Источник
Процесс, при котором клетка может убивать сама себя, называется запрограммированной клеточной гибелью (ЗГК). Этот механизм имеет несколько разновидностей и играет важнейшую роль в физиологии различных организмов, особенно многоклеточных. Самой часто встречающейся и хорошо изученной формой ЗГК является апоптоз.
Что такое апоптоз
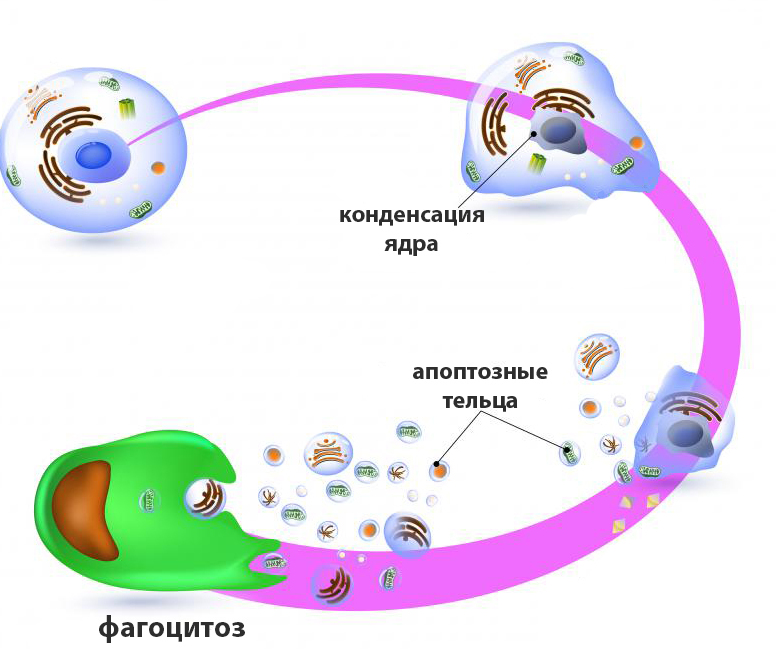
Апоптоз – это контролируемый физиологический процесс самоуничтожения клетки, характеризующийся поэтапным разрушением и фрагментацией ее содержимого с формированием мембранных пузырьков (апоптозных телец), впоследствии поглощаемых фагоцитами. Этот генетически заложенный механизм активируется под воздействием определенных внутренних или внешних факторов.
При таком варианте гибели клеточное содержимое не выходит за пределы мембраны и не вызывает воспаление. Нарушения в регуляции апоптоза приводят к серьезным патологиям, таким как неконтролируемые клеточные деления или дегенерация тканей.
Апоптоз представляет собой лишь одну из нескольких форм запрограммированной гибели клетки (ЗГК), поэтому отождествлять эти понятия ошибочно. К известным видам клеточного самоуничтожения относят также митотическую катастрофу, аутофагию и программированный некроз. Другие механизмы ЗГК пока не изучены.
Причины апоптоза клеток
Причиной запуска механизма запрограммированной клеточной гибели могут быть как естественные физиологические процессы, так и патологические изменения, вызванные внутренними дефектами или воздействием внешних неблагоприятных факторов.
В норме апоптоз уравновешивает процесс деления клеток, регулируя их количество и способствуя обновлению тканей. В таком случае причиной ЗГК служат определенные сигналы, входящие в систему контроля гомеостаза. С помощью апоптоза уничтожаются одноразовые или выполнившие свою функцию клетки. Так, повышенное содержание лейкоцитов, нейтрофилов и других элементов клеточного иммунитета по окончании борьбы с инфекцией устраняется именно за счет апоптоза.
Запрограммированная гибель является частью физиологического цикла репродуктивных систем. Апоптоз задействован в процессе оогенеза, а также способствует гибели яйцеклетки при отсутствии оплодотворения.
Классическим примером участия апоптоза клеток в жизненном цикле вегетативных систем является осенний листопад. Сам термин происходит от греческого слова apoptosis, что буквально переводится как «опадание».
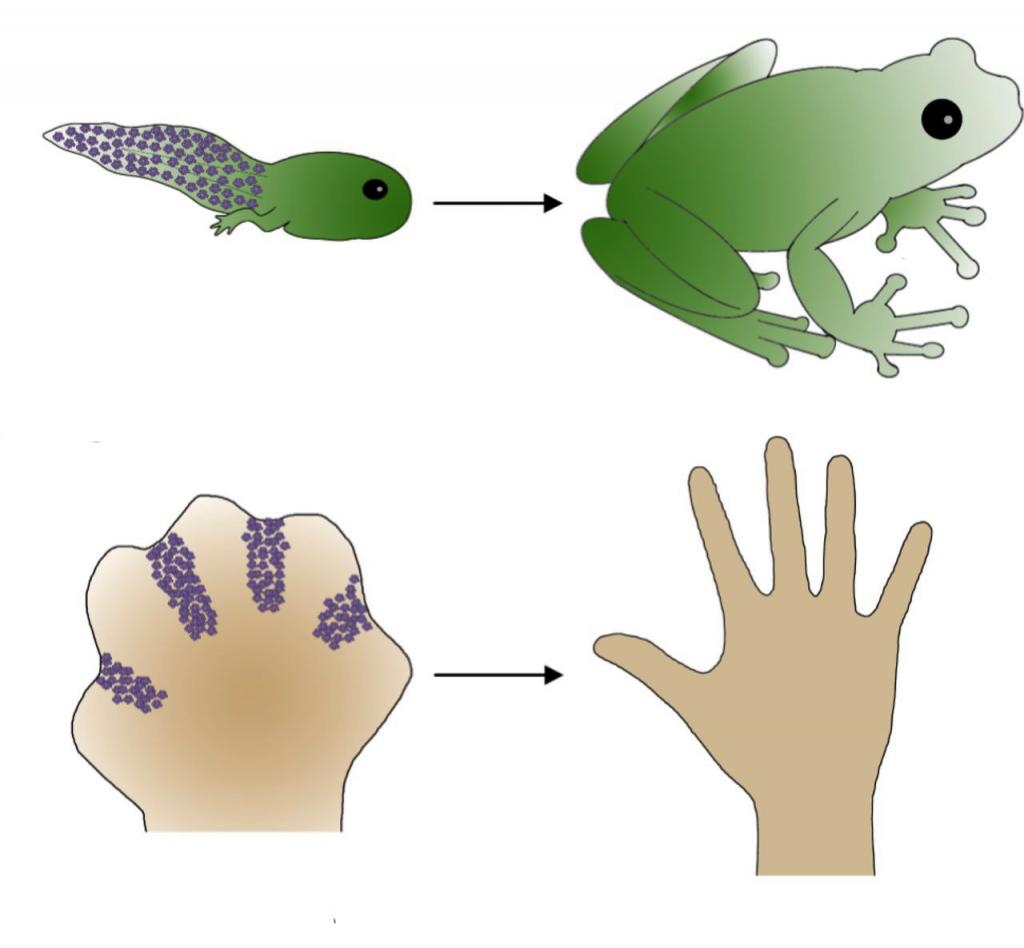
Апоптоз играет важнейшую роль в эмбриогенезе и онтогенезе, когда в организме сменяются ткани и атрофируются определенные органы. Примером могут служить исчезновение перепонок между пальцами конечностей некоторых млекопитающих или отмирание хвоста при метаморфозе лягушки.
Апоптоз может быть спровоцирован накоплением дефектных изменений в клетке, возникших в результате мутаций, старения или ошибок митоза. Причиной запуска ЗГК могут быть неблагоприятная среда (недостаток питательных компонентов, дефицит кислорода) и патологические внешние воздействия, опосредованные вирусами, бактериями, токсинами и т. д. При этом если повреждающий эффект слишком интенсивен, то клетка не успевает осуществить механизм апоптоза и погибает в результате развития патологического процесса – некроза.

Морфологические и структурно-биохимические изменения клетки во время апоптоза
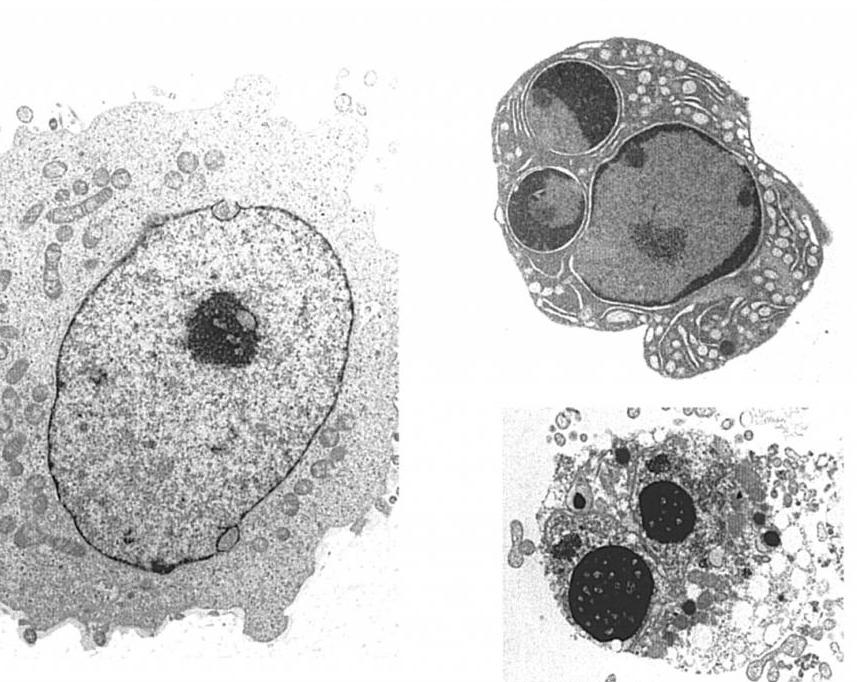
Процесс апоптоза характеризуется определенным набором морфологических изменений, которые с помощью микроскопии можно наблюдать в препарате ткани in vitro.
К основным признакам, характерным для апоптоза клеток, относят:
- перестраивание цитоскелета;
- уплотнение клеточного содержимого;
- конденсацию хроматина;
- фрагментацию ядра;
- уменьшение объема клетки;
- сморщивание контура мембраны;
- образование пузырьков на клеточной поверхности,
- деструкцию органоидов.
У животных эти процессы завершаются образованием апоптоцитов, которые могут быть поглощены как макрофагами, так и соседними клетками ткани. У растений формирования апоптозных телец не происходит, а после деградации протопласта сохраняется остов в виде клеточной стенки.
Помимо морфологических изменений, апоптоз сопровождается рядом перестроек на молекулярном уровне. Происходит повышение липазной и нуклеазной активностей, которые влекут за собой фрагментацию хроматина и многих белков. Резко увеличивается содержание сАМФ, изменяется структура клеточной мембраны. В растительных клетках наблюдается образование гигантских вакуолей.
Чем апоптоз отличается от некроза
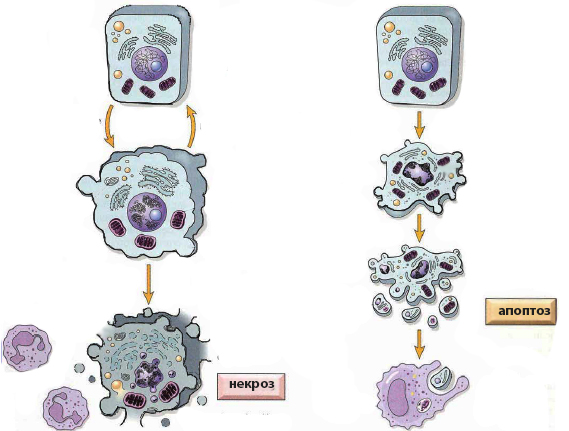
Главное различие между апоптозом и некрозом заключается в причине клеточной деградации. В первом случае источником разрушения служат молекулярные инструменты самой клетки, которые работают под строгим контролем и требуют затрат энергии АТФ. При некрозе происходит пассивное прекращение жизнедеятельности из-за внешнего повреждающего воздействия.
Апоптоз – это естественный физиологический процесс, сконструированный таким образом, чтобы не вредить окружающим клеткам. Некроз – это неконтролируемое патологическое явление, возникающее в результате критических повреждений. Поэтому неудивительно, что механизм, морфология и последствия апоптоза и некроза во многом противоположны. Однако имеются и общие черты.
| Характеристика процесса | Апоптоз | Некроз |
| объем клетки | уменьшается | увеличивается |
| целостность мембраны | сохраняется | нарушается |
| воспалительный процесс | отсутствует | развивается |
| энергия АТФ | затрачивается | не используется |
| фрагментация хроматина | имеется | присутствует |
| резкое падение концентрации АТФ | есть | есть |
| итог процесса | фагоцитоз | выброс содержимого в межклеточное пространство |
В случае повреждения клетки запускают механизм запрограммированной гибели в том числе для того, чтобы не допустить некротического развития. Однако недавние исследования показали, что существует иная непатологическая форма некроза, которую также отнесли к ЗГК.
Биологическое значение апоптоза
Несмотря на то что апоптоз приводит к клеточной гибели, его роль для поддержания нормальной жизнедеятельности всего организма очень велика. Благодаря механизму ЗГК осуществляются следующие физиологические функции:
- поддержание баланса между пролиферацией и смертью клеток;
- обновление тканей и органов;
- устранение дефектных и «старых» клеток;
- защита от развития патогенного некроза;
- смена тканей и органов при эмбрио- и онтогенезе;
- удаление ненужных элементов, выполнивших свою функцию;
- устранение клеток, нежелательных или опасных для организма (мутантных, опухолевых, зараженных вирусом);
- предотвращение развития инфекции.
Таким образом, апоптоз является одним из способов поддержания клеточно-тканевого гомеостаза.
У растений апоптоз часто запускается, чтобы блокировать распространение инфицирующих ткани паразитических агробактерий.

Этапы клеточной смерти
То, что происходит с клеткой при апоптозе, является результатом сложной цепочки молекулярных взаимодействий между различными ферментами. Реакции проходят по типу каскада, когда одни белки активируют другие, способствуя постепенному развитию сценария гибели. Этот процесс можно разделить на несколько этапов:
- Индукция.
- Активация проапоптических белков.
- Активация каспаз.
- Разрушение и перестройка клеточных органелл.
- Формирование апоптоцитов.
- Подготовка клеточных фрагментов к фагоцитозу.
Синтез всех компонентов, необходимых для запуска, реализации и контроля каждого этапа заложен генетически, почему апоптоз и называют запрограммированной гибелью клетки. Активация этого процесса находится под строгим контролем регуляторных систем, включающих в том числе и различные ингибиторы ЗГК.
Молекулярные механизмы апоптоза клетки
Развитие апоптоза обуславливается совокупным действием двух молекулярных систем: индукционной и эффекторной. Первый блок отвечает за контролируемый запуск ЗГК. В него входят так называемые рецепторы смерти, Cys-Asp-протеазы (каспазы), ряд митохондриальных компонентов и проапоптических белков. Все элементы индукционной фазы можно разделить на тригеры (участвуют в индукции) и модуляторы, обеспечивающие трансдукцию сигнала смерти.
Эффекторную систему составляют молекулярные инструменты, обеспечивающие деградацию и перестройку клеточных компонентов. Переход между первой и второй фазами осуществляется на этапе протеолитического каспазного каскада. Именно за счет компонентов эффекторного блока происходит гибель клетки при апоптозе.
Факторы апоптоза
Структурно-морфологические и биохимические изменения при апоптозе осуществляются определенным набором специализированных клеточных инструментов, среди которых наиболее важными являются каспасы, нуклеазы и мембранные модификаторы.
Каспазы – группа ферментов, разрезающих пептидные связи по остаткам аспарагина, фрагментируя белки на крупные пептиды. До начала апоптоза присутствуют в клетке в неактивном состоянии из-за ингибиторов. Главной мишенью каспаз являются ядерные белки.
Нуклеазы – ответственны за разрезание молекул ДНК. Особо важна в развитии апоптоза активная эндонуклеаза CAD, разрывающая участки хроматина в областях линкерных последовательностей. В результате образуются фрагменты длиной 120-180 нуклеотидных пар. Комплексное воздействие протеолитических каспаз и нуклеаз приводит к деформации и фрагментации ядра.

Модификаторы клеточной мембраны – нарушают асимметричность билипидного слоя, превращая его в мишень для фагоцитирующих клеток.
Ключевая роль в развитии апоптоза принадлежит каспазам, которые поэтапно активируют все последующие механизмы деградации и морфологической перестройки.
Роль каспаз в клеточной гибели
Семейство каспаз включает 14 белков. Часть из них не задействована в апоптозе, а остальные подразделяются на 2 группы: инициаторные (2, 8, 9, 10, 12) и эффекторные (3, 6 и 7), которые иначе называются каспазами второго эшелона. Все эти белки синтезируются в виде предшественников – прокаспаз, активируемых протеолитическим расщеплением, суть которого состоит в отсоединении N-концевого домена и разделении оставшейся молекулы на две части, в последствии ассоциирующиеся в димеры и тетрамеры.
Инициаторные каспазы необходимы для активации эффекторной группы, которая проявляет протеолитическую активность в отношении различных жизненно важных клеточных белков. К субстратам каспаз второго эшелона относятся:
- ферменты репарации ДНК;
- игибитор белка р-53;
- поли-(ADP-рибозо)-полимераза;
- ингибитор ДНК-азы DFF (разрушение этого белка приводит к активации эндонуклеазы CAD) и др.
Общее количество мишеней эффекторных каспаз насчитывает более 60 белков.
Ингибирование апоптоза клеток еще возможно на стадии активации инициаторных прокаспаз. Когда эффекторные каспазы вступают в действие, процесс становится необратимым.
Пути активации апоптоза
Передача сигнала для запуска апоптоза клетки может быть осуществлена двумя путями: рецепторным (или внешним) и митохондриальным. В первом случае процесс активируется через специфические рецепторы смерти, воспринимающие внешние сигналы, которыми служат белки семейства TNF (фактора некроза опухолей) или Fas-лиганды, расположенные на поверхности Т-киллеров.
В состав рецептора входит 2 функциональных домена: трансмембранный (предназначенный для связи с лигандом) и ориентированный внутрь клетки «домен смерти», индуцирующий апоптоз. Механизм рецепторного пути основывается на образовании DISC-комплекса, активирующего инициаторные каспазы 8 или 10.
Сборка начинается со взаимодействия домена смерти с внутриклеточными адапторными белками, которые, в свою очередь, связывают инициаторные прокаспазы. В составе комплекса последние превращаются в функционально-активные каспазы и запускают дальнейший апоптозный каскад.
Механизм внутреннего пути основан на активации протеолитического каскада особыми митохондриальными белками, выброс которых контролируется внутриклеточными сигналами. Выход компонентов органоидов осуществляется через образование огромных пор.
Особая роль в запуске принадлежит цитохрому с. Попадая в цитоплазму, этот компонент электротранспортной цепи связывается с белком Apaf1 (апоптотический фактор активации протеаз), что приводит к активации последнего. Затем Apaf1 связывают инициаторные прокаспазы 9, которые по механизму каскада запускают апоптоз.
Контроль внутреннего пути осуществляется особой группой белков семейства Bcl12, которые регулируют выход межмембранных компонентов митохондрий в цитоплазму. В составе семейства имеются как проапоптические, так и антиапоптические белки, баланс между которыми и определяет, будет ли запущен процесс.
К одним из мощных факторов, запускающих апоптоз по митохондриальному механизму, относятся реактивные формы кислорода. Еще одним значимым индуктором является белок р53, который активирует митохондриальный путь при наличии ДНК-повреждений.
Иногда запуск апоптоза клеток сочетает в себе сразу два пути: как внешний, так и внутренний. Последний обычно служит для усиления рецепторной активации.
Источник
