Цитотоксический иммунитет в клеточных реакциях
Иммунный ответ.
Иммунный ответ — это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном и направленная на его элиминацию.
Основные задачи иммунного ответа:
• распознавание лимфоцитами антигена в нативном состоянии (например, молекулы патогена) и представленного на поверхности модифицированных клеток (например, заражённых вирусами);
• деструкция патогена и повреждённых клеток;
• элиминация (выведение) продуктов деструкции из организма;
• формирование иммунной памяти.
Различают следующие формы иммунного ответа:
-клеточный
-гуморальный
иммунологическая толерантность.
В иммунном ответе принимают участие иммунокомпетентные клетки, которые могут быть разделены на антигенпрезентирующие (представляющие АГ), регуляторные (регулирующие течение иммунных реакций) и эффекторы иммунного ответа (осуществляющие заключительный этап в борьбе с АГ).
Иммунный ответ начинается с поглощения антигена антигенпрезентирующей клеткой. Этот процесс обозначается термином процессинг. В качестве АПК теоретически может выступать дендритные клетки, макрофаги и В-лимфоциты. Однако при первичном иммунном ответе, требующем вовлечения наивных Т-лимфоцитов, роль АПК могут эффективно выполнять только дендритные клетки. Затем происходит частичная деградация антигена с вычленением эпитопов. После этого в цитоплазме АПК каждый вычлененный эпитоп соединяется с молекулой МНС и образуется «процессированный антиген» – так называется комплекс эпитоп + МНС. Этот этап заканчивается презентацией процессированного антигена. Презентацией антигена называется вывод комплекса эпитоп + МНС на поверхностную мембрану антигенпрезентирующей клетки, а сам этот комплекс обозначается как презентированный антиген.
Дендритные клетки мигрируют в тканевую жидкость, а затем — в лимфу. С током афферентной лимфы дендритные клетки проникают в региональные лимфатические узлы. Попав в ткань лимфатического узла, дендритные клетки мигрируют в Т-зоны, Оказавшись в Т-зоне лимфоидных органов, дендритные клетки созревают (признак созревания — экспрессия молекул CD83) они сами начинают привлекать Т-лимфоциты, поступающие в узел в процессе рециркуляции. Т.о. происходит накопление Т-клеток необходимой специфичности в региональном лимфатическом узле. Комплекс эпитоп + МНС-II презентируется Т-хелперам, а комплекс эпитоп + МНС-I презентируется Т-киллерам (CD8-лимфоцитам).Первыми активируются Т-хелперы — CD4+ Т-лимфоциты, выступающие в качестве инициаторов антигенспецифической фазы иммунного процесса.На этом этапе CD4+ Т-клетки обозначаются как Th0-клетки.
Т-лимфоциты и дендритные клетки находятся в достаточно тесном контакте и непрерывно взаимодействуют друг с другом с помощью молекул адгезии и различных мембранных рецепторов. формируется зона устойчивого межклеточного контакта — иммунный синапс. Процесс рециркуляции непрерывен, поэтому практически все Т-лимфоциты, принадлежащие тому клону, который специфичен к комплексам пептид-МНС, присутствующим на поверхности интердигитальных клеток, взаимодейсвуют с дендритными клетками регионального лимфатического узла и задерживаются в нем. Описанный процесс называется улавливанием (рекрутированием) клонов Т-лимфоцитов. Аналогичным образом осуществляется презентация антигенных пептидов Т-клеткам макрофагами и В-лимфоцитами в ходе иммунного ответа.
Под активацией клеток понимают их переход из состояния покоя в функционально активное состояние. Процесс активации Т-хелпера начинается с получения им информационных сигналов от антигенпрезентирующей клетки. Первый информационный сигнал обусловлен контактом при полном соответствии TСR Т-хелпера с презентированным антигеном на поверхности АПК.
Второй и последующие информационные сигналы обусловлены корецепторными взаимодействиями Т-хелпера с АПК, что обозначают термином «костимуляция». Костимуляция Т-клеток — обязательный компонент презентации антигена.
Наиболее важная молекула костимуляции — CD28,расположена на поверхности Т-хелпера. В результате ее взаимодействия с молекулами CD80 и/или CD86, расположенными на поверхности АПК, происходит усиление активирующего сигнала, исходящего от рецепторного комплекса TCR–CD3.
Другую группу костимулирующих молекул образуют мембранные молекулы, которые относят к семейству рецепторов фактора некроза опухоли. Через них происходит активация дендритных клеток, макрофагов и В-лимфоцитов. Собственно хелперная функция Т-клеток в отношении В-лимфоцитов, необходимая для осуществления гуморального иммунного ответа, реализуется именно через этот путь костимуляции.
Эти информационные сигналы инициируют внутри Т-хелпера определенные биохимические реакции, что обуславливает пролиферацию (размножение) клона Т-хелпера (происходит так называемая экспансия клона).
Исходная численность клеток в каждом клоне Т-лимфоцитов мала и недостаточна для защиты организма от патогенов и других источников биологической агрессии. Именно поэтому первый процесс, в который вовлекаются активированные Т-клетки, — пролиферация. IL-2-зависимая пролиферация CD4+ Т-лимфоцитов продолжается 3–5 сут после активации. Она обеспечивает умножение численности клеток в клонах, вовлекаемых в иммунный ответ. Их число может превысить 106 . Это обеспечивает должную эффективность иммунного ответа.
В процессе размножения CD4+ Т-клеток запускается процесс их дифференцировки на субпопуляции. Такие субпопуляции называют адаптивными, поскольку они образуются в ходе адаптивного иммунного ответа на антигены, в отличие от естественных субпопуляций, формирующихся в ходе антигеннезависимой дифференцировки Т-клеток. Ранее других образуются 2 популяции Т-хелперв — Th1 и Th2 (Th — T-helper). Направления дифференцировки Т-хелперов (а следовательно, типа ответа) соответствует природе патогена.
Их дифференцировка зависит от действия по меньшей мере двух сигналов. Один из них поступает через TCR и ≪сообщает≫ о распознавании антигена в комплексе с молекулой MHC. Второй сигнал поставляют цитокины. Определение мембранных маркеров редко используют для дифференцирования Th1- и Th2-клеток. Главным подходом при разграничении Th1- и Th2-клеток служит оценка спектра секретируемых ими цитокинов, что представляется вполне адекватным, поскольку именно цитокины определяют специфические функции этих клеток. Так, ключевой цитокин Th1-клеток реализует основной эффект Th1-клеток — активацию макрофагов, одновременно подавляя развитие и активность Th2-клеток. Функции Th2-клеток в значительной степени определяются секрецией цитокина — обеспечение пролиферации активированных В-клеток, важную роль в запуске образования антител и ингибировании Th1-клеток. Т.о. через цитокины Th1- и Th2-клетки способны ингибировать развитие и функционирование друг друга.
Выбор направления дифференцировки Т-хелперов диктуется, с одной стороны, свойствами антигенов возбудителей, с другой — дополнительными факторами (пути поступления патогена, его способность взаимодействовать с различными клетками врожденного иммунитета и т.д.). Выбор преимущественно тех субспопуляций Т-хелперов также способствует вовлечению в иммунный ответ различных предшественников эффекторных клеток, что определяет в конечном итоге эффективность иммунного ответа.
Любой иммунный ответ включает две основные фазы — индуктивную и эффекторную.
Содержанием индуктивной фазы являются восприятие антигенного стимула лимфоцитами (достигаемое презентацией антигена) и дифференцировка эффекторных клеток. На осуществление этих процессов требуется примерно 1 неделя.
Содержание эффекторной фазы состоит в осуществлении защитных реакций эффекторными клетками. Различают 3 основных типа эффекторных Т-клеток, определяющих развитие иммунного ответа: цитотоксический Т-лимфоцит (Т-киллер), хелперная клетка Th1, хелперная клетка Th2. В случае гуморального иммунитета эффекторная фаза включает также выработку антител и поэтому называется еще продуктивной фазой ответа. Эффекторная фаза реализуется в последующие 1–2 нед.
После реализации иммунного ответа, т.е. элиминации чужеродных антигенов и их носителей, происходит запуск регуляторных (ограничительных) механизмов, приводящих к устранению морфологических и метаболических последствий иммунного ответа.
В иммунной системе сохраняется ≪след≫ иммунного ответа в виде иммунологической памяти, носителями которой служат Т- и В-клетки памяти.
Клеточный иммунный ответ направлен на защиту от внутриклеточных патогенов. В зависимости от локализации патогенов в цитоплазме или в фаголизосомах различают 2 варианта клеточного иммунного ответа — цитотоксический и воспалительный.
Цитотоксический клеточный иммунный ответ участвует преимущественно в защите от вирусных инфекций, а также от некоторых одноклеточных патогенов (лямблии, трихомонады). Кроме того, ему принадлежит важная роль в противоопухолевой защите.
Цитотоксический иммунный ответ осуществляют Т-лимфоциты, экспрессирующие корецептор CD8. Отличительной чертой этого вида иммунного ответа является:
презентация антигена осуществляется непосредственно Т- лимфоциту CD8, который одновременно выполняет и функцию антигенраспознающей и эффекторной клетки.
антигенный пептид презентируется в составе молекул MHC-I (MHC-I локализуются на всех ядросодержащих клетках организма)
в основе его эффекторных механизмов лежит контактный цитолиз – фагоцитоз, однако Т-клетки реализуют контактный цитолиз на основе специфического распознавания конкретных антигенов возбудителя и формируют иммунологическую память.
Цитотоксический иммунный ответ проходит в 4 этапа
I. Презентация дендритными клетками антигена CD8+ Т-лимфоцитам, приводящая к их активации.
II. пролиферация CD8+ Т-клеток
III. Дифференцировка CD8+ Т-клеток в цитотоксические Т-лимфоциты
(CTL), так называемые «прямые» киллеры.
IV. Реализация цитолиза клеток-мишеней.
Презентация и активация антигена происходит по тем же принципам, что и для Т-хелперов. Однако для развития эффективного ответа CD8+ Т-клетки должны получить стимулы от CD4+ Т-клеток через костимулирующую молекулу CD40. Пролиферативная экспансия клонов CD8+ Т-клеток длится 5–7 сут. Интенсивность деления активированных CD8+ Т-клеток выше, чем любых других лимфоцитов, вовлекаемых в иммунный ответ. Пролиферация обеспечивает увеличение численности цитотоксических Т-клеток в 50 000 раз. Как и в случае Т-хелперов, дифференцировка цитотоксических Т-лимфоцитов начинается в процессе их пролиферативной экспансии. В процессе дифференцировки цитотоксические Т-лимфоцитов мигрируют не в лимфоидные органы, а в барьерные ткани и очаги воспаления — в очаг и инфицирования вирусами и другими патогенами. В эпителии слизистой оболочки кишечника они составляют преобладающий клеточный тип.
Цитолиз клеток Т-лимфоцитами происходит с участием перфорина. Перфорин представляет собой особый протеин. В гранулах цитотоксических лимфоцитах он находится в виде растворимого белка-предшественника. Будучи секретирован Т-киллером, перфорин в течение нескольких секунд полимеризуется в мембране клетки-мишени с образованием поры. В результате клетка-мишень разрушается в результате осмотического лизиса. При этом цитолиз не сопровождается развитием гнойной воспалительной реакции и повреждением тканей. Однако, цитотоксические Т-лимфоциты используют еще один механизм контактного киллинга. Его суть состоит в передаче летального сигнала. При этом включается рецепторный механизм индукции апоптоза (генетически запрограммированная гибель клеток) клеток-мишеней, которые удаляются путем фагоцитоза макрофагами и дендритными клетками еще до их распада. На организацию сигнала к апоптозу для клетки-мишени цитотоксическому лимфоциту требуется не более 5 минут, после чего он физически переходит к другой клетке-мишени. Т.е. ЦТЛ является серийным киллером.
После успешного завершения цитотоксического иммунного ответа в течение нескольких дней 90–95% цитотоксических Т-лимфоцитов подвергается апоптозу. В то же время завершается формирование популяции CD8+ Т-клеток памяти, которые сами по себе лишены цитотоксической активности, но быстро приобретают ее при повторном распознавании специфического антигена. Это долгоживущие и не до конца дифференцированные Т-лимфоциты, которые при повторном контакте с причинным антигеном обуславливают развития вторичного иммунного ответа. В отличие от первичного (т.е. в ответ на первый контакт с антигеном), вторичный иммунный ответ развивается значительно быстрее, так как начинается не с одного клона недифференцированных клеток, а со сравнительно многочисленного пула клеток, уже прошедших первые стадии дифференцировки.
Читайте также:
Рекомендуемые страницы:
©2015-2020 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2016-08-08
Нарушение авторских прав и Нарушение персональных данных
Источник
Глава 10. Реакции клеточного иммунитета
ЦИТОТОКСИЧНОСТЬ Т- И НК-КЛЕТОК
В защитных реакциях, направленных на устранение инфицированных вирусами клеток организма, действуют цитотоксические Т- и НК-клетки
Клеточная цитотоксичность — важный механизм защиты против внутриклеточно локализованных возбудителей, таких как вирусы, некоторые бактерии и простейшие. Цитотоксическую активность могут проявлять несколько типов клеток — цитотоксические Т-клетки (Тц), нормальные киллерные клетки (НК) и иногда клетки миелоидного ряда, причем механизмы распознавания мишеней у них различные (рис. 10.12).
• Цитотоксические Т-клетки распознают специфические антигены (например, вирусные пептиды на поверхности инфицированных клеток) в ассоциации с молекулами МНС. Большая часть Тц-клеток несет маркер CD8 + и распознает антиген, презентируемый в ассоциации с молекулами МНС класса I, но примерно 10 % МНС-рестриктированных цитотоксических Т-клеток относятся к субпопуляции CD4+и распознают антиген в ассоциации с молекулами МНС класса II.
• Нормальные киллеры распознают клетки, у которых отсутствует экспрессия молекул МНС класса I. Кроме отрицательного, НК-клеткам свойственно и положительное распознавание своих мишеней с помощью рецепторов к различным лигандам. Например, благодаря Fc-рецепторам (CD16) они способны связывать антитела, образовавшие иммунные комплексы с антигенами на поверхности клеток-мишеней, — так называемая антителозависимая клеточная цитотоксичность (АЗКЦ), или киллерная (К) клеточная активность.
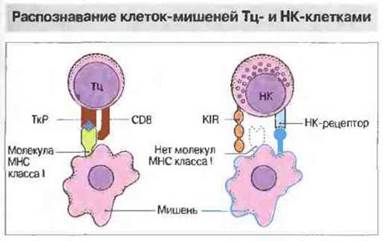
Рис. 10.12. Цитотоксические Т-клетки (Тц) своим рецептором (ТкР) распознают процессированный антиген, который представлен в ассоциации с молекулами МНС на клетке-мишени. Большинство Тц-клеток относится к субпопуляции CD8+и распознает антиген, презентированный в ассоциации с молекулами МНС класса I, но меньшая их часть, относящаяся к субпопуляции CD4+, способна распознавать антиген в ассоциации с молекулами МНС класса II. В отличие от Тц-, НК-клетки несут рецепторы подавления цитотоксичности (KIR, от англ. killer inhibitory receptor). Распознавая на клетке-мишени молекулы МНС класса I, эти рецепторы дают сигнал торможения цитотоксической активности. Положительное распознавание мишеней НК-клетками происходит с участием их собственных особых рецепторов (НК-рецепторы), в частности CD2 и CD69, или антител, с которыми они связываются через рецептор для Fc (CD16).
Главная функция Тц — это устранение клеток, зараженных вирусами (см. гл. 16). Почти все имеющие ядро клетки экспрессируют молекулы МНС класса I и в случае вирусной инфекции способны презентировать антиген возбудителя цитотоксическим Т-клеткам CD8+. Подробнее механизмы такой презентации рассмотрены в гл. 9. Собственные молекулы клеток после частичного расщепления в протеазомах транспортируются к эндоплазматическому ретикулуму, где они образуют комплекс с молекулами МНС класса I, и затем на поверхность клетки. Таким путем каждая клетка представляет «образцы» своих молекул для «осмотра» и опознавания Тц-клеткам CD8+. Тем же способом происходит презентация антигенов из микробов, которые локализуются внутри клеток.
Иногда для стабилизации связи между Тц- клеткой и ее мишенью требуются дополнительные взаимодействия (рис. 10.13); они могут способствовать и цитолизу. Например, цитолиз клеток-мишеней связавшимися с ними Тц-клетками in vitro можно вызвать антителами к CD3 или CD2, маркерам поверхности Тц. Вероятно, аналогичным образом цитолитическую активность Тц-клеток «включает» связывание с этими молекулами физиологических лигандов.

Рис. 10.13. Некоторые из лигандов, принимающих участие во взаимодействии между цитотоксическими Т-клетками и их мишенями.
Некоторые вирусы, в частности вирусы герпеса, пытаются избежать распознавания Тц-клетками, подавляя экспрессию молекул МНС класса I на поверхности инфицированных клеток; однако в этом случае вирус распознают НК-клетки. Следовательно, Тц- и НК-клетки можно рассматривать как два взаимодополняющих инструмента иммунитета против вирусной инфекции тканей.
Цитотоксическую активность НК-клеток подавляют молекулы МНС класса I
НК-клетки, происходящие в основном из больших гранулярных лимфоцитов (БГЛ), у человека составляют примерно 5 % лимфоцитов периферической крови. Чаше всего они имеют фенотип CD3-CD16+CD56+CD94+(см. приложение 2) и гаметное (неперестроенное) расположение генов Т-клеточного рецептора. В первоначальных работах по определению специфичности цитотоксического действия НК было установлено, что резистентность к нему обусловлена определенными доминантными аллелями локуса HLA-C. Впоследствии оказалось, что НК-клетки действительно способны распознавать различные аллотипы молекул МНС, однако любые из этих молекул, в том числе аллотипы локусов НLA-A и НLA-B, могут подавлять цитолиз.
Недавно опубликовано новое, весьма многообещающее открытие: обнаружены молекулы HLA-G, экспрессируемые только на клетках трофобласта и представляющие собой эффективные ингибиторы НК-цитотоксичности, которые обеспечивают устойчивость ко всем типам НК-клеток. Клетки трофобласта (наружный слой бластоцисты у млекопитающих) контактируют, когда сформирована плацента, с циркулирующей кровью матери, в отношении которой они аллогенны, поскольку обладают отцовскими генами МНС. Однако в этих клетках экспрессия всех обычных антигенов МНС, за исключением HLA-G, регуляторно подавлена. Следовательно, молекулы HLA-G необходимы для защиты плаценты от действия материнских НК-клеток.
НК-клетки распознают антигены МНС класса 1 с помощью молекул двух видов (рис. 10.14). Молекулы одною из них относятся к лектинам С-типа и первоначально были идентифицированы у мыши (Ly49) и крысы, а затем у человека (предположительно, CD94). Молекулы второго вида — это представители суперсемейства иммуноглобулин-подобных молекул, CD158а и CD158b (они связываются с различными молекулами HLA-C и имеют каждая по два IgSF-домена (от англ. immunoglobulin supergene family), а также обладающий тремя IgSF-доменами белок р70. Рецепторные молекулы этого типа вначале были идентифицированы у человека, позже эквивалентные структуры удалось выявить на клетках грызунов.

Рис. 10.14. Два типа рецепторов, опосредующих подавление молекулами МНС класса I цитотоксичности НК-клеток: иммуноглобулин-подобные молекулы (трехдоменный белок р70 и двухдоменные белки р50 и р58) и специфические лектины С-типа, в том числе Ly49 у мыши и CD94 у человека.
На поверхности НК- и К-клеток имеется несколько разных рецепторов для идентификации мишеней
НК-клетки атакуют свои мишени при участии в качестве рецепторов молекул CD2, CD16 и CD69, а также лектин-подобных рецепторов, сходных с теми, которые подавляют цитотоксичность. Рецептором для Fc (CD16) НК-клетки связываются с молекулами антител, присоединившихся к поверхности клеток-мишеней и тем самым опосредующих АЗКЦ (рис. 10.15). Обычно это интерпретируется как проявление киллерной (К) клеточной активности, но помимо Н К-клеток такую функцию могут выполнять и другие типы клеток с Fc-рецепторами, в частности Т-клетки. Экспрессирующие Fc-рецепторы клетки миелоидного ряда также проявляют К-клеточную активность, но, по всей вероятности, в отличие от НК- и Т-клеток, с использованием иных механизмов цитолиза (см. ниже).
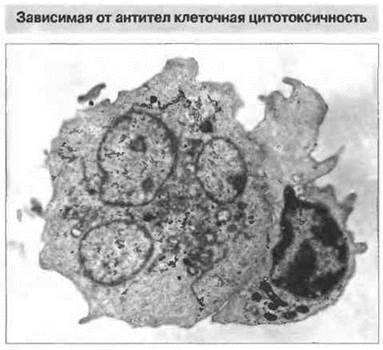
Рис. 10.15. К-клеточная активность. Электронно-микроскопическая фотография лимфоцита (расположен справа), атакующего нагруженную антителами клетку-мишень (расположена слева), х 2500. (Фото любезно предоставлено д-ром Р. Penfold.)
Потенциальная мишень для К-клетки — это экспрессированные на клеточной поверхности вирусные антигены, молекулы МНС и отдельные эпитопы, свойственные опухолевым клеткам. Кроме того, моноциты и (судя по некоторым противоречивым сообщениям) полиморфноядерные гранулоциты могут проявлять киллерную активность в отношении нагруженных антителами клеток опухолей. Такие клетки миелоидного ряда, как моноциты и эозинофилы, выполняют, несомненно, важную эффекторную роль в уничтожении нагруженных антителами шистосомул (см. гл. 18).
Активированные цитокинами клетки-киллеры относятся, вероятно, к НК-клеткам
В иммунологии разрабатывается несколько направлений экспериментальной иммунотерапии рака. Одно из них — это активация интерлейкином-2 in vitro собственных лимфоцитов больного с последующим их обратным введением. Такие лимфоциты, выделенные из крови или селезенки, получили название активированные цитокинами (лимфокинами) клетки-киллеры (ЛАК). Они проявляют не рестриктированную по МНС повышенную цитотоксичность и, по-видимому, происходят преимущественно из предшественников, не отличающихся от НК-клеток. Скорее всего, ЛАК — это продукт активации, а не какая- то особая клеточная линия. Способ противоопухолевой иммунотерапии с использованием ЛАК пока проходит этап клинических испытаний.
Цитотоксический эффект клеток-киллеров реализуется либо при контактном взаимодействии с мишенями, либо путем выделения цитокинов и экзоцитоза гранул
Для поражения мишени Тц-, НК- и К-клетки обладают несколькими механизмами воздействия. Один из них — это передача сигналов при непосредственном клеточном контакте через поверхностные структуры, другой непрямая сигнализация с помощью цитокинов. Кроме того, в цитоплазме многих цитотоксических Т-клеток CD8+ и БГЛ (НК- и К-клетки) обнаружены гранулы с белками, высвобождение которых вблизи цитоплазматической мембраны клетки-мишени вызывает ее повреждение. Какое из сочетаний этих трех механизмов цитотоксического действия будет использовано в конкретных условиях, зависит от типа цитотоксических клеток, в частности от субпопуляции Тц-клеток.
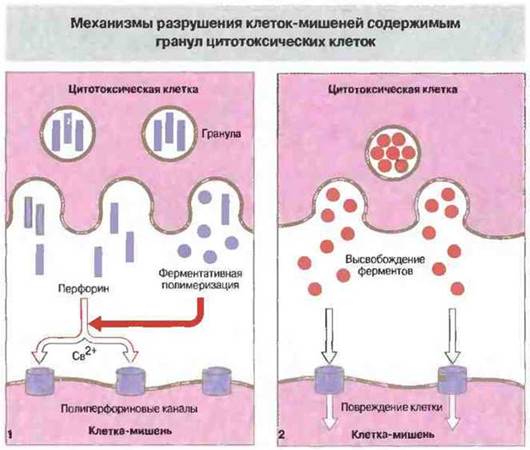
В гранулах цитотоксических Т-клеток содержатся перфорин и гранзимы. Гранулы НК-клеток и цитотоксических Т-клеток содержат несколько белков, в том числе перфорин и гранзимы (ассоциированные с гранулами ферменты). Как только цитотоксическая Т-клетка связывается со своей мишенью, гранулы внутри Тц перемешаются к тому участку мембраны, где произошел контакт с мишенью. Затем осуществляется Са2+-зависимое высвобождение содержимого из этих гранул в щель между цитотоксической клеткой и ее мишенью.
Перфорин — это мономерный белок, вызывающий образование пор в цитоплазматической мембране. По структуре и функции он близок к С9 (девятому компоненту системы комплемента). Кроме перфорина, гранулы содержат сериновую эстеразу, которая может входить в состав литического комплекса. В присутствии Са2+ мономеры перфорина связываются с мембраной клетки-мишени и полимеризуются, образуя трансмембранный канал. Несмотря на тесный контакт собственной плазматической мембраны с перфорином, сама цитотоксическая Т-клетка не повреждается им и продолжает поражать следующие клетки-мишени. Возможно, от самоповреждения Т-клетку защищает протеогликан хондроитин-сульфат А, который также присутствует в гранулах. Этот белок может связываться с перфорином и вызывать в результате его инактивацию.
Гранзимы — это набор сериновых эстераз, которые высвобождаются при экзоцитозе гранул и затем активируются. Действие гранзимов не обязательно для проявления цитотоксичности — клетки, лишенные этих ферментов, еще способны поражать свои мишени. Некоторые из гранзимов могут вызывать в клетках-мишенях запуск программы апоптоза и фрагментации ДНК, воздействуя на пути внутриклеточной сигнализации. Механизмы участия перфорина и гранзимов в цитолизе клеток-мишеней иллюстрирует рис. 10.16.

Рис. 10.16. При дегрануляции цитотоксических лимфоидных клеток перфорин и разнообразные ферменты (гранзимы) высвобождаются в непосредственной близости от цитоплазматической мембраны клетки-мишени. Затем происходит зависимая от Са2+ ферментативная полимеризация перфорина с образованием полиперфориновых каналов в мембране мишени (1). Через эти каналы внутрь клетки проникают выделяемые цитотоксической клеткой гидролитические ферменты и прочие токсические вещества, вызывающие повреждения (2).
Клетки-мишени могут также воспринимать цитотоксические сигналы через рецепторы для FasLи ФНО. Цитотоксические Т-клетки CD4+, как выяснилось, не содержат перфорин и поражают свои мишени в отсутствие Са2+. Таким образом, они обладают иным механизмом цитотоксического действия, что было доказано в опытах на Тц-клетках «нокаутных» мышей (полученных с использованием метода генного «нокаута»; см ниже). У таких мышей в результате направленной, сайт-специфической мутации не экспрессируется ген перфорина. В отсутствие перфорина цитотоксическая активность Т-клеток CD4+снижена, но не устранена полностью. Поиск дополнительного механизма цитотоксичности привел к идентификации на поверхности клеток-мишений группы молекул, связывание с которыми служит сигналом к апоптозу. Среди них прежде всего представляют интерес Fas (CD95) и рецепторы для ФНО. В эту группу молекул входят также СD30и CD40. Лиганд для Fas, т. е. FasL, экспрессируется на зрелых Т-клетках CD4+и CD8+ после их активации. Связывание FasL с рецепторными молекулами Fas вызывает агрегацию последних и присоединение к их внутриклеточным сегментам белка MORT-1, что в итоге приводит к апоптозу клеток-мишеней. От Fas зависит также выживание и устранение определенных субпопуляций лимфоцитов в период их созревания. По своему строению молекулы Fas похожи на рецепторы для ФНО. Например, те и другие имеют внутриклеточные (цитоплазматические) «смертоносные» домены — структурные мотивы, обнаруженные у ряда особых белков, контролирующих выживание клеток.
Гранулы Тц-клеток могут содержать также ФНОα и лимфотоксин (ФНОβ). Однако сами по себе эти цитокины не могут обеспечить цитотоксичность: отдельная Тц-кдетка способна вызвать гибель клетки-мишени за 3-4 ч, а действие ФНО проявляется гораздо позднее. Но сходство между ФНО-рецептором и Fas свидетельствует о потенциальном участии ФНОα и ФНОβ в поражении мишеней (рис. 10.17).
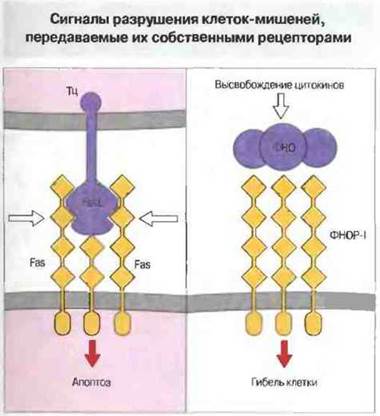
Рис. 10.17. Fas-лиганд (FasL) цитотоксических Т-клеток вызывает агрегацию молекул Fas-рецептора на поверхности клетки-мишени, вследствие чего происходит ассоциация внутриклеточных белков (например, MORT-1) начальное звено в цепи событий, ведущих к апоптозу. Fas имеет четыре внеклеточных домена (как представитель суперсемейства молекул, подобных рецептору для фактора роста нервов) и один цитоплазматический «домен клеточной гибели». Сигналом может также служить связывание ФНО с его специфическим рецептором первого типа (ФНОР-1), относящимся к тому же суперсемейству, что и Fas.
Итак, цитотоксическое действие Т-клеток CD8+основано на высвобождении содержимого гранул и экспрессии FasL, Т-клеток CD4+— в основном на экспрессии FasL, а НК-клеток, в первую очередь, на высвобождении содержимою гранул. В цитотоксическую активность всех этих клеток может вносить вклад ФНО.
Цитотоксическое действие клеток миелоидного ряда основано на целом ряде механизмов поражения мишеней
Уничтожение опухолевых клеток макрофагами часто обусловлено действием только ФНОα. Вместе с ИФγ, выделяемым Т- и НК-клетками. Этот цитокин вызывает мощный синергичный эффект цитолиза чувствительных опухолей (рис. 10.18). Механизмы цитотоксического действия, обусловленные активностью цитокинов, пока недостаточно изучены. В ряде случаев цитокины вызывают повышение активности циклооксигеназы и липоксигеназы с последующим внутриклеточным образованием свободных радикалов. Кроме того, возможны такие цитокин-зависимые эффекты, как образование свободных радикалов в результате митохондриального транспорта электронов и нарушение белкового синтеза. Клетки миелоидного ряда способны также выделять те же токсические медиаторы, которые действуют при разрушении микробных клеток внутри фагоцитов, в частности высокоактивные нестабильные метаболиты кислорода и азота (см. гл. 17).

Рис. 10.18. Помимо цитокинов, повреждение клеток-мишеней могут вызывать выделяемые клетками миелоидного ряда высокоактивные метаболиты кислорода и азота, катионные белки, гидролитические ферменты и компоненты комплемента.
Источник
