Crispr система иммунитета бактерий
…Планета Земля. Вокруг – необъятнейшие просторы воды, воздуха и почвы, кишащие твоими конкурентами: стоит тебе отличиться от соседа справа мутацией всего в одном важном гене, которая не даст тебе перерабатывать органику так же хорошо, как ему – и всё, твоя эволюционная гонка проиграна, манускрипт твоего генома забыт и вычеркнут из генофондной истории прокариот…
Таков он – жесточайший антиутопический микромир, в котором живут, сосуществуют и беспрестанно конкурируют одноклеточные организмы, не имеющие ядра, размер которых составляет в среднем несколько микрометров (1 мкм = 10-6 м).
Среди не слишком богатого арсенала, которым располагают эти прокариоты для выживания, есть и своя защита от вирусов-интервентов (бактериофагов, или просто фагов). О ней мы и поговорим подробнее.
Самое первое, что следует про неё сказать – это то, что она представляет собой прекрасный пример настоящего «ламарковского» наследования приобретённых признаков, то есть она передаётся по наследству при размножении клетки. Таким образом, однажды встретившись с каким-то вирусом, очень многие микробы способны «запомнить» его в виде последовательностей фаговой ДНК, вставив их в свой же геном, и эта «память» будет ещё некоторое время передаваться потомкам. Получается что-то наподобие фоторобота: если другой такой же (или немного отличающийся) вирус в будущем атакует бактерию, то он тут же получит мощный отпор со стороны клетки. При обычном заражении дело идёт так, что вирус впрыскивает свою ДНК или РНК и далее с них считывается необходимая информация и синтезируются нужные белки, причём для сего действия «заимствуются» ферменты и структуры самой клетки.
Интересно, что у эукариот – животных, растений и грибов – есть довольно похожий механизм с гораздо более разнообразными функциями, РНК-интерференция.
Такая система адаптивного иммунитета называется CRISPR/Cas (с англ. Короткие палиндромные повторы, регулярно расположенные группами / CRISPR-ассоциированные белки). Она представлена семейством ДНК-повторов, найденных в большинстве архейных (~90%) и бактериальных (~40%) геномов . Изначально открытие структуры CRISPR было сделано случайно у Escherichia coli в 1987 г., но акроним был придуман в 2002-м, после этого схожие структуры были замечены в геномах многих Бактерий и Архей .
Типичные локусы CRISPR состоят из нескольких несмежных прямых повторов, разделённых участками вариабельных последовательностей – спейсерами. Эти спейсеры (с англ. space – не только «космос», но и «пространство») представляют собой сегменты захваченных вирусных и плазмидных последовательностей и имеют высокую скорость эволюции для обоих cas-генов . cas-гены кодируют огромное и неоднородное семейство белков, которые несут функциональные домены типичных нуклеаз (ферменты, разрезающие ДНК), хеликаз (ферменты, расплетающие обе цепи ДНК), полимераз (ферменты, которые наращивают цепь ДНК при её удвоении) и ДНК-связывающих белков. Это означает, что белки, которые кодируются упомянутыми cas-генами, способны выполнять функции всех вышеперечисленных ферментов.
Многие повторы частично палиндромны (т.е. читаются одинаково в обоих направлениях) и благодаря этому имеют возможность формировать стабильные, высококонсервативные вторичные структуры в виде «шпилек»:

Размер CRISPR-повтора составляет 23–47 пар оснований, а спейсеров — от 21 до 72 пар. Число групп «повтор/спейсер» может достигать 375, но обычно меньше 50 . Микробы могут содержать больше одного локуса CRISPR (по идее один локус направлен на защиту от одного вируса); до 18 локусов было идентифицировано у архей Methanocaldococcus jannaschii, составляющих аж больше 1% генома . Обычно CRISPR находятся в бактериальной хромосоме, но могут быть идентифицированы и в плазмидной ДНК .
Для объяснения такой изменчивости спейсеров CRISPR выдвигалось несколько предположений:
-активация экспрессии соседних генов;
-мишень для ДНК-связывающих белков;
-разделение репликонов;
-«ремонтирование» (репарация) ДНК и др. .
В 2005 г. три независимых исследования выявили гомологию (общность происхождения) между спейсерной последовательностью и внехромосомными элементами, такими как вирусы и плазмиды. Это и привело к предположению, что CRISPR может обеспечивать адаптивный иммунитет против чужеродных генетических элементов. Кроме этого, данный механизм, как несложно догадаться, действует ещё и как ограничитель горизонтального переноса генетической информации (т.е. от бактерии к бактерии; такой перенос, к примеру, объясняет стремительное развитие устойчивости ко многим антибиотикам). Ну и, наконец, отмечено, что система CRISPR может активно участвовать в регуляции «своих» бактериальных генов (а также последовательностей профагов и транспозонов внутри генома – это такие некогда встроившиеся в ДНК вирусы-паразиты), в частности, при взаимодействии бактерий с организмом-эукариотом, в котором они паразитируют. Так, например, бактерия может подавлять выработку у себя некоторых антигенов, и это помогает ослабить иммунный ответ со стороны хозяина .
Структуру типичных CRISPR и весь этот механизм защиты можно представить такой схемой (далее будем опираться на неё):

Итак, мы выяснили, что в этой замечательной системе задействованы два партнёра, которые действуют сообща: генетические локусы CRISPR, содержащие элементы геномов некогда заражавших бактерию вирусов (пассивный), и семейство Cas-белков, которые используют эти локусы собственно для реализации защиты (активный). Сами локусы CRISPR – это не что иное, как чередование коротких палиндромных повторов и спейсеров.
А теперь разберём, что же тут на самом деле происходит.
Некоторые Cas-белки вовлечены в формирование новых спейсеров, другие обеспечивают CRISPR-зашифрованное сопротивление фагам и вступают в противостояние (интерферируют) с инвазивными генетическими элементами. Несмотря на то что сама защита закодирована в спейсерах, информация, которая лежит внутри CRISPR-кассет и пары «повтор/спейсер» становятся доступными для белков Cas только после транскрипции (перевода последовательности ДНК в РНК).
Итак, разделим механизм действия на две фазы: «иммунизация» и «ответ».
Начнём с первой. Представим, как множество бактериофагов садится на поверхность бактериальной клетки. Это выглядит примерно вот так:

Допустим, один из них впрыснул свою ДНК внутрь. Сегодня фагу не повезло: клетка уже познакомилась с таким же вирусом ранее. В тот раз с кусочками фаговой ДНК связался один из белков системы Cas и после их расщепления сформировал из них новые спейсеры, которые встроились в бактериальную ДНК между повторами и остались там до сего дня. При этом оказывается, что спейсер комплементарен своему прото-спейсеру на вирусном геноме. Принципиально важно (и это не даёт системе случайно атаковать собственную ДНК), что протоспейсеры фланкированы с обеих сторон короткой (2-5 п.н.) консервативной последовательностью, называемой РАМ (Protospacer Adjacent Motif; мотив, прилежащий к протоспейсеру) . Новый спейсер всегда встраивается со стороны АТ-богатой лидерной последовательности (связи А—Т слабее связей Г—Ц и поэтому в этом месте раскрутить ДНК и считать с неё информацию термодинамически легче), находящейся перед CRISPR-кассетой (см. картинку), в ней же находятся промоторные элементы и сайты посадки регуляторных белков .
Возвращаемся к «сегодняшнему» фагу. Для того, чтобы обезвредить его генетическую информацию, чтобы вирус не смог размножиться в клетке, нужно ещё очень постараться. И вот как это достигается. С локусов CRISPR происходит транскрипция ДНК – теперь все спейсеры представлены в виде одной длинной пре-crРНК (полиспейсерный предшественник CRISPR-РНК), которая разделяется на части в ходе процессинга (удаление повторов между ними, осуществляет эндонуклеаза Cas6), причём благодаря палиндромной структуре повторов сделать это довольно просто, так как в одноцепочечной РНК они представляют собой «шпильки» (картинка №1) – вот и вообразите, что такие вот «шпильки» висят между спейсерами. Удалить их – не проблема.
Далее в игру вступают белки Cas. Они связывают эти РНК-спейсеры, которые теперь называются crРНК (т.е. CRISPR-РНК), и используют последние в качестве матрицы. Эта матрица для Cas-белков – что-то в роде распечатки фоторобота нежелательного вируса: фиксируя эту распечатку одним участком (доменом) своей белковой молекулы, другим доменом они взаимодействуют с попавшими в клетку чужеродными кусочками ДНК и сравнивают обе картинки: если crРНК полностью комплементарны этим связанным фрагментам, то Cas-белки тут же разрежут эти кусочки на ещё более мелкие и дадут клетке понять, что её атакуют внешние агенты (эта стадия имеет своё название – CRISPR-интерференция).
 Cas-белки используют сrRNA (красные цепи) как матрицу
Cas-белки используют сrRNA (красные цепи) как матрицу
Очень длительная параллельная эволюция вирусов и их хозяев привела к появлению у вирусов защитных механизмов против CRISPR-интерференции, и это объясняет большое разнообразие CRISPR/Cas-систем у бактерий и архей. Анализом всего этого разнообразия занимаются биоинформатики .
Переходим ко второй части повествования – о корыстном применении этого бактериального механизма нами, человеческими особями.
Во-первых, зная, что эта система существует, можно фактически вычислить все чужеродные генетические элементы, на которые микроб и его предки составили «фоторобот» (спейсер) и засунули в свой архив (встроили в свою ДНК). В частности, это может быть полезно для получения информации о микробиоме (совокупности микроорганизмов, населяющих тело) человека. Ведь интересно то, что общее число клеток микробов, которые проживают в нас, больше наших собственных по меньшей мере в 10 раз! И не удивительно, что в 2007 году даже был запущен большой международный «the human microbiome project» (HMP). Для изучения такого объёма данных применяются методы метагеномики. Итак, исследование CRISPR-систем в микробиоме человека позволит восстановить историю недавних фаговых заражений основных бактерий микробиома .
Ну и, во-вторых, можно приватизировать эту машинку для генетических исследований и даже генно-клеточной терапии, используя CRISPR/Cas-систему для редактирования генома. По этой части существует ещё один механизм, который стал использоваться на два года раньше CRISPR, то есть в 2011 г. – «TALEN» (Transcription Activator-Like Effector Nucleases; эффекторные нуклеазы, подобные активаторам транскрипции) .
Биоинформатики классифицируют CRISPR/Cas-системы на три основных типа, среди них в геномной инженерии чаще всего используется система типа II-A, которая была подсмотрена и выделена у S. pyogenes. Судите сами: набор cas-генов у неё минимален, а один-единственный многофункциональный белок-универсал Cas9 осуществляет и процессинг пре-crРНК, и интерференцию чужеродной ДНК. Это оказалось жутко удобным и учёные решили, что просто грех этим не воспользоваться. А использовать эту технологию можно для двух великих целей: или какой-то ген «выключить» (на генетическом слэнге – «нокаутировать»), или, наоборот, «включить»:

Из чего же состоит общая стратегия редактирования генома с помощью сайт-специфических нуклеаз (ферментов, разрезающих ДНК в определённых участках)? Она включает четыре основных этапа:
- Выбор целевой нуклеотидной последовательности в геноме;
- Создание нуклеазной конструкции, направленной на выбранную мишень;
- Доставка этой конструкции в клеточное ядро;
- Анализ полученных мутаций .

Один из самых тяжёлых этапов – это выбор сайтов (точек в геноме) для специфичного внесения двухцепочечного разрыва. Здесь следует избегать повторяющихся сайтов (чтобы разрезать ДНК только в определённом месте), а также участков, которые имеют высокую гомологию с другими районами генома и потому сильно похожих на целевой сайт.
Известно, что нуклеаза Cas9 реагирует на присутствие РАМ с мотивом 5′-NGG-3′ (где N – любой из 4 нуклеотидов). То, что этот косенсус такой короткий, является с одной стороны преимуществом (его можно использовать для большого количества генов), а с другой – недостатком, так как сравнительно высока вероятность нецелевых мутаций (а двухцепочечные разрывы, надо сказать – наиболее тяжкое повреждение для ДНК, так как одноцепочечные хотя бы можно склеить по комплементарным основаниям). В этом отношении, например, CRISPR/Cas типа II бактерии N. meningitidis распознает PAM с консенсусом 5′-NNNNGATT-3′, что, безусловно, ограничивает возможности в выборе мишени, однако может повысить специфичность и снизить вероятность нецелевых мутаций. Разумеется, поиску нужных сайтов также помогает биоинформатика.
Показано, что для разрезания ДНК in vitro и в бактериальных клетках с использованием CRISPR/Cas9 необходимы и достаточны следующие компоненты:
- пре-crРНК и некодирующие РНК tracrRNA (это такие помощники для первых);
- РНКаза III;
- белок Cas9.
Использование этой системы в клетках млекопитающих имеет ряд особенностей – так, например, РНКаза III не нужна, потому что с процессингом crРНК неплохо справляются и собственные клеточные РНКазы . Вот так примерно выглядит генетическая конструкция для редактирования генома эукариот:
 Схема генетической конструкции, экспрессирующей элементы системы CRISPR/Cas. hCas9 – последовательность белка Cas9, оптимизированная для экспрессии в клетках эукариот. sgRNA – единая химерная РНК, содержащая части crRNA и tracrRNA, необходимые для функционирования. NLS – сигнал ядерной локализации, который обеспечивает попадание конструкций в ядро. Поли(А) – сигнал полиаденилирования
Схема генетической конструкции, экспрессирующей элементы системы CRISPR/Cas. hCas9 – последовательность белка Cas9, оптимизированная для экспрессии в клетках эукариот. sgRNA – единая химерная РНК, содержащая части crRNA и tracrRNA, необходимые для функционирования. NLS – сигнал ядерной локализации, который обеспечивает попадание конструкций в ядро. Поли(А) – сигнал полиаденилирования
Для того, чтобы всю эту махину доставить в культивируемые in vitro клетки, обычно используют плазмидные векторы (о том, что они собой представляют и как именно их можно загнать внутрь, можно почитать в другой моей статье о генной терапии).
 :Один из генов риса (справа) нокаутирован методом CRISPR, из-за чего проростки превратились в карликовых альбиносов
:Один из генов риса (справа) нокаутирован методом CRISPR, из-за чего проростки превратились в карликовых альбиносов
Наконец, нельзя не упомянуть о том, какой потенциал этот механизм несёт для нашей медицины. George Church из Гарвардского университета, чья лаборатория была одной из первых, продемонстрировавших работоспособность системы на человеческих клетках, вместе со своей командой синтезировал целую библиотеку из десятков тысяч РНК-последовательностей, которые могут быть нацелены на 90% человеческих генов .
«Вы можете закидать геном любыми вообразимыми CRISPR», – говорит Church.
Например, система уже активно используется для модификации плюрипотентных стволовых клеток и коррекции их генетического материала с последующим введением исправленных клеток в кровь человека (iPSC – индуцированные плюрипотентные стволовые клетки):

Или, к примеру, технология может помочь в поиске мишеней для противораковых препаратов – уже был проведён скрининг около 200 потенциальных мишеней в лейкозных клетках .
Таким образом, CRISPR/Cas-система оказалась очень удобной и эффективной для использования. С CRISPR учёные могут создавать мышиные модели человеческих заболеваний гораздо скорее, нежели раньше, изучать индивидуальные гены быстрее и запросто менять сложные гены в клетках лишь однажды для исследования их взаимодействий. Пионеры в этой области уже формируют компании для использования технологии в целях лечения генетических заболеваний. «Я не думаю, что есть другой пример в любой иной области, которая двигалась бы так же быстро», – считает Blake Wiedenheft, биохимик университета штата Монтана.
Автор: Азат Муртазин
Перевод картинок: Teddy Picker
Список литературы:
- 1 Philippe Horvath and Rodolphe Barrangou. CRISPR/Cas, the Immune System of Bacteria and Archaea. Science 327, 167 (2010)
- R. Jansen, J. D. Embden, W. Gaastra, L. M. Schouls, Mol. Microbiol. 43, 1565 (2002).
- S. Makarova et al. Evolution and classification of the CRISPR-Cas systems. Nat Rev Microbiol. 2011 June ; 9(6): 467–477
- R. K. Lillestøl, P. Redder, R. A. Garrett, K. Brügger, Archaea 2, 59 (2006).
- J. S. Godde, A. Bickerton, J. Mol. Evol. 62, 718 (2006).
- K. S. Makarova, L. Aravind, N. V. Grishin, I. B. Rogozin, E. V. Koonin, Nucleic Acids Res. 30, 482 (2002).
- Sampson TR, Saroj SD, Llewellyn AC, Tzeng YL, Weiss DS. A CRISPR/Cas system mediates bacterial innate immune evasion and virulence. Nature; 497(7448) (2013), 254—257
- Mojica F.J., Diez-Villasenor C., Garcia-Martinez J., Almendros C. Microbiology. 2009. V. 155. P. 733–740.
- Hale C.R., Majumdar S., Elmore J., Pfister N., Compton M., Olson S., Resch A.M., Glover C.V., Graveley B.R., Tern R.M. Mol. Cell. 2012. V. 45. № 3. P. 292–302.
- Немудрый А.А., Валетдинова К.Р., Медведев С.П., Закиян С.М. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий. Acta naturae | Том 6 № 3 (22) 2014 С. 20-42
- Гоглева А.А., Артамонова И.И. CRISPR-системы прокариотического иммунитета в микробиоме человека. https://old.itas2011.iitp.ru/pdf/1569459275.pdf
- Elizabeth Pennisi. The CRISPR Craze. SCIENCE. Vol 341 23 August 2013. P. 833-836
- Васильева Е.А., Мелино Д., Барлев Н.А. Применение системы направленного геномного редактирования CRISPR/Cas к плюрипотентным стволовым клеткам. Цитология (2015), том 57, №1. С. 19-30
- Junwei Shi, Eric Wang, Joseph P Milazzo, Zihua Wang, Justin B Kinney, Christopher R Vakoc. Discovery of cancer drug targets by CRISPR-Cas9 screening of protein domains. Nature Biotechnology, 2015
Источник
Инфографика на конкурс «био/мол/текст»: CRISPR/Cas — система адаптивного иммунитета бактерий и архей, которая пригодилась и эукариотам. Мы попытались предельно ясно отразить этот механизм, породивший взрыв в биологическом сообществе и, вероятно, сильно изменивший будущее науки и человечества. Из этой инфографики вы узнаете краткую историю изучения, механизм и возможные применения системы CRISPR/Cas.

Конкурс «био/мол/текст»-2016
Эта работа заслужила приз зрительских симпатий конкурса «био/мол/текст»-2016.
В конкурсе участвовала только инфографика!
Текст написала Ольга Волкова.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Дмитрий Геннадиевич Калашников.
Как устроена иммунная система прокариот?
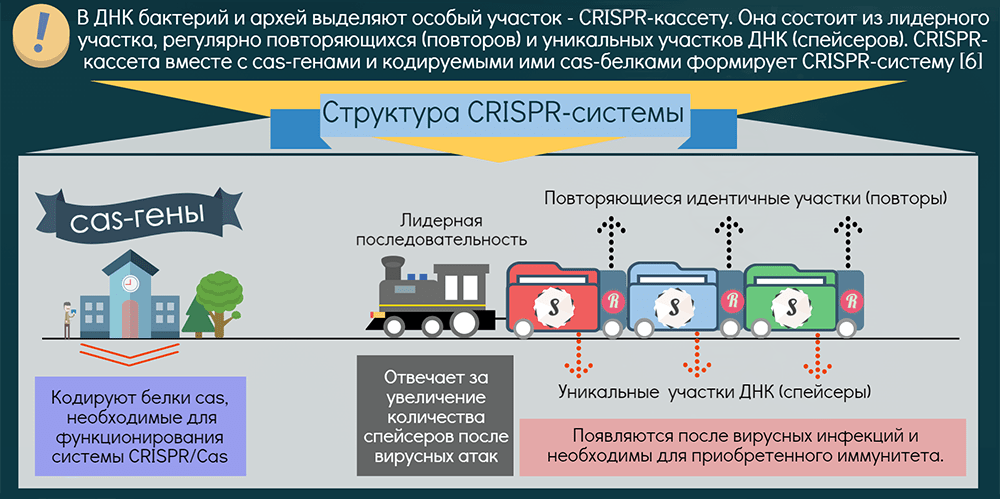
Системы CRISPR-Cas обнаружены почти у всех известных архей и половины бактерий. Чаще они находятся на хромосоме, реже — в составе фагов (вирусов бактерий) и других мобильных генетических элементов. Эти системы состоят из двух основных блоков: CRISPR-кассеты и прилегающего к ней кластера генов cas. Кассета — это блок прямых почти палиндромных («зеркальных», взаимокомплементарных последовательностей, способных складываться в шпильки) повторов размером 24–48 пар нуклеотидов. Эти повторы перемежаются спейсерами — уникальными вставками примерно такой же длины. Спейсеры идентичны различным участкам фагов и других мобильных элементов, когда-либо проникавших в эту клетку или ее предков. Число повторов в разных системах варьирует от единиц до сотен.
Таким образом, CRISPR можно считать коллекцией разделенных повторами «фотографий» нарушителей клеточных границ. Составляется эта коллекция простым заимствованием их кусочков, а чтобы противостоять новой инвазии этих же молекулярных агентов, коллекция должна регулярно «просматриваться» и обновляться. Для этой функции нужна лидерная последовательность, предшествующая череде повторов. Она богата «легкоплавкими» АТ-пáрами и содержит промотор, контролирующий транскрипцию CRISPR-кассеты («просмотр коллекции»).
Гены cas кодируют белки, берущие на себя всю тяжесть работы по встраиванию спейсеров и уничтожению агентов с идентичными последовательностями (протоспейсерами) и помогающие процессировать CRISPR-транскрипт: разделять фото-гирлянду на отдельные портреты. Функцию уничтожения выполняют Cas-белки, называемые эффекторными. В зависимости от типа эффекторов все CRISPR-системы разделяют на два класса: у I класса мишень уничтожается мультибелковым комплексом, а у II — одним крупным белком. Далее эти классы подразделяются на шесть типов. Большинство эффекторов атакует ДНК, лишь один — исключительно РНК [10], редкие — обе молекулы. Один организм может содержать несколько разных систем, а спейсеры различаются в разных клетках даже одной популяции .
Для решения инженерных задач больше всего подходит система II типа, относящаяся ко II классу, — она самая простая. Именно ее эффекторный белок называется Cas9 — то самое обозначение, что фигурирует в современных системах редактирования генома.
Как формируется CRISPR-опосредованный иммунитет?

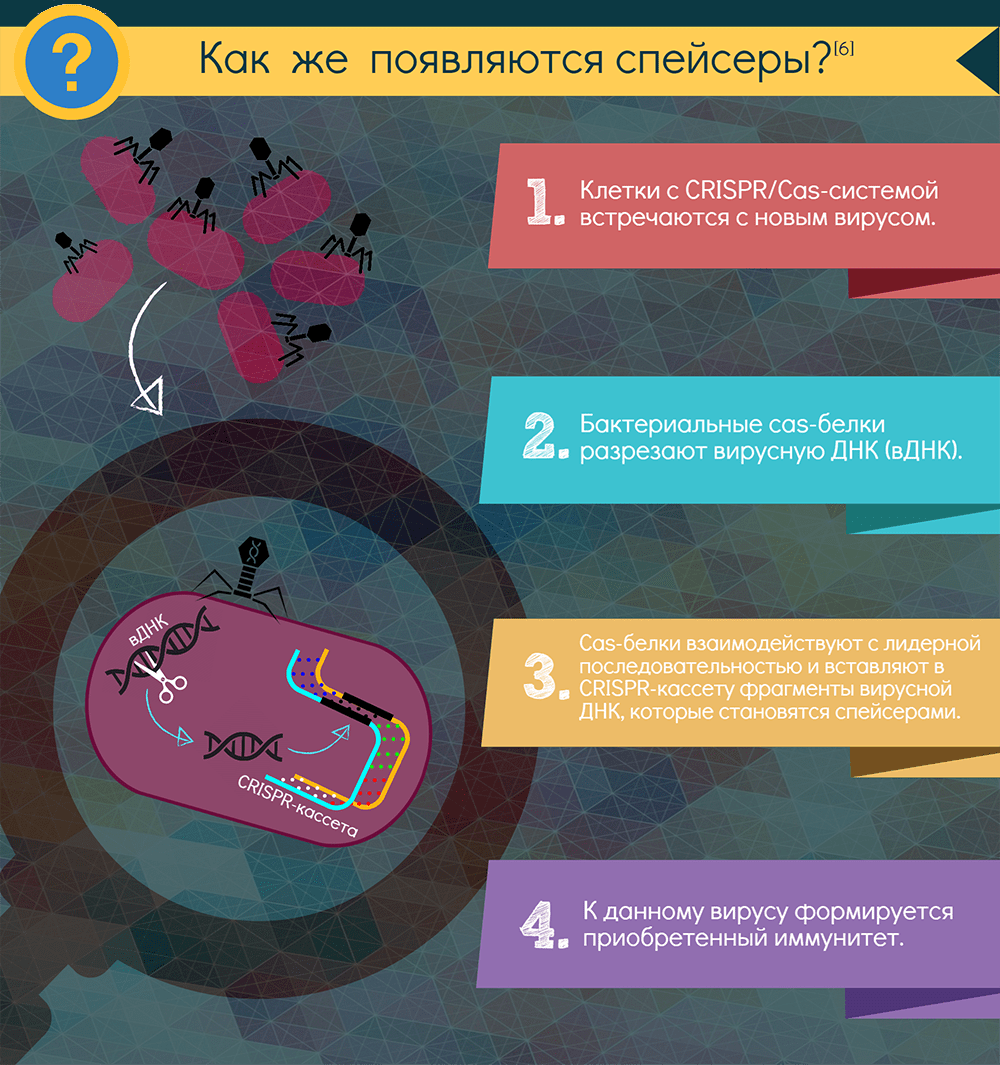
Если в бактерию или архею, снабженную CRISPR-системой, проникает вирус, включается адаптационный функциональный модуль системы: специфические Cas-белки — у всех систем это как минимум Cas1 и Cas2 — вырезают из чужака понравившиеся фрагменты. Подобрать протоспейсер в некоторых случаях помогает и эффекторный белок. Белки выбирают участки рядом с особой последовательностью PAM (protospacer adjacent motif) — всего несколько нуклеотидов, но неодинаковых для разных CRISPR-систем. Затем эти же адаптационные белки встраивают фрагмент в CRISPR-кассету, всегда с одной стороны — у лидерной последовательности. Так образуется новый спейсер, а заодно с ним — и новый повтор. Весь этот процесс называют адаптацией, или приобретением, а по сути это — запоминание врага. Информацию обо всех запомнившихся врагах получает при делениях всё потомство клетки.
Как реализуется CRISPR-опосредованный иммунитет?
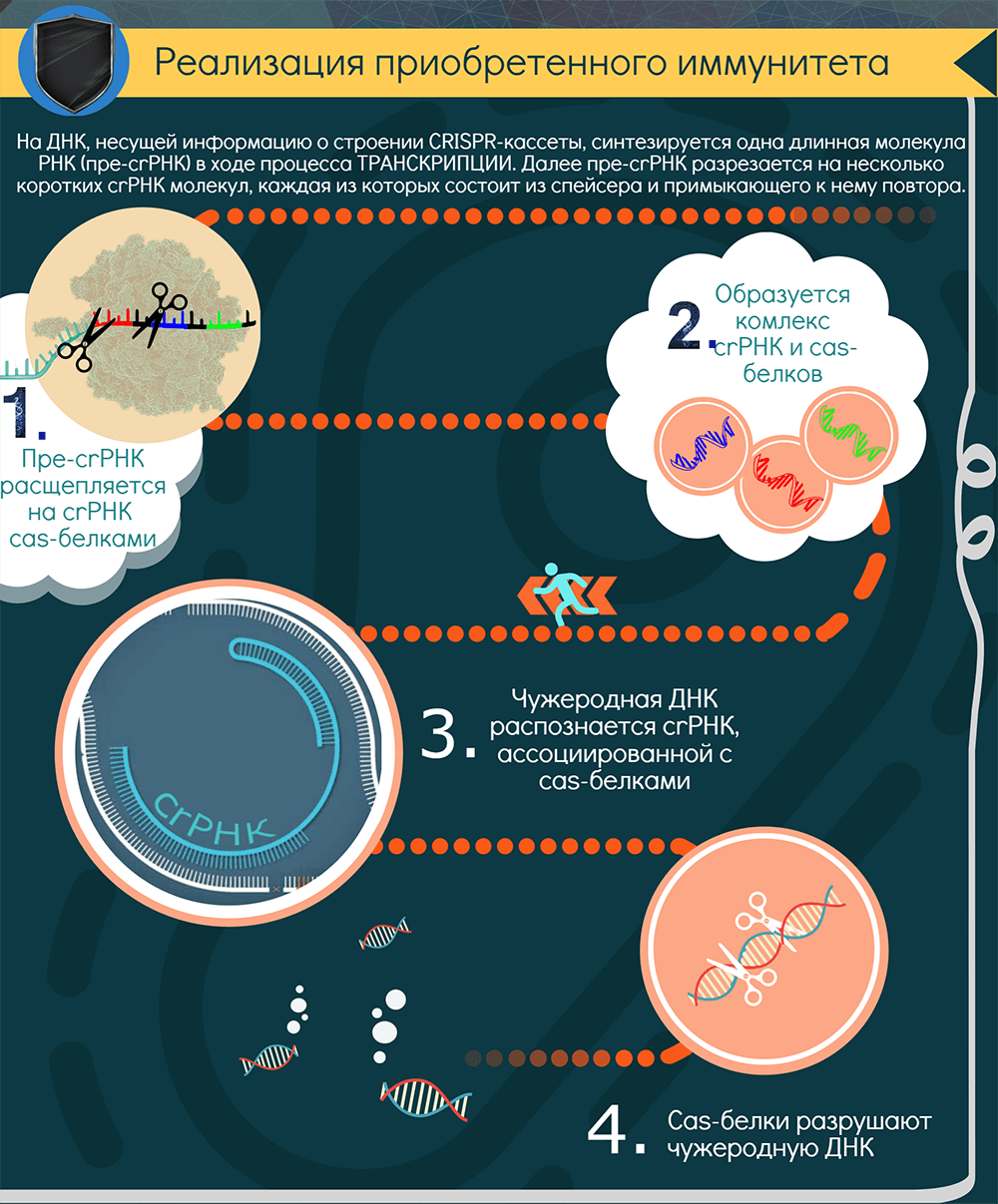
Для поиска повторно вторгающихся агентов CRISPR-кассета должна экспрессироваться. В результате ее транскрипции образуется длинная молекула РНК — pre-crРНК. С помощью РНКазы III и, как правило, Cas-белков транскрипт нарезается по повторам на отдельные crРНК — молекулы, содержащие один спейсер и кусочки окружающих его повторов (один из них длиннее). В системах II типа для этого процесса, называемого созреванием, необходим еще один участник — tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с cas-кластером [12].
Далее у систем I класса crРНК взаимодействует с комплексом Cas-белков, а у систем II класса crРНК либо дуплексы tracrРНК-crРНК связываются с одним белком-эффектором, например Cas9. Так образуется интерференционный функциональный модуль — рабочая иммунная единица, состоящая из направляющей РНК и эффекторного белка (или комплекса). Совокупность таких единиц «сканирует» клетку в поисках интервентов.
При обнаружении комплементарной crРНК последовательности, то есть протоспейсера, модуль «слипается» с ней и определяет, не помечена ли она как «своя», клеточная. Если нет, и если к ней прилегает тот самый PAM, то эффекторный белок, который представляет собой эндонуклеазу, разрезает обе цепи ДНК в строго определенных местах. Весь процесс называется интерференцией. В особом случае, у системы VI типа, происходит РНК-интерференция, потому что эффекторный белок является рибонуклеазой и разрушает РНК. Так или иначе, атакованные фаги или плазмиды выводятся из строя. Ну и появляется лишняя возможность «наворовать» новые спейсеры.
Какие проблемы могут возникнуть при реализации иммунного ответа? Не исключено, что по мере удаления от лидерной последовательности, то есть от CRISPR-промотора, шансы спейсера транскрибироваться и созреть уменьшаются. Кроме того, есть мнение, что удаленные спейсеры со временем могут накапливать мутации, препятствующие эффективной интерференции с мишенью, или вовсе удаляться. Но раз адаптация новых спейсеров происходит вблизи промотора, удаленные спейсеры представляют собой фото агентов, давно не нападавших на эту клеточную линию, и в постоянной боеготовности по отношению к ним клетка не нуждается. Настоящей же проблемой могут стать даже однонуклеотидные мутации мишени. В общем, комплементарность в этом деле превыше всего.
А не приручить ли нам чужой иммунитет?

Детально изучив принципы работы стрептококковой системы CRISPR-Cas9 (II тип), ученые подумали: а почему бы не попробовать с ее помощью корректировать геномы других организмов? Появились новые надежды относительно лечения генетических (и не только) заболеваний человека, ведь этот способ редактирования in vivo мог оказаться эффективнее уже вовсю тестируемых в то время нуклеаз ZFN и TALEN [13].
Всё, что требовалось для новой технологии, — это разместить на векторах ген белка Cas9 и CRISPR-кассету, где спейсеры сделать идентичными местам генома, которые нужно изменить. Меняя число и тип спейсеров, можно модифицировать сразу несколько разных участков генома. Довольно быстро поняли, что tracrРНК и crРНК можно безболезненно объединить в одну химерную молекулу sgРНК (single-guide RNA), а РНКазу III в эукариотических клетках спокойно подменяют другие рибонуклеазы. Ну и еще потребовалось оптимизировать систему для эукариотических клеток: подправить кодонный состав и добавить ядерный «адрес», чтобы она четко следовала к месту работы — хромосомам.
Получилась простая и, что немаловажно, дешевая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре выбранного организма, CRISPR-транскрипт нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут цель. Когда sgРНК находит комплементарный участок в геноме организма, Cas9 разрезает «натупо» обе цепи ДНК. Всё, работа CRISPR-системы на этом окончена. Теперь эстафета передается репарационным системам самогό организма. Они решают, как лучше залатать разрез: то ли просто сшить куски (это будет негомологичное соединение концов, NHEJ), то ли, если есть подходящая матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, поставить «заплатку» (это будет гомологичная рекомбинация). Так вот, первый вариант выгоден, если нужно что-то вырезать, второй — если нужно что-то вставить или заменить дефектный участок ДНК на нормальный, который просто вводят на подходящем векторе. Иногда используют гомологию с парной хромосомой, если на ней нужный локус не дефектный.
Разумеется, технология пока не лишена недостатков. Cas9, например, может проявлять нецелевую активность, «закрывая глаза» на мелкие несоответствия между sgРНК и мишенью. По словам К. Северинова, основная проблема — это биоинформатическое предсказание мишеней, поскольку, помимо наличия участка PAM, необходимо учитывать массу факторов, включая состояние хроматина. Кроме того, сценарий, по которому пойдет репарация разреза, не всегда соответствует желаемому, поэтому сейчас активно ищут факторы, влияющие на выбор этого сценария клеткой. Помимо оптимизации CRISPR-Cas9 и механизмов ее доставки в нужные клетки, ведется апробирование других типов CRISPR-систем [14].
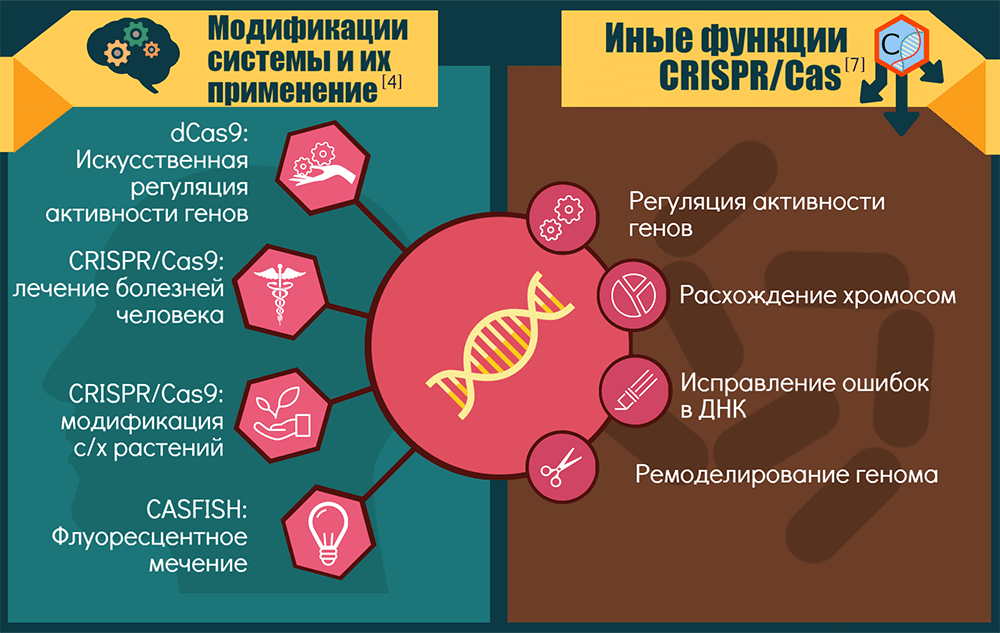
Спектр применений CRISPR-Cas9 и ее модификаций
Точки приложения CRISPR-технологии можно условно объединить в три крупные группы: «CRISPR — для исследований», «CRISPR — для биотехнологий» и «CRISPR — для терапии».
1. «CRISPR — для исследований». Технология позволяет изучать роль конкретных генов в процессах развития и жизнедеятельности организмов. Как вариант — устанавливать роль генов и их перестроек в возникновении и прогрессировании генетических болезней и рака: этот инструмент позволяет создавать прекрасные модельные системы [15].
Если Cas9 лишают одного нуклеазного домена, то белок становится никазой (nCas9) — режет только одну цепь ДНК, — а если лишают сразу двух, то белок становится инактивированным, или «мертвым» (dead, dCas9). Такой белок ничего не режет, зато систему CRISPR-dCas9 можно использовать для репрессии целых наборов генов или как платформу для конструирования более сложных регуляторных и модифицирующих комплексов. Например, если к ней привязать активирующий домен, то экспрессия целевых генов активируется. Для эпигенетической модификации нужных зон достаточно добавить модифицирующий домен. А пометив dCas9 флюоресцентными белками [16], можно визуализировать разные области хромосом. Ясно, что регуляторные возможности системы будут востребованы и в медицине. Кроме того, разные варианты CRISPR-Cas открывают новые возможности для скрининга мишеней лекарств [1].
2. «CRISPR — для биотехнологий». Здесь речь идет о применении CRISPR-Cas9 как минимум для трех целей:
- для улучшения свойств сельскохозяйственных животных и растений. Уже создали и протестировали CRISPR-системы для риса, пшеницы, кукурузы, сорго и многих других культур. Детально эта кухня разобрана в обзоре [17]. Помимо улучшения пищевых качеств, такими инструментами легко наделять культуры устойчивостью к вредителям и химикалиям, а животных — избавлять от нежелательных генов. Например, недавно в свиных клетках инактивировали эндогенных ретровирусов (не то чтобы здоровья свиньи ради, а держа в голове планы по трансплантации ее органов человеку) [18];
- для контроля распространения инфекций, переносимых животными. Например, уже всерьез размышляют о «заносе» в природные популяции малярийных комаров генов устойчивости к плазмодию или генов популяционного контроля [19]. Это стало принципиально возможным благодаря технологии «gene drive» (что-то типа «продвижения гена»), основанной на изменении классического наследования. С ее помощью встроенный в одну особь ген быстро распространяется по всей популяции. Принцип технологии иллюстрирует нашумевшая мутагенная цепная реакция у дрозофил [20];
- для конструирования новых метаболических путей и осуществления направленной эволюции биомолекул. Новые или оптимизированные ферментные системы бактерий и грибов, получаемые так легко и дешево, — предел мечтаний технологов из целого ряда отраслей промышленности. Но даже простое встраивание в промышленно важные штаммы бактерий систем CRISPR-Cas с заданными свойствами может защитить их от бактериофагов и нежелательных плазмид.
3. «CRISPR — для терапии». Здесь пределов для фантазии, кажется, и вовсе нет. Если говорить о наследственных заболеваниях, то CRISPR-Cas9 в культурах клеток или животных моделях уже «примерили» для серповидноклеточной анемии и β-талассемии, M2DS-синдрома и миодистрофии Дюшенна, муковисцидоза (исправили мутантный CFTR-локус в кишечных стволовых клетках человека) и тирозинемии, катаракты (у мышей устранили доминантную мутацию в гене Crygc) и пигментного ретинита. Вообще, болезни глаз сейчас в центре внимания, потому что в глаза генетические конструкции легко доставлять [14].
Преимущества коррекции генома в зародышевой линии (как совокупности любых генеративных клеток, связывающих друг с другом поколения организмов) и стволовых клетках очевидны, но даже изменения, вносимые в соматические клетки уже развитых органов, дают эффект. Особенно если речь идет о борьбе с болезнями печени и мышц. О результатах терапевтического применения CRISPR-Cas9 в разных типах клеток рассказывает свежий обзор [21].
Отдельное перспективное направление — борьба с хроническими вирусными заболеваниями типа гепатитов и ВИЧ-инфекции. Если возбудитель сохраняется в организме в виде провируса (вирусной ДНК, встроенной в клеточный геном), то его можно просто вырезать. Именно так и поступил коллектив биологов из США, избавив лимфоциты человека от ВИЧ (об этом сообщили сразу две «биомолекулярные» статьи: «Битва века: CRISPR VS ВИЧ» [22] и «CRISPR/Cas9 как помощник в борьбе с ВИЧ» [23]). Правда, ВИЧ — объект крайне изменчивый, и с ним еще придется поломать копья.
Можно помечтать, что в терапии опухолей найдут применение варианты недавно описанной CRISPR-системы VI типа — той, что уничтожает только РНК, причем, как оказалось, любую клеточную РНК без разбора: запустить такую систему в раковую клетку — это как наслать на нее проклятье [14].
CRISPR-Cas — это не только иммунитет
Оказывается, для бактерий и их эволюции эта система значит намного больше.
Неканонические активности CRISPR-систем или их отдельных компонентов возникали как побочные продукты их иммунной функции либо как самостоятельно отбираемые признаки. Скорее всего, CRISPR-кассеты и Cas-белки когда-то работали порознь, причем исходная задача последних состояла в регуляции экспрессии генов и репарации ДНК [7]. Современные компоненты CRISPR-Cas замечены:
- в регуляции активности генов. Эти системы могут вмешиваться в общение бактерий по типу quorum sensing («чувство кворума») [24] и регулировать таким образом групповое поведение: формирование плодовых тел и спор у миксококков и биопленок у синегнойной палочки. Белки Cas9 (систем II типа) регулируют вирулентность патогенов Legionella pneumophila, Francisella novicida, Campylobacter jejuni и, возможно, Neisseria meningitidis;
- в репарации ДНК. Cпособность к разрезанию CRISPR-кассеты для встраивания новых спейсеров, скорее всего, вторичное функциональное приобретение Cas1. Исходно он резал типичные рекомбинационные/репарационные интермедиаты и пока что не разучился это делать. Поэтому экспрессия генов cas повышает устойчивость некоторых бактерий к радиации, а отключение CRISPR-системы ведет к повышению их чувствительности к повреждающим ДНК факторам и нарушению расхождения хромосом;
- в ремоделировании (реорганизации) генома. Cas-белки иногда ошибаются и вместо вражеской ДНК делают спейсерами фрагменты своего генома. Если последовавшие за этим «аутоиммунные» реакции не приводят к гибели клетки, то чаще всего происходят крупные перестройки, направленные на частичное или полное избавление от «проштрафившейся» CRISPR-системы. Иногда перестройки могут повысить приспособленность хозяина к нише — например, за счет дупликации полезных генов;
- в конкуренции мобильных генетических элементов друг с другом, если они несут эти самые CRISPR-Cas-системы;
- во введении бактерий в «спящее», неактивное состояние. Функция эта по сути тоже иммунная, но экстремальная. Предполагают, что в избранных CRISPR-системах один из Cas-белков может служить «токсином», а его партнер — «антитоксином», и когда в клетку проникает фаг, «токсин» высвобождается и начинает крушить любую РНК. Но у «замирающей» при этом клетки есть время лихорадочно насобирать спейсеры. Если это не получается, то разбушевавшийся Cas-токсин доводит клетку до самоубийства. Доказать этот принцип пока не удалось [7]. Зато подобный драматический финал мы уже где-то видели: именно так поступает система VI типа. Такой исход фаговой инвазии называется абортивной инфекцией. Для клетки плохо, для популяции — хорошо…
- J. A. Doudna, E. Charpentier. (2014). The new frontier of genome engineering with CRISPR-Cas9. Science. 346, 1258096-1258096;
