Диссекция позвоночной артерии на мрт
Диссекция ВСА и ПА является частой причиной ИИ в молодом возрасте, реже – причиной изолированной шейной/головной боли. Диссекция представляет собой проникновение крови через разрыв интимы из просвета артерии в ее стенку с формированием интрамуральной гематомы (ИМГ), которая стенозирует/окклюзирует просвет артерии либо является источником артерио-артериальной эмболии, что в свою очередь приводит к ишемическому инсульту.
В последние годы в мире неуклонно растет интерес к диссекции артерий, кровоснабжающих головной мозг, – относительно новой и недостаточно изученной проблеме цереброваскулярных заболеваний. Ее основное клиническое проявление – ишемический инсульт (ИИ), чаще развивающийся в молодом возрасте. Изучение и прижизненная диагностика диссекции церебральных артерий стала возможной благодаря широкому внедрению в клинику магнитно-резонансной томографии (МРТ). МРТ позволяет безопасно для больного проводить повторное ангиографическое исследование, что важно для диагностики диссекции, поскольку она представляет собой динамическую патологию, а также с помощью режима Т1 с подавлением сигнала от жировой ткани (Т1 f-s) визуализировать непосредственно интрамуральную (внутристеночную) гематому (ИМГ) – прямой признак диссекции. Применение МРТ показало, что диссекция является весьма распространенной патологией, а не редкостью, как считалось ранее. Кроме того, стало очевидным, что диссекция церебральных артерий лишь в небольшом числе случаев приводит к летальному исходу, тогда как первоначально она рассматривалась как фатальное заболевание.
В России целенаправленное изучение диссекции церебральных артерий начали проводить с конца 90-х годов прошлого столетия в Научном центре неврологии РАМН (до 2007 г. – Научно-исследовательский институт неврологии РАМН) практически одновременно с исследованиями, выполняемыми за рубежом. Но первые морфологические описания отдельных случаев церебральной диссекции, клинически, однако, нераспознанной, были сделаны в 80-е годы XX в. в нашей стране Д. Е. Мацко, А. А. Никоновым и Л. В. Шишкиной и соавт. В настоящее время исследование данной проблемы ведут в Научном центре неврологии РАМН, где обследовано более 200 больных с прижизненно верифицированной диссекцией церебральных артерий, из которых более половины – больные с диссекцией внутренней сонной (ВСА) и позвоночной (ПА) артерий.
Диссекция церебральных артерий представляет собой проникновение крови из просвета артерии в ее стенку через разрыв интимы. Формирующаяся при этом ИМГ, разделяя слои артериальной стенки, распространяется по длине артерии на различное расстояние, чаще всего в сторону интимы, приводя к сужению или даже окклюзии просвета артерии, что служит причиной ишемии головного мозга. Стеноз незначительной степени, обусловленный ИМГ, клинически может протекать бессимптомно. Распространение ИМГ в сторону наружной оболочки (адвентиции) приводит к развитию псевдоаневризмы, которая может стать причиной изолированной шейно-головной боли, или к истинной расслаивающей аневризме. Тромбы, образующиеся в расслаивающей аневризме, являются источником артерио-артериальной эмболии и ИИ. Диссекция развивается как в магистральных артериях головы (ВСА и ПА), так и в их ветвях (средняя, задняя, передняя мозговые артерии, основная артерия). При этом большинство исследователей полагают, что диссекция чаще возникает в ВСА и ПА, чем в их ветвях. Вместе с тем нельзя исключить, что диссекция в ветвях ВСА и ПА часто недоучитывается из-за трудности визуализации в них ИМГ и ошибочно расценивается как тромбоз. Диссекция может развиваться в любом возрасте – от младенческого до пожилого, однако в большинстве случаев (по данным НЦ Неврологии РАМН – 75%) она наблюдается у лиц молодого возраста (до 45 лет). Отмечено, что при интракраниальном поражении возраст больных, как правило, меньше, чем при экстракраниальном, а при вовлечении ПА – меньше, чем при поражении сонных артерий. Распределение больных по полу также зависит от локализации диссекции: ВСА чаще поражается у мужчин, а ПА – у женщин. Диссекция обычно развивается у лиц, считающих себя здоровыми, не страдающих атеросклерозом, тромбофилией, сахарным диабетом и редко имеющих умеренную артериальную гипертонию.
Диссекция внутренней сонной артерии.
Основными провоцирующими факторами диссекции ВСА являются травма головы или шеи, как правило, легкая; физическая нагрузка с напряжением мышц плечевого пояса и шеи; наклоны, запрокидывание, повороты головы; прием алкоголя; текущая или предшествующая инфекция; прием контрацептивов или послеродовый период у женщин. В условиях предшествующей слабости артериальной стенки указанные факторы и состояния играют провоцирующую, а не каузальную роль, приводя к разрыву интимы и развитию диссекции, которая в этих случаях рассматривается как спонтанная.
Клинически диссекция ВСА чаще всего проявляется ИИ, реже – преходящим нарушением мозгового кровообращения (НМК). К более редким (менее 5%) ее проявлениям относятся изолированная шейная/головная боль, локализующаяся в большинстве случаев на стороне диссекции; изолированное одностороннее поражение черепных нервов вследствие их ишемии, когда питающие нерв артерии отходят от расслоенной ВСА; изолированный синдром Горнера, обусловленный воздействием ИМГ на периартериальное симпатическое сплетение, когда гематома в основном распространяется в сторону адвентиции и существенно не сужает просвет ВСА. Небольшие ИМГ могут протекать бессимптомно и случайно выявляются при МРТ. Характерный признак НМК при диссекции ВСА – головная/шейная боль. Боль, обычно тупая, давящая, реже пульсирующая, стреляющая, появляется за несколько часов или дней до ИИ на стороне диссекции. Ее причиной служит раздражение чувствительных рецепторов сосудистой стенки развивающейся в ней гематомой. Примерно у трети больных ИИ предшествует преходящее НМК в церебральном бассейне ВСА или глазничной артерии в виде кратковременного снижения зрения на стороне диссекции. НМК, как правило, развивается в бассейне средней мозговой артерии (СМА) и проявляется двигательными, чувствительными и афатическими нарушениями, которые в половине случаев выявляются утром при пробуждении, в другой половине случаев – во время активного бодрствования.
Прогноз для жизни в большинстве случаев благоприятный, летальный исход наблюдается примерно в 5% случаев. Обычно он наступает при обширных инфарктах мозга, обусловленных диссекцией интракраниального отдела ВСА с переходом на СМА и переднюю мозговую артерию. У большинства же больных, особенно при поражении экстракраниального отдела ВСА, прогноз для жизни благоприятный и наблюдается хорошее восстановление нарушенных функций. При вовлечении интракраниального отдела ВСА и распространении диссекции на СМА либо при эмболии последней восстановление нарушенных функций значительно хуже.
Рецидивы диссекции возникают нечасто и обычно отмечаются в 1-й месяц после дебюта заболевания. Они могут появляться как в интактной, так и в уже подвергавшейся диссекции артерии.
Основной механизм развития ИИ – гемодинамический в условиях нарастающего стенозирующе-окклюзирующего процесса в ВСА, обусловленного ИМГ. Реже НМК развивается по механизму артериоартериальной эмболии. Ее источником служат тромбы, образующиеся в расслаивающей аневризме, тромбированные фрагменты ИМГ, попадающие в кровоток при вторичном прорыве интимы, или тромботические наслоения в месте разрыва интимы.
Диссекция позвоночной артерии.
Диссекция ПА, по данным большинства авторов, наблюдается несколько реже, чем диссекция ВСА. Однако нельзя исключить, что ПА вовлекается чаще, чем указано в литературе, так как многие случаи диссекции ПА, проявляющейся изолированной цервикоцефалгией, клинически не распознаются и статистически не учитываются.
Основные клинические признаки диссекции ПА – ишемические НМК и изолированная шейная/головная боль. Такая боль возникает примерно в трети случаев. К редким проявлениям относятся нарушения кровообращения в шейном отделе спинного мозга, изолированная радикулопатия, нарушение слуха. Более чем у трети больных диссекция обнаруживается в обеих ПА, причем диссекция одной ПА может быть причиной НМК, а второй ПА – причиной изолированной шейной/головной боли, либо клинически протекать бессимптомно и выявляется только при нейровизуализации. Характерной особенностью НМК при диссекции ПА, как и при диссекции ВСА, является ее ассоциация с шейной/головной болью на стороне расслоенной ПА. Обычно боль локализуется по задней поверхности шеи и в затылке, появляясь за несколько дней или 2–3 недель до очаговых неврологических симптомов. Боль часто возникает после повторных наклонов, поворотов головы, длительного нахождения головы в неудобном положении, реже – после травмы головы/шеи, как правило, легкой. Наблюдаемое при этом натяжение ПА при слабости сосудистой стенки вызывает разрыв интимы и инициирует диссекцию. Причинами шейной/головной боли при диссекции ПА служат раздражение болевых рецепторов артериальной стенки формирующейся в ней гематомой, а также ишемия мышц шеи, в кровоснабжении которых участвуют ветви ПА. Еще одна особенность НМК состоит в том, что часто (около 80%) она развивается в момент поворота или наклона головы. Очаговые неврологические симптомы – атаксия, вестибулярные нарушения, реже – расстройство чувствительности, дизартрия, дисфагия, дисфония, парезы.
Наиболее частым механизмом развития НМК при диссекции ПА является артерио-артериальная эмболия. На это указывают клинические проявления (острое развитие симптомов ишемии головного мозга, обычно во время активного бодрствования, часто при повороте/наклоне головы) и результаты ангиографии (наличие у большинства больных гемодинамически незначимых стенозов, которые существенно не нарушают церебральную гемодинамику и обеспечивают дистальное продвижение эмболов). Источником эмболии многие исследователи считают фрагменты ИМГ, попадающие в кровоток при вторичном прорыве интимы. По мнению других исследователей, это внутрисосудистые пристеночные тромбы, сформировавшиеся в месте разрыва интимы. Решающее значение в верификации диссекции ВСА и ПА имеет нейровизуализационное исследование, в первую очередь МРТ в режиме ангиографии (МРА) и МРТ в режиме Т1 f-s, позволяющие выявить ИМГ. Наиболее частым характерным ангиографическим признаком диссекции ВСА/ПА является неравномерный, реже – равномерный пролонгированный стеноз («симптом четок», или «нитки бус», «симптом струны»), предокклюзионное конусообразное сужение просвета ВСА («симптом пламени свечи»). Такие характерные ангиографические признаки диссекции, как расслаивающая аневризма и двойной просвет, встречаются значительно реже. Диссекция представляет собой динамическую патологию: стенозы ВСА/ПА, обусловленные ИМГ, во всех случаях полностью или частично разрешаются через 2–3 месяца. Реканализация исходной окклюзии, вызванной диссекцией, наблюдается только в половине случаев. Характерными МРТ-признаками диссекции служат ИМГ, которая визуализируется в режиме Т1 f-s на протяжении ≥2 месяцев, и увеличение наружного диаметра артерии. Следует иметь в виду, что в течение 1-й недели заболевания ИМГ при МРТ в режиме Т1 f-s не выявляется, поэтому диагностическое значение приобретают компьютерная томография (КТ) и МРТ в режиме Т2 f-s.
В большинстве случаев с течением времени происходит хорошее или полное восстановление нарушенных функций. Диссекция ПА может рецидивировать. Через 4–15 месяцев рецидив отмечен у 10% пациентов.
Морфологическое исследование артерий мозга при диссекции играет основополагающую роль в выяснении причин слабости артериальной стенки, приводящей к диссекции. Оно позволяет выявить расслоение, истончение, а иногда и отсутствие внутренней эластической мембраны, участки фиброза в интиме, неправильную ориентировку миоцитов в медии. Предполагается, что изменение сосудистой стенки обусловлено генетически детерминированной слабостью соединительной ткани, в первую очередь патологией коллагена. Однако мутации в гене коллагена не обнаружены. Впервые в мире сотрудниками НЦ неврологии РАМН высказано предположение, что причиной слабости артериальной стенки является митохондриальная цитопатия. Это подтвердило исследование биоптатов мышц и кожи. При гистологическом и гистохимическом исследовании мышц обнаружены красные рваные волокна, изменение реакции на сукцинатдегидрогеназу и цитохромоксидазу, субсарколеммальный тип окрашивания в волокнах с сохранной реакцией. Электронно-микроскопическое исследование артерий кожи выявило изменения митохондрий, вакуолизацию, отложение жира, липофусцина и гликогена в клетках с измененными митохондриями, отложения кальция в экстраклеточном матриксе. Комплекс выявленных изменений, характерных для митохондриальной цитопатии, позволил российским исследователям предложить термин «митохондриальная артериопатия» для обозначения патологии артерий, предрасполагающей к диссекции.
Лечение ИИ, обусловленного диссекцией, окончательно не определено, так как отсутствуют рандомизированные плацебоконтролируемые исследования с включением большого количества больных. В связи с этим нет четко установленных методов лечения в остром периоде инсульта. Чаще всего рекомендуется введение прямых антикоагулянтов с последующим переходом на непрямые антикоагулянты, которые применяют в течение 3–6 месяцев. Цель их назначения – предотвращение артерио-артериальной эмболии и поддержание ИМГ в разжиженном состоянии, что способствует ее разрешению. Следует иметь в виду, что назначение больших доз антикоагулянтов может привести к нарастанию ИМГ и ухудшению кровоснабжения головного мозга. В качестве альтернативы этим препаратам в остром периоде инсульта рекомендуется применение антиагрегантов, при этом различия в исходах инсульта, по предварительным данным, отсутствуют. С целью оценки безопасности лечения низкомолекулярным гепарином и аспирином в остром периоде диссекции французские исследователи провели измерение объема и протяженности ИМГ в течение 1-й недели лечения. Небольшое увеличение этих параметров наблюдалось у трети больных, однако ни в одном случае не отмечено нарастания степени стеноза или развития повторной диссекции. Применение антикоагулянтов и антиагрегантов ограничивается 2–3 месяцами, в течение которых происходит развитие ИМГ. Дальнейший профилактический прием этих препаратов нецелесообразен, так как причиной ИИ при диссекции является не гиперкоагуляция, а слабость артериальной стенки. Поскольку основная причина, предрасполагающая к развитию диссекции – слабость артериальной стенки, лечебные мероприятия как в остром, так и в отдаленном периоде инсульта должны быть направлены на ее укрепление. Если учесть данные о митохондриальной цитопатии, приводящей к энергетической недостаточности клеток артериальной стенки и ее дисплазии, способствующей возникновению диссекции, можно считать обоснованным применение препаратов с «трофическим» и энерготропным действием. Одним из таких препаратов является актовегин, который используется как в остром, так и в отдаленном периоде инсульта, обусловленного диссекцией. Он представляет собой биологически активное вещество естественного происхождения – депротеинизированный дериват телячьей крови. Основное действие актовегина заключается в активизации клеточного метаболизма за счет облегчения поступления кислорода и глюкозы в клетку, что обеспечивает дополнительный приток энергетических субстратов и увеличивает в 18 раз продукцию АТФ – универсального донатора энергии, необходимой для жизнедеятельности и функционирования клетки. Используются и другие препараты с нейрометаболическим действием для восстановления нарушенных вследствие инсульта функций: церебролизин, пирацетам, глиатилин, цераксон.
В остром периоде диссекции, помимо медикаментозного лечения, большое значение имеет соблюдение следующих правил: необходимо избегать резких движений головой, травм, физического напряжения, натуживания, которые могут привести к нарастанию диссекции.
Диссекция ВСА и ПА является частой причиной ИИ в молодом возрасте, реже – причиной изолированной шейной/головной боли.
Знание клинических и ангиографических особенностей данного вида сосудистой патологии головного мозга позволяет провести правильное ее лечение и вторичную профилактику.
Статья добавлена 17 ноября 2015 г.
Источник
Резюме.В статье приведены два клинических случая диагностики и эффективного лечения диссекции позвоночной артерии, осложнившейся ишемическим инсультом в вертебрально-базилярном бассейне.
Одной из причин ишемических инсультов в молодом возрасте, наряду с тромбофилией, употреблением наркотиков, аномалией развития церебральных сосудов, в 25% случаев является диссекция артерий, кровоснабжающих головной мозг (1). Впервые данная патология была описана в середине ХХ века, а ее возникновение практически всегда считали следствием перенесенной травмы (6). Более детальное изучение диссекции экстра и интракраниальных артерий началось с середины 70-х годов ХХ века в связи с широким применением метода церебральной ангиографии (3).
Как правило, данная патология развивается вследствие продольного надрыва сосудистой стенки с образованием интрамуральной гематомы в зоне интима-медиа. По литературным данным, диссекция чаще наблюдается в экстракраниальных сосудах — 88% (каротидная — 58%, вертебральная –30%), и только в 12% она происходит в интракраниальном бассейне (5). Нередко при диссекции экстракраниальных артерий встречаются указания на травму, предшествовавшую развитию клинической картины инсульта. Травматическое расслоение стенки артерии возникает после тупой закрытой или проникающей травмы шеи, общего сотрясения (например, при падении) и чаще всего локализуется экстракраниально (4).
Иногда диссекция носит ятрогенный характер. Так, в некоторых клинических наблюдениях встречаются указания на отчетливую связь двусторонней диссекции позвоночных артерий с мануальной терапией на шейном отделе позвоночника (8). Спонтанной диссекции, как правило, предшествует резкое движение головой (ее повороты, наклоны, разгибание), во время которых может возникать компрессия или резкое растяжение сосудистой стенки расположенным рядом костносвязочным аппаратом (4).
Возникновению спонтанной диссекции иногда предшествует бессимптомная системная патология сосудистой стенки, обусловленная фибромускулярной дисплазией, наследственным поражением соединительной ткани (синдромы Элерса—Данлоса и Марфана), артериитом, ангиолипоматозом, костной патологией в шейном отделе позвоночника (синдром Клиппеля—Фейля) (2), (3). Доказана также связь спонтанной множественной диссекции с перенесенной незадолго острой инфекцией (9). Как правило, клинические проявления цервикальной диссекции складываются из повторяющихся транзиторных ишемических атак, инфарктов мозга, субарахноидальных кровоизлияний. Наиболее часто, (в 62-84%) при диссекции диагностируется инфаркт мозга (7), причиной развития которого является артериальная эмболия из области повреждения сосуда. Значительно реже имеет место гемодинамический вариант ишемического инсульта.
В 2015 году в сосудистом неврологическом отделении ГКБСМП им.Н.С.Карповича г.Красноярска наблюдались двое больных.
Клинический пример №1: больная Л., 21 год, поступила в отделение нейрореанимации с жалобами на слабость в правых конечностях, онемение в правой половине тела, головокружение, боль в области шеи слева. При детальном опросе выяснилось, что 19 дней назад, в период новогодних праздников, пациентка, катаясь с ледяной горки, получила «незначительную», по ее оценке, травму. Она описала падение, сопровождающееся запрокидыванием головы «назад». Ухудшение наступило без видимых причин, в связи с чем на догоспитальном этапе верификация диагноза была затруднена.
При неврологическом осмотре: сознание ясное, критична, инструкции выполняет. Отмечается резкая болезненность в области задней поверхности шеи слева. Выявляется сглаженность правой носогубной складки, центральный правосторонний гемипарез со снижением мышечной силы до 3 баллов, правосторонняя гемигипестезия по проводниковому типу, признаки динамической мозжечковой атаксии (интенция при пальце-носовой и коленно-пяточных пробах) с обеих сторон. Правосторонняя гомонимная гемианопсия.
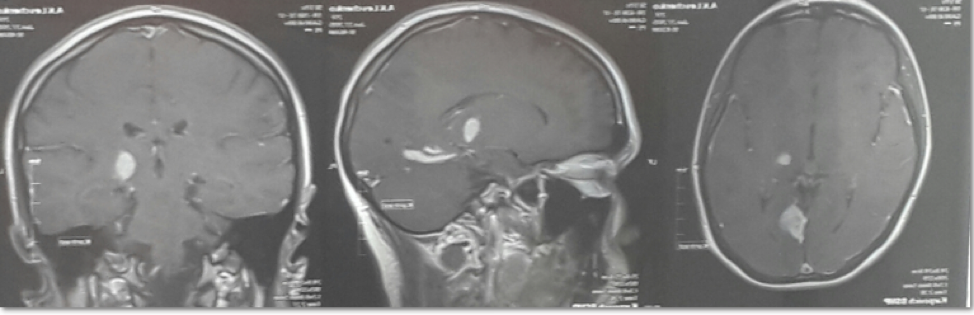
Рис.1. Больная Л. МРТ головного мозга.
На МРТ головного мозга : в медиобазальных отделах левой затылочной доли (в области язычковой извилины с распространением в гиппокамп) определяются мономорфные зоны цитотоксического отека неправильной формы, локализованные преимущественно в сером веществе мозга, размерами 2,3х7,6х2,3 см. Масс-эффект незначительный в виде сужения субарахноидальных борозд на уровне выявленных изменений. В области таламусов с двух сторон определяются очаги измененного МР сигнала. При внутривенном усилении определяется выраженное однородное накопление контраста (рис.1).
На МРА головного мозга определяется значительное сужение просвета и снижение кровотока (снижение интенсивности МР-сигнала) V4 сегмента правой позвоночной артерии на всем видимом протяжении. Вариант соединения позвоночных артерий – неслияние (правая позвоночная артерия не соединяется с аналогичным сегментом слева, продолжается в заднюю нижнюю мозжечковую артерию; слева – продолжается в основную артерию, равную по диаметру.
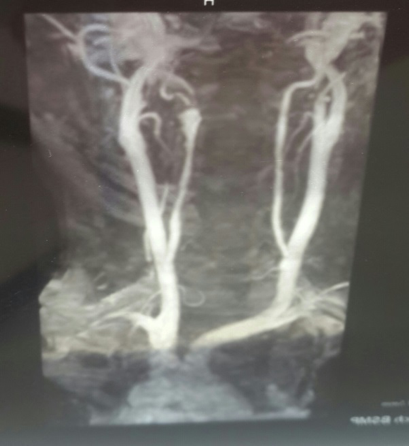
Рис.2.Больная Л. МРА артерий шеи.
На МРА артерий шеи: определяется выраженное расширение левой позвоночной артерии на уровне V2 верхнего края тела С3 позвонка до 0,7 см и последующее сужение менее 0,1-0,2 см на уровне тела С2 позвонка протяженностью 0,7 см. После сужения сохраняется расширение левой позвоночной артерии до V3 сегмента и на уровне сегмента (картина выраженного стеноза левой позвоночной артерии, выраженной престенотической дилатации в сегменте V2 левой позвоночной артерии (рис.2).
Данные нейровизуализации позволили установить диагноз: ишемический инсульт по типу артериальной тромбоэмболии в бассейне левой задней мозговой артерии с синдромом правостороннего центрального гемипареза, гемигипестезии, правосторонней гомонимной гемианопсии на фоне травматической диссекции левой позвоночной артерии с формированием критического стеноза этой артерии. Вариант развития сосудов Виллизиева круга (гипоплазия V3 сегмента и неслияние правой позвоночной артерии).
Немаловажное значение в развитии инсульта у данной больной играет выявленная на МРА аномалия развития сосудов Виллизиева круга. Так, «пострадавшая» артерия является практически единственным сосудом, из которого формируется весь вертебрально-базилярный бассейн. После консультации сосудистого хирурга было предложено проведение церебральной ангиографии с последующим решением вопроса об эндоваскулярном лечении стеноза левой позвоночной артерии.
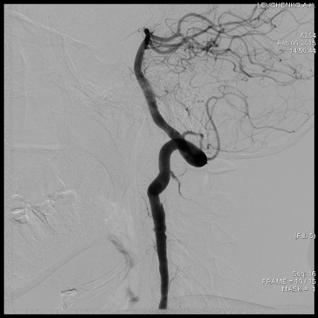
Проведенное эндоваскулярное контрастное исследование, подтвердило стеноз V2 сегмента левой позвоночной артерии 70% с постаневризматическим расширением (диссекция) и постаневризматическим критическим стенозом V3 сегмента (рис.3). Ангиографическими признаками диссекции левой позвоночной артерии у данной больной являются: неравномерность просвета сосуда, стеноз по типу «крысиного хвоста».
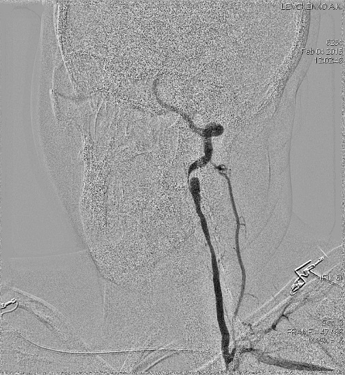
Рис.3.Больная Л. Ангиография левой позвоночной артерии (исходная).
Выполнено оперативное вмешательство: Эндопротезирование левой позвоночной артерии: РЭД (рентгенэндоваскулярная дилатация) в зоне стенозов баллонным катетером диаметром 2,0 мм, установлено 2 стента( BioMime 4,5х 16мм ), просвет артерии восстановлен. Рентгенконтраст: Визипак 320-160мл.

Рис.4.Больная Л. Ангиография левой позвоночной артерии (после операции).
На представленном снимке видно, что стеноза в сегментах V2 и V3 не выявляется, кровоток в левой позвоночной артерии восстановлен (рис.4).
После проведенного лечения: состояние больной удовлетворительное, мышечная сила восстановилась до 5 баллов в правой ноге и 4 баллов в правой руке, в которой также остается ощущение «онемения». Гомонимная гемианопсия регрессировала. С рекомендацией не прерывать прием дезагрегантов (плавикс, аспирин), а также продолжить нейропротективную, сосудистую терапию, пациентка была выписана под наблюдение невролога по месту жительства.
Клинический пример №2:
Больной Т., 31 год, поступил в стационар с жалобами на онемение и неловкость в левых конечностях, зрительные нарушения, головокружение. В неврологическом статусе при поступлении выявлялся: центральный парез VII,XII слева, центральный левосторонний гемипарез со снижением мышечной силы до 3б в руке и 4б в ноге, левосторонняя гомонимная гемианопсия, левосторонняя гемигипестезия.
На основании данных дообследования был выставлен диагноз: Повторный ишемический инсульт по типу артериальной тромбоэмболии в бассейне правой задней мозговой артерии с синдромом левостороннего центрального гемипареза, гемигипестезии, левосторонней гомонимной гемианопсии, на фоне диссекции правой позвоночной артерии с формированием аневризмы на уровне СI-CII.
Из анамнеза известно, что впервые был доставлен бригадой «скорой помощи» в неврологическое отделение ГКБСМП три месяца назад с жалобами на остро возникшую слабость в левых конечностях, нарушение зрения. После дообследования был установлен диагноз: ишемический инсульт в вертебрально-базилярном бассейне с синдромом левосторонней гомонимной гемианопсии, левостороннего центрального гемипареза. Выявленная на МСКТА мешотчатая аневризма на уровне С1-2 правой позвоночной артерии не была расценена как возможная причина ишемического инсульта.
Пациент выписан из стационара со значительным улучшением. Повторный инсульт в бассейне правой задней мозговой артерии развился через три месяца. Углубленный сбор анамнеза позволил установить, что в 2013 году больной перенес спинальную травму с компрессионным переломом L2-3 позвонков. Отмечался нижний парапарез, симптомы которого регрессировали на фоне лечения. В 2014 году — повторный эпизод падения с высоты, после чего появились боли в шейном отделе позвоночника.
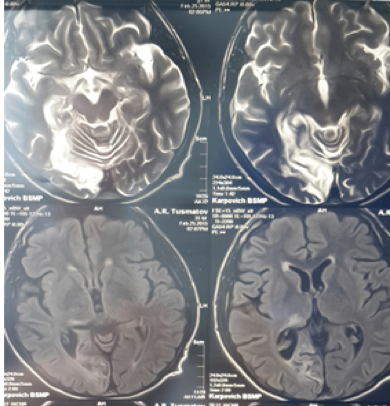
Рис.5. Больной Т.МРТ головного мозга.
На МРТ головного мозга: супратенториально, на медиальной поверхности правой затылочной доли обширная зона кистозно-ликворной трансформации размерами 56х20х18 мм. В таламусе справа — «застарелый» ишемический инсульт 14х8 мм с кистозно-ликворной трансформацией (рис.5).
На МРА головного мозга картина гипоплазии интракраниального сегмента позвоночной артерии справа.
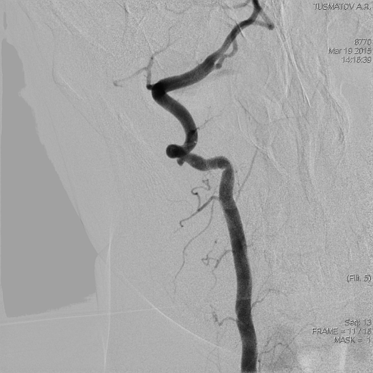
Рис.6. Больной Т. Ангиография правой позвоночной артерии (исходная).
На МСКТА и церебральной ангиографии: справа, на уровне СI-СII в позвоночной артерии определяется мешотчатая аневризма (рис.6) с широким основанием, размерами 3х1,5 мм в экстракраниальной части правой позвоночной артерии.
Проведено эндоваскулярное вмешательство на сосудах шеи, позволившее выявить стеноз позвоночной артерии в V3-V4, с аневризматическим мешком 2,4 на 1,9 мм; шейка аневризмы- 3,4мм. Выполнена РЭО аневризмы (спиралью CompassComplex 2,5х3,5см) со стент ассистенцией (LVIS 5х23мм). Просвет артерии восстановлен.Аневризматический мешок не контрастируется (рис.7). Рентгенконтраст: Визипак 320-160мл.
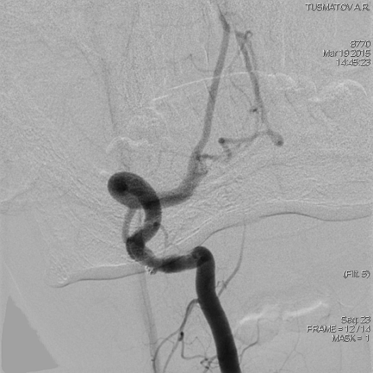
Рис.7. Больной Т. Ангиография правой позвоночной артерии (после операции).
Пациент выписан из стационара в удовлетворительном состоянии с рекомендациями принимать плавикс 75 мг в течение 2 месяцев, аспирин кардио 100 мг — пожизненно.
Таким образом, очевидно, что инсульт, развившийся в молодом возрасте, требует пристального внимания клиницистов. Для уточнения причины сосудистой катастрофы, помимо рутинных методов, необходимо проводить целенаправленное исследование брахиоцефальных артерий (МРА сосудов шеи, МСКТА сосудов шеи, а при необходимости — ангиографическое исследование по Сельдингеру).
Приведенные в данной статье клинические наблюдения показывают, что улучшение оснащенности сосудистого центра, привлечение технологий эндоваскулярной хирургии, способствует значительному повышению качества диагностики и лечения данного заболевания.
Источник
