Доктор медицинских наук иммунитет
В изначальной модели эпидемиологи предполагали, что коллективный иммунитет развивается при наличии иммунитета у 60% людей, перенесших инфекцию, пояснил РБК кандидат медицинских наук, врач-терапевт, советник гендиректора Московского международного медицинского кластера Ярослав Ашихмин.
«Но сейчас мы видим, что инфекция не развивается столь яростно, несмотря на то что иммунитет не превышает по всему миру 20%. Вероятно, это связано с тем, что изначальные модели были некорректны, мы оказались не очень хорошо подготовлены в плане эпидемиологии, надо все считать по-новому, и над верными показателями сейчас работают многие ученые. Точно можно сказать, что коллективный иммунитет должен быть более 20%», — сообщил он.
Как отметил Ашихмин, появление вакцины может переломить течение эпидемии, однако сказать, насколько она будет эффективна в борьбе с различными штаммами вируса, пока сложно.
«Как мы видим, мы логично сейчас совмещаем обе стратегии. Вирус оказался хуже гриппа, но не стал апокалипсисом. Люди во всем мире устали от карантина, и движение пошло по шведской модели так или иначе. Это постепенно формирует коллективный иммунитет, мы его в любом случае вырабатываем, ожидая появления вакцины», — уточнил эксперт.
По мнению завлабораторией трансплантационной иммунологии НМИЦ гематологии Григория Ефимова, модели о коллективном иммунитете опираются на неверную гипотезу, что люди имеют равные шансы заразиться коронавирусом. Он рассказал РБК, что вместе с коллегами в настоящий момент проводит исследование, которое позволяет наблюдать иммунитет к коронавирусу среди людей, ранее не болевших COVID-19.
«Мы видим, что у не болевших людей уже существует иммунный ответ — это не антитела, а Т-лимфоциты, которые распознают этот вирус. Зарубежные исследования показывают те же самые результаты. Скорее всего, это означает, что определенная часть людей невосприимчива к этой инфекции изначально. В рамках своего исследования мы выбираем людей, которые находились в тесном контакте с заболевшими, но сами не были инфицированы. Мы не можем сказать, какой именно процент людей обладает такими свойствами, но по ощущениям они легко находятся», — сказал Ефимов.
По его словам, если отталкиваться от факта, что существенная доля людей изначально невосприимчива к вирусу, то необходимый процент для формирования коллективного иммунитета может быть значительно ниже, чем 70%.
В марте ученые Университета Джонса Хопкинса пришли к выводу, что для выработки коллективного иммунитета к новому коронавирусу необходимо свыше 70% переболевших.
В России массовое тестирование на коронавирус началось в середине мая. К концу июня власти Москвы сообщали, что в столице антитела к коронавирусу были найдены у 19,5% населения. Глава Минздрава Михаил Мурашко также отмечал рост уровня популяционного иммунитета в Москве, что позволяет снижать заболеваемость. По его словам, регионы в этом вопросе отстают от столицы на три недели.
Источник
Еще несколько месяцев назад мир не знал о существовании
вируса, который изменит жизнь более 7,5 миллиардов человек.
Сегодня ученые всего мира пытаются найти вакцину и действенное
лекарство для борьбы с пандемией. Однако постепенно ученые узнают
больше подробностей о новом вирусе. Так, стало известно, что
SARS-CoV-2 в некоторых случаях избегает иммунного ответа и
приостанавливает выработку важной молекулы — интерферона. Как
коронавирусу это удается? Объясняет иммунолог, академик
Арег Тотолян.
Арег Артемович Тотолян — директор
Санкт-Петербургского института эпидемиологии и микробиологии
имени Пастера, доктор медицинских наук, профессор, академик
РАН.
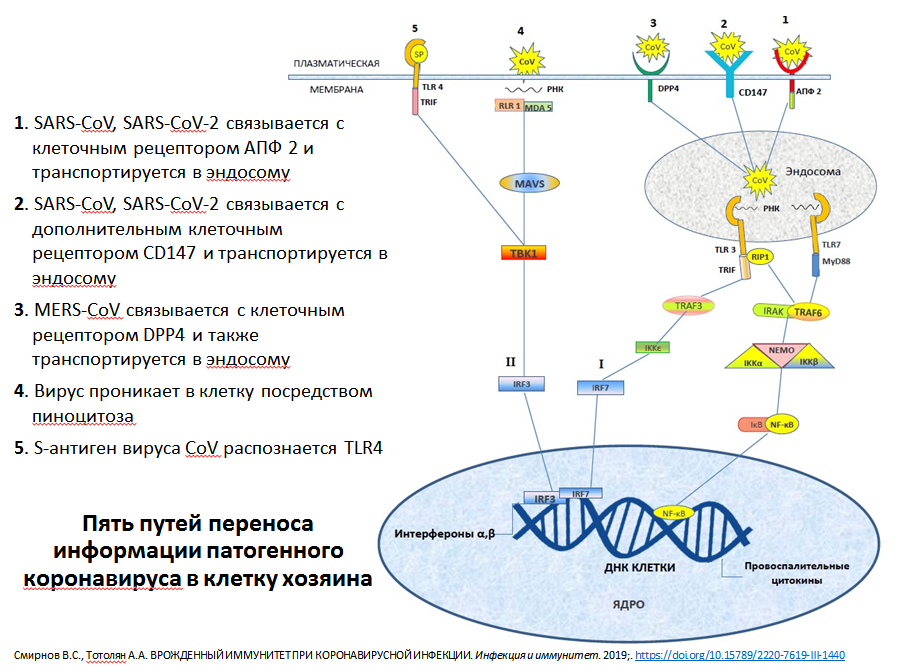
— Как вирус SARS-CoV-2 проникает в
клетку?
— Первая и основная клетка, в которую проникает вирус —
эпителиальная. Прежде всего, речь идет об эпителиальных клетках
верхних дыхательных путей. Ведь основные ворота для проникновения
вируса — это носоглотка и ротоглотка. При дальнейшем успешном
развитии инфекции поражаются средние и нижние дыхательные
системы.
В части случаев вирус поражает и другие органы и системы человека
— желудочно-кишечный тракт и почки. Об этом свидетельствует
соответствующая симптоматика — диарейный синдром и почечная
недостаточность.
Когда в январе 2020 году инфекция стала известна широкому кругу
специалистов, считалось, что единственный путь попадания вируса в
клетку осуществляется с помощью ангиотензинпревращающего фермента
— рецептора, получившего название ACE2. Но оказалось, что
существует второй рецептор, который выполняет функцию входных
ворот для вируса в клетку — CD147. Чем он примечателен?

Схема путей переноса информации патогенного коронавируса в клетку хозяина. Из презентации А.А. Тотоляна
Этот белок располагается на поверхности или мембране клетки.
Против него уже существует моноклональное антитело — то есть
лекарственный препарат, который применяют при лечении некоторых
онкологических заболеваний. Поэтому в ряде зарубежных странах
были инициированы клинические исследования этого препарата как
возможного кандидата для лечения COVID-19. Исследования
продолжаются, но пока результатов нет. Если этот препарат
окажется эффективным, то это значительно упростит ситуацию, а
главное — сэкономит время.
Вернемся к вопросу. Вирус, проникая в клетку, запускает целый ряд
механизмов, которые приводят к развитию дефектов. Нормальная
клетка при проникновении чужеродного микроорганизма ведет себя
соответствующим образом. Одно из проявлений ее поведения связано
с выработкой интерферона.
— Что собой представляет интерферон и каково его
место в иммунной системе?
— Интерфероны — это семейство белковых молекул, которые
продуцируются различными клетками организма человека и
обеспечивают, в том числе, противовирусный иммунитет. При этом
интерфероны обладают неспецифической активностью, то есть
действуют не на возбудителя какого-то конкретного заболевания, а
на любые вирусные частицы в целом. На сегодняшний день известно
целое семейство интерферонов — 20 разных молекул, объединенных
одним названием.
Наиболее известными являются три интерферона: альфа, бета и
гамма. Об остальных говорить не буду. Даже если читатели запомнят
три указанных представителя семейства интерферонов, этого вполне
достаточно для общего понимания. Интерферон-альфа обладает
истинной противовирусной активностью, чуть слабее — интерферон
бета. Интерферон гамма напрямую не обладает противовирусной
активностью. У него другая функция — иммунорегулирующая. Он
принимает самое активное участие в регуляции иммунного ответа, во
взаимодействии врожденного и адаптивного иммунитета.
Поэтому, в первую очередь, нас интересует интерферон альфа. По
идее эпителиальные клетки должны были вырабатывать интерферон
альфа и гамма при встрече с коронавирусом. Но в отношении
интерферона альфа этого не происходит. Почему? Дело в том,
что у вируса SARS-CoV-2 есть определенные механизмы, с помощью
которых он подавляет не только продукцию интерферона, но и сам
синтез.
— Как ему это удается?
— Эти процессы происходят на молекулярном уровне. Они приводят к
дефекту эпителиальной клетки, после чего она не может
продуцировать интерферон альфа. Этот факт имеет множество
последствий для организма. Чтобы не допустить этого, специалисты
проводят заместительную терапию с помощью препаратов на основе
интерферона альфа, которые позволяют восполнить дефицит.
— Так мы помогаем иммунитету?
— Да, верно. Мы вводим интерферон извне, тем самым компенсируя
дефект, вызванный вирусом. Препараты на основе интерферона альфа
особенно должны быть эффективны на ранних этапах, пока инфекция
не спустилась в нижние отделы дыхательных путей.
А интерферон гамма, напротив, важен на поздних этапах, когда
инфекция сопровождается пневмонией и так называемым цитокиновым
штормом.
Дело в том, что клетки иммунной системы «общаются» между собой с
помощью самых разных молекул, которые называются цитокинами. В
ответ на инфекцию они, естественно, синтезируются более активно.
Поначалу эти молекулы выполняют защитную функцию, привлекая в
очаг воспаления всё больше иных молекул и клеток. Но наступает
момент, когда ситуация выходит из под контроля, и цитокины
продуцируются в огромном количестве, тем самым нанося вред самому
организму. И именно здесь важную роль играет интерферон гамма,
который как раз запускает синтез целого ряда цитокинов. Поэтому
целесообразно применять терапию с помощью антицитокиновых
препаратов, чтобы нормализовать этот процесс.
Если цитокинового шторма нет, применять препараты для
антицитокиновой терапии нельзя. Ведь так мы добьемся диаметрально
противоположного результата. Выключение любого нормально
функционирующего компонента иммунной системы приводит к развитию
иммуносупрессии — дефекта иммунной системы.
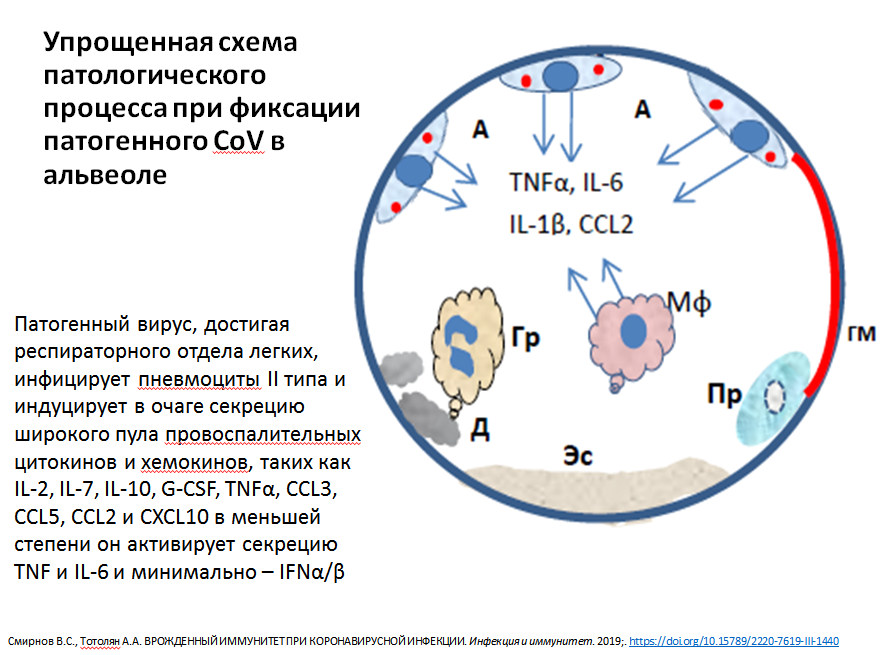
Схема патологического процесса при фиксации вируса в альвеоле. Из презентации А.А. Тотоляна
Другие схемы представлены в презентации академика
Арега Тотоляна.
— Давайте поговорим об особенностях протекания
болезни COVID-19. Почему она поражает именно легкие? Вирусу
комфортнее в этой среде или есть какие-то другие
объяснения?
— Просто вирусу проще попасть в организм через нос или рот, а
затем в легкие. А в ряде случаев, как я уже упоминал, он попадает
в желудочно-кишечный тракт.
Иммунная система очень многогранна и распространена по всему
организму, имея «представительства» практически во всех органах и
тканях. Если иммунная система желудочно-кишечного тракта не
справляется с ситуацией, значит, вирус с большей вероятностью там
поселится. Такая же ситуация обстоит с почками. Скажем, если
пациент страдает сахарным диабетом, то его почки также находятся
в поврежденном состоянии. Следовательно, вирус может задержаться
именно в почках.
— Сейчас многие научные коллективы ищут вакцину и
лекарство против нового коронавируса. На чем они будут
основаны?
— Начнем с вакцин. Сегодня как минимум 8 коллективов в России
занимаются разработкой вакцины. Если ее удастся создать, то она
поможет нам со второй волной пандемии. По разным оценкам, вирус
может приобрести сезонный характер.
Я не думаю, что мы успеем использовать вакцину в нынешней
ситуации. Скорее всего, пандемия завершится до того, как вакцина
получит путевку в жизнь. Это работа, прежде всего, на
перспективу. По сути, вакцина — это долгосрочная профилактика. Ее
появление позволит нам быстро сформировать иммунизированную
прослойку, которая будет защищать остальных.
Ведь мы не можем иммунизировать всех подряд. Существуют
определенные ограничения, которые не позволяют использовать одну
и ту же вакцину для всех. Есть также пациенты с иммунодефицитом,
приобретенным или врожденным. Для таких групп пациентов некоторые
вакцины просто противопоказаны. Именно поэтому 100%-я вакцинация
не достигается. Но она, по существу, и не нужна. Согласно теории
коллективного иммунитета, достаточно 70% населения с иммунитетом
к вирусу, чтобы избежать пандемии.
Если говорить о лечении, то наиболее эффективными специфичными
против вируса иммунопрепаратами должны стать терапевтические
моноклональные антитела — антитела, вырабатываемые иммунными
клетками, принадлежащими к одному клеточному клону, то есть
произошедшими из одной плазматической клетки-предшественницы.
Пока таких препаратов в нашем распоряжении нет, клиницисты идут
другим путем: переливают плазму реконвалесцентов, то есть
выздоравливающих людей. В крови выздоровевших имеются
специфические антитела. Их плазму крови вводят тем, кто наиболее
тяжело переносит заболевание.
— Какие препараты, разрабатываемые сегодня, будут
наиболее перспективными?
— На первое место я бы поставил терапевтические антитела.
Моноклональные антитела, как я уже говорил, это препараты,
которые обладают высокой селективностью в отношении молекулярной
мишени. Антитела обладают способностью точно связываться с
антигеном благодаря специальным антигенсвязывающим участкам,
имеющим к нему высокую специфичность. Это определяет
селективность лекарств на основе антител в отношении конкретной
мишени.
Вторые по значимости — пептиды, которые могут обладать
активностью против вируса. В своих исследованиях мы решили пойти
как раз по этому пути. Как нам кажется, результаты могут
оказаться весьма перспективными.
Это то, что касается перспектив иммунотерапии. Пациенты, особенно
с тяжелыми формами заболевания, получают самое разнообразное
лечение и в части применяемых препаратов, и в части медицинских
технологий. В этом вопросе «карты в руки» клиницистам, которые
непосредственно ведут этих пациентов, прежде всего,
реаниматологам и пульмонологам.
Интервью осуществлено при поддержке Министерства науки и
высшего образования РФ и Российской академии наук
Источник
Профессор аллерголог-иммунолог Юрий Смолкин рассказал, как на самом деле работает наша иммунная система и как влияют на нее разные вещества и продукты [инфографика]
Как на самом деле работает наша иммунная система и как влияют на нее разные вещества и продуктыФото: GLOBAL LOOK PRESS
Изменить размер текста:
О последних научно-медицинских данных про связь долголетия и состояния нашей иммунной системы «КП» рассказал директор Научно-клинического консультативного центра аллергологии и иммунологии, профессор Юрий Смолкин.
СОЛНЦЕ ПРОБИВАЕТ БРЕШЬ В ЗАЩИТЕ?
— Юрий Соломонович, об иммунитете постоянно говорят, все призывают его повышать, считается, что он закладывает основы для активного долголетия. Но как «выглядит» иммунитет, когда он хороший, и когда на самом деле плохой — мало кто себе представляет. Что говорит сейчас наука на этот счет?
— Наука говорит, что иммунитет — это целая армия, защищающая наш организм как от внешних врагов (бактерий, вирусов, грибков и т. д.), так и от внутреннего неприятеля — например, собственных клеток, которые перерождаются в онкологические. В иммунную систему входят особые виды клеток, ткани, факторы, циркулирующие в крови — в общем, это разнородный комплекс. Поэтому иммунитет нельзя ни понизить, ни повысить, ни сдвинуть вправо-влево. То есть на самом деле мы не можем его как-то заметно улучшить, можем только поддерживать в нормальном состоянии. И еще можем ухудшить. Например, если подвергнуть человека облучению.
— Солнечное облучение, которое мы ловим при загаре, тоже бьет по иммунитету?
— Конечно, солнечное облучение это разновидность радиоактивного, поэтому чрезмерное пребывание на солнце вредит иммунитету (напомним, врачи рекомендуют загорать до 10 утра и после 4 — 5 часов вечера. — Ред.).
ИММУНОСТИМУЛЯТОРЫ НА КАЖДЫЙ ДЕНЬ
— А как насчет популярных сейчас иммуностимуляторов, иммуномодуляторов, иммунокорректоров — все эти слова можно встретить на ярких упаковках в витринах аптек. И нас повсюду уверяют, что эти препараты нужны для укрепления иммунитета и продления молодости. Кстати, еще часто утверждается, что эти средства не имеют побочных эффектов.
— Любой препарат, который действительно работает, то есть дает эффект, отличный от плацебо (пустышки), всегда имеет побочное действие. Поэтому, заявляя, что нет «побочки», производители сами расписываются и в отсутствии основного эффекта — якобы иммуностимулирующего. Вообще же, чтобы изменить иммунный ответ организма, нужно очень сильное воздействие. На сегодня есть небольшое количество лекарственных средств, которые способны на это, и они применяются только в крайних случаях, как правило, при очень тяжелых заболеваниях — онкологических, ВИЧ.
— То есть «иммуностимуляторы на каждый день» попросту не работают и не помогут отдалить старость?
— Убедительных доказательств, что такие средства положительно действуют на иммунную систему, и уж тем более на старение организма, до сих пор никто не получил.
ВМЕСТО ВЫВОДА
— Когда человек разумно, без фанатизма, занимается физнагрузками — делает по утрам зарядку, ходит пешком — то в организме выделяется несколько десятков полезных веществ, — радует наш эксперт. — Эти вещества отвечают за повышение настроения, улучшение сна, и в том числе усиливают иммунную защиту.
В целом лучше всего работают на активное долголетие самые простые правила: упомянутые разумные физнагрузки, полноценный сон и здоровое питание. Какие продукты и вещества полезны для иммунитета — см. в рубрике «Будь в курсе».
БУДЬ В КУРСЕ
Работает — не работает?
Раскрученные средства из аптек, как поясняет эксперт, поднять иммунитет не могут. А на что способны продукты и вещества, которые традиционно считаются природными иммуностимуляторами? Мы попросили профессора-иммунолога Юрия Смолкина оценить самые популярные в народе средства.
— Мед. «Хороший качественный мед действительно является отличным природным средством, помогающим поддержать иммунитет. Это редкий случай, и такое воздействие меда подтверждено научными исследованиями. К сожалению, полезные свойства меда не пригодятся тем, кто страдает аллергией на сам продукт, пыльцу и другие компоненты, производимые пчелами», — предупреждает профессор.
— Чеснок. «Это бактерицидное средство, то есть помогает убивать определенные виды бактерий. На сам иммунитет не действует».
— Шиповник, черная смородина. «Иммуностимулирующего эффекта у них нет. Просто поддерживают нормальную жизнедеятельность организма, поскольку содержат полезные вещества».
— Женьшень. «Не стимулирует иммунную систему напрямую, но воздействует на вегетативную нервную систему, которая влияет на разные органы, в том числе задействованные в иммунном ответе». Так что, в конечном счете, женьшень может не только поднимать тонус, но и «подбадривать» иммунитет. Однако важно помнить о противопоказаниях — в частности, нужно быть осторожными и советоваться с врачом при заболеваниях щитовидки, центральной нервной системы, сердечно-сосудистых нарушениях.
ИСТОЧНИК KP.RU
Источник
Одной и той же болезнью разные люди болеют по-разному. Факторов, которые влияют на индивидуальную клиническую картину, множество, и чем больше накапливалось данных в медицинской статистике, тем яснее становилось, что многие заболевания имеют половую специфику. Например, от ревматоидного артрита женщины 40—60 лет страдают значительно чаще, чем их ровесники-мужчины. И бронхиальной астмой женщины болеют тоже чаще, хотя процент курящих мужчин несравнимо больше. С другой стороны, женщины легче переносят травмы, кровотечения, заражение крови. Можно заметить, что различия по полу проявляются в тех случаях, когда болезнь и её основные симптомы связаны с воспалением. Поскольку за воспаление отвечает иммунитет, то сам собой напрашивается вывод, что иммунная система у мужчин и женщин работает по-разному. Действительно, женский иммунитет более активен, он быстрее справляется с сепсисом и быстрее помогает заживлять раны, но, с другой стороны, увеличивается риск того, что иммунитет начнёт атаковать собственные клетки организма: женщины чаще болеют красной волчанкой, рассеянным склерозом, синдромом Шегрена и другими аутоиммунными заболеваниями.
Томас Гейнсборо. Портрет мистера и миссис Эндрюс. 1750 год. Лондонская национальная галерея.
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
‹
›
Почему женский иммунитет отличается от мужского? Сама по себе иммунная система, её клетки (лимфоциты, макрофаги, плазмоциты) и гуморальные агенты (антитела, цитокины, лимфокины) никаких половых признаков не имеют. Однако иммунитет теснейшим образом связан с нервной и эндокринной системами, а в них половых отличий более чем достаточно. Обнаружено свыше 1100 генов, в той или иной степени связанных с различиями в иммунных реакциях у женщин и мужчин. Если говорить о нервной системе, то сейчас уже довольно точно известны особенности в структуре мозга, определяемые полом. В мужском больше белого вещества, в женском — серого. Из-за этого кора мозга у женщин немного толще, а потому имеет чуть более сложный ландшафт (так как большее количество серого вещества нужно как-то скомпоновать и уложить с помощью извилин). Кроме того, есть разница в величине отдельных мозговых структур: например, гиппокамп, который считается одним из главных центров памяти, у мужчин в среднем побольше. Крупнее у них и миндалевидное тело, отвечающее за обработку эмоций и опять-таки за память. С возрастом у мужчин происходит уменьшение общего объёма мозга, но одновременно увеличиваются размеры лобной и височной долей, а у женщин с возрастом происходит уменьшение размеров гиппокампа и коры теменной области. Объём серого вещества у обоих полов линейно снижается с возрастом, однако у мужчин этот процесс идёт более интенсивно. Наконец, не так давно нейробиологи нашли различия во внутримозговых соединениях: у женщин преимущество отдано межполушарным связям, а у мужчин — внутриполушарным. Хотя далеко не всегда понятно, как структурные особенности отражаются (и отражаются ли) на когнитивных функциях и поведении обоих полов. В том, что касается внутримозговых соединений, структурные данные вполне согласуются с результатами психологических экспериментов, согласно которым женщины лучше управляют вниманием, лучше запоминают слова и лица и лучше ориентируются в группе, то есть проявляют хорошие социальные навыки. Мужчины же в соответствующих тестах выигрывают в сенсомоторных заданиях и в умении ориентироваться в пространстве. И такие когнитивно-поведенческие различия проявляются как раз к 12—14 годам, — когда начинает возникать специфика в структуре проводящих путей мозга.
Одна из важнейших функций нервной системы — реакция на стресс, в том числе и психологический. Проявляется она по-разному: человек может впасть в депрессию, а может стать агрессивным, предпочитая нападение уходу в себя. В любом случае стресс подавляет иммунитет, и раз у нас есть половые отличия в нервной системе, то и стрессовый эффект подавления иммунитета у мужчин и женщин должен отличаться. Действительно, депрессия сильнее вредит женскому иммунитету, нежели мужскому. Отрицательная эмоциональная нагрузка вызывает увеличение уровня воспалительных белков цитокинов, из-за чего у женщин с низким порогом гнева (то есть раздражающихся по пустякам) повышается риск развития невосприимчивости тканей к инсулину, что является одной из характерных черт диабета 2-го типа. У мужчин этот вопрос недостаточно изучен.
Но почему отличия в нервной системе отражаются на иммунитете? Здесь нужно вспомнить, через каких посредников мозг, нер-вы могут действовать на иммунную систему. Во-первых, это нейромедиаторы — вещества, которые участвуют в передаче импульса от одной нервной клетки к другой. Они могут действовать не только на нейроны, но и на другие клетки. Во-вторых, это гормоны. Так, хронический стресс стимулирует выброс гормонов надпочечников — глюкокортикоидов, а также пролактина и ФРН (фактора роста нервов), которые действуют на иммунитет, замедляя заживление ран, ухудшая ответ на вакцинацию и снижая противораковые способности иммунной системы. Анализируя связь между полом и гормональным состоянием при остром психологическом стрессе, исследователи выяснили, что у мужчин и женщин по-разному работают две важнейшие эндокринные железы — гипоталамус и гипофиз, находящиеся в тесной связи друг с другом. Межполовые различия в их работе сказываются на уровне стрессового глюкокортикоида кортизола, секреция которого в надпочечниках контролируется гипоталамо-гипофизарной осью: у женщин амплитуда кортизола доходила до максимума при социальном стрессе, а у мужчин — при мотивационном, связанном с решением задач. То есть характер стресса (что само по себе относится к высшей когнитивной деятельности), преломляясь сквозь различное гендерное восприятие, по-разному отражался на состоянии эндокринной системы.
Заговорив о гормонах, невозможно пройти мимо половых стероидов, андрогенов и эстрогенов. Все знают, что у мужчин и женщин преобладают разные группы половых гормонов и что у женщин активность эстрогенов подчиняется периодическому циклу. Однако не стоит думать, что эти стероиды управляют только половой системой, — и андрогены и эстрогены находятся в тесной и взаимообратной связи и с нервной системой, и с другими гормонами, и с иммунитетом. Влияние половых стероидов на нервную систему приводит к активации многих систем, отвечающих за наши эмоции и поведение. Так, эстрадиол способствует тревоге и депрессии, тогда как тестостерон часто связывают с агрессивным поведением. Исследования на животных продемонстрировали связь эстрогенов с повышенной чувствительностью организма к стрессу и ослаблением когнитивных функций.
С другой стороны, лабораторные и клинические данные указывают на защитные, нейропротекторные свойства эстрогенов, что можно, по крайней мере частично, объяснить взаимодействием эндокринной и иммунной систем. Например, эстроген подавляет продукцию воспалительных факторов при повреждении мозга и тормозит нейродегенеративные заболевания, такие как синдром Паркинсона и синдром Альцгеймера. (Андрогены, подобно эстрогенам у женщин, проявляют нейропротекторные свойства у мужчин. Одним из механизмов такого действия может быть стимуляция обмена веществ в ЦНС.)
Свой вклад в половые различия вносит и разная динамика мужских и женских половых стероидов. У мужчин уровень андрогенов с возрастом падает медленно, так что у них резких изменений как в работе нервной системы, так и в функционировании иммунитета не случается. У женщин же реакции на стресс усугубляются во время менопаузы, когда уровень стероидов резко меняется и заместительная гормонотерапия помогает смягчить такую «стрессонеустойчивость». Кроме того, реакции иммунной системы на стресс зависят от фазы менструального цикла и беременности. В целом у женщин в репродуктивном возрасте амплитуда реакции на стресс ниже, чем у мужчин, но в лютеальной фазе (когда в яичниках разрушается вр?менная железа, называемая жёлтым телом и синтезирующая прогестерон и немного эстрогена) приближается к мужской. Колебания уровня эстрогенов и прогестерона в течение женского полового цикла закономерно отражаются на колебании уровней факторов иммунорегуляции. У женщин, находящихся на пороге климакса, эстроген вызывает перепады настроения и повышенную тревожность, действуя через нервные пути, которые используют в качестве нейромедиаторов серотонин, дофамин, гамма-аминомасляную кислоту (ГАМК), адреналин и норадреналин.
Половые стероиды могут влиять на иммунитет не только через нервную систему, но и напрямую, воздействуя непосредственно на иммунные клетки. Так, рецепторы эстрогена обнаружены во многих типах иммунных клеток, включая B- и Т-лимфоциты, дендритные и NK-клетки. Эстрогены влияют на врождённые иммунные ответы и стимулируют синтез так называемых молекул адгезии (благодаря которым лимфоциты могут закрепиться в очаге повреждения) и хемокинов — веществ, контролирующих местную иммунную реакцию, например то же воспаление. Вообще же половые стероиды могут быть как иммуностимуляторами, так и иммуносупрессорами, в зависимости от конкретного гормона, его концентрации в данный момент времени и количества рецепторов к нему. В целом считается, что андрогены, мужские стероидные гормоны, и гормоны беременности прогестины работают как иммуносупрессоры, тогда как эстрогены связаны с усилением иммунного ответа, причём они действуют не только на собственно иммунные клетки, но и на служебные клетки стромы (опорной структуры) лимфоузлов, синтезирующие регуляторные иммунные белки цитокины.
Непосредственное взаимодействие половых гормонов с иммунитетом заметно сказывается во время менопаузы. В этот период особенно возрастает риск повреждения костей вследствие остеопении и остеопороза, когда снижаются масса костной ткани и её минеральная плотность. С одной стороны, эстрогены сами по себе необходимы для поддержания должной минерализации костной системы. С другой стороны, известно, что воспаление, инфекция и аутоиммунные заболевания также связаны с системными и локальными костными потерями. Сейчас доказано прямое участие иммунных Т-клеток и цитокинов в формировании и функционировании остеокластов (клеток, разрушающих кость) и остеобластов (клеток, порождающих костное вещество). Дефицит эстрогенов побуждает Т-клетки повышать уровень остеокластогенных факторов.
Старение организма отражается и на состоянии иммунитета, что проявляется, в частности, в уменьшении тимуса (влочковой железы), в котором происходят созревание, дифференцировка и иммунологическое «обучение» Т-клеток. В результате снижается клеточный ответ не только на новые патогены, но и на те, которые уже должны быть известны иммунной системе, что приводит к снижению защиты от инфекционных заболеваний. Хотя механизмы, отвечающие за возрастное ослабление тимуса, до конца не известны, есть данные о том, что тут не обходится без половых стероидов. Устранение гормонов сопровождается омоложением старого тимуса с выраженным увеличением его массы и выхода Т-клеток в циркуляцию. Изменения сохраняются весьма длительное время, более того — даже временное снижение стероидов способно значительно простимулировать тимическую активность и расширить активность циркулирующих Т-клеток, что может иметь важное значение при иммунодефицитных состояниях, связанных либо с возрастом, либо с результатами токсического лечения (химио- и радиотерапия, лечение ВИЧ).
Мы так долго обсуждаем половые гормоны, что может сложиться впечатление, будто за «смычку» нервной, иммунной и эндокринной систем отвечают только эстрогены да андрогены. Однако это не так. Ранее мы упоминали ещё глюкокортикоиды (стероидные гормоны надпочечников), пролактин, нейропептид ФРН (фактор роста нервов), нейромедиаторы; к ним можно добавить инсулин, гормон роста соматотропин, соматостатин, пептиды лептин, грелин, опиоиды и многие, многие другие. Кроме центральной нервной системы существует ещё периферическая, которая тоже участвует в регуляции активности иммунитета. Наконец, не только нервная и эндокринная системы влияют на иммунную, но и наоборот. Мы уже говорили о том, как колебания эстрогена влияют на эмоциональное состояние и когнитивные функции; есть данные о том, что цитокины и факторы роста, секретируемые иммунными клетками при воспалении или стрессе, могут влиять на работу эндокринной и центральной нервной систем. Например, цитокины, обладающие противовоспалительным эффектом, вмешиваются в гормональные сигнальные пути и способны поэтому провоцировать гормональную резистентность, когда ткани перестают чувствовать то или иное активное вещество (мы упоминали, что в случае инсулина такая резистентность приводит к диабету 2-го типа). Подробный анализ всех веществ, связывающих эндокринную, нервную и иммунную системы и обуславливающих половые различия между ними, занял бы слишком много места, поэтому мы напоследок остановимся на двух гормональных пептидах, лептине и грелине.
Лептин синтезируется преимущественно жировыми клетками — адипоцитами и высвобождается в кровь во время еды, по мере насыщения. Он служит анорексигенным (подавляющим аппетит) медиатором, посылая соответствующие сигналы в мозг и одновременно стимулируя сжигание жира. Но лептин — это не только «гормон сытости»: есть сведения, что он участвует в развитии и поддержании иммунной и воспалительной реакций. Уровень лептина повышается во время инфекций, при остром и хроническом воспалительных процессах, что указывает на его роль в иммунной защите организма. Лептин задействован в патогенезе аутоиммунных заболеваний (энцефаломиелит, диабет 1-го типа, воспалительные заболевания ЖКТ и артриты). Хотя точно его роль в этих заболеваниях не ясна, очевидно, что он работает как мощный иммуномодулятор, гормон и цитокин с провоспалительной природой, способный регулировать врождённый и адаптивный иммунный ответы.
Другой метаболический гормон с противоположной лептину функцией, грелин, синтезируется преимущественно в желудке и служит мощным орексигенным (возбуждающим аппетит) фактором, контролирующим расход энергии, ожирение и секрецию гормонов роста.
Повышение уровня лептина в крови обычно сигнализирует мозгу, что человек сыт, тогда как повышение уровня ацетилированного грелина говорит о голоде. Сходным образом пересекаются их сигналы в иммунных клетках: в отличие от лептина, грелин оказывает противовоспалительное действие. То есть ожирение, вызванное дисбалансом в лептино-грелиновой системе, может спровоцировать иммунологические расстройства. Но лептином и грелином тут дело не ограничивается: в недавней статье в журнале «Immunity» группа исследователей из Института Вейцмана (Израиль) сообщает, что ожирение и сопутствующие ему повышенное кровяное давление, высокий уровень холестерина в крови и симптомы диабета возникают на фоне исчезновения дендритных иммунных клеток. Они следят за балансом своих «коллег» — Т-клеток, которые, лишившись контроля со стороны, провоцируют ожирение у подопытных мышей.
В этих примерах, иллюстрирующих связь иммунитета с энергетическим обменом веществ, хорошо видно, с какими сложностями приходится сталкиваться врачам: очевидно, что медицинский препарат, который должен подействовать на молекулы-посредники одной системы (например, седативное средство), в какой-то мере подействует и на вещества, принадлежащие ассоциированным «департаментам» (иммунному и эндокринному). И для того чтобы повысить качество лечения, чтобы избежать побочных эффектов, мы должны как можно полнее представлять себе метаболические взаимосвязи в нашей иммунно-нейро-эндокринной суперсистеме.
Источник
