Хронический гепатит в клеточный иммунитет
Сахарова Д.А., Терешков П.П., Витковский Ю.А.
Введение. Мировая пандемия вируса гепатита С остается злободневной реальностью современности. Гепатит С (HCV) характеризуется высокой частотой хронизации, длительным персистированием возбудителя, высоким риском развития осложнений – цирроза печени, первичной гепатокарциномы и является ведущим в структуре смертности от заболеваний печени. Установлено, что основную роль в формировании характера иммунного реагирования макроорганизма играет взаимодействие в системе «вирус-хозяин», что определяет сценарий развития событий при HCV-инфекции [4].
В настоящее время считается доказанным, что высокая частота (50-85% по данным различных авторов) формирования хронических форм и развития осложнений обусловлена «ускользанием» вируса от иммунного надзора [5, 6]. Механизмы этого феномена до сих пор четко не установлены. Предполагается, что центральную роль в элиминации вируса гепатита С играет Т-клеточное звено иммунитета, которое, в конечном итоге всё же оказывается недостаточным [1, 7]. Существенное значение в поддержании патологического процесса у больных придается недостаточности CD4+ Т-хелперов и дисбалансу цитокинов [8].
При этом не в полной мере выяснены вопросы, касающиеся состояния системы иммунитета в зависимости от клинических факторов – наличия репликации, активности процесса, стадии и длительности заболевания, наличия сопутствующей патологии, генотипа HCV, что может иметь важное практическое значение [1].
Таким образом, многие аспекты иммунного ответа при гепатите С остаются невыясненными, в том числе в зависимости от стадии фиброза печени и длительности заболевания, хотя это актуально как в теоретическом, так и в практическом плане.
Цель исследования: изучить некоторые показатели иммунного статуса больных хроническим вирусным гепатитом С в зависимости от ряда клинических характеристик заболевания.
Материалы и методы. Было обследовано 69 человек, находившихся на стационарном лечении в ГУЗ «Краевая клиническая инфекционная больница» г. Читы за период с 2011 по 2013 г. по поводу хронического вирусного гепатита С. Женщины составили 30,4% (21 человек), мужчины – 69,6% (48 человек). Возраст обследованных находился от 16 до 58 лет, средний возраст – 36±1 лет. От всех пациентов получено добровольное информированное согласие на участие в исследовании.
Диагноз хронического вирусного гепатита С выставлен на основании клинико-лабораторных данных и обнаружения рибонуклеиновой кислоты (РНК) HCV методом полимеразной цепной реакции (ПЦР). Длительность заболевания до 5 лет выявлена у 66,7%, свыше 5 лет – у 33,3%. Первая степень биохимической активности процесса определялась у 55,0% больных хроническим вирусным гепатитом С (ХВГС), вторая – у 45,0%. Стадия заболевания по Metavir F0-F1 была диагностирована у 43,5% (30); F2 – у 42,0% (29); F3-F4 – у 14,5% (10).
Группу контроля составили 9 здоровых человек в возрасте от 27 до 42 лет, средний возраст 34,0±2 лет. Женщин было 66,7% , мужчин – 33,3%. От всех обследованных получено добровольное информированное согласие на участие в исследовании.
Кровь для иммунологического обследования получали путем пункции локтевой вены в строго стерильных условиях на 2-3-и сутки стационарного лечения. Взятие крови осуществляли в утренние часы (8-9 часов) строго натощак. Для иммунофенотипирования кровь забирали в пробирку VACUTAINER (BD), содержащую динатриевую соль ЭДТА объемом 2,5 мл.
Изучались активность и количество Lymphocytes (CD45+), T-cell (CD3+), T-help (CD3+CD4+), T-killer (CD3+CD8+), T-cellAktiv (CD3+HLA-DR+), T-helpAktiv (CD3+CD4+HLA-DR+), T-killAktiv (CD3+CD8+HLA-DR+), B-cell (CD19+), NK-cell (CD3-CD16+CD56+), T-NK-cell (CD3+CD16+CD56+). Оценку субпопуляционной структуры лимфоцитов осуществляли стандартным методом прямого пяти-параметрического иммунофлюоресцентного окрашивания цельной крови с использованием коммерческого лизирующего/фиксирующего раствора OPTILYSE С (Beckman Coulter) и панели моноклональных антител tetraCHROME™ и IOTest (Beckman Coulter): 1-ая панель – CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5 и HLA-DR-PC7; 2-ая панель – CD45-FITC/CD56-RD1/CD19-ECD/CD3-PC5 и CD16-PC7. Контрольные пробы инкубировали с иммуноглобулинами, мечеными флуорохромами (FITC, RD1, ECD, PC5, PC7) соответствующего изотипа – мышиные IgG1, IgG2a IOTest (Beckman Coulter). Цитофлюорометрию осуществляли на проточном цитофлюориметре «Cytomics FC-500» (Beckman Coulter, USA), регистрировали суммарно не менее 10 тыс. событий. Данные анализировали с помощью программы CXP Cytometer (Beckman Coulter).
Определение показателя лимфоцитарно-тромбоцитарной адгезии (ЛТА) проводили по методу, предложенному Ю.А. Витковским и соавт. (1999) [2]. Свежую гепаринизированную кровь обследуемых больных наслаивали на градиент урографин-фикол (плотность 1,077) и выделяли лимфоциты. Собирали интерфазное кольцо, содержащие клетки и кровяные пластинки, однократно промывали фосфатно-солевым буфером (рН 7,4) и центрифугировали при 1000 об/мин в течение 3-4 минут. Надосадочную жидкость сливали, осадок микроскопировали в камере Горяева. Показатель ЛТА выражали числом лимфоцитарно-тромбоцитарных коагрегатов на 100 клеток (норма – 13-15%). Степень адгезии (ЛТИ) определяли как число кровяных пластинок, адгезированных на поверхности одного лимфоцита (норма – 3,0±0,3).
Статистическая обработка полученных результатов осуществлялась с использованием пакета анализа Microsoft Excel. Она включала описание выборки, нахождение средней арифметической, среднеквадратического отклонения и ошибки средней арифметической, определялись частоты встречаемости признаков, группировка данных. Достоверность различий определялась по t-критерию Стьюдента.
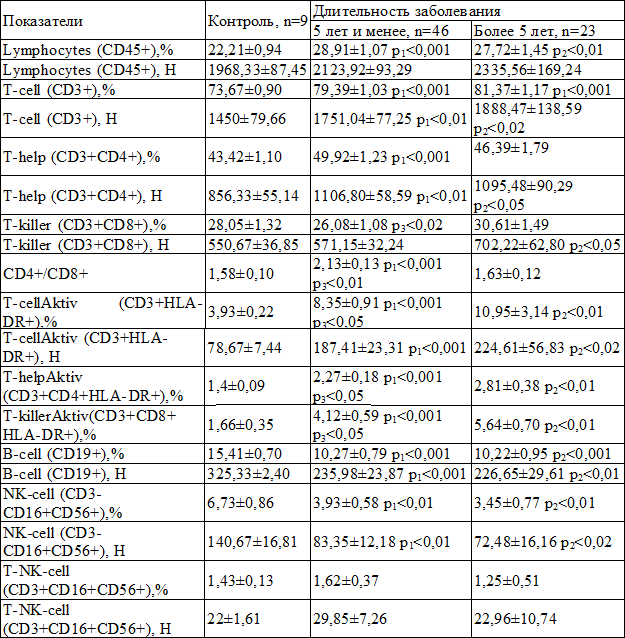
Результаты и их обсуждение. Установлено, что у всех больных хроническим вирусным гепатитом С изменены показатели иммунограммы, по сравнению с контролем, при этом аналогичные закономерности определялись вне зависимости от стадии фиброза печени (табл. 1). Общими изменениями, по сравнению с контролем, явились значимое повышение относительного и абсолютного количества лимфоцитов, субпопуляций CD3+, CD3+CD4+, активированных Т-лимфоцитов (CD3+HLA-DR+), активированных Т-хелперов (CD3+CD4+HLA-DR+), активированных Т-киллеров (CD3+CD8+HLA-DR+). Одновременно отмечено снижение, по сравнению с контролем, процента и количества субпопуляций лимфоцитов CD19+ и CD3-CD16+CD56+. Повышенным оказался и иммунорегуляторный индекс (CD4+/CD8+).
В табл. 2 представлены средние показатели иммунограммы больных хроническим вирусным гепатитом в зависимости от степени активности процесса, в сравнении с контролем. Изменения иммунограммы аналогичны описанным выше, при этом значимых отличий между первой и второй степенью активности не зарегистрировано.
Изменения показателей иммунограммы у больных хроническим вирусным гепатитом С в зависимости от длительности заболевания представлены в табл. 3. Выявлено, что чем продолжительнее стаж болезни, тем значимо больше становилось активированных Т-лимфоцитов (р<0,05), активированных Т-хелперов (р<0,05) и активированных Т-киллеров (р<0,05). При этом иммунорегуляторный индекс (CD4+/CD8+) был повышен на ранних сроках заболевания и снижался после 5 лет болезни (р<0,01). Другие показатели клеточного иммунитета не зависели от длительности течения хронического вирусного гепатита С.
Не выявлено отличий, в сравнении с контролем, по таким показателям клеточного иммунитета, как абсолютное и относительное количество Т-киллеров (CD3+CD8+) и относительного количества субпопуляции CD3+CD16+CD56+.
В настоящее время широко изучаются межклеточные взаимодействия, особенно между системой гемостаза и иммунитета. Установлено, тромбоциты
Таблица 1. Сравнительная характеристика средних значений показателей иммунного статуса у больных ХВГС на разных стадиях фиброза печени (M±m)
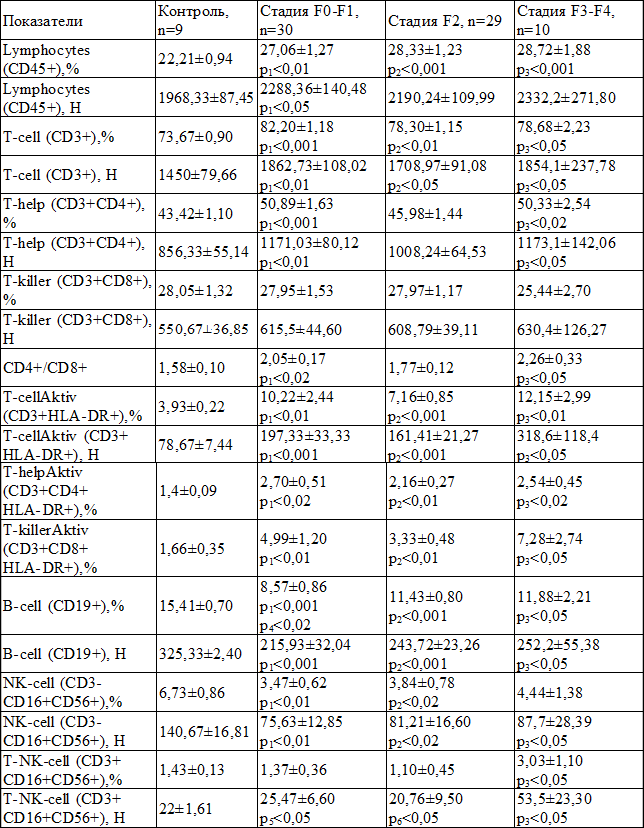
Примечания: р1 – достоверное различие показателей группы F0-F1 с контролем; р2 – достоверное различие показателей группы F2 с контролем; р3 – достоверное различие показателей группы F3-F4 с контролем; р4 – достоверное различие показателей группы F0-F1 с группой F2; р5 – достоверное различие показателей группы F0-F1 с группой F3-F4; р6 – достоверное различие показателей группы F2 с группой F3-F4
Таблица 2. Сравнительная характеристика средних значений показателей иммунного статуса у больных ХВГС в зависимости от степени активности процесса (M±m)
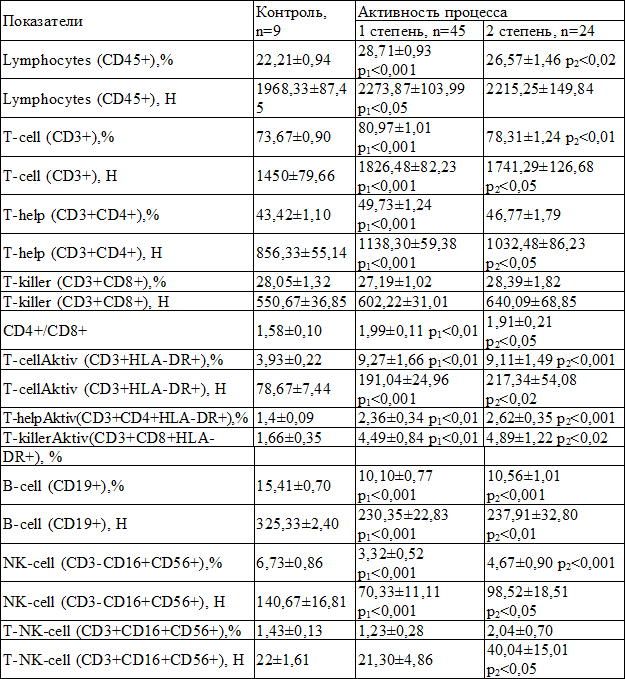
Примечания: р1 – достоверное различие показателей группы с 1 степенью активности с контролем; р2 – достоверное различие показателей группы со 2 степенью активности с контролем; р3 – достоверное различие показателей группы с 1 степенью активности с группой со 2 степенью активности
имеют отношение к протеканию воспалительных реакций: адгезивные взаимодействия между тромбоцитами и лейкоцитами являются важными звеньями механизмов, обеспечивающих миграцию лейкоцитов в зону повреждения, а, следовательно, воспаления и развития иммунных и репаративных реакций [2, 3]. Этот феномен получил название лимфоцитарно-тромбоцитарной адгезии.
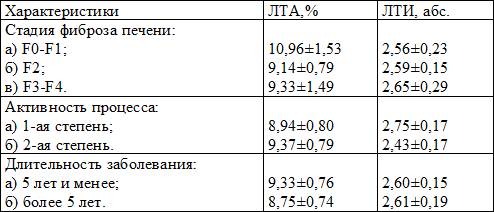
Установлено, что у больных хроническим вирусным гепатитом С общий показатель ЛТА оказался пониженным – 9,13 ± 0,56%, при этом значимых отличий от стадии фиброза печени, активности процесса и длительности заболевания не выявлено (табл. 4). При этом заметна тенденция к повышению лимфоцитарно-тромбоцитарной адгезии с ростом степени активности и снижение ее с увеличением стажа болезни.
Таблица 3. Сравнительная характеристика средних значений показателей иммунного статуса у больных ХВГС в зависимости от длительности заболевания (M±m)

Примечания: р1 – достоверное различие показателей группы с длительностью заболевания 5 лет и менее с контролем; р2 – достоверное различие показателей группы с длительностью заболевания более 5 лет с контролем; р3 – достоверное различие показателей группы с длительностью заболевания 5 лет и менее с группой с длительностью заболевания более 5 лет
Среднее число тромбоцитов, вступивших в контакт с лимфоцитами, у больных ХВГС было уменьшенным – 2,60 ± 0,12. Нами не получено зависимости изменения этого показателя от изучаемых характеристик заболевания, но заметно снижение ЛТИ с увеличением степени активности процесса.
Таблица 4. Показатели ЛТА и ЛТИ у больных хроническим вирусным гепатитом С в зависимости от некоторых клинических характеристик заболевания
Выводы. Таким образом, у больных хроническим вирусным гепатитом С, в сравнении с контролем, установлен значительный рост популяции активированных Т-лимфоцитов (CD3+HLA-DR+), активированных Т-хелперов (CD3+CD4+HLA-DR+) и активированных Т-киллеров (CD3+CD8+HLA-DR+), что является проявлением дизрегуляции клеточного иммунитета и отражает иммунопатогенез HCV-инфекции. При этом данные изменения зависят от длительности заболевания, и не коррелируют со стадиями фиброза печени и степенью активности процесса.
Одновременно с этим, выявлено значимое снижение процента и количества субпопуляций лимфоцитов CD19+ и CD3-CD16+CD56+.
Показатель лимфоцитарно-тромбоцитарной адгезии оказался сниженным у больных ХВГС, особенно у лиц с более высоким стажем болезни, что свидетельствует о дисфункции Т-лимфоцитов, проявляющейся в уменьшении их способности к адгезии тромбоцитов.
Полученные результаты демонстрируют необходимость изучения иммунограммы и теста лимфоцитарно-тромбоцитарной адгезии для оценки иммунитета у больных хроническим вирусным гепатитом С.
Источник
Комментарии
Опубликовано в журнале:
Медицина для всех
№ 1, 2001 — »» МИР БЕЗ ГЕПАТИТОВ В НОВОМ ВЕКЕ
JANGU BANATVALA1, PIERRE VAN DAMME2, STEPHAN OEHEN3
1Department of Microbiology, John Radcliffe Hospital, Oxford, UK
2Centre for Evaluation of Vaccination, Department of Epidemiology, University of Antwerp, Antwerp, Belgium
3University Hospital Zurich, Institute for Experimental Immunology, Zurich, Switzerland Продолжительный иммунитет к НВV-инфекции — в этом заинтересован каждый человек, врачи и медицинский персонал, занимающиеся вакцинацией, менеджеры, органы управления здравоохранением.
Продолжительный иммунитет означает, что в популяции будет поддерживаться иммунная защита от инфекции на достаточно высоком уровне, а также отпадет необходимость в проведении каких-либо промежуточных бустерных вакцинаций. В результате снижения заболеваемости и смертности от HBV-инфекции, снижения расходов на лечение заболевания и, конечно, снижения стоимости бустерных вакцинаций значительно возрастает экономическая выгода, связанная с существованием длительного иммунитета к инфекции.
Благодаря тому, что общедоступными становятся результаты долговременных исследований эффективности НВ-вакцин, а также накапливаются данные о взаимосвязи между иммуногенными свойствами вакцины, клеточным иммунитетом и иммунологической памятью, появилась возможность идентифицировать факторы, которые влияют на формирование иммунологической памяти к HBV-инфекции.
Иммуногенность первичной вакцинации позволяет прогнозировать и первичный и вторичный, анамнестический, ответ на НВ. Возможно, это имеет отношение и к иммунологической памяти и, как следствие, эффективности долговременной защиты от инфекции. Таким образом, напрашивается вывод, что использование высокоиммуногенных НВ вакцин создаст оптимальные условия для полноценного формирования иммунологической памяти и продолжительного иммунитета к HBV-инфекции.
Положение с НВ-вакцинацией в настоящее время
Финансовые проблемы заметно ограничивают использование НВ-вакцин. Несмотря на то, что снижение цены на НВ-вакцину в развивающихся странах с 20 USD до 3,0-5,0 USD за одну дозу сделало возможным массовое использование этой вакцины в детских иммунизационных программах, она по-прежнему остается дороже большинства других вакцин. В настоящее время во многих странах рекомендуется проводить периодические бустерные вакцинации даже иммунокомпетентных лиц, кроме того, бустерные дозы предусмотрены для иммунокопромитированных субъектов в случае снижения титра антител против поверхностного антигена HBV (анти-HBs) ниже 10 mlU/ml. Однако результаты научных исследований не подтверждают необходимости рутинной бустерной вакцинации для поддержания долговременной иммунологической защиты в этих популяциях. Как следствие были предложены новые рекомендации, суммированные в таблице 1. Они ограничивают круг лиц, нуждающихся в бустерной НВ-вакцинации, до иммунокомпромитированных групп риска, таких как пациенты, которым проводится гемодиализ, страдающие хронической почечной недостаточностью или заболеваниями печени и ВИЧ-позитивные субъекты. Повсеместное распространение новой концепции приведет к существенной экономии средств и в развитых, и, что наиболее важно, в развивающихся странах. Однако наряду с признанием отсутствия необходимости в бустерной вакцинации важно учитывать и те соображения, которые позволят оптимизировать первичный курс вакцинации.
Существуют также данные о возможности снижения числа доз первичного курса иммунизации с трех до двух без какого-либо ослабления эффективности НВ вакцинации. Такое сокращение количества доз, наряду с экономией, связанной с повышением доступности комбинированных вакцин, включающих НВ, окажет важнейшее влияние на расширение охвата прививками населения, необходимого для достижения цели глобального искоренения HBV-инфекции.
Таблица 1.
| Группы, в которых традиционно проводится бустерная НВ-вакцинация | Группы, в которых бустерная вакцинация предусмотрена новыми рекомендациями |
| Иммунокомпетентные лица Иммунокомпромитированные лица Медицинские работники и другие служащие с профессиональным риском заражения Путешественники Группы повышенного риска Иммунокомпромитированные лица | |
Что означает иммунитет к HBV?
Важно провести разграничение между защитой от субклинической и клинически выраженной инфекции. Клинически выраженная инфекция, которая может быть идентифицирована путем определения HBsAg и приводящая к клиническому заболеванию, после вакцинации не наблюдалась. Так называемая скрытая, или субклиническая, инфекция приводит к сероконверсии с появлением анти-HBs (антитела к ядерному НВ-антигену), протекает с транзиторной виремией и без выраженных симптомов, а также без заболевания. У индивидуумов, которые были ранее вакцинированы, но содержание анти-HBs значительно снизилось (до неопределяемого уровня), может произойти анамнестическое повышение содержания специфических антител за период менее 4 дней с момента вирусной «атаки». В то время, когда инфекция еще ограничивается небольшим количеством гепатоцитов, быстрое образование антител В-клетками памяти позволяет предотвратить распространение вируса и пресекает инфекцию до того, как появляется риск развития хронического вирусоносительства.
Иммунный ответ при естественном заражении HBV
Течение HBV-инфекции определяется сложным взаимодействием между различными составляющими антивирусного иммунного ответа хозяина. Гуморальный иммунный ответ, в ходе которого появляются нейтрализующие антитела к поверхностному антигену HBV (HBsAg), является необходимым условием эффективного клиренса вируса. Нейтрализующие антитела синтезируются активированными В-клетками. После заражения HBV невакцинированного человека протективные антитела появляются на 50-150-й день, в то время как цитопатические вирусы вызывают более быструю ответную реакцию (6-14-й день).
Клеточный иммунный ответ играет решающую роль в клиренсе HBV из инфицированных гепатоцитов. Вплоть до недавнего времени считалось, что это происходит исключительно в результате деструкции гепатоцитов цитотоксическими Т-клетками (CTL). Однако Т-хелперные клетки-индукторы вирус-специфических CTL играют еще и другую роль, состоящую в секреции нецитотоксических цитокинов: y-интерферона (IFNg) и фактора некроза опухолей-а (TNF-а), которые способны подавлять экспрессию вирусных генов и таким образом «лечить» инфицированные клетки.
Иммунный ответ, индуцированный НВ-вакцинацией
Большинство работ в этой области характеризует иммунный ответ на HBsAg, используемый в производстве рекомбинантных НВ-вакцин. Основные рекомбинантные НВ-вакцины, которые успешно используются с момента их внедрения в 1986 году, содержат дрожжевой HBsAg. Введение вакцины приводит к презентации HBsAg по классической схеме, то есть от антиген-презентирующих клеток (АПК) — Т-хелперным лимфоцитам (CD4), которые распознают антиген в комплексе с молекулами II класса МНС на АПК. Т-хелперные клетки запускают дифференцировку HBsAg-специфических В-лимфоцитов в быстро пролиферирующие анти-HBsAg иммуноглобулин (IgG)-продуцирующие клетки. Антиген-специфические В-клетки ответственны за продукцию анти-HBs (IgG). Вслед за первичным иммунным ответом образуются В- и Т-клетки памяти, которые способствуют стремительному протеканию последующих анамнестических реакций.
Влияние антигена на формирование иммунологической памяти:
- персистенция антигена играет важную роль в образовании антител-продуцирующих В-клеток памяти и, следовательно, в поддержания протективного уровня антител;
- персистенция антигена зависит от введенной дозы и возрастает с ее увеличением;
- нереплицирующиеся антигены с наиболее высоким числом повторов индуцируют наиболее сильный В-клеточный ответ
Взаимосвязь между гуморальным ответом и лимфопролиферацией
Зависимость гуморального иммунного ответа от Т-клеток привела к появлению работ, исследующих взаимосвязь между уровнем антител и лимфопролиферацией. Эксперименты с использование спот-фермент-связанного иммуносорбентного анализа (spot-ELISA), метода определения in vitro способности циркулирующих В-лимфоцитов продуцировать анти-HBs, продемонстрировали тесную корреляцию между продукцией анти-HBs IgG in vitro и иммунологической памятью (характеризуемой частотой В-клеток памяти). Статистически достоверная корреляция также была обнаружена между кинетикой и нарастанием содержания антител in vivo и Т-клеточным иммунным ответом in vitro.
Иммунологическая память
Механистической основой иммунологической памяти являются селективная экспансия и дифференцировка клонов антиген-специфических В- и Т-лимфоцитов. В то время как В-клеточный ответ — основной фактор иммунологической памяти, общепризнанным является факт, что наличие Т-клеток способствует В-клеточной персистенции и что «память» формируется в результате сложных взаимодействий В-, Т-, CTL-клеток памяти и комплексов антиген-антитело. Формирование иммунологической памяти — ключевая особенность специфического иммунного ответа, эту функцию выполняют В- и Т-лимфоциты памяти, синтезируемые в результате первичной антигенной стимуляции. Эти клетки сохраняют способность к быстрой пролиферации, дифференцировке и, в случае В-клеток памяти, быстрой продукции специфических антител при последующей встрече с идентичным антигеном. Иммунологическая память, таким образом, может рассматриваться как адаптивный иммунный ответ на антиген, который уже знаком иммунной системе. В обычных условиях вторичный иммунный ответ подразумевает продукцию сывороточных антител в более высокой концентрации и через более короткий промежуток времени по сравнению с первичным, кроме того, синтезируемые антитела обладают более высокой связывающей способностью. Для того чтобы понять, какие факторы оказывают воздействие на вакцин-индуцированную иммунологическую память, мы должны рассмотреть следующие иммунологические механизмы.
Персистенция иммунологической памяти к HBV
В то время как ответ CTL играет решающую роль в элиминации HBV из инфицированных гепатоцитов, гуморальный иммунный ответ ограничивает распространение инфекции путем нейтрализации вируса в крови, на слизистых и в экстраклеточном пространстве. Иммунологическая память к HBV, таким образом, фокусируется на быстром синтезе специфических антител. Имеющиеся данные говорят в пользу того, что иммунологическая память сохраняется после снижения содержания анти-HBs IgG ниже определяемого уровня. Действительно, анамнестический ответ, о котором судят по гуморальному ответу на бустерную вакцинацию, наблюдался у индивидуумов, у которых анти-HBs IgG не определялись на протяжении 28-31 месяца. Таким образом, снижение и практически исчезновение антител после первичной вакцинации не означает потери иммунитета, пока сохраняется иммунологическая память. Мощный Т-клеточный ответ также наблюдался спустя несколько лет после клинического разрешения острой HBV-инфекции.
В ходе испытания вакцин, а также в результате долговременных наблюдений за вакцинированными было показано, что иммунологическая память к НВ сохраняется в течение, по крайней мере, 5-12 лет.
Так как основная задача вакцинации в детском или подростковом возрасте состоит в формировании как можно более длительного иммунитета, используемая вакцина должна обладать оптимальными иммуногенными свойствами. Исследования вакцин-индуцированного иммунитета к НВ показывают, что вакцинация приводит к формированию иммунитета к инфекции и он сохраняется даже в том случае, когда антитела в крови уже не определяются. Предположение о том, что у адекватно вакцинированных лиц имеет место иммунологическое праймирование, подтверждается данными о том, что HBsAg-специфические лимфоциты памяти циркулируют в периферической крови вакцинированных людей, даже если у них к тому времени уже не обнаруживаются специфические антитела. Однако было показано, что гуморальный ответ на завершенный первичный курс вакцинации тесно коррелирует с будущей реакцией на ревакцинацию. Иммуногенность первичной вакцинации, таким образом, является ключевым фактором, определяющим силу последующего анамнестического ответа. Так как анамнестический гуморальный ответ зависит от В-клеток памяти, есть основания считать, что более сильный вторичный иммунный ответ является индикатором более мощного потенциала В-клеток памяти, который, в свою очередь, отражает иммуногенность первичного курса иммунизации.
Взаимодействие антигена, гуморального и клеточного иммунного ответа в формировании иммунологической памяти (упрощенная схема)
Исследования, в которых иммунологическая память оценивалась путем проведения бустерной вакцинации, не только демонстрируют наличие иммунологической памяти, но подтверждают последние рекомендации об отсутствии необходимости и бустерной дозы для поддержания иммунитета.
Перспективы
Дальнейшее изучение вопросов, связанных с проблемой иммунологической памяти, в будущем, несомненно, окажет влияние на политику вакцинации против HBV. Проведенные в этом направлении исследования уже позволили сделать выводы о том, что В-клетки обеспечивают существование долговременной иммунологической памяти и о синергии Т- и В-клеточных реакций, которые, безусловно, внесут свой вклад в понимание механизмов формирования долговременной иммунологической памяти. Необходимо продолжать наблюдения за группами вакцинированных против гепатита В людей, анализируя и клеточный, и гуморальный иммунитет. Также следует оценить эффект объединения НВ-вакцины с другими детскими вакцинами в комбинированных препаратах.
Существующие на сегодняшний день представления о роли первичного иммунного ответа в формировании иммунологической памяти подчеркивают важность гарантии полноценного иммунного ответа на первичный курс вакцинации. Это тем более важно в плане снижения количества доз вводимой вакцины.
Перевод Лагеревой Ю.Г.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
