Иммунитет к антибиотикам от гмо
Статья на конкурс «био/мол/текст»: Пожалуй, трудно придумать еще одну биологическую проблему, которую бы так активно обсуждали в СМИ, вагоне метро и очереди за батоном. ГМО. Эти три буквы, увы, пугают и вызывают недоверие. Хочется еще раз расставить все точки над «ё» и разобраться в том, зачем нужны ГМО, каковы плюсы современных генно-инженерных технологий и с какими трудностями и мерами предосторожности они связаны.
Что такое ГМО?
Итак, сайт «Википедия» дает следующее определение ГМО: «ГМО (генетически модифицированный организм) — организм, генотип которого был искусственно изменен при помощи методов генной инженерии. Это определение может применяться для растений, животных и микроорганизмов. Генетические изменения, как правило, производятся в научных или хозяйственных целях. Генетическая модификация отличается целенаправленным изменением генотипа организма в отличие от случайного, характерного для естественного и искусственного мутационного процесса».
Стόит сказать пару слов о том, с чего началась история ГМО. 1973 год можно считать годом рождения генной инженерии. Тогда в лаборатории Стэнли Нормана Коэна научились «комбинировать и трансплантировать» гены: в клетки E. coli начали вводить рекомбинантные кольцевые ДНК (плазмиды) [1]. Эти эксперименты показали, что определенные гены, включенные в плазмиду, можно запросто доставить в другой организм, где они будут работать. Но использовать эту технологию в медицине и сельском хозяйстве стали далеко не сразу: первый рекомбинантный препарат появился в 1982 году, а первая сельскохозяйственная культура — в 1992. Почему же к этой технологии отнеслись с такой осторожностью?
Научный журналист Ася Казанцева пишет в своей книге «В интернете кто-то не прав»: «Слышали ли вы когда-нибудь, чтобы производители мобильных телефонов или газированных напитков проводили научные конференции, посвященные тому, что мобильные телефоны или газированные напитки могут быть опасны? А создатели ГМО с этого начали». Дело в том, что в 1975 году в Калифорнии прошла Асиломарская конференция, на которой ученые совместно с представителями общественности обсуждали возможные риски, связанные с рекомбинантными ДНК и их хозяевами. В итоге был принят свод правил, регламентирующих работу с генетическими конструкциями разного происхождения. В частности, генным инженерам предписывалось по максимуму использовать биологические барьеры, предотвращающие распространение рекомбинантных ДНК за пределами популяций их лабораторных хозяев, а заодно и соблюдать меры предосторожности, утвержденные для работы с патогенами. Эти предписания и вообще вынос дискуссии за пределы научной среды в определенной мере создали преграды на пути развития генной инженерии [2].
Рецепты от матушки-природы
На самом деле, мы не первые, кто придумал ГМО. Существуют и природные генные инженеры — например, Agrobacterium tumefaciens (ныне — Rhizobium radiobacter). Дело в том, что у этой бактерии есть своя кольцевая ДНК, Ti-плазмида (от tumor-inducing — онкогенная), особый участок которой — Т-ДНК (от transfer DNA — переносимая ДНК) — может встраиваться в геном растений, вызывая бурное деление клеток корня и формирование опухолей — корончатых галлов, выделяющих ценные для бактерии-паразита питательные вещества, опины. Помимо Т-ДНК, Ti-плазмида содержит гены, кодирующие белки, которые образуют канал между бактерией и растением для протаскивания в растительную клетку Т-ДНК. Сама же бактерия и ее огромная (>200 т.п.н.) Тi-плазмида внутрь клетки не проникают. Так растительная клетка, ничего не подозревая, включает в свой геном фрагмент чужеродной ДНК, а затем клетка делится и передает Т-ДНК по наследству своим потомкам.
Как известно, лень — двигатель прогресса. Зачем выдумывать велосипед, когда есть готовая природная генная конструкция. Биотехнологи берут плазмиду A. tumefaciens, вырезают из нее онкогены и вставляют нужные им (целевые) последовательности. Обманутая бактерия добросовестно встраивает модифицированную T-ДНК в растительную клетку и ждет, что та начнет делиться и производить опины. Но вместо этого растение производит то, что нужно человеку. Например, с помощью такого «коварного» подхода удалось получить устойчивую к засухе кукурузу MON87460. В эту кукурузу был введен ген cspB, отвечающий за производство белка, который стимулирует транскрипцию генов, необходимых для преодоления стрессов (засухи в частности), а главное — играет роль РНК-шаперона, облегчающего синтез белков путем «распутывания» мешающих вторичных структур РНК. Потребителю же должно быть приятно то, что по вкусу трансгенные кукурузные початки никак не отличаются от обычных [2]. История жестокого обмана бактерии отражена на рисунке 1.
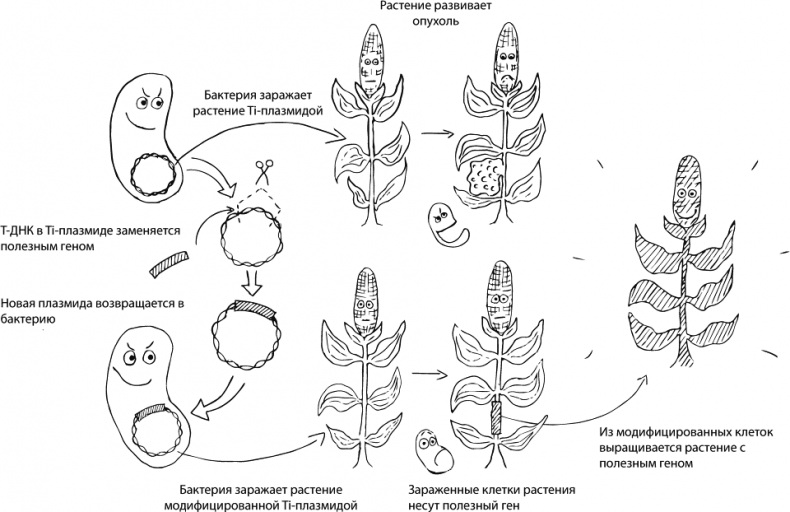
Рисунок 1. Как ученые обманывают Agrobacterium tumefaciens. Описание дано в тексте статьи.
Главный недостаток так называемой агробактериальной трансформации — невозможность контролировать, в какое именно место растительной ДНК встроится новая конструкция. Но сейчас появилась новая технология, позволяющая контролировать этот процесс, — CRISPR/Cas9, — и на ней обязательно нужно остановиться.
CRISPR/Cas9. По образу и подобию хромосомному
Это одна из самых модных технологий, позволяющих редактировать геном «в режиме онлайн». Интересно то, что эту систему мы тоже позаимствовали у бактерий. Скажем несколько слов об истории ее открытия.
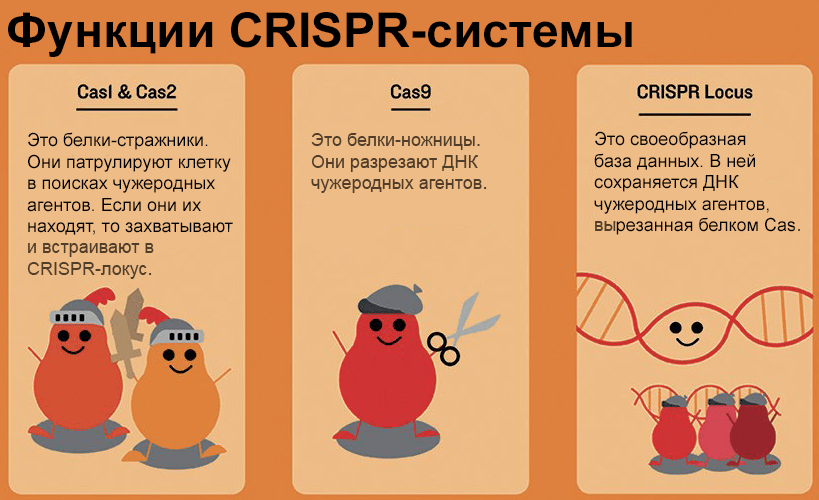
В 1987 году японские ученые обнаружили в геномах бактерий участки с регулярной структурой — короткие одинаковые последовательности чередовались с уникальными фрагментами, которые у разных бактерий даже одного вида не имели ничего общего. Такие участки назвали CRISPR (clustered regularly interspaced short palindromic repeats) [3]. Оказалось, что система CRISPR, как это ни удивительно, играет у бактерий роль приобретенного иммунитета. Если в бактерию проникает вирус (фаг), она вырезает фрагмент вирусной ДНК и встраивает его в собственный геном, а именно — в CRISPR-локус. Так формируются спейсер, а заодно — и очередной повтор, отделяющий новый спейсер от предыдущего. По спейсеру бактерия затем строит РНК-зонд (по-научному — РНК-гид), соединяющийся с Cas-белком и плавающий в клетке в поисках комплементарных нуклеиновых кислот (протоспейсеров). В том случае, если таковые найдены, то есть снова вторгся тот же фаг, начинает работать белок-ножницы Cas — эндонуклеаза, которая разрезает распознанные последовательности, а следовательно, блокирует размножение вируса [2]. Иными словами — если бактерия повторно встретится с вирусом, фрагмент которого встроен в ее геном, она будет устойчива к этой инфекции.
Наиболее просто из систем CRISPR/Cas устроены системы II типа, где эффекторным (уничтожающим мишень) белком служит Cas9 (рис. 2). Такой механизм характерен, например, для бактерии Streptococcus pyogenes. В бактериальном иммунном контроле обычно помимо Cas-эффекторов задействованы «патрульные» белки Cas1 и Cas2, которые в комплексе распознают нарушителя клеточных границ и интегрируют его фрагмент в самое начало (ближе к промотору) CRISPR-локуса — «на память». В системах II типа Cas9, видимо, участвует и в процессе приобретения спейсеров, помогая Cas1/Cas2 выбрать наиболее подходящие фрагменты [4].

Рисунок 2. Упрощенное представление функций компонентов системы CRISPR. Описание дано в тексте статьи.
Из вышесказанного становится ясно, почему иммунитет CRISPR адаптивный: он совершенствуется и учится противостоять новым типам инфекции. Это подчеркивается еще и снижением эффективности спейсеров по мере их удаления от промотора CRISPR-локуса: если многие поколения бактерий давно не сталкивались с тем или иным агентом, снижается «напряженность иммунитета» к нему. CRISPR — это интересный пример эволюции по Ламарку: события жизни организма непосредственно влияют на его ДНК, изменяя ее так, что организм становится более приспособленным [3].
Рассмотрим на конкретном примере, как бактерии борются с вирусами. Вот, например, бактерия Streptococcus thermophilus используется для получения молочнокислых продуктов, но, к сожалению, она страдает от различных вирусных инфекций. Не случайно именно на этом модельном организме провели ключевые эксперименты по уточнению функции CRISPR-систем. Если живую культуру S. thermophilus заражали бактериофагами, то большинство бактерий погибало, но очень небольшая часть выживала. Чем же выжившие отличались от изначальной культуры? Оказалось, что их геном стал длиннее на 0,01% за счет того, что в CRISPR-последовательность добавились 1–4 новых фрагмента (спейсера). При повторном заражении этой культуры теми же вирусами все клоны выживали. Как будто, переболев вирусной инфекцией, бактерия стала немного опытнее и записала себе в «медицинскую карту» что-то важное об этом вирусе, и такая инфекция ей теперь не страшна. Если же ученые специально вырезали из вирусного генома небольшие фрагменты и вставляли их в виде новых спейсеров, то клетка оказывалась невосприимчивой к исходному вирусу, даже если никогда раньше с ним не встречалась.
Эта серия простых и изящных экспериментов на S. thermophilus полностью подтвердила гипотезу об иммунной функции CRISPR-систем. Благодаря полярной манере включения новых спейсеров, CRISPR-кассеты можно буквально читать как историю взаимоотношений прокариот и их паразитов в определенном эволюционном промежутке. CRISPR — это не только иммунитет, но еще и память о недавних победах прокариотической клетки [5].
Какую же практическую пользу из этой системы смог извлечь человек? Как вообще она работает в клетках эукариот? Если просто запустить CRISPR/Cas9 в клетку, эта система разрежет обе цепи ДНК в месте, которое укажет специально сконструированный РНК-гид, но разрез залатают обычные клеточные репарационные машины — путем негомологичного соединения концов (non-homologous end joining, NHEJ) либо гомологичной рекомбинации — если есть матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, произойдет «заштопывание по шаблону». Это означает, что в зависимости от целей человека можно устроить в нужном месте делецию — «выключить» проблемную область генома — или «подставить» матрицу с нужными свойствами, чтобы просто заместить, например, мутантный, патологический вариант гена нормальным.
MCR, «за» и «против»

Рисунок 3. История мораториев в биологии. В 1975 году был введен мораторий на исследования рекомбинантных ДНК, в 1997 — на клонирование человека, в 2012 — на эксперименты по изменению свойств (вирулентности) вируса «птичьего» гриппа.
И это еще не всё. Можно сделать так, чтобы клетка «починенную» хромосому воспринимала как образец для ремонта второй хромосомы. В 2015 году ученые из Калифорнийского университета для апробации метода в качестве «заплатки» использовали саму кассету CRISPR/Cas9, которая затем экспрессировалась X-хромосомой мух и модифицировала гомологичную хромосому. В итоге потомству передавались уже измененные хромосомы, и инсерция CRISPR/Cas9 из поколения в поколение «саморазмножалась», замещая нормальные аллели. Этот метод получил название «мутагенная цепная реакция» (mutagene chain reaction, MCR) [6].
В том же году Лианг и соавторы провели работу на триплоидных (заведомо нежизнеспособных) эмбрионах с бета-талассемией. Из 86 CRISPR-отредактированных эмбрионов только 71 продолжил развиваться, и только у четырех из них ген был отредактирован правильно [7]. Эта статья вызвала настоящий взрыв споров на тему того, насколько вообще этично проводить такие исследования.
В Nature Эдвард Ланфир, один из исследователей ZF-нуклеаз (белков-ножниц, содержащих ДНК-связывающий домен «цинковые пальцы»), и его коллеги призвали к мораторию на любые эксперименты, касающиеся редактирования генов эмбрионов человека или половых клеток: «Стоит ли испытывать судьбу, даже если будет заметен терапевтический эффект от модификации зародышевых клеток? Мы готовы вступить в открытую дискуссию на тему дальнейших исследований в этой области». К слову, в биологии уже написана целая история мораториев на различные исследования (рис. 3). Но вернемся к CRISPR. Некоторое время спустя группа ученых выступила с предложением избегать попыток модификации клеток зародышевой линии человека, но поддержала идею работы с клетками человека в том случае, если они не участвуют в развитии и поддержании беременности (например, соматических клеток) [8].
Теперь стόит затронуть перспективы использования этой технологии. MCR может позволить, например, создать комаров, неспособных переносить малярию и лихорадку Денге. Появится возможность быстро выводить линии мышей со множественными мутациями для лабораторных исследований и не тратить время на тщательный скрининг [6]. Помимо этого, есть работы по тестированию CRISPR/Cas9 на мышах с целью лечения миодистрофии Дюшенна [9]. Тем не менее существуют опасения, что мы просто не знаем о возможных побочных эффектах таких изменений половых и эмбриональных клеток, в связи с чем и был предложен мораторий.
Почему ГМО полезны?
Ограничимся некоторыми яркими прикладными примерами, имеющими отношение к экологии, питанию и материалам.
«Эко-свинка»
На первый взгляд может показаться, что между свиньями, фосфором и экологическими катастрофами нет ничего общего. Но это не так. Существует серьезная сельскохозяйственная проблема: свиньи не могут усваивать большую часть фосфора в комбикормах, так как он представлен в форме фитатов, солей фитиновой кислоты. Неусвоенный фосфор в составе свиного навоза в конце концов попадает в водоемы, в которых начинается бурное размножение водорослей — они-то с радостью едят фитаты. Из-за токсичных продуктов обмена водорослей погибают рыбы и другие водные организмы. В общем, катастрофа. Но генные инженеры предложили проект «Эко-свинка». К сожалению, он пока так и остался проектом, не вышедшим на рынок. Но идея очень красивая. Речь идет о генетически модифицированных свиньях, способных усваивать фитаты. Идея заключалась в том, чтобы встроить в геном свиней ген, который кодирует фермент, необходимый для расщепления фитатов (а взять его можно у той же E. coli) [10]. Будем надеяться, что когда-нибудь ученые облегчат свиньям жизнь 🙂
Стальная коза, трансгенный хлопок, суперсладость и кошерный сыр
А теперь рассмотрим примеры полезных ГМО, никак не связанные между собой: просто они красивые, и захотелось о них рассказать. В 2002 году в Science появилась статья о том, что генетически модифицированные клетки млекопитающих могут производить паутину. Канадская фирма Neхia вывела коз, в геном которых был встроен ген белка паутины. Оказалось, что молоко таких коз можно использовать для получения биостали, которая даже прочнее кевлара — материала, из которого делают современные бронежилеты [10].
Но генная инженерия помогает создавать не только новые материалы, но и успешно выращивать старые. Еще 1997 году в Китае приступили к выращиванию генно-модифицированного хлопчатника, снабженного гéном бактерии Bacillus thuringiensis. Белок Cry1Ac, кодируемый этим геном, токсичен только для гусениц некоторых бабочек и, по-видимому, безвреден для всех остальных животных, включая человека. Это привело к снижению численности популяции хлопковой совки — опасного вредителя многих сельскохозяйственных культур. В результате в выигрыше оказались не только производители хлопка, но и крестьяне, выращивающие сою, кукурузу, арахис и различные овощи [11].
Что касается сладкого, то существует такое растение, как Thaumatococcus daniellii, и у него есть ген, кодирующий белок тауматин, который в тысячи раз слаще сахара! Сейчас ведутся работы по созданию микроорганизмов и растений, производящих этот белок. Помимо сладости, тауматин увеличивает устойчивость растений к ряду инфекций [10].
Ну и напоследок — про кошерный сыр. Известно, что для приготовления обычного сыра ранее использовался фермент, выделяемый из сычуга — одного из отделов пищеварительного тракта жвачных животных. Но теперь биотехнологи встроили гены сычужных ферментов в геном бактерий, предоставив возможность получать кошерный сыр. Кажется, это редкий пример сотрудничества науки и религии [10].
Меры предосторожности
С одной стороны, приведенные выше примеры полезности ГМО — «песчинка как в морских волнах, как мала искра в вечном льде». Но с другой стороны, у любой технологии есть свои проблемы, связанные с вопросами этики и безопасности. Выше уже шла речь о моратории на использование CRISPR/Cas9 в отношении человеческих эмбрионов. В экспериментах на обезьянах показано, что из десяти отредактированных с помощью этой системы эмбрионов рождается, увы, не больше половины [8]. Что касается использования ГМО, то здесь больше всего опасаются реакций на продукт, которые не всегда возможно предусмотреть. Например, в 1992 году селекционная компания Pioneer разработала ГМ-сою, добавив в нее ген бразильского ореха и тем самым устранив в сое природный дефицит аминокислоты метионина. Такие бобы были предназначены в первую очередь для тех людей, для кого соя — основной продукт питания. Но вскоре оказалось, что у небольшого процента людей бразильский орех вызывает аллергию. Соответственно, и такая ГМ-соя тоже может вызывать аллергию [12].
Вышеперечисленные факты не умаляют достоинства генных технологий, а говорят о том, что любой метод требует грамотного и аккуратного использования. Поэтому хотелось бы закончить статью словами молекулярного генетика Джорджа Чёрча из Гарвардской медицинской школы в Бостоне, считающего, что de facto мораторий стόит налагать на все технологии, пока не доказана их безопасность: «Задача заключается в доказательстве того, что пользы в технологии больше, чем риска» [8].
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Казанцева А. В интернете кто-то неправ! М.: CORPUS, 2016. — 376 с.;
- Найдены системы CRISPR, использующие обратную транскрипцию;
- Heler R., Samai P., Modell J.W., Weiner C., Goldberg G.W., Bikard D., Marraffini L.A. (2015). Cas9 specifies functional viral targets during CRISPR-Cas adaptation. Nature. 519 (7542), 199–202;
- CRISPR-системы: иммунизация прокариот;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Liang P., Xu Y., Zhang X., Ding C., Huang R., Zhang Z. et al. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6, 363–372;
- Vogel G. (2015). Embryo engineering alarm. Science. 347, 1301–1301;
- Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик;
- Панчин А. Сумма биотехнологии. М.: CORPUS, 2016. — 432 с.;
- Элементы: «Трансгенный хлопок помог китайским крестьянам победить опасного вредителя»;
- Мэтт Р. Геном. Автобиография вида в 23 главах. М.: ЭКСМО, 2015. — 432 с.
Источник
24 июня 2016 года Государственная Дума Российской Федерации приняла в третьем чтении законопроект «О внесении изменений в отдельные законодательные акты РФ в части совершенствования государственного регулирования в области генно-инженерной деятельности». Текст законопроекта подразумевает, что с момента вступления его в силу 1 июля 2017 года на территории Российской Федерации запрещается выращивать и разводить генно-модифицированные растения и животных. Так стоит ли все же задействовать технологии генной инженерии для обеспечения продовольственной безопасности России? Перевешивают ли коммерческие и потребительские достоинства ГМО реальные и потенциальные риски их использования?
Что такое ГМО
Термин ГМО расшифровывается как «генетически модифицированный организм». Так называют живой организм, генотип которого был искусственно изменён при помощи методов генной инженерии: в него были перенесены гены из других организмов (их называют «трансгенами»). В сельском хозяйстве генная инженерия помогает получать новые сорта растений и породы животных с заранее заданными свойствами. В отличие от традиционной селекции, которая уже давно используется для этих целей, генетическая модификация переносит всего один ген, а не целый набор. Кроме того, она позволяет достичь результата гораздо быстрее и придать организмам новые признаки, которые нельзя перенести путём скрещивания с близкородственными видами.
С помощью генной инженерии выводят, например, картофель, которому не страшен колорадский жук, томаты, способные при обычной температуре храниться 2–3 месяца, и рис, обогащенный витамином «А» и железом. А еще можно получать растения, способные синтезировать вакцины, ферменты и другие полезные вещества. Например, уже существуют трансгенный салат и бананы, вакцинирующие от гепатита «В». Чтобы, например, вырастить бананы, которых хватит для вакцинации всех мексиканских детей в возрасте до 5 лет, требуется всего 9,72 гектара земли.
Кто и какие ГМО производят в мире
Первые линии ГМО, предназначенные для коммерческого использования, были разработаны американской компанией «Монсанто» в конце 80-х годов прошлого века. В 2008 году для выращивания генетически модифицированных культур во всем мире использовалось 5%-7% от общих посевных площадей, и площади под ГМО культуры продолжают увеличиваться примерно на 10 миллионов гектар в год.
Основными производителями трансгенных культур являются США, Канада, Бразилия и Аргентина – именно на их территории расположено 95% площадей, занятых ГМ сортами сельскохозяйственных культур. При этом 99% этой площади занимают четыре культуры: соя, хлопок, кукуруза и рапс. Всего же в мире допущено к производству более 100 линий генетически модифицированных растений. Среди них цикорий, кукуруза, дыня, папайя, картофель, рис, кабачки, сахарная свёкла, табак, томаты. Из технических культур также разрешён генетически модифицированный лён, из декоративных – гвоздика.
Чем страшны ГМО?
Противники ГМО считают, что их коммерческое применение началось преждевременно, поскольку ученые не могут еще точно рассчитать все последствия проводимых модификаций, в том числе, влияние их на общую экологическую ситуацию и на здоровье потребителей. Ген, привносимый в растительный или животный организм извне, отвечает не только за один, главный признак, ради которого его и используют, но и за ряд каких-то других признаков, и кроме того, он оказывает влияние на соседние гены – поэтому просчитать заранее все последствия ученые пока не могут.
Все нежелательные риски, ожидаемые при потреблении и возделывании ГМ культур, можно условно разбить на пищевые, экологические и агротехнические. По каждому из них сторонники ГМО приводят свои контрдоводы, но при этом нередко лукавят и недоговаривают.
Пищевые риски от употребления ГМО и полученных из них продуктов
Как правило, токсичным или аллергенным действием обладают трансгенные белки, обеспечивающие устойчивость получаемых сортов к различным вредителям и заболеваниям. Интересны результаты сравнительного анализа частоты заболеваний, связанных с качеством продуктов питания, который был проведен в США и Скандинавских странах. Население этих стран имеет высокий уровень жизни, качественно близкую продуктовую корзину, сопоставимые медицинские услуги. Так вот. Оказалось, что за несколько последних лет в США частота пищевых заболеваний была в 3-5 раз выше, чем в странах Скандинавии. При этом единственное существенное отличие в качестве питания – активное употребление в пищу ГМ продуктов в США и их практическое отсутствие в рационе скандинавских народов.
Сторонники ГМО переводят этот спор в несколько иную плоскость, указывая, например, что трансгенная соя, которую чаще всего обвиняют в аллергенности, является аллергеном и в своем изначальном варианте, а также на то, что аллергик может запросто встретиться с незнакомым доселе белком и в самых обычных, не ГМ продуктах. Они справедливо замечают, что аллергику важно знать белковый состав продукта, а не генетическое происхождение белков.
Помимо этого, трансгенные растения с течением времени могут перестать вырабатывать полезные для человека вещества или даже начать вырабатывать вещества вредные. Особую угрозу для здоровья человека представляют потенциальные негативные эффекты генетически модифицированных продуктов при их длительном и неконтролируемом употреблении.
Вероятность встраивания трансгенов в геном млекопитающих и человека ничтожно мала, поскольку наши клетки имеют несколько изолирующих барьеров, препятствующих такому переносу. Однако, по технологическим причинам, в трансгенные растения вместе с геном ценного признака переносят маркерные гены устойчивости к антибиотикам. Такие гены могут перейти в бактерии кишечника человека, и тогда его нечем будет лечить.
Сторонники ГМО возражают на это, что ГМ растения, разрешённые к использованию, содержат гены устойчивости, которые, во-первых, уже широко распространены в почвенных и кишечных бактериях, во-вторых, придают устойчивость к антибиотикам, не использующимся в клинической практике.
Серьезные риски несут и разработки трансгенных сортов растений, способных к интенсивному синтезу биологически активных веществ: вакцин, гормонов роста, факторов свертывания крови, антител человека, и других.
Неконтролируемое распространение вакцин в составе пищевых продуктов также несет в себе колоссальные риски. На стадии внутриутробного развития, формирующаяся у зародыша человека или животного, иммунная система «учится» распознавать «свои» белки, не путая их в дальнейшим с «чужими». Если белок вакцины в это время попадет в кровоток эмбриона, то родившийся ребенок не сможет вырабатывать иммунитет к данному заболеванию, всегда распознавая данную бактерию или вирус как «свой».
Экологические и агротехнические риски
Существуют также серьезные риски отрицательного влияния трансгенных организмов на экологию и агротехнику. В основном они сводятся к нарушению экологического равновесия и сокращению видов. Так, в экспериментах, проведённых в Англии, показано, что биологическое разнообразие на полях с трансгенными растениями падает в три раза. Причём резкое его снижение характерно как для почвенных организмов, так и для насекомых, амфибий, рептилий, птиц и млекопитающих. Сторонники ГМО указывают, что подобные риски возникают и при традиционной селекции. Однако стоит отметить, что масштаб изменения свойств, и степень агрессивности у трансгенных организмов значительно выше, чем у сортов и пород, полученных при обычной селекции.
Экономические риски
Не стоит сбрасывать со счетов и риски экономические. Они могут быть связаны, например, с рисками отсроченного изменения свойств, которые проявляются через несколько поколений и связаны с адаптацией нового гена в геноме растения. Так, у трансгенной кукурузы, устойчивой к засухе, после нескольких лет культивирования неожиданно проявился новый признак — растрескивание стебля, что приводило к гибели всего урожая на полях.
Кроме того, распространение ГМО означает все возрастающую зависимость фермеров от биотехнологических компаний, поставляющих семена. Нередко трансгенные сорта разрабатываются по специальной технологии, так что их семена становятся стерильными или не всходят. Справедливости ради следует отметить, что это свойство присуще не только трансгенным растениям, но и гибридам, полученным с помощью селекции. Так, например, в сельском хозяйстве уже несколько десятилетий широко используются гибриды «F1», семена которых ежегодно приходится закупать заново.
Станет ли ГМО панацеей от голода?
Сторонники ГМО продвигают их как панацею от угрозы голода растущему человечеству и экологических рисков от увеличения сельхозплощадей и использования химикатов. Действительно, благодаря технологиям генной инженерии только за 2003 год на полях было использовано на 172 миллионов кг меньше пестицидов, чем за год до этого, а выбросы парникового газа сократились на 10 миллионов кг, что эквивалентно тому, как если бы с дорог на целый год исчезло разом 5 миллионов автомобилей. Это весьма впечатляющий результат, особенно если учитывать, что в последующие годы масштабы использования ГМО культур только возросли.
Однако повышения урожаев и эффективной защиты от вредителей можно добиться и без помощи генных технологий, используя естественные, природные механизмы. По мнению экспертов, необходимо уделять больше внимания традиционной селекции и экологически чистому сельскохозяйственному производству.
Роль ГМО в спасении развивающихся стран от голода сильно преувеличена. Такой подход не учитывает то, что истинная причина голода в этих странах заключается не в отсутствии продуктов питания и витаминов, а в трудном доступе к ним и в бедности населения. В 2002 г. в Индии было уничтожено 60 миллионов тонн зерна, т.к. население не имело средств к его приобретению, а в Замбии в 2003 г. по той же причине на складах сгнило 300 тысяч тонн маниоки. Решение проблемы и обеспечение безопасности продуктов питания заключается в преодолении социальных и экономических барьеров, которые ограничивают покупательную способность бедных людей в области продуктов питания. Дорогостоящие технологии, такие как генная инженерия, принадлежащие крупным корпорациям, только увеличивают эти барьеры, приводя малообеспеченные семьи к ещё большей бедности.
Продвижение ГМ технологий способствует возрастанию зависимости и фермеров, и в целом агропромышленного комплекса государства от транснациональных биотехнологических корпораций, которым страна, использующая ГМО, должна платить роялти. В настоящее время патенты на более 90% всех ГМ семян принадлежат 3 компаниям-гигантам: Monsanto (США), Syngenta (Швейцария) и Bayer (Германия).
Агробизнес в сфере ГМО развивается стремительными темпами, и по уровню инвестиций и динамики увеличения прибылей сравним только со сферой компьютерных технологий. В 1995 году трансгенных растений было продано на 75 миллионов долларов, однако в 1999 году объем продаж ГМ культур составил уже 2,1-2,3 миллиарда. Предполагается, что суммарная прибыль транснациональных корпораций, занимающихся разработкой, выращиванием и продажей ГМ растений, к 2020 году составит от 50 до 100 миллиардов долларов. При этом, по экспертным оценкам, создание каждого нового вида ГМ организма стоит порядка 3 миллионов. Корпорации – разработчики ГМО, получают все большее влияние в политической сфере. Сегодня согласие использовать биотехнологии часто является предпосылкой получения экономической помощи.
В настоящее время истинные цели производителей ГМО, судя по всему, остаются за рамками тем новостей и газетных полос. Возможно, мы узнаем их только тогда, когда они будут реализованы.
Политика, корысть или благоразумие?
Сегодня ГМ культуры выращивают Аргентина, Австралия, Канада, Китай, Германия, Колумбия, Индия, Индонезия, Мексика, Южная Африка, Испания, США. Две трети всех ГМ культур в мире выращивается в США. Интересно, что в Америке маркировка продуктов с ГМО необязательна. По оценкам экспертов, до 80% продуктов питания в США содержат ГМ составляющие.
Европа относится к трансгенным продуктам сдержаннее. Маркируются все продукты, содержащие более 0,9% ГМО. Ряд стран ЕС требуют маркировки всех продуктов с любым количеством ГМО. Во многих странах ЕС запрещено использование ГМ компонентов в продуктах детского питания.
Специфика и опасность широкомасштабного эксперимента по выпуску ГМО в окружающую среду заключается еще и в том, что ГМО невозможно будет вернуть в исходное положение в случае возникновения негативных эффектов. Большинство европейцев не желают питаться ГМО. Региональные власти должны быть способны защитить качество маркировки, чистоту стандартов и органическое производство, а также конкурентоспособные цены на сырье, не содержащее ГМО.
Запреты – не выход
Как заявляют эксперты, сегодня мы не можем отказаться от ГМ продуктов даже теоретически. Хотим мы того, или нет, но трансгенные продукты уже вошли в нашу жизнь, и возврат к свободному от них миру уже невозможен. В наших силах лишь свести к минимуму риски от их употребления, грамотно выстраивая систему законов и совершенствуя механизм экспертизы.
Говоря о России. Использование ГМ сортов в отечественном сельском хозяйстве вряд ли в корне изменит продовольственную ситуацию в нашей стране – ведь они эффективны лишь при грамотном уходе. Гораздо более действенным и значительно менее рискованным был бы планомерный переход к интенсивным сельскохозяйственным технологиям.
Однако это вовсе не должно означать запрета на научные разработки в сфере биотехнологий. По оценкам некоторых экспертов, в 2010 году общемировой доход от применения генно-инженерных технологий составил более 1 триллиона долларов. Соответственно, эта отрасль науки является и самой инвестируемой. Так, США, являясь безусловным лидером по разработке и производству ГМО, ежегодно инвестируют более 100 миллиардов долларов в генно-инженерную отрасль. По данным экспертов, в 2009 году в России на биотехнологические исследования было потрачено всего около 30 миллионов долларов.
То, что Россия с каждым годом теряет свои позиции в мировой науке и высокотехнологичной промышленности, уже давно стало общим местом. Между тем, очевидно, что снижение рисков от использования ГМ продуктов невозможно без продолжения интенсивных исследований в этой сфере. Необходимо совершенствовать технологию получения ГМО и всесторонне изучать биологию трансгенных растений. Доказательства безопасности трансгенных продуктов должны опережать их коммерческое использование.
Источник
