Иммунитет рак предстательной железы
Применение иммунотерапии при различных видах рака
На данный момент онкологам доступны разные виды иммунотерапии:
- Моноклональные антитела. Эти препараты представляют собой искусственные аналоги иммунной системы. Каждое из них имеет конкретную мишень — определенное вещество, вырабатываемое раковыми клетками.
- Ингибиторы контрольных точек. Контрольные точки — вещества, которые подавляют работу иммунитета. В норме они нужны для того, чтобы иммунная система не атаковала здоровые ткани. Раковые клетки часто используют контрольные точки для «маскировки». Ингибиторы снимают этот блок, после чего опухоль подвергается атаке.
- Противораковые вакцины. Организм можно привить не только против инфекций, но и против рака. Первая такая вакцина была одобрена в Америке еще в 2010 году. Пациенту вводят вещества, которые вырабатывают опухолевые клетки, чтоб стимулировать иммунный ответ.
- Модуляторы работы иммунитета. Обычно такие лекарства включают интерфероны, интерлейкины, факторы роста. Они улучшают работу иммунитета неспецифически — то есть не против каких-то определенных компонентов раковых клеток, а в общем.
- Клеточная иммунотерапия. Это направление показало успехи в некоторых исследованиях. Суть в том, что у пациента берут собственные иммунные клетки, активируют их против компонентов опухоли, затем размножают новый активированный клон в лаборатории и возвращают в организм больного. Такой «десант» начинает агрессивно атаковать раковые клетки. Это помогает уменьшить или полностью уничтожить опухоль.
Многие ученые считают, что за иммунотерапией будущее в лечении рака. Исследования в этом направлении продолжаются, в лабораториях разрабатывают и тестируют новые препараты.
Как уже было сказано, при любых формах и стадиях может применяться иммунотерапия.
Радиотерапия и химиотерапия вызывают много побочных эффектов, переносятся тяжело. А при иммунотерапии этого не наблюдается. Учеными разрабатываются постоянно новые препараты, которые подразделяются по группам. Рассмотрим, какие средства могут быть назначены при различных раковых болезнях:
- При раке легкого – Patritumab, Bavituximab, Rilotumumab.
- При раке почки – препарат MPDL3280A, препарат CT-011, Nivolumab.
- При раке простаты — PROSTVAC-VF, Sipuleucel-T, Ipilimumab, вакцина GVAX, ProstAtak.
- При раке желудка — препарат SU11248. Онкология желудка особенно хорошо реагирует на иммунотерапию.
Как применяется иммунотерапия рака на разных стадиях?
Часто больные обращаются в медицинское учреждение за помощью, когда заболевание уже находится в запущенном состоянии. На данном этапе обычно появляются метастазы, поэтому общепринятые методы лечения не дают желаемого результата. Объем злокачественных клеток стремительно увеличивается, что приводит к летальному исходу пациента.
Традиционное лечение даже с применением агрессивных вариантов облучения и химиотерапии не может переломить негативный ход заболевания. Клеточная иммунотерапия дает возможность организму восстановить противораковую функцию иммунной системы.
1. Забор опухолевой ткани или венозной крови, или стволовых клеток у пациента.
2. Создание противоопухолевой вакцины.
3. Вакцинация пациента.
4. Рассматривается возможность применения химиотерапии.
5. Использование дезоксината для выведения токсинов после процедур химиотерапии.
Благодаря данному лечению в 1,5–2 раза можно снизить число злокачественных клеток, это влечет значительное уменьшение опухолевого образования или полный регресс злокачественного процесса.
Целесообразность иммунотерапии заключается в борьбе со злокачественными новообразованиями, а также онкогематологическими болезнями. Лечит рак на любой стадии, в том числе и на самой поздней. А традиционные методы в онкологии способны победить заболевание только на ранних стадиях.
Рассмотрим, как применяется иммунотерапия при онкологии на различных стадиях:
- Болезнь на первой стадии заключается только в появлении злокачественных клеток, на второй образуется локализованная опухоль. Применяется чаще всего хирургическое лечение, радио- и химиотерапия. Иммунотерапию назначают в качестве дополнительного средства.
- Хоспис для онкологических больных – это то место, где пребывают безнадежные пациенты, у которых последняя стадия рака. Здесь по возможности продлевают жизнь, в том числе при помощи иммунотерапии.
- На третьей стадии рака происходит метастазирование. Последняя или четвертая стадия болезни проявляется рецидивами. Заболевание на данных этапах уже трудноизлечимо при помощи только традиционных способов, поэтому иммунотерапию применяют как основной метод лечения.
Методы проведения иммунотерапии при лечении онкологии
В отличие от иммунотерапии, химиотерапия, радиооблучение оказывают губительное влияние на иммунитет. Его необходимо восстанавливать с помощью укрепляющих витаминов, фитотерапии, здорового образа жизни. Но самостоятельно разрабатывать программу восстановления внутренних резервов организма не рекомендуется, это делается при согласовании с лечащим врачом.
Схема восстановительных мероприятий для иммунной системы предполагает лечение природными адаптогенами и антиоксидантами. Дополнительную терапию игнорировать нельзя. Она защищает ослабленный организм от внутренних, внешних факторов, провоцирующих развитие онкологии.
От состояния иммунной системы человека зависит исход многих заболеваний. Для победы над недугом необходимо сделать так, чтобы организм активизировался. При помощи собственных защитных ресурсов он будет бороться с опухолью.
Что представляет собой иммунотерапия? В организм вводят биологические препараты, обладающие противоопухолевой активностью. Их так и называют — противоопухолевые средства.
В данных медикаментах присутствует определенное количество следующих действующих веществ:
- цитокинов;
- моноклональных антител.
При попадании в организм они начинают уничтожать злокачественные клетки, одновременно с этим система питания опухоли оказывается перекрытой.
Иммунотерапия становится все более распространенной в мире. Врачи склонны к применению стимуляции иммунитета при лечении большого количества онкологических болезней.
Но этот метод является довольно молодым в терапии рака. Только последние десять лет его применяют наиболее активно. Иммунотерапия при раке кожи хорошо зарекомендовала себя.
Стоимость курса иммунотерапии
Иммунотерапия отличается от химиотерапии только по одному аспекту. Она индивидуальна.
Иммунотерапевтический алгоритм лечения подбирается каждому конкретному больному в соответствии с состоянием защитного механизма. Задача иммунотерапии в онкологии — поддержка и пробуждение внутренних резервов организма на противодействие болезни.
Химиотерапия сопровождается иммунологической схемой приёма препаратов, укрепляющих иммунитет.
При локализации злокачественной опухоли в разных органах стандарт медицинской помощи бывает похожим. Различия предполагаются по комбинациям, алгоритму применения.
Онкологическая иммунотерапия считается дорогим лечением, поскольку проводится веществами получаемыми при сложных биотехнологиях. Применяются новейшие разработки генетики, молекулярной химии.
Препараты получаются лабораторным способом, они применимы для конкретного больного, против определённого рака. Программа бывает разной, зависит от стадии болезни, степени метастазирования, разрастания опухоли.
Онкология требует сложного алгоритма лечения, в процессе участвуют различные специалисты, нужна дорогостоящая диагностика. Это сказывается на цене курса иммунотерапии.
Рак легких — одно из самых распространенных онкологических заболеваний. По заболеваемости и уровню смертности он занимает первое место у мужчин и третье место у женщин.
Почти 20% пациентов, умерших от злокачественных опухолей, погибли от рака легкого. В группе повышенного риска находятся курильщики в возрасте старше 50 лет.
На каждые 3–4 миллиона выкуренных сигарет приходится одна смерть от рака легких.
Меланома — далеко не самая распространенная (всего 2%) форма рака кожи, но она очень агрессивна и чаще других опухолей приводит к смерти. Так, в 2012 году в мире было диагностировано 232 000 новых случаев меланомы, 55 000 больных погибли. Меланома рано метастазирует, после чего многие методы лечения становятся неэффективны.
На поздних стадиях для лечения меланомы применяют пембролизумаб (Кейтруда), ипилимумаб (Ервой), ниволумаб (Опдиво).
При раке желудка I–III стадии основным методом лечения является хирургическое удаление опухоли, нередко его дополняют курсом химиотерапии и лучевой терапии. На IV стадии, когда опухоль распространяется за пределы органа и дает метастазы, шансы на полную ремиссию стремятся к нулю.
В таких случаях проводят лечение, направленное на замедление роста опухоли, сокращение её размеров, продление жизни пациента.
Именно на IV стадии, когда рак желудка не реагирует на другие виды лечения, может принести пользу иммунотерапия. Эффективны такие препараты, как трастузумаб и рамуцирумаб.
В настоящее время исследования в отношении иммунотерапии при раке желудка ведутся в четырех основных направлениях: ингибиторы контрольных точек, таргетная иммунотерапия моноклональными антителами, противораковые вакцины и клеточная иммунотерапия.
При лечении рака почек иммунотерапией применяет две группы иммунопрепаратов:
- Цитокины — белки, которые активируют иммунную систему и заставляют её бороться с раком. Для лечения применяют искусственно синтезированные аналоги этих белков: интерлейкин-2 (IL-2) и интерферон-альфа.
- Ингибиторы контрольных точек. Контрольные точки — это особые молекулы иммунной системы, которые она использует, чтобы сдерживать себя от атаки здоровых клеток. Иногда они мешают бороться против опухолевых клеток. При раке почек применяют Ниволумаб (Опдиво) — он блокирует PD-1, белок, который находится на поверхности T-лимфоцитов.
Лечение иммунотерапевтическими препаратами имеет некоторые общие моменты с химиотерапией. Такое сходство заключается в том, что клетки опухоли погибают в пределах органов и тканей тела, и организму приходится избавляться от них, как от чужеродного вредоносного материала. Это очень ресурсоёмкая задача, поэтому пациент может испытывать симптомы, вызванные перенапряжением различных систем организма.
Несомненное преимущество иммунотерапии в том, что она зачастую работает в случаях, когда неэффективны другие виды лечения. Иммунопрепараты могут усилить основную терапию, существенно повысить шансы на успешную борьбу с раком.
В отличие от химиопрепаратов, они не атакуют все быстро размножающиеся клетки подряд, у них есть четко определенная «мишень», поэтому они реже вызывают побочные эффекты. Наконец, иммунотерапия «обучает» иммунную систему распознавать и атаковать опухолевую ткань — это обеспечивает долгосрочный эффект и помогает снизить риск рецидива.
Однако, не всё так гладко. У иммунопрепаратов есть и минусы.
Они работают далеко не у всех пациентов. Иногда опухоль удается уничтожить полностью, а иногда — лишь замедлить её рост. Ученые пока не могут объяснить, почему результаты лечения бывают такими разными.
Несмотря на то, что побочные эффекты встречаются не так часто, как при химиотерапии, иногда они могут быть весьма серьезными. Иммунотерапия — это всегда длительное лечение.
Со временем иммунопрепарат, который помогал пациенту ранее, может перестать работать. К минусам можно отнести и достаточно высокую стоимость иммунотерапии при раке.
Таким образом, в каждом случае решение нужно принимать индивидуально. Прежде чем назначить иммунотерапию, врач обязательно взвесит все возможные преимущества и риски.
Ещё один минус иммунотерапии — она подходит не для всех типов рака. Существует не так много онкологических диагнозов, для которых разработан препарат, который способен точно и эффективно воздействовать на клетки данного рака.
Однако это путь, по которому онкология продолжает идти, открывая всё новые и новые препараты и их комбинации, которые способны воздействовать на новые виды опухоли. Всё остальное – это исключительно преимущества, которые могут отменить остальные виды лечения уже в обозримом будущем.
Иммунотерапия – это самый современный медикаментозный метод лечения рака. Стоимость иммунотерапии рака немаленькая. Особенно в сравнении с другими известными методами. Стоимость лечения зависит от вида применяемого иммунопрепарата, типа и стадии опухоли, ее степени агрессивности. Высокая цена иммунотерапии связана с тем, что производство иммунопрепаратов – сложный и дорогой процесс.
Иммунитет позволяет защититься от внутренних врагов (различные видоизменившиеся клетки) и внешних (микробы, вирусы), способных размножаться бесконтрольным путем.
В человеческом организме ежедневно образуется несколько тысяч раковых клеток, и иммунитет должен быстро обнаружить их развитие и полностью подавить. Если он не справляется со своими функциями, опухоль в итоге начинает вырабатывать вещества, которые существенно снижают защитные способности организма. У большей части онкобольных диагностируют подавленный иммунитет.
Исследования, проведенные учеными, доказывают, что значительное влияние на восстановление противораковой функции иммунитета могут оказывать дендритные клетки и Т-лимфоциты.
Применяется с целью лечения меланомы на стадиях, когда проявляются метастазы. Данная методика позволяет существенно и очень быстро усилить способности иммунитета к противодействию злокачественным образованиям.
Активность ТИЛ-клеток в 75 раз выше аналогичных показателей лимфоцитов. Из удаленных тканей опухоли получают ТИЛ-клетки, их помещают в специально подготовленную среду, чтобы они могли развить противоопухолевые способности. После этого в кровь пациента возвращают значительно усиленные и размноженные ТИЛ-клетки.
T-хелперы относятся к числу самых активных телец иммунной системы, которые формируют адаптивный иммунитет. Сферы применения Т-клеточной иммунотерапии: лечение раковых образований, аутоиммунных заболеваний, ВИЧ и других сложных вирусов.
1. С использованием клеток, полученных из организма больного.
2. С использованием донорских клеток.
Организм учится распознавать раковые клетки и уничтожать их благодаря иммунотерапии. Препараты, которые при этом используются, не являются токсичными. Поэтому как таковых побочных эффектов не наблюдается, таких как, например, дает химиотерапия или облучение при онкологии. Последствия достаточно неприятные. Они проявляются следующими симптомами:
- тошнотой и рвотой;
- диареей;
- проблемой с кожей;
- полной потерей волос;
- слабостью.
Но в небольшом числе случаев организм может отреагировать следующими симптомами и на иммунотерапию:
- Воспалением слизистых.
- Тошнотой.
- Сыпью или любыми другими аллергическими реакциями.
- Низким давлением.
Иммунотерапия может объединяться с другими способами лечения онкологии, что усилит воздействие на раковые клетки.
При помощи радиоиммунотерапии, к примеру, борются с раком. Происходит фиксация радиоактивного изотопа к моноклональным антителам или активация Т-хелперов радиомагнитными частицами. Израильский институт имени Вайцмана создал впервые вакцину для терапии лейкемии (рак крови). Испытания ее были успешными, поэтому она запущена в производство. Патент принадлежит западным фармацевтическим компаниям.
Многих интересует вопрос о том, как называется анализ на раковые клетки. Его часто именуют анализом на онкомаркеры. Специалистом лаборатории оцениваются некоторые из них, по их наличию можно судить о работе внутренних органов.
Новые исследования подтвердили, что раковая опухоль может быть уничтожена определенными патогенными микроорганизмами. К ним относят:
- вирусы;
- клостридии;
- различные бактерии;
- дрожжевые грибки и т. д.
На их основе создаются векторные противоопухолевые вакцины. Если эти микроорганизмы обработать определенным способом в условиях лаборатории, то организм не заболеет. А вот резкая выработка иммунных тел произойдет. Эти иммунные тела являются, в том числе, противоопухолевыми.
Противоопухолевые вакцины
Применение методики вакцинации позволяет восстановить противоопухолевый иммунитет человека и предотвратить развитие и распространение онкопатологии. Вакцины могут включать в себя клетки опухоли или антигены.
Клеточные вакцины создаются из раковых клеток больного. После изъятия их обрабатывают специальным способом.
При достижении стадии, когда клетки неспособны совершать деление, их вводят в тело больного для формирования особого иммунитета.
Источник
Существует прямая, обусловленная физиологически, связь между абляцией опухолевой ткани и последующим иммунологическим ответом. Классическая концепция вакцинации – широко известна. Согласно этой концепции для того, чтобы вакци- нация оказалась успешной, необходимо введение в организм антигена (обычно это белок) или материала, который имитирует этот антиген. Организм, в свою очередь, вырабатывает свой кратко- или долгосрочный иммунологический ответ.
Концепция противораковых вакцин с терапевтической точки зрения является сходной. Для изготовления противораковых вакцин используется какая-либо разновидность антигенного компонента опухоли. Таким образом, это своего рода провокационная терапия, одобренная в США и в некоторых странах Европейского союза, и являющаяся очень быстро развивающейся областью.
Ключевыми компонентами противораковой вакцины являются три аспекта. Вопервых, должен быть в наличии опухолевый антиген – мишень для предстоящей терапии; во-вторых, специфическая система, включающая антигенпрезентирующие клетки, которая работает наподобие моста, для доставки и представления антигена другим иммунокомпетентным клеткам; и, наконец, лимфоцитарная система – она является эффектором и занимается тем, что непосредственно уничтожает опухолевые клетки. И лишь при наличии и адекватном функционировании всех трех компонентов система противораковой вакцины будет работать.
За последнее десятилетие изучено множество антигенов, которые могли бы быть онкоспецифическими, то есть не экспрессироваться нормальными клетками. К сожалению, на сегодняшний день не найдено ни одной белковой молекулы, которая присутствовала бы исключительно в опухолевой ткани. Этот белок всегда в том или ином количестве будет находиться на поверхности огромного множества нормальных клеток организма. Существует несколько типов молекул, которые представляют интерес (MAGE-1 MAGE-3 Tyrosinase, PSA, PSMA, PAP, Her-2/neu), причем не только для урологов, но и для врачей других специальностей. Очень интересной является способность одного рекомбинантного антигена вызывать достаточный для терапии иммунный ответ, предполагающий повсеместное воздействие на все опухоли данного типа. К сожалению, рак по своей природе является гетерогенным и состоит из различных клеток, экспрессирующих различные наборы антигенов. Это главное препятствие для создания универсальной вакцины, которая действовала бы на все без исключения опухолевые клетки.
Одно из самых интересных исследований, иллюстрирующее вышесказанное, было проведено в Университете им. Вашингтона в Сиэтле. В этом исследовании проводилось вскрытие умерших с метастатическим РПЖ, в кратчайшие сроки после наступления смерти пациента, во время которого осуществлялся забор костного материала из метастазов. Несмотря на то, что более 70% опухолевых клеток экспрессировали ПСА, доля ПСА- позитивных клеток сильно различалась в различных образцах (стандартное отклонение > 25%), взятых от одного и того же пациента. От 0 до 95% метастазов у одного пациента имели нейроэндокринный фенотип (позитивны на хромогранин А). Данное исследование подчеркивает гетерогенность метастатического РПЖ – гистологическую и иммунофенотипическую. Поэтому лечение, направленное на фенотип одного из метастазов, не может иметь эффек та в других метастазах, по причине тканевой гетерогенности.
Новая концепция противораковой вакцины
Мы подошли к новой концепции противораковой вакцины. Идея состоит в том, что разрушенная тем или иным образом (механически или термически) опухолевая ткань высвобождает большое число разнообразного и высокоспецифичного антигенного материала, который является первым из ключевых компонентов. Использование аблятивных техник для получения антигенного материала имеет большие преимущества, поскольку поврежденные ткани потенциально имеют множество разновидностей собственных (аутологичных) опухолевых антигенов, в том числе тех, которые не были до сих пор описаны. При использовании аблятивных методов, это может быть достигнуто на локальном уровне (in situ), избавляя от необходимости синтезировать или производить антиген в лаборатории (ex vivo).
Если рассмотреть криоабляцию, то непосредственно после выполнения процедуры всегда отмечается рост сывороточного уровня ПСА, что связано с разрушением и поступлением в кровоток содержимого значительного количества разрушенных клеток предстательной железы (рисунок 1). Сходным же образом выделяются и другие антигены, экспрессируемые в опухолевой ткани. Существует множество этих антигенов, что может говорить нам о гетерогенности фенотипа опухоли. Таким образом, мы имеем значительное количество антигенного материала после криоабляции, для получения адекватного иммунного ответа.
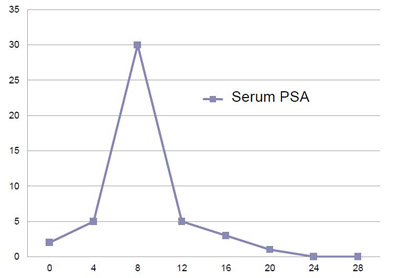
Time (hrs) following cryoablation
Рисунок 1. Пик повышения ПСА после криоабляции
Но это лишь один из необходимых компонентов для создания противораковой вакцины, антигенные компоненты которой могут быть предоставлены аблятивными технологиями.
Как указывалось выше, следующий необходимый компонент для создания вакцины – это иммунная система, вследствие функционирования которой антигенпрезентующие клетки, являющиеся посредниками между опухолевыми антигенами и эффекторными клетками, предоставляют последним антигенный материал.
Если мы взглянем на лимфоцит, основной эффекторный элемент иммунной системы, который действует на высвобожденные при абляции опухоли антигены, то заметим, что на поверхности Т-клеток имеются рецепторы, которые распознаютразличные чужеродные белки, количество которых возрастает, когда он атакует свою цель (рисунок 2). Однако при этом Т-клетка нуждается во множестве ко-стимулирующих сигналов, которые должны присутствовать для увеличения клона клеток, направленных против того или иного антигена, и обеспечивать, таким образом, генерацию иммунного ответа. Ключевым же является тот факт, что недостаточно одного лишь присутствия антигена после абляции опухолевой ткани, необходимы также презентация антигена для рецепторов Т-клеток и присутствие большого количества вспомогательных сигналов в их окружении.
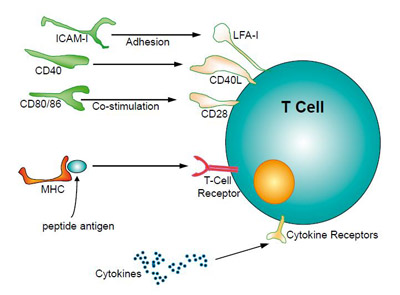
Рисунок 2. Различные сигналы, требующиеся для активации T-клеток
Антигенпрезентирующая клетка (рисунок 3) способна не просто контактировать с поверхностными рецепторами Т-клеток, но и выделять растворимые и рецепторные вещества, стимулирующие Т-клетку. При сочетании всех указанных выше факторов взаимодействия, эффекторная клетка реагирует на антигенный сигнал очень быстро, сила реакции нарастает с логарифмической скоростью, что и обусловливает клинический иммунный ответ.
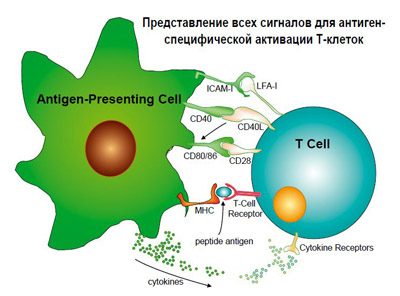
Рисунок 3. Антиген-презентирующие клетки
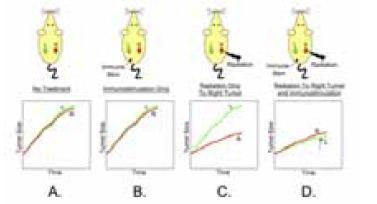
Дендритные клетки (DC) – это наиболее известная и изученная разновидность антигенпрезентирующих клеток. Одно из исследований доктора Demaria – многокогортное исследование на животных, которым имплантировались опухоли в левую и правую почки (рисунок 4). Опухоль в левой почке никогда не подвергалась лечению. Животные разделялись на 4 группы в зависимости от вида лечения, применяемого к правой почке: без лечения; только иммуностимуляция; только облучение; облучение вместе с иммуностимуляцией. Животные из первых двух групп показали примерно одинаковый уровень роста опухоли с обеих сторон. При использовании облучения рост опухоли в правой почке существенно замедлялся. Когда исследователи использовали одновременное облучение одной опухоли и введение аутологичных дендритных клеток, то помимо уменьшения опухоли на стороне воздействия, было зарегистрировано также заметное подавление опухоли на противоположной стороне. Это очень элегантная демонстрация тормозящего эффекта иммунной системы, и в особенности, вовлеченных DC.
Иммунологически опосредованное ингибирующее влияние ионизирующего излучения на нелеченную опухоль.
Demaria, et al. IJROBP 58(3):862-70, 2004
Рисунок 4. «Тормозящий» эффект
Доктор Ablin в 1970 г. в Нью-Йорке отметил неожиданную реакцию отдаленных метастазов после криоабляции рака предстательной железы (РПЖ). Им была задокументирована регрессия метастазов РПЖ, с локализацией в позвоночнике, после криоабляции простаты. В то время механизм данной реакции остался не раскрытым.
Одно из исследований на крысах со сходным дизайном было опубликовано несколько лет назад. Опухоль спонтанно метастазировала в легкие. После криоабляции опухоли простаты была отмечена активизация DC, что сопровождалось замедлением роста легочных метастазов. Животные, которые подвергались криоабляции и введению DC показали лучший профиль выживаемости.
Наша идея состоит в объединении аблятивных и клеточных технологий. Мы верим, что DC служат связующим звеном между лимфоцитами и антигенами опухоли. Однако, в итоге, ответственной за результат иммунной терапии должна быть эффекторная система.
Иммунная система имеет две функции (рисунок 5). Одна из них стимулирующая/цитотоксическая – проявляется путем активации иммунного ответа и усиления активности эффекторов (Т-клетки, В-клетки, антитела), способных к непосредственному уничтожению чужеродных антигенов. Другая, зеркальное ее отражение – это регуляторная/защитная функция, в виде регуляторных Т-клеток, задача которой в ослаблении иммунного ответа. И до тех пор, пока мы не поймем, как эта система работает, мы не сможем регулировать взаимодействие двух противоположных сторон иммунной системы.
Цитотоксический/Стимулирующий
| Регуляторный/Защитный
|
Рисунок 5. Две стороны иммунной системы
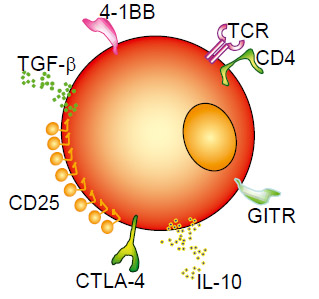
Цитотоксическая часть иммунной системы на первых порах представлена необученной Т-клеткой, не способной что-либо уничтожить (рисунки 6, 7). После ее активации дендритными клетками, и сопутствующими пептидными сигналами, начинается производство армии высокоспецифичных Т-клеток, способных уничтожать клетки, несущие чужеродные антигены (например, опухолевые клетки).В то же время регуляторные Т-клетки, которые подвержены гиперэкспрессии у онкологических больных, защищают опухоль путем снижения воспалительной реакции, уменьшения активации Т-клеток. Существует множество исследований, доказывающих этот факт. И мы должны подавить эту защитную функцию регуляторных Т-клеток любым доступным способом (таблица 1).
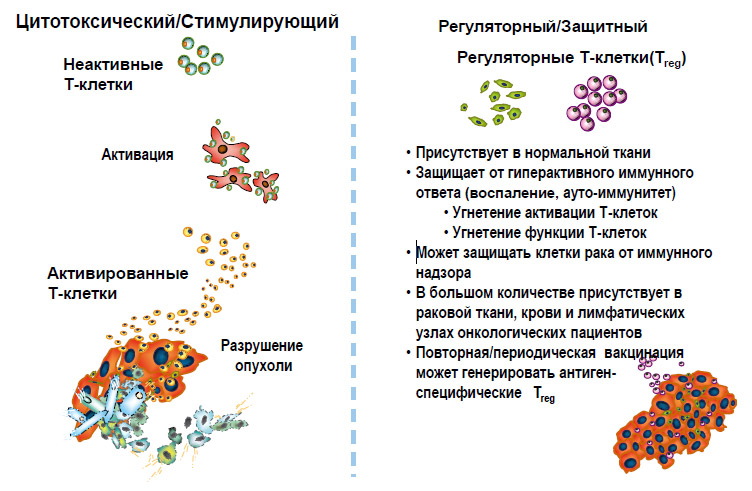
Рисунок 6
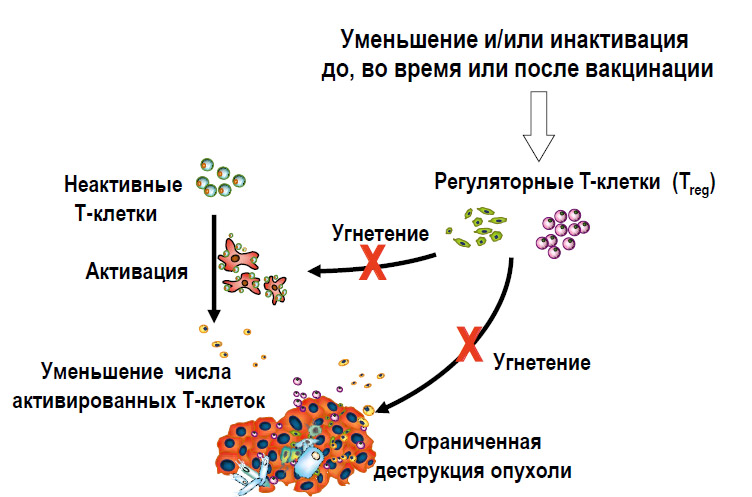
Рисунок 7. Стратегия преодоления Treg-эффекта для повышения эффективности вакцинации от рака
Таблица 1. Агенты для подавления регуляторных Т-клеток
| Агенты | Тип | Цель | Механизм |
|---|---|---|---|
| Anti-CTLA-4 (MDX-10, Medarex) | антитело | CTLA-4 | Блокада |
| Denileukin diftitox (ONTAK®, Ligand) | IL-2 иммунотоксин | CD25 | Направленs ная гибель клеток |
| Anti-CD25, CD4 | антитело | CD25, CD4 | Блокада |
| Anti-41BB | антитело | 41BB | Агонисты/активация |
| Anti-GITR | антитело | GITR | Агонисты/активация |
| Cyclophosphamide (Cytoxan®, Neosar®) | Pharmaceutical | ? | Селективное уничтожение или инактивация? |

Дендритные клетки (DC) – это наиболее известная и изученная разновидность антигенпрезентирующих клеток. Одно из исследований доктора Demaria – многокогортное исследование на животных, которым имплантировались опухоли в левую и правую почки (рисунок 4). Опухоль в левой почке никогда не подвергалась лечению. Животные разделялись на 4 группы в зависимости от вида лечения, применяемого к правой почке: без лечения; только иммуностимуляция; только облучение; облучение вместе с иммуностимуляцией. Животные из первых двух
групп показали примерно одинаковый уровень роста опухоли с обеих сторон. При использовании облучения рост опухоли в правой почке существенно замедлялся.
Когда исследователи использовали одновременное облучение одной опухоли и введение аутологичных дендритных клеток, то помимо уменьшения опухоли на стороне воздействия, было зарегистрировано также заметное подавление опухоли на противоположной стороне. Это очень элегантная демонстрация тормозящего эффекта иммунной системы, и в особенности, вовлеченных DC.
Доктор Ablin в 1970 г. в Нью-Йорке отметил неожиданную реакцию отдаленных метастазов после криоабляции рака предстательной железы (РПЖ). Им была задоку-
ментирована регрессия метастазов РПЖ, с локализацией в позвоночнике, после криоабляции простаты. В то время механизм данной реакции остался не раскрытым.
Одно из исследований на крысах со сходным дизайном было опубликовано несколько лет назад. Опухоль спонтанно метастазировала в легкие. После криоабляции опухоли проста- ты была отмечена активизация DC, что сопровождалось замедлением роста легочных метастазов. Животные, которые подвергались криоабляции и введению DC показали лучший профиль выживаемости.
Наша идея состоит в объединении аблятивных и клеточных технологий. Мы верим, что DC служат связующим звеном между лимфоцитами и антигенами опухоли. Однако, в итоге, ответственной за результат иммунной терапии должна быть эффекторная система.
Иммунная система имеет две функции (рисунок 5). Одна из них стимулирующая/цитотоксическая – проявляется путем активации иммунного ответа и усиления активности эффекторов (Т-клетки, В-клетки, антитела), способных к непосредственному уничтожению чужеродных антигенов. Другая, зеркальное ее отражение – это регуляторная/защитная функция, в виде регуляторных Т-клеток, задача которой в ослаблении иммунного ответа. И до тех пор, пока мы не поймем, как эта система работает, мы не сможем регулировать взаимодействие двух противоположных сторон иммунной системы.
Цитотоксическая часть иммунной системы на первых порах представлена необученной Т-клеткой, не способной что-либо уничтожить (рисунки 6, 7). После ее активации дендритными клетками, и сопутствующими пептидными сигналами, начинается производство армии высокоспецифичных Т-клеток, способных уничтожать клетки, несущие чужеродные антигены (например, опухолевые клетки). В то же время регуляторные Т-клетки, которые подвержены гиперэкспрессии у онкологических больных, защищают опухоль путем снижения воспалительной реакции, уменьшения активации Т-клеток. Существует множество исследований, доказывающих этот факт. И мы должны подавить эту защитную функцию регулятор-
ных Т-клеток любым доступным способом (таблица 1).
В США проводятся десятки исследований, направленных на изучение веществ, которые могут подавлять различные звенья иммуносупрессивного влияния регуляторных Т-клеток. Используется множество агентов, основанных на антите-
лах и рецепторах, которые усиливают свойства цитотоксических Т-клеток.
Возвращаясь к аблятивным технологиям: у нас имеется достаточно широкий арсенал средств, которые мы можем использовать, в надежде повлиять на отдаленные мета-
стазы у пациентов очень высокого риска (рисунок 8). Путем разрушения основной опухоли мы можем высвободить широкий профиль антигенов опухоли, затем мы можем активизировать DC пациента для формирования системного иммунного ответа. Последнее, в настоящее время, является предметом интенсивного изучения. Мы также можем использовать несколько стратегий для достижения данной цели, но, пока мы не изменим иммунную среду пациента, этот процесс будет угнетаться.
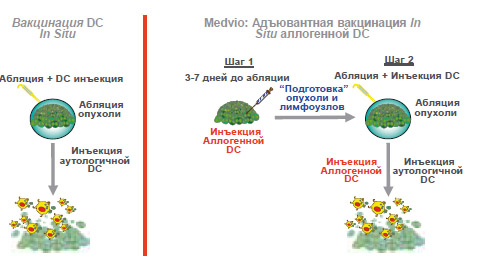
Рисунок 8. Наш подход
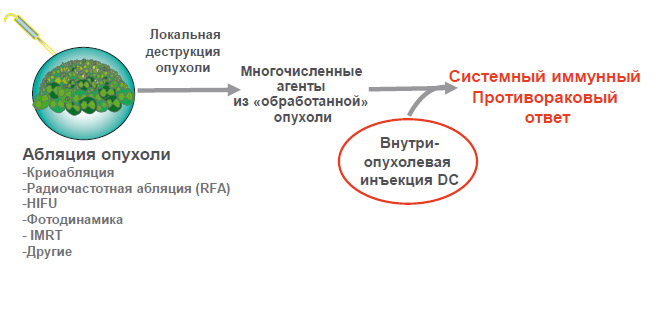
Рисунок 9. Вакцинация DC in situ. Абляция опухоли после внутриопухолевой инъекции DC
Потенциальные преимущества введения дендритных клеток in situ:
- поврежденные ткани опухоли после абляции потенциально могут раскрыть большое разнообразие собственных (аутологичных пациенту) антигенов опухоли, что приводит к генерации поликлонального иммунного ответа;
- нагрузка дендритных клеток антигенами осуществляются in situ, тем самым устраняя необходимость затрат на синтез и обработку антигенов ex vivo;
- абляция играет также и циторедуктивную роль.
Отток жидкости от любой первичной опухоли происходит в местные лимфатические коллекторы. Опухоль растет, прогрессирует, проявляет инвазивные свойства и в изобилии наполняет эти лимфоузлы регуляторными Т-клетками
и иммуносупрессивными факторами, которые предотвращают активацию и нарушают функционирование дендритных клеток и цитотоксических Т-лимфоцитов, снижая тем самым, интенсивность возможного иммунного ответа. И мы долж-
ны в корне изменить эту ситуацию.
Наш подход заключается во введении клеточного адъюванта до операции непосредственно в лимфатическую систему и опухоль (рисунок 9). При этом вследствие реакции Т-клеток на антигенную стимуляцию произойдет высвобож-
дение различных воспалительных цитокинов (Типа 1), включая IFN-α, IFN-γ,TNF-α, IL-2, IL-12, IL-15, и IL- 18. Затем выполняется абляция опухоли тем или иным способом, что приводит к увеличению пула сенсибилизированных клеток и уничто-
жению опухоли. Наличие цитокинов 1 типа локально в ложе опухоли и в дренирующем лимфоузле может обеспечить сигналы к созреванию и активации введенных аутологичных DC, а также к подавлению иммуносупрессивного микроокружения.
Выводы
1. Минимально инвазивные аблятивные технологии обеспечивают весьма актуальный и специфический источник антигенов опухоли, которые потенциально
могут быть использованы в качестве материала для противоопухолевой вакцины, направленной против раковых клеток находящихся далеко за пределами первичной опухоли.
2. Дендритные клетки – как собственные, так и введенные извне – представляют собой ключевой клеточный мост между опухолевыми антигенами и стимуляцией высокоспецифичных цитотоксиче
