Иммунные механизмы противоопухолевого иммунитета
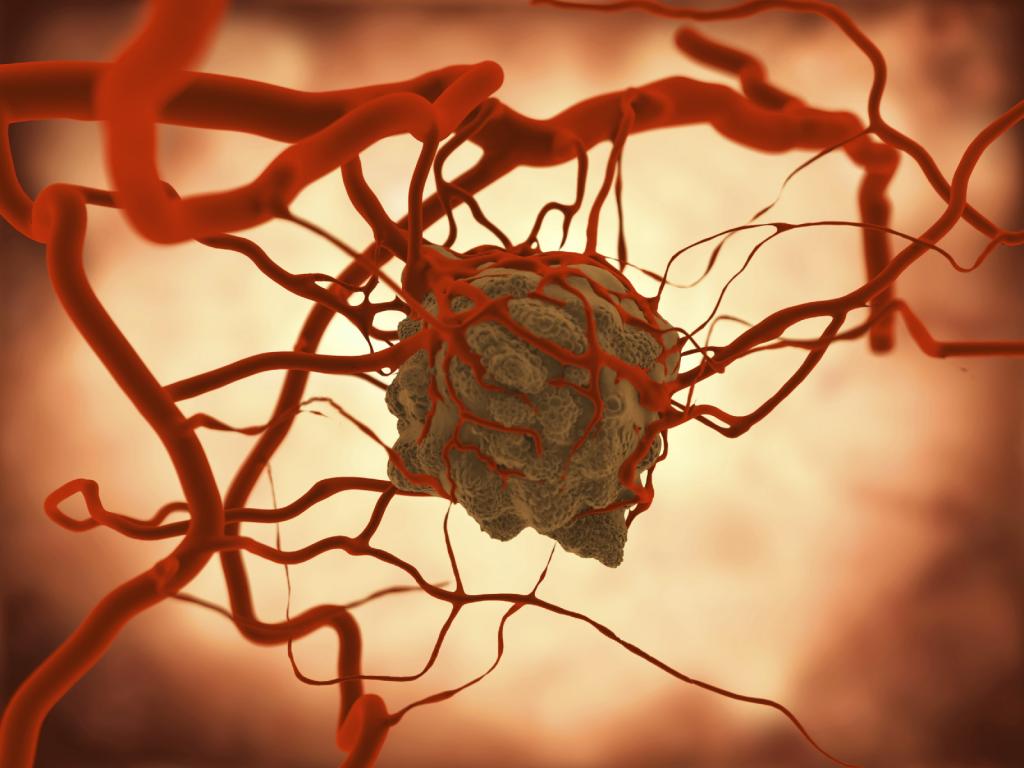
Исследование противоопухолевого иммунитета и устранение факторов, вызывающих его ухудшение, являются важными проблемами в современной медицине. Злокачественные новообразования занимают одно из лидирующих мест среди причин смертности и инвалидизации населения в развитых странах. В норме баланс количества делящихся и отмирающих клеток регулируется естественным образом. Если размножение клеток приобретает неконтролируемый характер, то возникают злокачественные опухоли. Механизм контроля этого процесса со стороны иммунной системы зависит от нескольких факторов, подавляющих или стимулирующих процесс избыточного деления.
Общее описание
Под иммунитетом принято понимать совокупность защитных механизмов живого организма от негативного воздействия чужеродных агентов. Чаще всего эти процессы связаны с инфекционными (бактериальными, вирусными, грибковыми, протозойными) заболеваниями. Однако существуют и другие способы защиты, одним из которых является противоопухолевый иммунитет.
В деятельности любого живого организма возникают моменты, когда ему необходимо быстрое деление клеток (травма, воспалительный процесс и другие). При развитии определенного иммунного ответа количество клеток, чувствительных к воздействию антигена (молекулы, связанной с антителом), увеличивается в несколько тысяч раз. При нормальном течении процесса после завершения данной реакции ускоренное деление клеток останавливается.
Для злокачественной опухоли характерно нарушение этого механизма. Размножение клеток продолжается постоянно и имеет независимый характер. Постепенно происходит замещение нормальных тканей в пораженном органе и прорастание опухоли в окружающие области. Перемещаясь по кровяному руслу, клетки опухоли продолжают делиться и в другой локализации, что приводит к появлению метастаз. Этот дефект непрерывного деления наследуется всеми потомками опухолевых клеток. Их мембраны изменены таким образом, что человеческий организм воспринимает объекты как чужеродные.
С другой стороны, в организме имеется способ, который может остановить этот процесс, – противоопухолевый иммунитет. В иммунологии возникновение опухолей является свидетельством того, произошли нарушения естественного защитного механизма.
История открытия
Еще в 18 веке было замечено, что у некоторых больных, перенесших инфекционные болезни, исчезали злокачественные опухоли. В конце 19 века американский хирург-онколог Вильям Коли выявил взаимосвязь между заражением гемолитических стрептококком Streptococcus pyogenes и уменьшением (а в некоторых случаях – и полным исчезновением) опухолей злокачественного характера. Им была разработана противораковая вакцина на основе этих бактерий для лечения пациентов с саркомой. В то время еще не были известны механизмы противоопухолевого иммунитета в иммунологии, поэтому его работы подвергались сильной критике, а впоследствии были забыты почти на 100 лет.
В середине XX века было открыто, что введение макромолекул липосахарида, из которых состоят оболочки клеток микробов, может приводить к отмиранию опухолей. Однако в 70-е гг. XX в. ученые установили, что этот процесс вызывает не сам липосахарид, а белковый фактор (фактор некроза опухоли, или ФНО), вырабатываемый следующими типами клеток иммунной системы при контакте с микробами:
- активированные макрофаги;
- нейтрофилы;
- Т-лимфоциты;
- тучные клетки;
- астроциты;
- NK-клетки (натуральные киллеры).
Взаимосвязь иммунитета и образования опухолей
В пользу наличия связи между состоянием иммунитета и развитием злокачественных опухолей свидетельствуют следующие факты:
- увеличенная распространенность таких новообразований у пациентов с иммунодефицитным состоянием, а также в пожилом возрасте (что связано со снижением защитных сил организма);
- выявление у больных специфических антител и Т-клеток, чувствительных к антигенам опухолей;
- возможность формирования противоопухолевого иммунитета и иммунопролиферативных заболеваний (при искусственном введении антител и подавлении иммунитета соответственно).
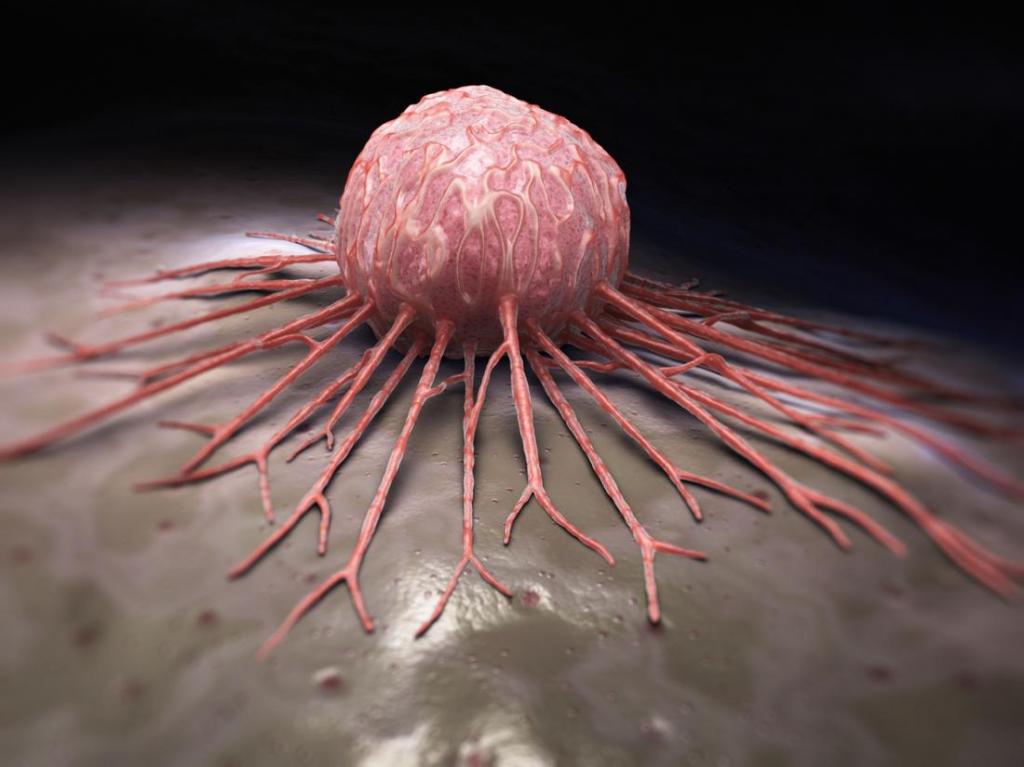
Защитная функция иммунитета заключается не только в уничтожении чужеродных агентов (вирусов, грибков и бактерий), но и клеток-мутантов, из которых образуются опухоли. Для них характерна антигенная специфичность, которая зависит от причины появления новообразования:
- вирусы (папилломы, лейкоза и другие);
- химические канцерогены (метилхолантрен, бензопирен, афлотоксины и другие);
- эндокринные нарушения (метаболическая иммунодепрессия);
- физические факторы окружающей среды (все виды излучений).
Естественный противоопухолевый иммунитет очень слабо влияет на уже сформировавшееся злокачественное новообразование. Это связывают со следующими факторами:
- быстрый рост опухоли, опережающий активизацию иммунных сил;
- выделение опухолевыми клетками антигенов, которые связывают соответствующие рецепторы на поверхности лимфоцитов-киллеров;
- подавление клеточного иммунитета со стороны новообразования.
Принцип действия
Механизм противоопухолевого иммунитета в медицинской науке еще мало изучен. Несмотря на то что выявлена его защитная функция, антитела могут отражать опухолевые антигены, не вызывая разрушения злокачественных клеток. В некоторых случаях иммунотерапия даже дает обратный эффект, способствуя увеличению новообразования.
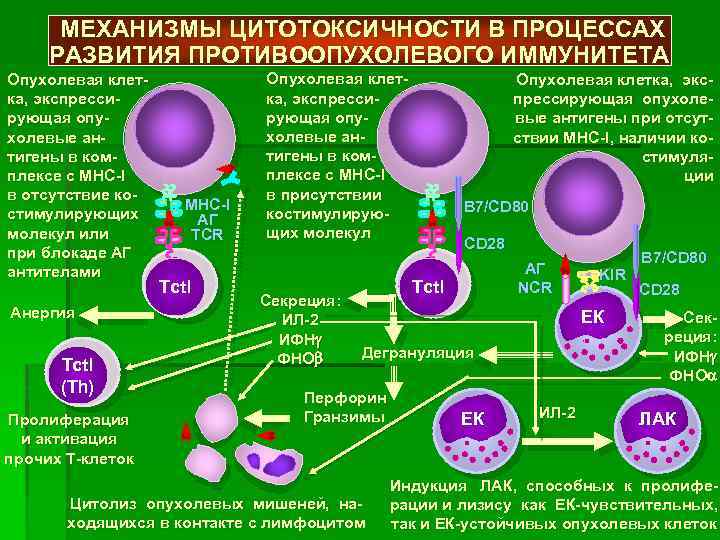
Согласно современным представлениям, ключевую роль в данном процессе играют активизированные макрофаги и клетки-киллеры. Особенностью противоопухолевого иммунитета является то, что он характеризуется сложным механизмом взаимодействия организма-хозяина и новообразования. Выделяют 4 основные группы факторов:
- Антибластомные – гуморальные и клеточные (Т-лимфоциты, ФНО, макрофаги, ЕК- и К-клетки, специфические антитела, интерфероны, интерлейкины), подавляющие развитие опухоли и разрушающие ее клетки.
- Иммунорезистентность новообразования, или его способность противостоять противоопухолевому иммунитету.
- Пробластомные: угнетающие иммунитет (вещества-супрессоры, вырабатываемые макрофагами и лимфоцитами; гормоноподобные соединения, интерлейкин-10, циркулирующие иммунные комплексы, протеины группы TGFβ, состоящие из антигенов, антител и компонентов комплемента); усиливающие иммунитет (ФНО, вырабатываемый макрофагами; гамма-интерферон, интерлейкины 2 и 6, фактор роста эндотелия; иммунодефицитные состояния).
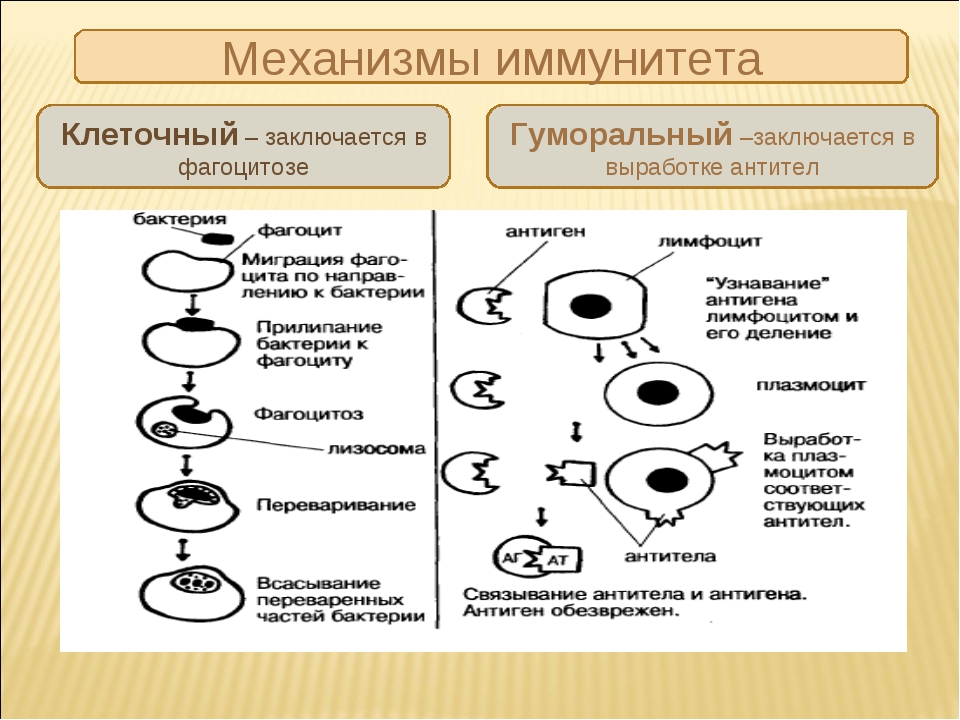
Эффекторные механизмы
Основной функцией эффекторных механизмов противоопухолевого иммунитета является блокирование и уничтожение патогенов. Выделяют 2 группы рецепторов, избирательно связывающиеся со специфическими антигенами. На основании этого различают также 2 типа эффекторных механизмов:
- Гуморальный, функционирующий за счет растворимых (гуморальных) факторов – антител, которые связывают и удаляют антиген.
- Клеточный (антителонезависимый), реализующийся с участием клеток иммунной системы, важнейшими из которых являются Т-лимфоциты, макрофаги, NK-клетки. Они непосредственно разрушают чужеродные, инфицированные и опухолевые клетки.
Если патологически измененная клетка избежала гибели при воздействии эффекторных механизмов, то может наступить период равновесия между ее делением и подавляющим влиянием иммунитета. При прогрессировании злокачественного процесса происходит выход опухолевой ткани из-под контроля иммунных механизмов.
Важнейшую роль в подавлении деления клеток играют 2 типа лимфоцитов, запускающих процесс некроза – Т-лимфоциты и NK-клетки, распознающие стрессорные молекулы, которые выделяет новообразование. Т-лимфоциты формируются в течение более длительного времени, а их предшественники распознают опухолевые антигены. Th1-лимфоциты запускают механизм воспаления, что приводит к активизации макрофагов. Продукты секреции последних способствуют нарушению местного кровоснабжения тканей, что также влечет гибель тканей опухоли.
Участие Т-лимфоцитов проявляется в пропитывании злокачественного новообразования лимфоидными клетками, которые разрушают его клетки путем растворения, или цитолиза. Активизация лимфоцитов происходит под действием цитокинов – белковых информационных молекул, с которыми они вместе проникают в опухоль.
Большое значение среди внутренних факторов, присущих иммунной системе организма человека, имеет также гамма-интерферон. Его функции заключаются в следующем:
- Подавление деления опухолевых клеток.
- Активизация процесса их запрограммированной гибели.
- Стимулирование выработки цитокинов, которые привлекают в новообразование Т-лимфоциты.
- Активация макрофагов и развития Т-хелперов, необходимых для укрепления противоопухолевого иммунитета.
- Подавление образования новых кровеносных сосудов, что ухудшает питание опухоли и способствует более быстрой гибели ее клеток.
Противоопухолевый иммунитет: причины его низкой эффективности
Рост злокачественных новообразований и их устойчивость к иммунитету объясняются следующими причинами:
- слабая способность индуцирования иммунного ответа у опухолевых антигенов;
- выживание (естественный отбор) опухолевых клеток, устойчивых к иммунитету;
- постоянное видоизменение антигенов;
- наличие капсулы у опухоли;
- секреция опухолевых антигенов в растворимой форме, что приводит к подавлению иммунного ответа;
- расположение новообразования в местах, где возникновение антигена не приводит к воспалительному иммунному ответу (так называемая «привилегированная» локализация – костный мозг, нервная, эндокринная и половая система, тимус);
- утрата некоторых компонентов эффекторной системы в результате генетических или приобретенных (вторичных) иммунодефицитных состояний;
- производство опухолевыми клетками пробластомных факторов, подавляющих иммунитет и способствующих увеличению новообразования;
- у новорожденных – незрелость эффекторных систем, влекущее за собой нераспознавание опухолевых клеток.
Эти механизмы неэффективности противоопухолевого иммунитета приводят к тому, что новообразование становится мало иммуногенным и не воспринимается организмом как чужеродный элемент. В результате снижается защитная реакция. Иммунные механизмы не могут привести к отторжению уже сформировавшейся злокачественной опухоли.
Особенности

К особенностям противоопухолевого иммунитета относятся:
- Основную роль в иммунном ответе играют Т-лимфоциты, макрофаги и NK-клетки, разрушающие опухолевую ткань. Значение гуморального иммунитета значительно меньше.
- Раковые антигены распознаются или непосредственно макрофагами и дендритными клетками, отвечающими за врожденный и адаптивный иммунитет, или через Th1-хелперы.
- Взаимодействие организма и опухоли происходит по трем направлениям: естественная и приобретенная резистентность к злокачественным новообразованиям, иммунодепрессия со стороны опухоли. Совокупность этих факторов и составляет противоопухолевый иммунитет.
- Злокачественные клетки в процессе естественного отбора приобретают механизмы защиты против врожденного иммунитета. Формируется их новый фенотип, происходит эволюция новообразования.
Опухолеассоциированные антигены разделяют на 2 группы – первого типа (характерны для многих видов новообразований, имеют вирусное происхождение) и второго, очень специфичные и обнаруживаемые у всех пациентов, имеющих данный вид опухоли.
Одной из общих особенностей противовирусного и противоопухолевого иммунитета является то, что он носит как специфический характер, то есть направлен против определенных видов патогенов, так и неспецифический (уничтожает все чужеродное организму). Неспецифическими факторами служат мононуклеарные и NK-клетки, активизирующиеся под влиянием интерлейкина 2 и интерферонов, а также лимфокин-активированные киллерные клетки и цитокины.
Иммунодиагностика
В последние годы в медицине находит применение иммунодиагностика злокачественных новообразований. В ее основе лежит выявление в крови следующих белковых соединений:
- антигены, ассоциированные с опухолями;
- антитела;
- лимфоциты, восприимчивые к опухолевым антигенам.
Малоинвазивная иммунодиагностика позволяет выявить рак различных органов на ранней стадии развития опухоли по наличию специфических антигенов (в скобках указана локализация злокачественного новообразования):
- PSA (простата).
- P-53 (мочевой пузырь).
- SCC (легкие, пищевод, прямая кишка).
- СА-19-9 (поджелудочная железа).
- СА-125 (яичники).
- СА-15-3 (молочная железа).
Однако антитела к определенному антигену в крови пациентов с раком определяются нечасто (в 10 % случаев). Иммуноглобулины к опухолеассоциированных антигенов выявляют чаще – у 50 % больных. В настоящее время в медицинской научной среде ведутся поиски и других антигенов, помогающих в диагностике рака.
Иммунопрофилактика и лечение
Для повышения противоопухолевого иммунитета используют иммуномодуляторы, опосредованно активизирующие клетки иммунной системы:
- Интерлейкины 1 и 2. Эти белковые соединения относятся к группе провоспалительных цитокинов (информационных молекул) и являются биологически активными веществами, вырабатываемыми лейкоцитами. Интерлейкины – главные участники в процессе формирования иммунного ответа при внедрении патогенов в микробиологии. Противоопухолевый иммунитет активизируется за счет активного деления лимфоцитов (Т-киллеры, NK-клетки, Т-хелперы, Т-супрессоры и продуценты антител). Интерлейкин 2 также активизирует выработку фактора некроза опухолей.
- Препараты из группы интерферонов. Они стимулируют иммунный ответ путем представления Т-лимфоцитам антигенов, которые были захвачены макрофагами и дендритными клетками. Т-хелперы выделяют белковые информационные молекулы, активирующие работу других клеток иммунной системы. В результате происходит повышение противоопухолевого иммунитета. Отдельные виды интерферонов (гамма-интерферон) могут непосредственно воздействовать на макрофаги и киллеры.
- Адъюванты. Они вводятся вместе с основными иммунобиологическими медицинскими препаратами и служат для усиления ответа со стороны защитных сил организма. Чаще всего их используют для здоровых людей при вакцинации. Одной из особенностей противоопухолевого иммунитета в микробиологии, касающейся данного типа веществ, является то, что они могут концентрировать на своей поверхности антигены. Это обеспечивает более длительный эффект. Для целенаправленной доставки антигенов в органы лимфатической системы применяют липосомы – пузырьки с липидными биослоями. Наиболее распространенными веществами этой группы являются полный и неполный адъювант Фрейнда, гидроксид алюминия, коклюшная палочка, осажденная на алюминиевых квасцах; Полиоксидоний.
- Элементы клеток бактерий (иммуностимуляторы Продигиозан, Ликопид, Ромуртид и другие).
Проведенные на животных эксперименты показывают, что при введении опухолевых антигенов происходит формирование иммунологической памяти. В результате после этого отторгается трансплантируемая злокачественная опухоль. В последние годы в медицине ведутся активные разработки, которые дадут возможность создания противоопухолевой иммунной памяти путем вакцинации. Пока в этом направлении создан один тип прививок – для повышения иммунитета к вирусам папилломы человека, которые индуцируют возникновение рака шейки матки у женщин («Гардасил» и «Церварикс» зарубежного производства).
Виды опухолей
Иммунотерапия является эффективной в отношении следующих видов опухолей:
- меланома, возникающая из меланоцитов – пигментных клеток;
- неходжкинские лимфомы, происходящие из лимфоцитов;
- рак почек, прямой кишки, яичников;
- волосатоклеточный лейкоз (поражение В-лимфоцитов, белых клеток крови);
- глиома (опухоль мозга);
- саркома мягких тканей, происхождение которой связано с эпителиальными клетками и соединительной тканью.
Источник
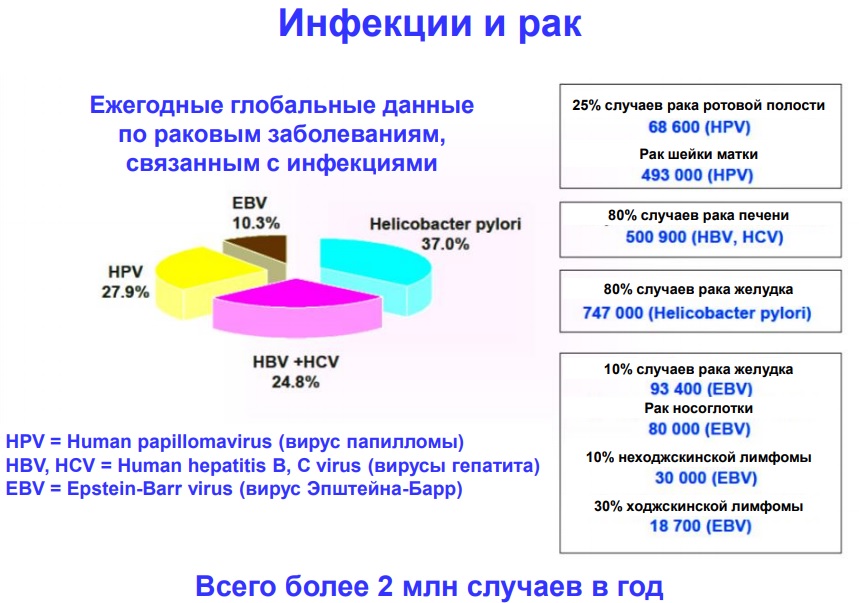
1) Антигеннеспецифические
компоненты иммунной системы:
— фагоциты
(кислородные радикалы, гидролитические
ферменты,
TNF-);
— CD16+ (АЗКЦ, спонтанная
цитотоксичность);
2) Антигенспецифические
компоненты иммунной системы:
— Т-цитотоксические
лимфоциты (СD8+);
— антитела —
антиидиотипы против BCR трансформированного
клона В-лимфоцитов и МАТ против
опухолеассоциированных антигенов могут
быть использованы в терапии опухолей,
однако имеются данные о стимулирующем
влиянии антител на рост опухолей.
Регуляцию
антигенспецифических реакций осуществляют
главным образом Th-1 (IL-2, IFN-,
TNF-, IL-3), опосредуя
вовлечение макрофагов, CD16+, Т-цитотоксических
лимфоцитов. Цитокины могут также
контролировать аномальный клеточный
рост, индуцируя дифференцировку и
подавляя опухолевую трансформацию.
14.5. Механизмы “ускользания” опухолей из-под контроля иммунной системы:
1) низкая экспрессия
опухолевых антигенов (шеддинг);
2) низкая степень
экспрессии дифференцировочных антигенов
(HLA);
3) модуляция
мембранных антигенов опухолевых клеток
— связывание антител с мембранным
антигеном и погружение его внутрь клетки
без ресинтеза;
4) опухолевые клетки
выделяют растворимые формы мембранных
антигенов, которые могут “перехватывать”
антитела в циркуляции и блокировать
АЗКЦ;
5) отсутствие
экспрессии костимулирующих молекул
CD80 и CD86 (В7.1 и В7.2), что приводит к энергии
Т-цитотоксических лимфоцитов;
6) экспрессия
ингибиторных молекул (TNF, TGF-,
IL-10,PGЕ2) и снижение
экспрессии рецепторов к ингибирующим
факторам роста;
7) нарушение
экспрессии рецепторов к цитокинам на
малигнизированных клетках;
8) усиление экспрессии
адгезивных молекул (ICAM-I, VCAM-I) и рецепторов
к хемокинам на опухолевых клетках
приводит к усилению риска метастазирования;
9) способность
опухолевых клеток экспрессировать
Fas-L (опухолевые клетки уничтожают
Т-цитотоксические лимфоциты, вступающие
с ними в контакт).
10) нарушение ответа
иммунокомпетентных клеток на цитокины.
14.6. Изменения в иммунном статусе опухоленосителей на разных стадиях опухолевого роста.
Наиболее
существенные причины неадекватного
иммунного ответа на опухоль:
— отсутствие
протективных опухолевых антигенов;
— индуцирование
опухолью периферической селекции
Т-лимфоцитов и нарушение функций ИКК в
опухолевом очаге;
— дисбаланс
цитокинов, продуцируемых
опухольинфильтрирующими лимфоцитами;
— количественные
и качественные сдвиги в метаболизме
клеток и организма в целом.
Этапы формирования
иммунодепрессии при злокачественном
росте.
I стадия —
первоначальное нарушение иммунологической
реактивности (характерна для
иммунодефицитных состояний, при
облучении, трансплантации, длительном
приеме иммунодепрессивных лекарственных
препаратов, у пожилых людей). Возможно
развитие опухолевого зачатка из единичной
опухолевой клетки. Наибольшее значение
имеет нарушение экспрессии антигенов
HLA I и II классов, а также костимулирующих
молекул на дендритных клетках и
несостоятельность антигенраспознающего
рецептора Т-хелперов. Иммунодепрессивное
воздействие опухоли обусловлено ее
способностью угнетать иммунокомпетентные
клетки на тканевом уровне.
II стадия —
иммунореактивность при сформировавшейся
локализованной опухоли (системная
иммунодепрессия). Рост опухоли вызывает
снижение иммунологической реактивности
в районе опухоли, которое постепенно
распространяется на ближайшие лимфоузлы.
Иммунодепрессия формируется посредством
секреции супрессорных факторов. II стадия
может закончиться образованием
регионарных метастазов.
III стадия —
иммунореактивность при развитом раке
(тотальная иммунодепрессия).
Характеризуется расстройством
иммунорегуляции вследствие гиперпродукции
иммуносупрессорных цитокинов и нарушения
процессов регуляции и обмена веществ
—метаболическая иммунодепрессия.
На этой стадии проявляются отдаленные
метастазы и наблюдается генерализация
опухолевого процесса. На иммунодепрессивные
воздействия накладываются и негативные
влияния на иммунную систему таких
компонентов комплексного лечения, как
циторедуктивные вмешательства, лучевая
и химиотерапия.
Метаболическая
иммунодепрессия — комплекс негативных
изменений в иммунной системе пациентов
с онкологической патологией, вызванных
расстройством обмена веществ. Ключевые
патогенетические факторы: 1) провоспалительные
цитокины (IL-1, TNF-);
2) глюкокортикоиды; 3) метаболиты
углеводного и липидного обмена — глюкоза
и неэстерифицированные жирные кислоты.
Системная иммунодепрессия проявляется
при трансформации первичного опухолевого
зачатка в опухолевый клон. Секреция
супрессорных белков начинается на
стадии трансформации и усиливается при
последующей малигнизации (AFP, HCG, CEA, SP1 —
осуществляют прямое ингибирующее
действие на клетки-эффекторы или
стимулируют клетки, функционально
ориентированные на супрессию).
Дополнительное супрессорное воздействие
оказывают продуцируемые опухолями
цитокины (IL-10, TGF) иPGЕ2.
Таким образом,
общая иммунодепрессия при опухолях
имеет многофакторное происхождение и
обычно сочетается со способностью
клеток опухолевого клона противостоять
воздействию эффекторов иммунной системы.
14.7. Иммунодиагностика
опухолей направлена на:
— выявление изменений
в иммунном статусе с целью назначения
адекватной иммунокоррекции;
— выявление маркеров
опухолевых клеток.
Изменения в
иммунном статусе онкобольных:
— снижение
общего количества Т-лимфоцитов (СD3+) и
их функциональной активности;
— нарушение
соотношения иммунорегуляторных клеток
(уменьшение количества Тh-1 и снижение
их функциональной активности);
— снижение количества
и функциональной активности CD16+ (CD16+,
CD56+);
— повышение
концентрации ЦИК.
При углубленном
иммунологическом обследовании выявляются
следующие дисфункции:
— нарушение
антигенпредставляющей функции дендритных
клеток;
— снижение
функциональной активности макрофагов;
— нарушение
эффекторной функции CD8+-лимфоцитов;
— снижение
чувствительности иммунокомпетентных
клеток к цитокинам и уменьшение экспрессии
субъединиц IL-2R;
— уменьшение
экспрессии мРНК гранзима В;
— нарушение баланса
“проопухолевых”, “противоопухолевых”
и “регуляторных” цитокинов.
Серологические
опухолеассоциированные маркеры (ОМ) в
онкологической клинике.
ОМ — белки,
которые синтезируются и секретируются
в значительно больших количествах
опухолевыми клетками по сравнению с
нормальными. Описано большое число ОМ,
повышение содержания которых ассоциировано
с развитием опухолевого процесса. ОМ
не обладают органной Или опухолевой
специфичностью, т.к. могут наблюдаться
у 10-30% больных с доброкачественными
процессами разных органов. Практически
широко применяются приблизительно
15-20 ОМ.
ОМ нашли широкое
применение при динамическом наблюдении
для раннего выявления субклинических
рецидивов и для контроля за эффективностью
противоопухолевой терапии. Для солидных
опухолей большинства локализаций и
гистологических типов подобраны 2-5 ОМ.
Наиболее информативные ОМ приведены в
табл.1.
Соседние файлы в предмете Иммунология
- #
- #
Источник
