Изучение активации врожденного иммунитета
Иммунная система позволяет нам существовать в мире, полном патогенных микроорганизмов — вирусов, бактерий, грибов. Нобелевская премия по физиологии и медицине 2011 года вручена за открытия в области активации врожденного иммунитета (половину премии разделили Брюс Бётлер и Жюль Хоффман) и за изучение роли дендритных клеток в приобретенном иммунитете (вторая половина премии присуждена Ральфу Стайнману, к сожалению, скончавшемуся 30 сентября). Эти достижения не только дали понимание того, как слаженная работа врожденного и адаптивного иммунитета защищает организм, но и открыли новые перспективы в лечении инфекций, рака и воспалительных заболеваний.
Две линии иммунной обороны
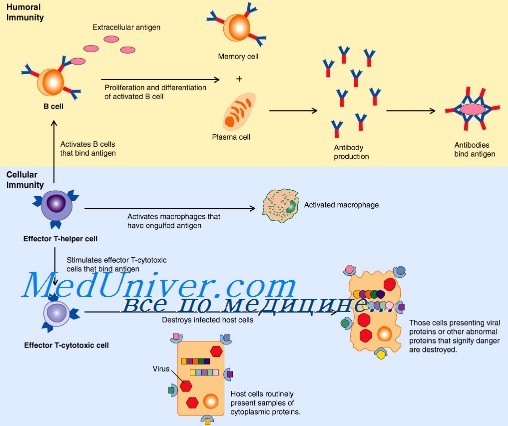
Мы обитаем в мире, буквально кишащем патогенными микроорганизмами (бактериями, грибами, вирусами и паразитами), однако наши организмы оснащены совершенной системой защиты, позволяющей (в норме) не замечать опасного соседства. «Первая линия» иммунной обороны — врожденный иммунитет — уничтожает вторгшиеся в организм патогены на основе технологии «свой—чужой», распознавая черты, всегда присутствующие у «захватчиков», но отсутствующие в собственном организме. Если же инфекции удается прорваться, вступает в работу «вторая линия» — приобретенный, или адаптивный, иммунитет. Основанный на согласованной работе B- и T-лимфоцитов, он действует посредством специфических к конкретной инфекции антител и клеток-«убийц», уничтожающих зараженные клетки и саму инфекцию. В отличие от врожденного иммунитета, способность к распознаванию патогенов которого закодирована генетически, приобретенный иммунитет обучается распознавать новые «образы» врага и сохраняет память о нем, мгновенно «вспоминая», встретившись вновь.
Однако, обеспечивая необходимую защиту, иммунные механизмы скрывают и опасность: если «активационный барьер» слишком низок, иммунитет может активироваться собственными молекулами, что приводит к развитию аутоиммунных и воспалительных заболеваний.
Организация иммунной системы изучалась в течение XX века постепенно; в частности, нобелевскими премиями отмечены изучение строения антител и определение механизма распознавания Т-клетками инородных веществ. Однако только с работами Бётлера, Хоффмана и Стайнмана стали понятны механизмы, активирующие врожденный иммунитет и связывающие его с иммунитетом приобретенным.
Открытие сенсоров врожденного иммунитета
Пионерское открытие Жюля Хоффмана было сделано в 1996 году, когда он с коллегами исследовал, как дрозофила сопротивляется инфекциям [1]. Они работали на линиях мух, мутантных по нескольким генам, включая ген Toll, участвующий в эмбриональном развитии (за открытие роли этого гена также вручена Нобелевская премия в 1995 году). Хоффман с коллегами открыли, что мухи с мутантным геном Toll погибали при заражении бактериями или грибами, в то время как «дикий тип» чувствовал себя вполне сносно. В результате их работ был сделан вывод, что продукт этого гена — Toll-рецептор — «чувствует» патогенные микроорганизмы и запускает механизмы врожденного иммунитета.
Брюс Бётлер с коллегами, со своей стороны, искали рецепторы, которые могли бы активироваться элементом клеточной стенки бактерий липополисахаридом (ЛПС), который при попадании в кровь вызывает септический шок (чрезмерная активация иммунной системы, грозящая смертью). В 1998 году они обнаружили, что мыши, не реагирующие на введение ЛПС, имели мутации в гене, гомологичном Toll у дрозофил. Продукт этого гена — Toll-подобный рецептор — и оказался искомым сенсором липополисахарида [2]. Связывание ЛПС (обозначающее присутствие бактерий) активирует иммунитет и запускает воспаление, а чрезмерная концентрация ЛПС приводит к септическому шоку. Это открытие показало, что и членистоногие, и млекопитающие используют схожие стратегии противостояния бактериальным инвазиям.
Открытия Хоффмана и Бётлера фактически положили начало новой «горячей» области биологии: впоследствии было открыто более 10 Toll-подобных рецепторов, каждый распознающий свой «образ», характерный для разных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней.
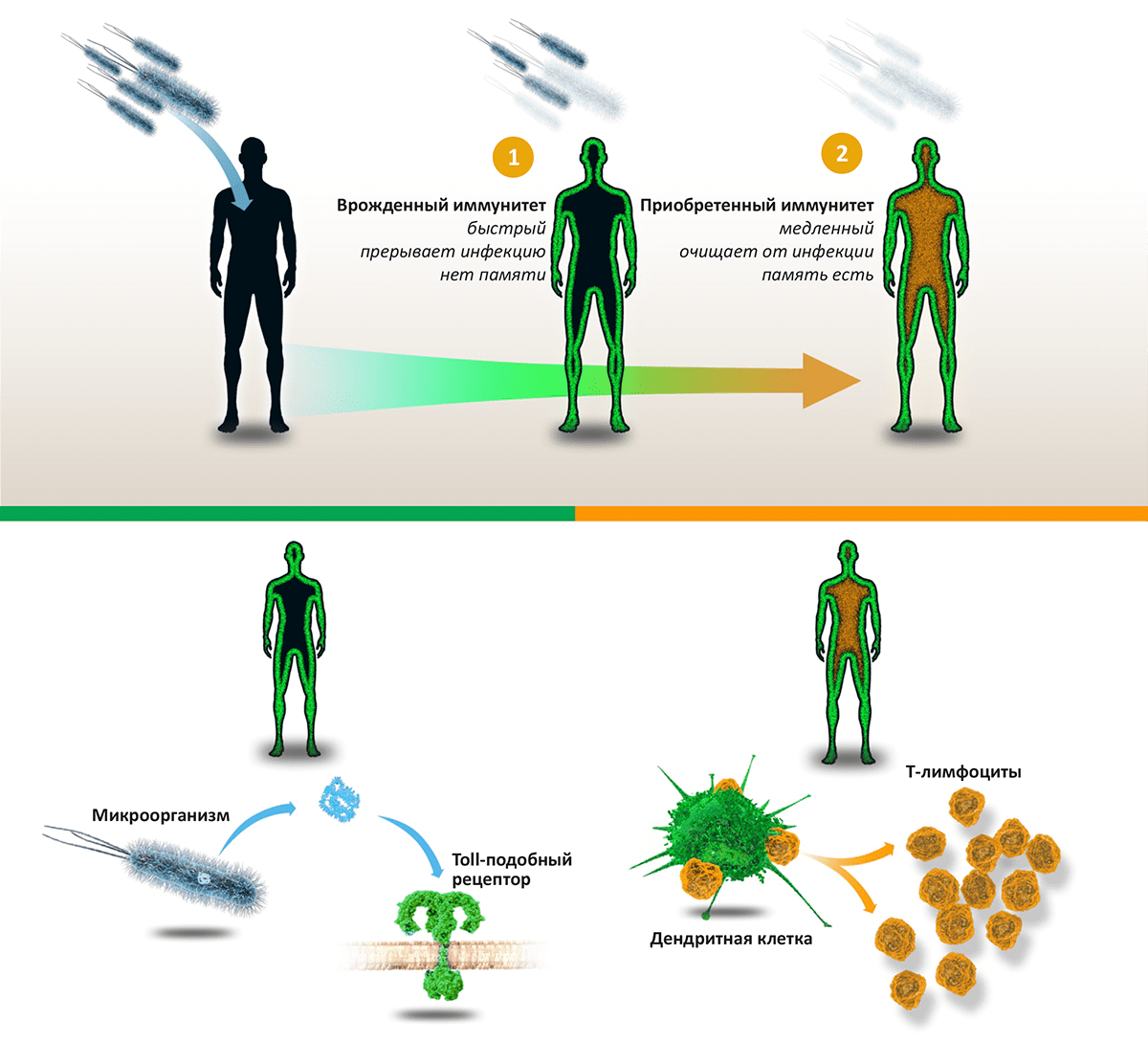
Рисунок 1. Схема работы иммунитета. Проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует «две линии» иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Врожденный иммунитет: компоненты микроорганизмов, такие как липополисахарид, связываются с Toll-подобными рецепторами, находящимися на поверхности многих клеток организма. Это запускает врожденный иммунитет, активирующий воспалительную реакцию и уничтожающий «захватчиков». Приобретенный иммунитет: Дендритные клетки активируют T-лимфоциты, лежащие в основе каскада иммунных реакций, приводящих к синтезу антител и уничтожению патогенов и зараженных клеток.
Новый игрок в команде адаптивного иммунитета
Еще в 1973 году Ральф Стайнман открыл новый тип клеток иммунитета с длинными отростками, названный им дендритными клетками. Его предположение было — что эти клетки активируют T-лимфоциты, играющие ключевую роль в приобретенном иммунитете и иммунной памяти. Это предположение блестяще подтвердилось в клеточных экспериментах, где добавление дендритных клеток к популяции Т-лимфоцитов способствовало формированию иммунитета [3–5].
Дальнейшие работы Стайнмана и других исследователей были направлены на то, чтобы понять, как приобретенный иммунитет определяет, — надо ли реагировать на то или иное вещество, или можно этого не делать. Обнаружилось, что дендритные клетки воспринимают сигналы от системы врожденного иммунитета, и это управляет их способностью активировать T-клетки. Это позволяет нашему иммунитету прицельно бороться с патогенными микроорганизмами, «не обращая внимания» на молекулы нашего собственного тела.
Фундаментальные науки — медицине
Достижения нобелевских лауреатов 2011 года пролили свет на подробности работы систем врожденного и приобретенного иммунитета. Это знание легло в основу создания новых стратегий лечения многих болезней, — например, новых вакцин против инфекций и попыток «натравить» собственную иммунную систему на раковые опухоли. В дополнение к этому, стало понятно, почему организм иногда начинает атаковать свои собственные ткани, что приводит к воспалительным и аутоиммунным заболеваниям.
Горькая ирония
Как известно, Нобелевская премия не вручается посмертно. Однако этот год стал исключением: 30 сентября после продолжительной борьбы с раковой опухолью скончался Ральф Стайнман, — буквально за несколько дней до объявления лауреатов премии. Нобелевский комитет не знал об этом, и обнародовал свое решение 3 октября. Несмотря на этот печальный казус, решение менять не будут. Работы Стайнмана легли в основу терапии дендритными клетками — перспективного способа лечения воспалительных и онкологических заболеваний. К сожалению, самому ему оказалось суждено стать жертвой такого заболевания [6], [7].
И снова мимо!..
Сегодня интернет пестрит сообщениями, что опять — в который уже раз! — Нобелевский комитет обошел своим решением российских ученых. Речь идет о российском эмигранте Руслане Меджитове [8], который, вместе со своим (ныне уже покойным) учителем Чарльзом Дженуэем показал, что и у людей существуют Toll-подобные рецепторы [9]. Если бы Дженуэй был жив, то, скорее всего, именно он был бы третьим лауреатом премии (вместо Стайнмана), а сама премия была бы конкретно за врожденный иммунитет.
По материалам пресс-релиза Нобелевского комитета [10].
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- A. Poltorak. (1998). Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene. Science. 282, 2085-2088;
- R. M. Steinman. (1973). IDENTIFICATION OF A NOVEL CELL TYPE IN PERIPHERAL LYMPHOID ORGANS OF MICE: I. MORPHOLOGY, QUANTITATION, TISSUE DISTRIBUTION. Journal of Experimental Medicine. 137, 1142-1162;
- R. M. Steinman, M. D. Witmer. (1978). Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice.. Proceedings of the National Academy of Sciences. 75, 5132-5136;
- G. Schuler. (1985). Murine epidermal Langerhans cells mature into potent immunostimulatory dendritic cells in vitro. Journal of Experimental Medicine. 161, 526-546;
- Нобелевскую премию присудили только что умершему от рака ученому. Но другого выбирать уже не будут. (2011). NewsRu;
- Воронин Е. (2011). Ральф Стайнман. shvarz.livejournal.com;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- The Nobel Prize in Physiology or Medicine 2011. (2011). The Nobel Prize.
Источник
В нынешнем году Нобелевская премия по физиологии и медицине присуждена Брюсу Бойтлеру и Жюлю Хоффманну за открытие механизмов активации врождённого иммунитета, и Ральфу Штайнману за открытие дендритных клеток и их роли в активации адаптивного иммунитета. Эти исследования называют революционными, поскольку открытие врождённого иммунитета в корне изменило представление о функционировании иммунной системы.
Брюс Бойтлер, Исследовательский институт Скриппса (США). Фото: www.nobelprize.org.
Жюль Хоффманн, Институт молекулярной и клеточной биологии, CNRS (Франция). Фото: www.nobelprize.org.
Ральф Штайнман, Рокфеллеровский университет (США). Фото: www.nobelprize.org.
Дендритные клетки как бы показывают T-клеткам их «врагов».
‹
›
Иммунитет. Это слово давно и прочно заняло своё место в лексиконе современного человека. Чаще всего под иммунитетом понимают способность организма защищаться от опасных вирусов, бактерий, грибков или других паразитов. Но что это за механизм и как, собственно, осуществляется эта защита, понимают лишь немногие специалисты. Механизм и вправду очень сложный. Нобелевские лауреаты этого года вскрыли лишь некоторые ключевые моменты «первой линии обороны» — системы врождённого иммунитета.
В природе существуют две линии защиты, два вида иммунитета. Первая и самая древняя — система врождённого иммунитета, которая нацелена на разрушение клеточной мембраны чужеродной клетки. Она присуща всем живым существам — от дрозофилы до человека. Если всё же какой-либо белковой молекуле-чужаку удалось прорваться сквозь «первую линию обороны», с ней расправляется «вторая линия» — адаптивный, или приобретённый, иммунитет.
Адаптивный иммунитет — это высшая форма защиты, которая присуща только позвоночным. Механизм приобретённого иммунитета очень тонко настроен и специфичен. Вкратце: при попадании в организм чужеродной белковой молекулы белые кровяные клетки (лейкоциты) начинают производить антитела — на каждый белок (антиген) вырабатывается своё определённое антитело. Сначала активируются так называемые T-клетки (T-лимфоциты), которые начинают производить активные вещества цитокины, запускающие синтез антител B-клетками (B-лимфоциты). Сила или слабость иммунной системы обычно оценивается по количеству именно B- и T-клеток, настолько они важны для защиты организма. Взаимодействие антиген — антитело очень сильное и очень специфическое. Когда антитела «садятся» на белки-антигены, находящиеся на поверхности вируса или бактерии, развитие инфекции в организме блокируется.
Процесс выработки антител запускается не сразу, у него есть определённый инкубационный период, зависящий от типа патогена. Зато, если уж процесс активации пошёл, как только та же самая инфекция попытается проникнуть в организм ещё раз, B-клетки моментально отреагируют выработкой антител, и инфекция будет уничтожена немедленно, не причинив никакого вреда. Именно поэтому на некоторые виды инфекций у человека вырабатывается иммунитет на всю оставшуюся жизнь.
А вот система врождённого иммунитета неспецифична и не обладает «долгосрочной памятью», поскольку реагирует на некие молекулярные структуры, присущие всем патогенным микроорганизмам. Эти структуры получили название «патоген-ассоциированные молекулярные образы» (pathogen-associated molecular patterns — PAMP). Такими PAMP служат молекулы, входящие в состав клеточной мембраны бактерий. Несмотря на химические различия, все эти структуры обладают следующими свойствами: они синтезируются только микроорганизмами (в клетках животных их нет, поэтому распознавание PAMP расценивается иммунной системой как сигнал к началу борьбы с чужаком); они характерны для целого ряда патогенов, а не только для одного; эти структуры являются важными для жизнедеятельности бактерии, поэтому в процессе эволюции они меняются очень медленно (иначе иммунная система просто не успевала бы настраивать распознавание). Если бактерии удаётся прорвать «первую линию обороны» и избежать уничтожения макрофагами или гранулоцитами, то в борьбу должна включиться система приобретённого иммунитета.
Каким образом система врождённого иммунитета подаёт знак системе приобретённого иммунитета на выработку специфических антител? Вот за решение этого ключевого вопроса иммунологии и присуждена Нобелевская премия 2011 года.
В 1973 году Ральф Штайнман открыл новый вид клеток, которые назвал дендритными, поскольку внешне они напоминали дендриты нейронов. Клетки обнаружились во всех тканях организма, которые соприкасались с внешней средой: в коже, лёгких, слизистой оболочке желудочно-кишечного тракта. Сначала исследователь предположил (в ту пору это вызвало скептицизм многих учёных), а затем и доказал, что дендритные клетки служат посредниками между врождённым и приобретённым иммунитетом. То есть «первая линия обороны» подаёт через них сигнал, который активирует T-клетки и запускает каскад выработки антител B-клетками.
Как оказалось позже, дендритные клетки (так же как и макрофаги и эпителиальные клетки) имеют на клеточной поверхности специальные белковые комплексы — рецепторы. Гены, кодирующие эти рецепторы, аналогичны Toll-генам плодовой мушки дрозофилы (от нем. toll — сногсшибательный, безумный), играющим ключевую роль в эмбриогенезе. В 1996 году Жюль Хоффманн обнаружил, что у мушек с «выключенным» Toll-геном полностью отсутствовал иммунитет и они погибали от любой грибковой инфекции. Хоффманн предположил, что ген Toll важен не только для развития эмбриона, он ещё играет ключевую роль в иммунной системе. Как оказалось, этот ген кодирует специальные рецепторы, распознающие молекулы в структуре мембран бактериальных патогенов (PAMP), посылая биохимический сигнал на устранение «чужака». Их назвали «Toll-подобные рецепторы» (англ. Toll-like).
При взаимодействии РАМР с Toll-подобным рецептором на поверхности дендритной клетки появляются белки-антигены, которые и запускают адаптивный иммунный ответ T-клеток. У человека обнаружен десяток таких Toll-подобных рецепторов. Некоторые из них находятся на поверхности клеток, другие «плавают» в клеточной цитоплазме. Конечным результатом взаимодействия PAMP с этими рецепторами является активация T-клеток. На клеточном уровне происходит активация фагоцитов: они начинают продуцировать активные формы кислорода, а следовательно, более интенсивно переваривать «обрывки» клеточных стенок чужеродных бактерий.
В 1998 году Брюс Бойтлер изучал рецепторы бактериальных липополисахаридов (LPS) — молекул, в которых липид и сахар «сшиты» между собой. LPS — очень активные в иммунологическом отношении молекулы, они не просто стимулируют, а «суперстимулируют» иммунитет, в определённых условиях вызывая септический шок. Бойтлер пытался найти ген, отвечающий за эффекты LPS, и обнаружил, что мыши, нечувствительные к LPS, имеют мутацию в гене, очень похожем на Toll-ген мушки-дрозофилы. Toll-подобный рецептор случайно оказался тем самым неуловимым LPS-рецептором, то есть LPS взаимодействует с Toll-подобным рецептором, приводя к активации воспалительных процессов, вплоть до септического шока. Так выяснилось, что у мушек и мышей есть один и тот же механизм защиты от инфекции. «Зловредными» компонентами мембраны клеточных бактерий, которые и вызывали реакцию врождённого иммунитета, оказались липополисахариды — компоненты клеточной стенки грамотрицательных бактерий.
Открытие врождённого иммунитета привело к появлению новых подходов в профилактике и лечении заболеваний, в разработке новых вакцин и противоопухолевых препаратов.
Источник
Активация врожденного иммунитета. Стадия активации врожденного иммунитетаВрожденная иммунная защита первично нацелена на распознавание и элиминацию чужеродных структур. Инфекционные агенты располагают многими факторами вирулентности, воздействие которых может быть разрушительным для защитных механизмов врожденного иммунитета. Организм хозяина выработал уникальные стратегии распознавания патогенных структур микроорганизмов, процессинга их и презентации антигенов Т-лимфоцитам. Активация врожденного иммунитета, обеспечивающая оптимальное развитие специализированных эффекторных механизмов, может быть концептуально разделена на две стадии: 1 — фаза детекции, в течение которой комбинация поверхностных рецепторов распознает присутствие чужеродных структур при вторжении микрорганизмов, и 2 — фаза трансмиссии этой сенсорной информации на язык, понятный для клеток адаптивной иммунной системы, например, через продукцию хемокинов и цитокинов. Универсальная стратегия распознавания микроорганизмов эффекторами врожденного иммунитета основана на детекции доменных структур, которые называются патоген-ассоциированными молекулярными образами — PAMPs (pathogen-associated mollecular patterns), а распознающие их рецепторы врожденной иммунной системы — образраспознающими рецепторами — PRRs (pattern-recognition receptors). PAMPs — консервативные (неспецифические, невариабельные) структуры микроорганизмов общие для разных патогенов, их нет у млекопитающих, поэтому они распознаются иммунной системой как «чужое» с помощью паттерн-распознающих рецепторов (PRRs), включая семейство сигнальных Toll-подобных рецепторов (TRL). Существуют еще и альтернативные рецепторы врожденного иммунитета, такие как нуклеотид-связывающий олигомеризующийся домен (nucleotide-binding oligomerization domain — NOD), локализующийся внутриклеточно. NOD распознают РАМР независимо от участия TLR, активируют ядерный фактор KB (NF-kB) и усиливают продукцию IFN-y.
Эти эволюционно законсервированные рецепторы распознают PAMPs, включающие различные компоненты бактериальной стенки, среди которых наиболее известные — это липополисахариды, пептидогликан, липотейхоевые кислоты, маннаны, флагеллин, бактериальная ДНК, вирусные двуспиральные РНК, глюканы. До недавнего времени рассматривалось, что PAMPs обычно экспрессируются на поверхностях микробов и отсутствуют на клетках организма хозяина, однако в последнее время появляются работы, демонстрирующие наличие паттернов хозяина, распознаваемых рецепторами этого класса. В настоящее время известно два типа рецепторов врожденного иммунитета, обеспечивающих информирование организма о проникновении патогена. К первому типу относятся растворимые рецепторы для патогенов: C1q комплемента, ЛПС-связывающий белок, маннозосвязывающий лектин, С-рективный белок. Второй тип рецепторов для патогенов — рецепторы, экспрессирующиеся клетками врожденного иммунитета. Закодированные в геноме, рецепторы врожденной иммунной системы имеют ряд отличий от рецепторов лимфоцитов. Они экспресси-руются на эффекторных клетках врожденной иммунной системы, осуществляющих первую линию защиты, а также на профессиональных антигенпрезентирующих клетках (макрофагах, дендритных клетках и В-лимфоцитах). — Также рекомендуем «Варианты образраспознающих рецепторов PRRs. Toll-подобные рецепторы» Оглавление темы «Врожденный иммунитет»:
|
Источник
