Эффекторами клеточного иммунитета являются
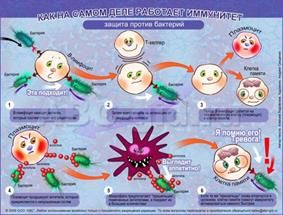
Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
При попадании в организм человека «клетки-агрессора», иммунная система распознаёт чужеродные и собственные измененные макромолекулы (антигены) и удаляет их из организма. Также при первичном контакте с новыми антигенами происходит их запоминание, что способствует их более быстрому удалению, в случае вторичного попадания в организм.
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов. Это клетки иммунной системы, являющиеся
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
- В-клетки (распознающие «агрессора» и вырабатывающие к нему антитела);
- Т-клетки (выполняющие функцию регулятора клеточного иммунитета);
- NК- клетки (разрушающие отмеченные антителами чужеродные структуры).
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
Справочно. Важной особенностью T-клеток является их способность реагировать только на презентированные антигены. На одном T-лимфоците находится только один рецептор к одному конкретному антигену. Это обеспечивает отсутствие реакции T-клеток на собственные аутоантигены организма.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
Около половины Т-лимфоцитов имеют антиген CD4, то есть являются Т-хелперами. Это помощники, стимулирующие процесс секреции антител В-лимфоцитами, стимулируют работу моноцитов, тучных клеток и предшественников Т-киллеров к «включению» в иммунную реакцию.
Справочно. Функция хелперов осуществляется за счёт синтеза цитокинов (информационных молекул, регулирующих взаимодействие между клетками).
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Важно. Нарушение работы клеток-помощников, а именно недостаточность их функции, наблюдается у больных с приобретённым иммунодефицитом. Т-хелперы являются основной мишенью ВИЧ. В результате их гибели нарушается иммунная реакция организма на стимуляцию антигенов, что приводит к развитию тяжёлых инфекций, росту онкологических новообразований и летальному исходу.
Т-киллеры
Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
После лизирования клетки «агрессора» Т-киллеры остаются жизнеспособными и продолжают циркулировать в крови, разрушая чужеродные антигены.
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Справочно. Помимо обеспечения реакций нормального иммунного ответа, Т-эффекторы могут участвовать в реакциях антителозависимой клеточной цитотоксичности, способствуя развитию гиперчувствительности второго типа (цитотоксической).
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Важно. Препараты с цитотоксическим действием используют в химиотерапии онкологических заболеваний.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Т-супрессоры и клетки памяти
Супрессоры подавляют функцию хелперов и В-лимфоцитарного звена. Однако современная классификация не выносит супрессоры в отдельную субпопуляцию. Поскольку доказано, что решающую роль в угнетении иммунной реакции играют апоптоз и специфические цитокины.
Помимо основных T-лимфоцитов, в организме человека существуют потомки клеток, контактировавших с антигеном и имеющих к нему рецепторы. Это клетки обеспечивающие иммунологическую память. Они способны в течение от десяти до 15 лет сохранять память об антигене, передавая её другим клеткам.
Справочно. Благодаря клеткам памяти обеспечивается быстрый иммунный ответ при повторном попадании «агрессора» в организм.
Нулевые лимфоциты
К ним относят лимфоциты, не имеющие T и B маркеров. Они составляют до 10% от всей популяции лимфоцитов. К ним относят NК-клетки (естественные киллеры) и K-клетки (киллерные).
Справочно. Основным отличием NK-клеток от T-киллеров является способность уничтожать не сенсибиллизированные клетки-мишени.
K-клетки отвечают за антителозависимую клеточную цитотоксичность. Они отражают взаимодействия гуморального и клеточного звеньев иммунитета, а также выступают в качестве «наводчиков» эффекторных (выполняющих функцию – в данном случае уничтожение) клеток на мишень.
NК- клетки обеспечивают контроль за качеством клеток и участвуют в формировании противовирусного иммунитета, обеспечиваютзащиту от роста опухолей и размножения мутировавших (дефектных) клеток.
Диагностика клеточного иммунитета
Диагностика T- и B-лимфоцитарного звена позволяет оценить состояние клеточного иммунитета. Базовое исследование с определением процентного содержания Т-, В- и нулевых клеток проводится с целью выявления первичных или вторичных иммунодефицитов, а также при контроле иммуностимулирующего лечения.
Исследование основных популяций при помощи маркеров CD3, 8, 19, 16+5б, а также соотношение между хелперами и киллерами, позволяет комплексно оценить иммунный статус. Для исследования используют венозную кровь.
Диагностика проводится при выявлении и контроле течения:
- аутоиммунных заболеваний (увеличено содержание CD3, CD4 хелперов);
- лимфолейкозов (повышено количество Т-лимфоцитов CD3);
- злокачественных новообразований (увеличено количество NK);
- ВИЧ (CD3, CD8);
- хронических инфекций, аллергических реакций, бронхиальной астмы и т.д.
Справочно. В зависимости от результатов анализа пациенту может быть рекомендована консультация иммунолога, гематолога, аллерголога, онколога или инфекциониста. С дальнейшим лечением у профильного специалиста по основному заболеванию.
Источник
Лекция 8
Клеточный иммунитет – это иммунитет, опосредованный клетками.
Клеточный иммунитет является основным способом защиты организма от:
1) внутриклеточных бактерий, вирусов, грибов;
2) чужеродных клеток и тканей, измененных своих клеток.
Клеточный иммунитет является основой трансплантационного и противоопухолевого иммунитета. Реакции клеточного иммунитета лежат в основе аллергий IV типа и ряда аутоиммунных заболеваний.
Клеточный иммунитет может быть перенесен в другой организм с помощью сенсибилизированных лимфоцитов.
Основными эффекторами клеточного иммунитета являются Т-цитотоксические лимфоциты. Помимо цитотоксических Т- лимфоцитов, в развитии и реализации клеточной формы защиты организма принимают участие НК-клетки и макрофаги (К-клетки).
Защитное действие клеточных иммунных реакций проявляется:
– в цитотоксическом действии иммунокомпетентных клеток на клетки-мишени (в киллинге клеток, инфицированных вирусом, чужеродных, опухолевых клеток или отторжении трансплантата);
– во внутриклеточном переваривании бактерий (внутриклеточном киллинге).
1. В цитотоксическом разрушении клеток-мишеней (клеток, инфицированных вирусом, опухолевых и аллогенных клеток) принимают участие Т-киллеры, НК-клетки, макрофаги (К-клетки), которые используют следующие механизмы (Рис 12-1.).
Р и с. 12-1. Механизмы цитотоксического разрушения клеток-мишеней в клеточных иммунных реакциях.
Т-лимфоциты (СD8+- клетки) и НК-клетки (СD16+- клетки) цитолиз клеток-мишеней вызывают посредством продукции перфоринов и фрагментинов. Механизм цитолиза приведен на рис.12-5, 12-6.
Распознавание ими клеток-мишеней и чужеродных антигенов не связано с представлением антигенных пептидов молекулами ГКГ. В отличие от цитотоксических Т-лимфоцитов, развитие цитотоксичности в ряду НК-клеток не требует их пролиферации и дифференцировки. НК-клеточная активность не повышается при вторичном иммунном ответе; в ряду НК-клеток не формируются клетки «иммунной памяти». Цитотоксическая активность НК-клеток усиливается под влиянием ИЛ-2, ИНФa, ИНФb, ИЛ-12, ИЛ-15. НК-клетки способны без предварительной сенсибилизации, при первой встрече вызывать лизис клеток-мишеней (оказывать прямое цитотоксическое действие). Механизм цитотоксического действия НК-клеток на клетки-мишени аналогичен тому, который используют Т-киллеры. Они, как и Т-лимфоциты, продуцируют перфорины, фрагментины и несут мембрано-связанные Fas лиганды.
Р и с. 12-5. Экзоцитоз перфоринов Т-киллером и образованние поры в мембране клетки-мишени.
Р и с 12-6. Пути индукции апоптоза клеток-мишеней Т-киллерами.
Макрофаги, К-клетки цитолиз клеток-мишеней вызывают через развитие реакции АЗКЦ. Механизм цитотоксического действия приведен на рис.12-7.
Р и с. 12-7. Антитело-зависимая клеточная цитотоксичность.
2. Клеточные иммунные реакции являются основным способом защиты организма от внутриклеточных бактерий. Переваривание бактерий, для которых основной «средой обитания» являются макрофаги, происходит в результате активации инфицированных клеток факторами (секреторным ИНФ-g и мембранным ФНОa), которые продуцируются стимулированными антигеном Т-клетками воспаления. Механизм такого процесса приведен на рисунке 12-8.
Р и с. 12-8. Механизм активации инфицированных макрофагов Т-лимфоцитами.
В результате распознавания иммуногенного комплекса на инфицированных макрофагах CD4+ Т-клетки воспаления активизируются, и экспрессируют на своей поверхности ФНОa и усиливают продукцию ИНФg. Совместное действие этих цитокинов приводит к кислородному взрыву в макрофагах и активному накоплению в них веществ с бактерицидной активностью. Кроме того, в активированных макрофагах усиливается экспресссия молекул ГКГ 2 класса и рецептора ФНОa, что обеспечивает дополнительное вовлечение наивных Т-клеток воспаления в иммунный процесс.
Источник
-лимфоциты(Т, B, NK)
-моноциты
-макрофаги
-нейтрофилы
-эозинофилы
-базофилы(тучные) клетки
Клеточн факторы врожденного иммунитета: Нейтрофилы и Макрофаги(моноциты)-«профессиональные» фагоциты.
Для уничтожения:
1. Кислороднонезависимый мех-м(гидролитические ферм)
2. Кислородзависимый(«кислородн» взрыв с обр н2о2 и аниона о2-, гипохлорида-для киллинга)
3. NO (и производные) после дополн активац с помощью Т-хелперов.
Продукция и секреция:
+Вещ-ва для уничтожения прод вне клетки
+Сигнальные вещ-ва (цитокинов и тд…)
МОНОЦИТЫ и МАКРОФАГИ – Антигенпредставл кл (АПК)
Представляют антигены-презентац антигенов в компл с МНС (главн комп гистосовместим) Т-клетками.
ДЕНДРИТНЫЕ кл-с отростками.
— захват, затем процессинг антигена
— презентац антигенов Т-лимфоцитам (гл АПК)
— костимулирующие сигналы Т-лимф
— др. функц-регуляц созревания Т-лимф в тимусе
БАЗОФИЛЫ(тучн кл) – Синтез и секреция медиаторов воспаления(гистамин, простагландин, гепарин…) Вызыв аллергич реакц, несут на поверхн рецепторы к иммуноглобулинам Е и Fe
ЭОЗИНОФИЛЫ – антителзависимое цитотоксическое вещ-во(действ в отношении личинок гельминтов) Уч в аллергич реакции, несут рецепторы к иммуноглобулинам Е и Fe
NK-клетки (норм киллеры)-лимфоциты. Уничтожают кл опухолей и инфицированные вирусами. Цитотоксич действие-без апоптоза в отлич от Т и В лимфоцитов. Не имеют антиген спецефич рецепторов. Убивают кл, лишившиеся MHCl. Проявл антителзависимую кл цитотоксичность (связ «хвост» антитела с помощбю Fe рец и убивают кл с кот это антитело взаимодействует).
73. Т-лимфоциты – клеточные факторы приобретенного клеточного иммунитета.
Термин клеточный иммунитет используется для описания такого противоинфекционного или противоопухолевого иммунного ответа, в котором антителам принадлежит не ведущая, а вспомогательная роль.
Основу клеточного иммунитета составляют лимфоциты, которые для своего созревания переселяются из костного мозга в другой центральный орган лимфоидной системы — тимус (вилочковая железа). Эта ветвь лимфоцитов получила название тимус-зависимые, или Т-лимфоциты.
Т-лимфоциты выполняют следующие функции:
– являются основными эффекторами клеточного иммунитета (эти клетки опосредуют клеточные цитотоксические реакции, а также реакции ГЗТ);
– являются регуляторами воспаления, иммунных реакций и гемопоэза;
– участвуют в процессах репаративной и физиологической регенерации различных тканей.
В организме человека Т-лимфоциты многократно покидают лимфоидные органы, попадая сначала в лимфу, затем в кровь, а из крови снова возвращаются в органы. За свою жизнь лимфоцит может проходить более 100 километров. Благодаря интенсивной циркуляции, лимфоциты, когда в них возникает потребность, быстро появляются в «горячих точках».
В тимусе формируются разные виды Т-клеток.
1.некоторые Т-лимфоциты обладают способностью разрушать клетки, содержащие чужеродный антиген, их назвали цитотоксическими или «киллерами«.
2.другая разновидность лимфоцитов —Т-хелперы — первыми распознают чужеродные вещества. Т-хелперы не способны вырабатывать антитела и убивать клетки-мишени, но, распознавая чужеродный антиген, они реагируют на него выработкой различных факторов, которые необходимы для размножения и созревания В-клеток и Т-киллеров. Именно Т-хелперы распознают антигены и влияют на деятельность других типов Т-клеток, оказывают помощь В-клеткам в образовании антител. По их командам иммунная система направляет Т-лимфоцитов-киллеров, задача которых убивать зараженные клетки.
3.существуют еще Т-супрессоры, которые подавляют активность иммунного ответа, когда необходимость в нем отпадает. Если иммунные клетки будут продолжать работать, то будут поражаться собственные здоровые клетки организма, что приведет к развитию различных болезней (их называют аутоиммунными).
74. В-лимфоциты – клеточные факторы приобретенного гуморального иммунитета.
Приобретенный иммунитет:
• Т и В лимфоц
• MHC (у чел HLA)
• Антитела
• Клеточный и Гуморальный иммунный ответ
В-лимфоциты-гуморальный иммун. Распознание нерасщепл антигенов. Наивные В-лимф. Плазматические В-кл памяти-вторичный иммунитет.
Отличия Т— и В-лимфоцитов:
— по месту антигеннезависим дифференц: Т-лимфоциты в тимусе, В-лимфоциты в лимфоидной ткани других органов.
— по выполняемым функциям: Т-лимфоциты обеспечивают преимущественно клеточный иммунитет, В-лимфоциты – гуморальный иммунитет. Функционально Т— и В-клетки делят на субпопуляции. Среди Т-лимфоцитов выделяют Тх (хелперы) – активируют эффекторные клетки, Тк (киллеры) – эффекторные цитотоксические клетки, Тс (супрессоры) – подавляют иммунный ответ, Т-лимфоциты памяти.
В-лимфоциты дифференцируются в плазматические клетки, вырабатывающие иммуноглобулины (антитела) и в клетки памяти, несущие информацию о встрече с каким- либо антигеном.
— по содержанию в крови: Т-лимфоцитов – 70-80%, В-лимфоцитов — 10-20%.
Функция лимфоцитов:
1) участие и обеспечение иммунных реакций.

В-лимфоциты проходят предварительную обработку в печени и костном мозге.
Существуют два важных различия между В- и Т-лимфоцитами.
— Во-первых, В-лимфоциты активно секретируют реактивные агенты, называемые антителами, в отличие от Т-лимфоцитов, реагирующих с антигеном непосредственно. Антитела — это крупные белковые молекулы, способные соединяться с антигенной субстанцией и разрушать ее.
— Во-вторых, разнообразие В-лимфоцитов выражено больше, чем у Т-лимфоцитов, т.е. формируются миллионы типов В-лимфоцитарных антител с разными специфическими реактивностями.

Источник
клеточным или гуморальным. Клеточный иммунитет обеспечивают иммунокомпетентные Т-лимфоциты, которые образуются из стволовых клеток, мигрирующих из красного костного мозга, в тимуса. Попадая в кровь, Т-лимфоциты создают большую часть лимфоцитов самой крови (до 80%), а также оседают в периферических органах иммуногенеза (прежде всего в лимфатических узлах и селезенке), образуя в них тимус-зависимые зоны, которые становятся активными точками пролиферации (размножения) Т-лимфоцитов вне тимуса. Дифференциация Т-лимфоцитов происходит в трех направлениях. Первая группа дочерних клеток способна при встрече с «чужим» белком-антигеном (возбудителем болезни, или собственным мутантом) вступать с ним в реакцию и уничтожать его. Такие лимфоциты называются Т-киллераш («убийцами») и характеризуются тем, что способны собственными силами, без предварительной иммунизации и без подключения антител и защитного комплемента плазмы крови (толкование этих понятий см. далее), осуществлять лизис (уничтожение путем растворения клеточных мембран и н Связывание белков) клеток-мишеней (носителей антигенов). Таким образом, Т-киллеры является отдельной ветвью дифференциации стволовых клеток (хотя их развитие, как будет описано далее, регулируемый Г-хелперов) и предназначены создавать как бы первичный барьер в противовирусном и противоопухолевый иммунитет организма.
Другие две популяции Т-лимфоцитов называются Т-хелперы и Т-супрессоры и осуществляют клеточный иммунный защиту через регуляцию уровня функционирования Т-лимфоцитов в системе гуморального иммунитета. Т-хелперы («помощники») в случае появления в организме антигенов способствуют быстрому размножению эффекторных клеток (исполнителей иммунной защиты). Различают два подтипа клеток хелперов: Т-хелперы-1, выделяющие специфические интерлейкины типа 1Л2 (гормоноподобные молекулы) и в-интерферон и связаны с клеточным иммунитетом (способствуют развитию Т-хелперов) Т-хелперы-2 выделяют интерлейкины типа ИЛ 4-1Л 5 и взаимодействуют преимущественно с Т-лимфоцитами гуморального иммунитета. Т-супрессоры способны регулировать активность В и Т-лимфоцитов в ответ на антигены.
Гуморальный иммунитет
Гуморальный иммунитет обеспечивают лимфоциты, которые дифференцируются из стволовых клеток мозга не в тимуса, а в других местах (в тонкой кишке, лимфатических узлах, глоточных миндалинах и т. д.) и называются В-лимфоцитами. Такие клетки составляют до 15% всех лейкоцитов. При первом контакте с антигеном чувствительны к нему Т-лимфоциты интенсивно размножаются. Некоторые из дочерних клеток дифференцируют в клетки иммунологической памяти и на уровне лимфоузлов в £-зонах превращаются в плазматические клетки, далее способны создавать гуморальные антитела. Способствуют этим процессам Т-хелперы. Антитела представляют собой большие протеиновые молекулы, имеющие специфическое родство к тому или иному антигену (на основе химической структуры соответствующего антигена) и называются иммуноглобулинов. Каждая молекула иммуноглобулина составлена из двух тяжелых и двух легких цепей связанных друг с другом дисульфидных связей и способных активизировать клеточные мембраны антигенов и присоединять к ним комплемент плазмы крови (содержит 11 протеинов, способных обеспечивать лизис или растворения клеточных мембран и свя Связывание белков клеток-антигенов). Комплемент плазмы крови имеет два пути активизации: классический (от иммуноглобулинов) и альтернативный (от эндотоксинов или ядовитых веществ и от лекарств). Выделяют 5 классов иммуноглобулинов (lg): G, A, M, D, E, различающихся по функциональным особенностям. Так, например, lg М привычно первым включается в иммунный ответ на антиген, активизирует комплемент и способствует поглощению этого антигена макрофагами или лизису клетки; lg А размещается в городах наиболее вероятного проникновения антигенов (лимфоузлах желудочно-кишечного тракта, в слезных, слюнных и потовых железах, в аденоидах, в молоке матери и т. д.) чем создает прочный защитный барьер, способствуя фагоцитозу антигенов; lg D способствует пролиферации (размножению) лимфоцитов при инфекциях, Т-лимфоциты «распознают» антигены при помощи включенных в мембрану гаммаглобулина, образующих антитело, связывая звена, конфигурация которых соответствует трехмерной структуре антигенных детерминированных групп (гаптенов или низкомолекулярных веществ, которые могут связываться с белками антитела, передючы им свойства белков антигена), как ключ соответствует замку (Г. Вильям, 2002; Г. Ульмер и др.., 1986). Активированные антигеном В-и Т-лимфоциты быстро размножаются, включаются в процессы защиты организма и массово погибают. В то же время не многие из активированных лимфоцитов превращаются в В-и Т-клетки памяти, которые имеют длительный срок жизни и при повторном инфицировании организма (сенсибилизации) В-и Т-клетки памяти «вспоминают» и распознают структуру антигенов и быстро превращаются в эффекторные (активные) клетки и стимулируют клетки плазмы лимфоузлов на изготовление соответствующих антител.
Повторные контакты с определенными антигенами могут иногда давать гиперергични реакции, сопровождающиеся повышенной проницательностью капилляров, усилением кровообращения, зудом, бронхоспазм и т. п.. Такие явления называются аллергическим реакциям.
Неспецифический иммунитет, обусловленный наличием в крови «естественных» антител, которые часто возникают при контакте организма с кишечной флорой. Насчитывают 9 веществ, которые вместе образуют защитный комплемент. Одни из таких веществ способны нейтрализовать вирусы (лизоцим), вторые (С-реактивный белок) подавляют жизнедеятельность микробов, третьи (интерферон) уничтожают вирусы и подавляют размножение собственных клеток в опухолях и др.. Неспецифический иммунитет обусловливают также специальные клетки-нейтрофилы и макрофаги, способные к фагоцитозу, т. е. к уничтожению (переваривания) чужеродных клеток.
Специфический и неспецифический иммунитет подразделяется на врожденный (передастся от матери), и приобретенный, который образуется после перенесенной болезни в процессе жизни.
Кроме этого существует возможность искусственной иммунизации организма, которая проводится либо в форме вакцинации (когда в организм вводят ослабленный возбудитель болезни и этим вызывают активизацию защитных сил что до образования соответствующих антител), либо в виде пассивной иммунизации, когда делают так называемое прививки против определенной болезни путем введение сыворотки (плазмы крови не содержащая фибриногена, или фактора ее свертывания, а зато имеет готовые антитела против определенного антигена). Такие прививки делают, например, против бешенства, после укусов ядовитых животных и так далее.
Как свидетельствует В. И. Бобрицкая (2004) у новорожденного ребенка в крови насчитывается до 20 тыс. всех форм лейкоцитов в 1 мм3 крови и в первые дни жизни их количество растет, даже, до 30 тыс. в 1 мм3, что связано с рассасыванием продуктов распада кровоизлияний в ткани ребенка, которые обычно происходят при рождении. Через 7-12 первых дней жизни количество лейкоцитов снижается до 10-12 тыс. в I мм3, что и сохраняется в течение первого года жизни ребенка. Далее количество лейкоцитов постепенно уменьшается и в 13-15 лет устанавливается на уровне взрослых (4-8 тыс. в 1 мм 3 крови). У детей первых лет жизни (до 7 лет) среди лейкоцитов преувеличивают лимфоциты и только в 5-6 лет их соотношение выравнивается. К тому же дети до 6-7 лет имеют большое количество незрелых нейтрофилов (юных, палочки — ядерных), что и обуславливает относительно низкие защитные силы организма детей младшего возраста против инфекционных заболеваний. Соотношение различных форм лейкоцитов в составе крови называется лейкоцитарной формулой. С возрастом у детей лейкоцитарная формула (табл. 9) значительно меняется: растет число нейтрофилах тогда как процент лимфоцитов и моноцитов уменьшается. В 16-17 лет лейкоцитарная формула принимает состав, характерный для взрослых.
Инвазия организма всегда приводит к возникновению воспаления. Острое воспаление обычно порождается реакциями антиген-антитело при которых активация комплемента плазмы крови начинается через несколько часов после иммунологических повреждений, достигает своей вершины через 24 часа, а угасает через 42-48 часов. Хроническое воспаление связано с влиянием антител на Т-лимфоцитарная систему, привычно проявляется через возрастная характеристика лейкоцитарной формулы
1-2 дня и достигает пика через 48-72 часа. В месте воспаления всегда повышается температура (связано с расширением сосудов); возникает припухлость (при остром воспалении обусловлено выходом в межклеточное пространство белков и фагоцитов, при хроническом воспалении — добавляется инфильтрация лимфоцитов и макрофагов); возникает боль (связано с повышением давления в тканях).
Болезни иммунной системы очень опасны для организма и зачастую приводят к летательным последствий, так как организм фактически становится незащищенным. Выделяют 4 основных групп таких болезней: первичная или вторичная иммунная недостаточность, нарушение функции; злокачественные заболевания, инфекции иммунной системы. Среди последних известным является вирус герпеса и угрожающе распространяясь в мире, в том числе и в Украине, вирус анти-HIV или anmiHTLV-lll/LAV, который вызывает синдром приобретенного иммуннодифицита (AIDS или СПИД). В основе клиники СПИД лежит вирусное повреждение Т-хелперных (Th) цепи лимфоцитарной системы, что ведет к значительному росту количества Т-супрессорах (Ts) и нарушение соотношения Th / Ts, которое становится 2:1 вместо 1:2, следствием чего является полное прекращение продукции антител и организм погибает от любой инфекции.
Источник
