Клеточные механизмы противовирусного иммунитета
Глава 16. Противовирусный иммунитет
ЗАЩИТНЫЕ МЕХАНИЗМЫ С УЧАСТИЕМ Т- И В-КЛЕТОК
При отсутствии Т-клеток организм-хозяин весьма восприимчив к атакам вирусов. Так, у бестимусных мышей (мыши nude — голые, или бесшерстные) с врожденным отсутствием зрелых Т-клеток вирус простого герпеса (HSV, от herpes simplex virus), введенный в кожу, вызывает распространяющееся поражение и в конце концов, проникая в центральную нервную систему, гибель животных. Чтобы защитить этих мышей, достаточно вскоре после заражения перенести им HSV-специфичные Т-клетки. Важное значение Т- и В-клеток, противодействующих вирусным инфекциям, будет рассмотрено ниже.
Антитела и комплемент способны ограничить распространение вируса и предотвратить повторную инфекцию
Антитела могут нейтрализовать инфекционность вирусов. Если вирусу удается преодолеть барьеры врожденного иммунитета, он вызывает развитие адаптивного (специфического) иммунного ответа с появлением цитотоксических Т-клеток, хелперных Т-клеток и противовирусных антител. Антитела служат главным препятствием для распространения вируса в другие клетки и ткани, особенно для проникновения его в кровоток. В лимфоидной ткани слизистых оболочек образуются преимущественно антитела класса IgA, предотвращающие повторную инфекцию.
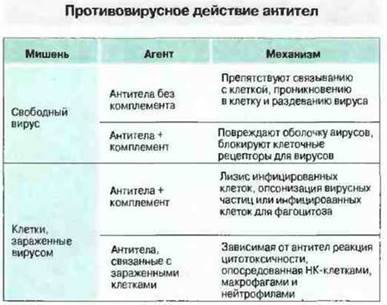
Антитела могут быть направлены против любого вирусного антигена, синтезируемого в инфицированной клетке, однако сдерживание инфекции обеспечивают только те из антител, которые специфичны к гликопротеинам, экспрессированным на оболочке вирусов иди на мембране инфицированных клеток. Механизмы гуморального противовирусного иммунитета могут быть различными. Так, способ устранения инфекционности вирусных частиц зависит от их локализации — внеклеточной или внутриклеточной (рис. 16.5). О действии in vivo защитных механизмов, перечисленных на рис. 16.5, свидетельствует то, что инъекция моноклональных вирус-нейтрализующих антител весьма эффективно угнетает репродукцию вирусов. Присутствие в кровотоке нейтрализующих вирус антител — это и важный фактор предотвращения повторной инфекции.

Рис. 16.5. Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
Комплемент участвует в нейтрализации внеклеточных вирусов некоторых видов. Комплемент также способен повреждать оболочку вируса — осуществлять виролиз. Некоторые вирусы непосредственно вызывают активацию комплемента по классическому или альтернативному пути. Тем не менее комплемент не рассматривают как главный фактор защиты против вирусов, поскольку при недостаточности компонентов системы комплемента не отмечено предрасположенности к тяжелым вирусным инфекциям у человека.
Антитела мобилизуют комплемент и/или эффекторные клетки для разрушения инфицированных вирусами клеток организма. Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. В результате его активации происходит сборка лизирующего мембрану комплекса и лизис зараженных клеток (см. гл. 4). Комплемент-зависимый цитолиз возможен лишь при высокой плотности экспрессии вирусных антигенов па клеточной мембране (примерно 5 х 106на клетку). В противоположность этому, для лизиса по механизму АЗКЦ необходимо присутствие на поверхности клетки-мишени лишь 103 молекул IgG — такое количество обеспечивает связывание с ней НК-клеток. Эти клетки связываются с нагруженной антителами мишенью через FcγRIII (CD16) и быстро разрушают ее посредством перфоринов (см. гл. 10). Насколько важен in vivo каждый из этих механизмов, пока трудно понять. Лучшее доказательство в пользу АЗКЦ получено на мышах при изучении защитного эффекта противовирусных моноклональных антител; не проявляя нейтрализующей активности in vitro, они оказались способны защитить С5-дефицитных животных при введении им высокой дозы вируса. (Эта линия мышей была использована для того, чтобы исключить антивирусный эффект терминальных компонентов системы комплемента.)
Т-клетки участвуют в формировании и действии противовирусного иммунитета несколькими путями
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Образование антител в ответ на большинство антигенов зависит от тимуса, поскольку для переключения изотипа и созревания аффинности необходимо участие Т-клеток CD4+. Кроме того, эти клетки помогают в индукции цитотоксических Т-клеток CD8+, а также в привлечении макрофагов в очаг вирусной инфекции и в их активации.
Цитотоксические Т-клетки CD8+. Это главная Т-клеточная система для осуществления в организме противовирусного иммунологического надзора, и действует она весьма эффективно и избирательно. Цитотоксические Т-клетки CD8+, рестриктированные по антигенам МНС класса I, скапливаются в очагах размножения вирусов и разрушают инфицированные ими клетки. Данный механизм иммунологического надзора, по-видимому, весьма важен, так как фактически все клетки тела экспрессируют молекулы МНС класса I.
Процессинг и презентация вирусных белков. Вероятно, любой вирусный белок может быть процессирован в цитоплазме АПК с образованием пептидов, которые затем транспортируются к эндоплазматическому ретикулуму и ассоциируют с молекулами МНС класса I. Для организма-хозяина это создает определенные преимущества, так как белки вируса, экспрессируемые клеткой в начале цикла его размножения, становятся доступными для Т-клеточного распознавания задолго до появления нового поколения вирусных частиц. Например, Т-клеточный иммунитет к цитомегаловирусной инфекции у мыши специфичен в отношении наиболее раннего вирусного белка рр89. Его протективный эпитоп определен как пептид Lb, состоящий из девяти аминокислотных остатков и презентируемый молекулой МНС класса I. Иммунизация мышеи рекомбинантным вирусом коровьей оспы, несущим ген рр89, полностью защищает их от инфекции CMV. Делеция участка ДНК, кодирующего нано-пептид Ld, лишает белок рр89, экспрессируемый вирусом коровьей оспы, протективной активности.
Важность Т-клеточных механизмов в противовирусном иммунитете in vivo установлена различными способами:
• путем адоптивного переноса антигенспецифичных субпопуляций или клонов Т-клеток зараженным животным для проверки на способность устранения вируса;
• на животных, лишенных Т-клеток CD4+или CD8+путем введения специфических моноклональных антител, и
• на мышах, избирательно лишенных эмбриональных генов CD4, CD8 и β2-микроглобулина методом генного нокаута.
Как установлено, мыши, лишенные методом генного нокаута определенных субпопуляций лимфоцитов, сохраняют способность к иммунному ответу на вирусную инфекцию. Можно рассматривать это как хорошую иллюстрацию многократного функционального дублирования, вероятно свойственного иммунной системе. Например, Т-клетки CD4+в отсутствие Т-клеток CD8+могут компенсировать иммунологическую недостаточность и устранять инфекцию.
Т-клетки CD4+ способны выполнять важные эффекторные функции в иммунном ответе на вирусную инфекцию. В иммунном ответе на инфекцию эпителиальных покровов, вызванную вирусом простого герпеса I типа (HSV-I), главной эффекторной клеточной популяцией служат Т-клетки CD4+. Они, как и в реакциях гиперчувствительности замедленного типа (см. гл. 26), мобилизуют и привлекают макрофаги, и эго ускоряет ликвидацию вируса. Макрофаги служат важными участниками этого процесса (рис. 16.6). В качестве ключевых цитокинов в ответе на герпесвирусную инфекцию действует ИФγ, необходимый для активации моноцитов, и фактор некроза опухолей (ФИО), оказывающий ряд противовирусных эффектов, сходных с эффектами ИФγ, но осуществляемых иными путями.

Рис. 16.6. При кожной герпесвирусной (HSV) инфекции в качестве защитных факторов действуют Т-клетки СD4+, макрофаги и ИФγ. Т-клетки CD4+получали от мышей, зараженных HSV за 8 сут до опыта, и переносили сингенным мышам, вскоре после этого зараженным HSV внутрикожно. Одной группе этих мышей вводили антитела к CR3 (чтобы блокировать миграцию макрофагов в место заражения), другой — антитела к ИФγ (чтобы блокировать активацию макрофагов), остальные животные служили контролем. Мышей дополнительной контрольной группы заражали, но не переносили им Т-клетки CD4+. Через 5 сут после заражения определяли количество оставшегося инфекционного вируса. Результаты показывают, что протективный эффект Т-клеток CD4+реализуется при участии макрофагов и ИФγ.
Цитотоксические Т-клетки CD4+. При заражении вирусом кори в организме образуются цитотоксические Т-клетки CD4+, которые распознают и лизируют инфицированные вирусом клетки-мишени, экспрессирующие молекулы МНС класса II. Это указывает, что процессинг и презентация антигенов вируса кори происходят обычным способом — путем фагоцитоза и расщепления (см. гл. 9). Однако существует, предположительно, и другой, еще неизвестный механизм, посредством которого белки или пептиды вируса кори перемещаются из цитозоля в везикулы класса II.
Защитные противовирусные механизмы обобщенно представлены на рис. 16.7, а динамика их индукции — на рис. 16.8.

Рис. 16.7. Проникновению вирусов в клетки слизистой оболочки препятствуют антитела IgA. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФα и ИФβ) и приобретенного (ИФγ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и НК-клетки — для разрушения инфицированных вирусом клеток-мишеней. (АЗКЦ — антителозависимая клеточноопосредованная цитотоксичность.)

Рис. 16.8. Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и в инфицированных тканях раньше всего выявляются НК-клетки и интерферон. Затем в регионарных лимфоузлах или селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). После этого в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
Источник
Специфический, или адаптивный, противовирусный иммунитет (в отличие от естественного, врожденного, иммунитета) определяется уникальными свойствами иммунных Т- и В-лимфоцитов избирательно отвечать на чужеродные, в т.ч. вирусные, антигены и формировать специфическую иммунную память, выражающуюся в усиленной и ускоренной реакции на повторную встречу с этим же инфекционным агентом.
На поверхности лимфоцитов имеются индивидуальные антигенсвязывающие рецепторы, благодаря которым они способны избирательно распознавать и специфически взаимодействовать с чужеродным антигеном (антигенными детерминантами, или эпитопами) в силу комплементарности (стерического соответствия, сродства). Сродство пространственных конфигураций обусловливает взаимодействие антигенных детерминант вируса с рецепторами Т- и В-лимфоцитов. В результате этого в лимфоцитах активируются метаболические процессы и лимфоциты приобретают способность пролиферировать в клоны абсолютно идентичных клеток, дифференцироваться в более зрелые клетки, выполняющие определенные эффекторные функции. Согласно клонально-селекционной теории Бернетта (1971), каждому клону иммунокомпетентных лимфоцитов присущ свой уникальный по специфичности рецептор, способный взаимодействовать только с определенной антигенной детерминантой.
Основными звеньями специфического иммунитета являются две популяции лимфоцитов: Т- и В-клетки. В свою очередь, Т-лимфоциты подразделяются на несколько функционально неоднородных субпопуляций.
Иммунокомпетентные В-лимфоциты реагируют, прежде всего, на внеклеточный вирус с последующей нейтрализацией антителами его инфекционных свойств, тогда как Т-лимфоциты элиминируют инфицированные вирусом клетки организма хозяина.
В вязи с этим различают: 1) опосредованный антителами гуморальный иммунитет, зависящий от В-клеток лимфоидной системы; 2) клеточный иммунитет, опосредованный Т-лимфоцитами.
Иммунные реакции как опосредованные Т-клетками, так и гуморальными антителами играют большую роль в противовирусной защите организма.
Клеточно-опосредованный специфический иммунитет.Механизмы клеточного противовирусного иммунного ответа организма в целом очень сложны и основаны на кооперации различных типов клеток – АПК (макрофагов и дендритных клеток), NK, Th, ЦТЛ – с гуморальными факторами: специфическими антителами и неспецифическими медиаторами (ИФН, цитокины, комплемент, ингибиторы и др.).
Кооперация клеток в иммунном ответе может быть как позитивной, так и негативной.
К основным субпопуляциям Т-клеток специфического иммунитета относятся эффекторы цитотоксических реакций: Т-лимфоциты (CD8+ и CD4+ ЦТЛ) и уже упоминавшиеся регуляторные CD4+ типа Th1 и Th2. Известно также существование множества других субпопуляций, выполняющих самые разнообразные функции.
CD8+ ЦТЛ несут на своей поверхностной мембране комплекса молекул: Т-клеточный АГ-связывающий рецептор, CD4 и CD8 (корецепторы). Именно с помощью трех этих видов молекул ЦТЛ специфически распознают процессированные до коротких пептидов (эпитопов) вирусные антигены на поверхности клеток-мишеней, представленные в ассоциации с антигенами МНС I. Т-клеточный АГ-связывающий рецептор Т-лимфоцитов сходен по своей структуре с таковым В-лимфоцитов и гуморальными антителами; он также относится к рецепторным молекулам суперсемейства иммуноглобулинов.
Т-лимфоциты избирательно распознают чужеродные вирусные антигены лишь в сочетании со «своими», т.е. гомологичными (генетически однородными) антигенами МНС. Этот феномен получил название МНС-рестрикции.
Антигены МНС I имеются на поверхности всех клеток, которые играют существенную роль в распознавании вирусных антигенов Т-клеточными рецепторами ЦТЛ. Функция МНС I заключается в связывании мелких вирусспецифических пептидов внутри клетки и презентировании их CD8+-Т-лимфоцитам на поверхности клетки.
CD8+ ЦТЛ, будучи эффекторными клетками, способны осуществлять прямой цитолитический эффект с деструкцией инфицированных вирусом гомологичных клеток (МНС I-рестриктированных) посредством секретируемого ими лимфотоксина перфорина.
CD4+-Th-клетки играют важную роль в регуляции всех иммунных противовирусных реакций, опосредованных как ЦТЛ, так и В-клетками. В результате специфической антигенной стимуляции при участии АПК Th1- либо Th2-клетки активируются и пролиферируют в клоны, необходимые для дифференцировки других клеток, способных иммунно реагировать на этот антиген.
Кроме того, установлено, что CD4+-лимфоциты могут действовать как прямые эффекторные клетки (CD4+ ЦТЛ), экспрессирующие перфорин. Перфорин, очевидно, играет основную роль в антиген-специфической цитотоксичности, опосредованной как CD8+, так и CD4+ ЦТЛ.
Специфический гуморальный противовирусный иммунитет. Доказана огромная роль гуморального звена иммунного ответа, обусловленного антителами, наряду с Т-клеточными факторами иммунитета в противовирусной защите. Гуморальные АТ представляют представляют собой не что иное, как иммуноглобулиновые АГ-связывающие рецепторы В-лимфоцитов. В основе специфичности АТ лежит соответствие, взаимная комплементарность активного центра АТ пространственной конфигурации АГ-детерминанты.
Различают тимусзависимые и тимуснезависимые антигены. В-клеточный ответ на тимуснезависимые АГ начинается с того, что АПК транспортируют вирус для прямой индукции В-лимфоцитов. Последние избирательно распознают и взаимодействуют с чужеродным АГ, после чего начинают активно пролиферировать с образованием клонов идентичных клеток с дальнейшей дифференцировкой в АТ-продуцирующие плазматические клетки, секретирующие специфические гуморальные АТ.
Большинство вирусных АГ являются тимусзависимыми, а это значит, что В-клеточный иммунный ответ на такие АГ нуждается в помощи медиаторов, продуцируемых Th2-клетками. В этом случае АПК сначала презентируют АГ-детерминанты, ассоциированные с МНС II, Т-хелперам, которые активируют В-клетки.
Несмотря на существование тимуснезависимого гуморального ответа, есть основания полагать, что тимусзависимый АТ-ответ наиболее эффективен.
Мономер молекулы иммуноглобулина (Ig) состоит из 2 идентичных тяжелых и 2 легких цепей, соединенных в определенную структуру дисульфидными связями. Каждая цепь содержит вариабельные и константные области.
Ввиду различий в константных областях тяжелых цепей иммуноглобулины подразделяются на пять классов: IgM, IgG, IgA, IgE и IgD, значение которых в противовирусном иммунитете неодинаково. Наибольшую роль играют IgG, IgM и IgA.
Антитела класса IgM возникают в результате первичной реакции организма на антиген. Они появляются первыми на ранних стадиях инфекции. Полагают, что они эффективны в виролизе и агглютинации вируса. IgM синтезируются без помощи CD4+-T-клеток, но секретируемые этими клетками цитокины необходимы, как правило, для переключения с IgM на IgG.
IgG образуются в более поздние сроки, чем IgM. Они составляют 70-80 % иммуноглобулинов сыворотки крови. Различают системный и локальный IgG-ответ. Гуморальные IgG играют важную роль в протективном иммунитете при острых и хронических инфекциях, они участвуют в элиминации вирусов, контролировании репликации вирусов и защите от реинфекции. IgG особенно эффективны в нейтрализации вирусов. Существенно, что антитела IgG могут проникать через плаценту от матери к плоду и обеспечивать трансплацентарный иммунитет.
Секреторные IgA наряду с IgG определяют локальный иммунитет. Поступая из сыворотки или синтезируясь в слизистых оболочках, они важны для формирования местного иммунитета при вирусных инфекциях респираторного, кишечного, генитального трактов. Полагают, что сывороточные АТ и ЦТЛ являются основными факторами, от которых зависит исход инфекционного процесса и выздоровление организма, тогда как перекрестно реагирующие секреторные IgА имеют существенное превентивное значение: они предупреждают возникновение инфекций, вызываемых разными вирусными вариантами.
Антитела действуют как на свободный внеклеточный вирус путем его нейтрализации, виролизиса, агглютинирующего, опсонизирующего эффектов и др., так и на внутриклеточный вирус, участвуя в разрушении инфицированных клеток-мишеней с помощью эффекторных клеток или комплемента.
Нейтрализующая активность антител зависит от их аффинности и авидности. Аффинитет – это степень сродства АТ и АГ, выражающаяся константой равновесия и определяющая прочность их взаимодействия под влиянием межмолекулярных нековалентных связей. Авидность АТ характеризует прочность связи АГ с АТ.
На ранних стадиях инфекции образуются менее авидные АТ, легко диссоциирующие из комплексов с вирусами. Вторичный иммунный ответ развивается быстрее и проявляется более эффективно, нежели первичная реакция на АГ. Это объясняется тем, что в организме сохраняются В-клетки памяти, стимулирующие синтез высокоафинных АТ. Установлена прямая зависимость между титрами специфических АТ в крови переболевших или вакцинированных лиц и резистентностью к вирусным инфекциям.
Гуморальный ответ организма формируется по отношению к определенным типам вирусов, к отдельным белкам и АГ-детерминантам вирусных белков. Но наряду с этим также имеет место индукция перекрестно реагирующих АТ, возникающих на общие АГ гетерологичных вирусов, что немаловажно для предупреждения инфекций, обусловленных разными вирусными вариантами, в т.ч. при вакцинации.
Неодинакова защитная роль АТ и Т-лимфоцитов при различных вирусных инфекциях, что зависит, прежде всего, от природы и свойств самого возбудителя и механизмов патогенеза инфекционного процесса. Взаимоотношения отдельных звеньев иммунитета при острых инфекциях отличаются от таковых при хронических и латентных вирусных инфекциях.
Источник
