Когда у плода формируется иммунитет
Развитие иммунной системы у плода начинается на 2-3-й неделе жизни в утробе матери, а уже на 9-15-й неделе выявляются первые признаки становления клеточного иммунитета. На 3-м месяце беременности у развивающегося плода могут появляться бласты. На 6-й неделе жизни плода начинают типироваться антигены HLA как 1, так и 2 класса. Тимоциты появляются с 7-8-й недели, и к 14-й неделе они располагаются, в основном, в корковом слое тимуса. К 9-й неделе в вилочковой железе можно обнаружить малые лимфоциты, которые вскоре переходят в кровь. В периферической крови нарастание числа лимфоцитов происходит чрезвычайно быстро – к 12-й неделе их количество в 1 мм3 равно приблизительно 1000, а к 20-25 неделе около 10000.
Первые В-лимфоциты появляются в печени после 8-й недели беременности и лишь затем – в костном мозге. В течение длительного срока беременности в печени и крови доминируют пре-В-лимфоциты, в цитоплазме которых выявляются М-глобулиновые цепи, но отсутствуют рецепторы к иммуноглобулинам. Последние в печени плода выявляются приблизительно на 9-й неделе гестации и лишь на 20-й неделе – в периферической крови.
С 12-й недели В-лимфоциты плода способны переходить в плазматические клетки и синтезировать IgM, с 5-го месяца – IgG, а с 7-го – IgA. IgE выявляются у плода на 12-й неделе в легких и на 21-й неделе – в селезенке. Следует отметить, что синтез иммуноглобулинов у плода ограничен. Так, концентрация IgE к моменту рождения крайне низка (в 100-200 раз меньше, чем у взрослого), что обусловлено слабой аллергизацией плода. Очень низкой остается содержание и других иммуноглобулинов. Исключение составляет лишь IgG, которые переходят через плаценту от матери к плоду и потому их содержание в крови достаточно велико.
До момента рождения как Т-, так и В-лимфоциты обладают малой функциональной активностью, хотя и способны в низких концентрациях продуцировать отдельные интерлейкины и интерфероны.
По мнению В. Ботвиньевой, иммунная система ребенка претерпевает 5 критических периодов.
Первый критический период –это период новорожденности. Сразу после рождения в процентном отношении общее число лимфоцитов и Т-лимфоцитов у ребенка снижено. Однако в это время у ребенка имеется резко выраженный физиологический лейкоцитоз, благодаря чему содержание всех популяций лимфоцитов, а также число бластов достаточно высоко. Все Т-лимфоциты новорожденного несут маркер незрелости. Для В-лимфоцитов характерно наличие всех Аг – CD19, CD20, CD23, CD25.
На 5-е сутки после рождения, когда наступает первый перекрест в содержании форменных элементов крови, относительное число лимфоцитов возрастает, но их количество из-за уменьшения общего содержания лейкоцитов остается приблизительно таким же, как и при рождении. Пассивный иммунитет ребенка обеспечивается материнским IgG, прошедшим к плоду через плаценту. IgA в период новорожденности не выявляется, а отсюда отсутствие местного барьерного иммунитета слизистых оболочек. Плазмоциты новорожденного первых дней жизни практически не способны к секреции иммуноглобулинов, за исключением IgM, концентрация которого к 3-му месяцу соответствует приблизительно 50% от уровня взрослого человека.
Уровень IgE даже у взрослых людей очень низок. В крови пупочной вены он практически не выявляется, ибо его концентрация не превышает 0,5-1 МЕ (в норме у взрослого 100 МЕ). У большинства детей первых 3-х месяцев жизни IgE определить не удается.
Чрезвычайно важную роль в иммунной защите ребенка играет секреторный иммуноглобулин А (SIgA), выполняющий барьерную функцию в желудочно-кишечном тракте и органах дыхания. Однако SIgA по ходу желудочно-кишечного тракта у новорожденного отсутствует, что делает его уязвимым к кишечным инфекциям. Указанная восприимчивость к инфекциям объясняется еще и тем, что через плаценту не проникает IgM, появляющийся в ответ на действие ЛПС грамотрицательных бактерий.
В то же время высоко содержание SIgA в грудном молоке и особенно молозиве. Кроме того, в молозиве и грудном молоке находятся IgG, IgM и, в значительно меньшей концентрации, – IgE, обладающие также выраженной защитной функцией против возбудителей различных детских заболеваний. В молозиве, особенно в первые 2 дня после родов, обнаружена высокая концентрация IL-8. Не исключено, что значительная продукция IL-8 эпителиальными клетками молочных желез приводит к повышению в молозиве числа нейтрофилов и концентрации лактоферрина, принимающих участие в защите новорожденного ребенка от инфекционных болезней. Все это лишний раз свидетельствует, как важно раннее (сразу после рождения) прикладывание ребенка к груди матери и кормление женским молоком.
Несмотря на несовершенство собственной иммунной системы ребенка, материнские IgG, прошедшие к плоду через плаценту, а также SIgA молозива и материнского молока обеспечивает ему защиту от многих вирусных и бактериальных заболеваний.
Второй критический период (3-6 месяцев)характеризуется, главным образом, исчезновением из крови ребенка материнского IgG, в результате чего исчезает пассивный иммунитет к детским инфекциям. Несмотря на выраженный лимфоцитоз, в этот период сохраняется супрессорный характер иммунного ответа. На внедрение большинства Аг ребенок реагирует появлением IgM, которые не оставляют иммунной памяти, благодаря чему вновь может проявиться рецидив только что перенесенного заболевания. Точно такой же тип иммунного ответа в этом возрасте возникает на вакцинацию против столбняка, дифтерии, коклюша, полиомиелита и кори. Вот почему в этом возрасте перенесенные коклюш и корь не оставляют иммунитета.
Второй критический период развития иммунной системы ребенка отличается также тем, что в этом возрасте начинают секретироваться IgG.
Уже в первые месяцы жизни ребенка синтезируется барьерный IgA, однако он проявляет слабую активность. Сказанное обусловлено тем, что у ребенка первых месяцев жизни синтезируется в основном секреторный компонент, не обладающий активностью Ат, а не истинный SIgA. Забегая вперед, отметим, что минимально-достаточные сроки созревания SIgA колеблются от 8 месяцев до 1,5-2-х лет. Только к этому времени у ребенка начинает функционировать местный иммунитет пищеварительной системы. Окончательно же SIgA созревает лишь к 10-12 годам.
IgE после 40-й недели выявляется не более чем у 30-35% детей. Концентрация его нарастает очень медленно и приходит к норме взрослых к моменту полового созревания.
Во второй критический период ребенок чрезвычайно подвержен заболеваниям дыхательного аппарата и пищеварительной системы, а также возникновению детских инфекций.
Третий критический период – второй год жизни ребенка–характеризуется сохранением первичного иммунного ответа. Уровень IgM к концу первого года жизни достигает 70%, а к 2-м годам – показателей взрослых людей. К этому сроку в ответ на Аг могут синтезироваться IgG, а, следовательно, может проявляться вторичный иммунный ответ, ибо сохраняются Т- и В-лимфоциты памяти. На втором году жизни преимущественно синтезируются IgG1 и IgG3. К этому сроку число лимфоцитов достигает максимума. В иммунном ответе преобладает хелперная активность по отношению к В-лимфоцитам, которые при переходе в бласты преимущественно синтезируют IgM, IgG1 и IgG3. Следует заметить, что в этом возрасте в крови повышается концентрация не только IgG, но и IgA.
Тем не менее, в третий критический период местный иммунитет еще недостаточно развит, из-за чего дети чувствительны к респираторным вирусным инфекциям.
Четвертый критический период – 4-6-й годы жизни,когда формируется второй перекрест лимфоцитов и нейтрофилов, и уменьшается относительное число лимфоцитов. В этом возрасте концентрация IgG, IgM и IgA достигает цифр, характерных для взрослых людей, а уровень IgE даже может превышать его (максимально до 150 МЕ, при норме 100 МЕ). Завершение формирования системы местного иммунитета наблюдается у большинства детей к 7-ми годам.
Четвертый критический период характеризуется высокой частотой атопических, паразитарных и иммунокомплексных заболеваний и формированием хронических болезней – пневмонии, пиелонефрита, гломерулонефрита.
Пятый критический период – подростковый – наступает у девочек к 12-13-ти годам, а у мальчиков – в 14-15 лет. Показатели клеточного и гуморального иммунитета в этот период мало отличаются от таковых взрослых людей, а дефекты иммунной системы и восприимчивость к различным заболеваниям связаны с особенностями гормонального статуса. Пубертатный скачок массы и длины тела сопровождается относительным снижением лимфоидной ткани, а гормональная перестройка – супрессией клеточного и преобладанием гуморального иммунитета. Система местного иммунитета к этому сроку полностью сформирована, все классы и субклассы IgG и IgA находятся в крови в такой же концентрации, как и у взрослых.
К этому периоду окончательно выявляются индивидуальные, генетически детерминированные типы иммунного ответа – сильный, средний и слабый.
С началом полового созревания могут обостриться хронические воспалительные процессы – пневмония, туберкулез и другие.
Зная, к каким заболеваниям предрасположен ребенок в различные критические периоды развития иммунной системы, врач может предпринимать профилактические меры для предупреждения их развития (своевременное назначение прививок).
Источник
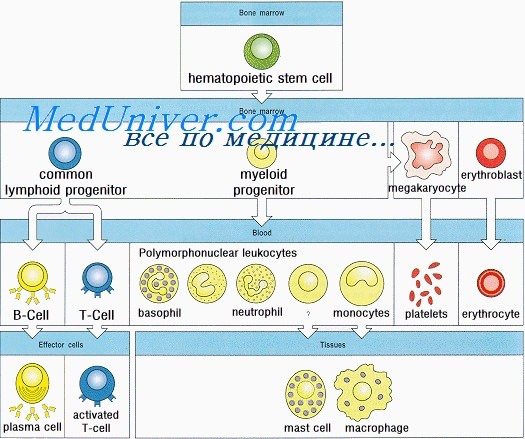
Формирование иммунитета у плода. Неонатальный лимфопоэзЗащиту организма от инфекционных агентов обеспечивают физические барьеры (кожа, слизистые оболочки и реснитчатый эпителий) и различные компоненты иммунной системы. Последняя состоит из Т- и В-лимфоцитов, NK-клеток, дендритных и фагоцитирующих клеток, а также белков комплемента. Иммунная система защищает организм также от аутоиммунных заболеваний и развития злокачественных опухолей. Иммунная система человека развивается из ткани первичной кишки. Полипотентные кроветворные стволовые клетки впервые появляются в желточном мешке на 2,5-3-й неделе внутриутробного развития и на 5-й неделе мигрируют в печень плода. Позднее они попадают в костный мозг, где и остаются на протяжении всей жизни. Из этих клеток образуются лимфоидные стволовые клетки, которые в зависимости от локализации дифференцируются в Т-, В- и NK-клетки. В середине I триместра беременности у плода образуются первичные лимфоидные органы (тимус и костный мозг), а вскоре и вторичные — селезенка, лимфатические узлы, миндалины, пейеровы бляшки и lamina propria. В этих органах дифференцировка Т-, В- и NK-лимфоцитов из стволовых клеток продолжается в течение всей жизни. Как для органогенеза, так и для клеточной дифференцировки необходимо взаимодействие поверхностных молекул лимфоидных клеток с их микроокружением. Многочисленность и разнообразие этих поверхностных молекул отражена в международной классификации дифференцировочных антигенов, которые носят название кластеров дифференцировки (CD). Т- и В-лимфоциты — единственные компоненты иммунной системы, способные распознавать специфические антигены; именно из них образуются клетки памяти (адаптивный иммунитет). Из кроветворных стволовых клеток образуются и NK-клетки, которые также являются лимфоцитами. Они защищают организм от вирусных инфекций, уничтожают опухолевые клетки и участвуют в регуляции иммунных реакций. Белки, синтезируемые и секретируемые Т- и В-лимфоцитами и NK-клетками, а также взаимодействующими с ними клетками, называются цитокинами. Некоторые из этих белков получили название интерлейкинов (ИЛ). На 4-й неделе внутриутробной жизни из эктодермы третьей жаберной дуги и эндодермы третьего глоточного кармана образуется первичная закладка тимуса. На 7-8-й неделе правая и левая его части перемещаются каудально и сливаются друг с другом. На 8-й неделе предшественники Т-лимфоцитов из печени плода через кровь начинают поступать в окружающую тимус мезенхиму. Эти про-Т-лимфоциты идентифицируют по поверхностным белкам CD7 и CD34. К 8-8,5 нед. гестации СD7-клетки обнаруживаются уже в самом тимусе, причем на некоторых из них экспрессируются также CD4 и CD8.
Первый из этих маркеров характерен для зрелых Т-лимфоцитов-хелперов (Th), a CD8 — для зрелых цитотоксических Т-лимфоцитов и NK-клеток. Кроме того, на некоторых клетках присутствуют одиночные цепи антигенраспознающих рецепторов Т-лимфоцитов (TCR, Ti), но не полные TCR. Зрелые TCR представляют собой гетеродимеры, состоящие из двух цепей — либо а и b, либо у и 8. TCR экспрессируются на клеточной поверхности вместе с CD3, образуя комплекс из пяти полипептидных цепей). Рекомбинация гена TCR осуществляется путем слияния крупных отдаленных друг от друга сегментов ДНК. Эти сегменты называются V (вариабельным), D (дополнительным) и J (соединяющим), причем каждый из них имеет ряд вариантов. Сегменты VDJ присоединяются к константной области а-гена, а сегменты VJ — к р-гену, завершая строение генов, кодирующих TCR. Случайная комбинация сегментов и определяет, в основном, огромное разнообразие TCR, придавая им способность распознавать миллионы различных антигенов. Рекомбинация генов TCR регулируется ферментами RAG-1 и RAG-2 (рекомбиназы, активирующие гены), а также другими ферментами. При тяжелом комбинированном иммунодефиците у мышей и некоторых людей процесс рекомбинации нарушен. Рекомбинация генов TCR знаменует собой превращение про-Т-лимфоцитов в пре-Т-лимфоциты. Этот процесс начинается вскоре после заселения тимуса стволовыми клетками. На 8-10-й неделе внутриутробной жизни начинают формироваться Т-лимфоциты с разной функцией. На 9,5-10-й неделе более 95% тимоцитов экспрессирует CD7, CD2, CD4, CD8 и цитоплазматический CD3, а примерно 30% — внутренний антиген клеток коркового вещества тимуса. К 10-й неделе 25% тимоцитов обладают TCRaP. Число таких тимоцитов в ходе эмбрионального развития постепенно увеличивается и после рождения превышает 95 %. По мере экспрессии TCR начинаются процессы позитивной и негативной селекции клеток коркового вещества тимуса. Позитивная селекция происходит путем взаимодействия незрелых тимоцитов (слабо экспрессирующих TCR) с МНС на эпителиальных клетках тимуса. В результате активируются и созревают только те тимоциты, рецепторы которых способны взаимодействовать с чужеродными антигенами, представляемыми им антигенами МНС. Зрелые тимоциты, прошедшие процесс селекции, экспрессируют либо CD4, либо CD8. Первые способны взаимодействовать с чужеродными антигенами, представляемыми молекулами HLA класса II, а вторые — с антигенами, представляемыми классом I HLA. Затем начинается негативная селекция, обусловленная взаимодействием выживших тимоцитов, экспрессирующих значительно большее количество TCR, с пептидами хозяина, представляемыми HLA классов I и II, которые присутствуют на поступивших из костного мозга макрофагах, дендритных клетках и, возможно, В-лимфоцитах. Взаимодействие с этими антигенами включает программу апоптоза (запрограммированной гибели) аутореактивных тимоцитов. Клетки коркового вещества тимуса плода относятся к числу наиболее быстро делящихся клеток организма; их количество за 2 нед. после заселения тимуса стволовыми клетками возрастает в 100 000 раз. По мере их созревания происходят процессы селекции, в результате которых 97 % этих клеток погибает. Выжившие клетки несут на своей поверхности либо только CD4, либо только CD8, но не оба этих антигена и мигрируют в мозговое вещество тимуса. Одновременно с появлением тимоцитов, обладающих только одним дифференцировочным антигеном, развиваются и функции Т-лимфоцитов, но до их выхода из тимуса эти клетки остаются незрелыми. Одна стволовая клетки дает начало примерно 3000 зрелых клеток мозгового вещества тимуса. Они устойчивы к лизирующему эффекту кортикостероидов. На 11—12-й неделе внутриутробной жизни Т-лимфоциты начинают покидать тимус, заселяя селезенку, лимфатические узлы и аппендикс, а на 14-15-й неделе — и миндалины. Наибольшее их количество скапливается в корковом веществе лимфатических узлов, вокруг артериол селезенки и в лимфе грудного лимфатического протока. Клетки, недавно покинувшие тимус, одновременно экспрессируют изоформы CD45RA и CD62L (L-селектин). Рекомбинация генов TCR в ходе этого процесса приводит к образованию в качестве побочного продукта круговых эписом, которые обнаруживаются в Т-лимфоцитах, недавно покинувших тимус. В Т-лимфоцитах, созревающих вне тимуса, эписомы отсутствуют. Молекула адгезии, L-селектин, взаимодействует с углеводными компонентами специфических участков кровеносных сосудов. Такие участки (венулы с высоким эпителием) присутствуют в периферических лимфоидных органах, что и определяет задержку лимфоцитов в них. К 12-й неделе внутриутробной жизни Т-лимфоциты приобретают способность к пролиферации под действием растительных лектинов, таких как ФГА и КонА, и аллогенных клеток; антигенсвязывающие Т-лимфоциты появляются на 20-й неделе. — Также рекомендуем «Созревание и дифференцировка В-лимфоцитов у плода. Синтез иммуноглобулинов в утробе матери» Оглавление темы «Иммунитет плода»:
|
Источник
Иммунная система новорожденных сильнее, чем считалось раньше. Несмотря на то, что после рождения организму сразу приходится бороться с вирусами и бактериями, младенец быстро растет и развивается. От чего зависит иммунитет новорожденного ребенка, как долго работает иммунитет, «позаимствованный» грудничком у мамы еще во внутриутробной жизни, и как действует защита грудного молока и молочной смеси в период роста и развития малыша, рассказывает врач-неонатолог Валерия Максимовна Щелкунова.
— Валерия Максимовна, что такое иммунитет и есть ли он у новорожденных?
— Иммунитет — это способность противостоять агрессивным воздействиям внешней среды. На ребенка действуют совершенно разные факторы: от патогенных микроорганизмов и вирусов до аллергенов. Могут влиять на иммунитет грудничка и факторы внешней среды.
Раньше бытовало мнение, что ребенок рождается совсем без иммунитета, так как все девять месяцев находится в стерильной среде и ему незачем вырабатывать собственные иммунные клетки. Исследования последних лет доказывают, что формирование иммунитета новорожденного начинается еще внутриутробно.
Каким может быть иммунитет новорожденного ребенка
Врожденный иммунитет
| Приобретенный иммунитет
|
Формирование иммунитета у новорожденных происходит постепенно. Поддержать здоровье малышам помогают их мамы — сначала внутриутробно, затем с грудным молоком мать передает ребенку факторы иммунной защиты. Так происходит, пока иммунитет малыша не сформируется окончательно и он не будет готов к самостоятельному противостоянию окружающей среде.
— Каков иммунитет новорожденного ребенка и чем он отличается от иммунитета взрослого? Как формируется иммунитет у тех, кто только появился на свет?
— Иммунитет новорожденного отличается даже от иммунитета пятилетнего ребенка. Он еще незрелый, и для формирования иммунных реакций требуется время. Сначала мама передает малышу антитела для защиты через плаценту и грудное молоко, и как только ребенок становится способен вырабатывать собственные антитела, мамины перестают работать. У взрослого человека нет таких процессов: для возникновения иммунитета к заболеванию нужно им переболеть или пройти вакцинацию.
У новорожденных детей также существуют критические периоды — самые важные для формирования иммунитета. Прежде всего это первые месяцы жизни. Для малыша это настоящее испытание.
1 период — с рождения до одного месяца Ребенок защищен мамиными антителами. Происходит знакомство с огромным количеством факторов окружающей среды (перемена среды обитания означает активное обсеменение микрофлорой, патогенными микроорганизмами). | 2 период — три-четыре месяца Мамины антитела перестают защищать малыша, происходит перестройка организма, и детскому иммунитету приходится справляться с угрозами самостоятельно. | 3 период — взрослый ребенок и возраст 18+ В старшем возрасте критические периоды есть, но после 3 лет они связаны обычно со сменой привычной среды обитания (садик, школа и так далее), воздействием внешних факторов, а не перестройкой иммунитета. |
— Когда у новорожденного появляется иммунитет?
— Иммунитет появляется еще внутриутробно, но полноценно начинает функционировать к 4—6-месячному возрасту. Конечно, все индивидуально и зависит от того, например, как протекала беременность, какое питание получала мама во время кормления грудью и кормит ли она грудью вообще.
Формирование иммунитета идет с первых секунд после рождения вплоть до 18 лет, да и в более старшем возрасте. На мой взгляд, иммунитет постоянно развивается, потому что сталкиваться с разными условиями внешней среды, которые стимулируют иммунную систему, можно беспрерывно.
— От чего зависит иммунитет у новорожденных детей на грудном вскармливании и какие факторы могут сказаться негативно на его формировании?
— По отношению к новорожденным факторы можно разделить на две группы, но в целом иммунитет напрямую зависит от нас самих, от окружающей среды.
Внутриутробные факторы
| Внеутробные факторы
|
— Правда ли, что новорожденные часто болеют ОРВИ? Как родителям определить, что болезнь протекает в пределах нормы и нет поводов для беспокойства?
— Новорожденные болеют ОРВИ независимо от вида питания, но чаще это действительно случается на искусственном вскармливании. Младенцы на грудном вскармливании получают фактор иммунозащиты от мамы. Поэтому тяжесть и продолжительность заболевания у грудничков могут быть разными.
Врачи всегда проявляют особую настороженность в случаях ОРВИ у маленьких детей. Поводов для беспокойства много, поэтому с появлением первых признаков заболевания нужно проконсультироваться с врачом и ни в коем случае не заниматься самолечением:
- ОРВИ часто протекает с катаральными явлениями, что у младенцев чревато проблемами;
- новорожденные во время болезни дышат ртом — процесс кормления становится невозможным, что приводит к осложнениям, которые трудно лечить;
- заболевание из легкой формы быстро переходит в тяжелую, когда присоединяется вторичная бактериальная инфекция.
— Как ухаживать за ребенком до того, как у него начнет формироваться собственный иммунитет?
— Особенностей в уходе нет. На начальных этапах нужна стерилизация того, что попадает в рот ребенку (не нужно держать соски и пустышки в свободном доступе). Но и фанатизм проявлять не стоит, иммунитет этого явно не оценит. Ребенок должен сталкиваться с патогенной микрофлорой в дозированных небольших количествах, чтобы выработать к ним устойчивость и собственные антитела — и не болеть в будущем.
Также ребенка необходимо одевать по погоде, соблюдать правила простой гигиены, смотреть за его питанием, весо-ростовыми прибавками. Тогда не будет и проблем с иммунитетом.
Как укрепить иммунитет малыша
- Закаливание. Закаливание повышает сопротивляемость организма инфекциям. Его можно начинать с первых дней жизни и сопровождать водными процедурами: первые купания устраивать в воде температурой 37 °C. Потом ее можно постепенно понижать до 25—26 °C.
- Грудное вскармливание. Чтобы укрепить иммунитет ребенка через грудное молоко, для мамы нет специального рациона. Она просто должна питаться здоровой правильной пищей — разнообразно, полноценно, без диет типа гречки с куриной грудкой, чтобы получать все белки, жиры, углеводы, витамины и минералы. Витаминно-минеральный дефицит восполняют эндогенным путем под наблюдением специалиста.
- Народные средства. Чеснок, лук содержат природные фитонциды, которые обладают обеззараживающим эффектом. Но в больших количествах и постоянно к ним прибегать не совсем комфортно. Проще поставить дома различные дизсредства и обеззараживатели воздуха.
- Фармпрепараты, витамины при грудном вскармливании. По последним рекомендациям кормящим женщинам не назначают поливитаминные комплексы, хотя многие мамы любят накупить массу пилюль разного назначения (и с идентичными составами). В итоге ребенок съедает огромные дозы ненужных витаминов. Вопрос о витаминах должен решаться с врачом после сдачи анализов. При дефиците какого-либо вещества врач определяет, будет ли ребенок получать его эндогенно либо восполнять недостаток с пищей.
- Искусственное вскармливание. Ребенок-искусственник получает необходимые витамины и минералы из смеси. Современные адаптированные смеси сбалансированы по витаминно-минеральному составу и дневной норме, поэтому дополнительные препараты ребенку не требуются. В период болезни или патологии, при которой конкретный макро-, микроэлемент или витамин нужен в большем количестве, он отдельно назначается врачом. Среднестатистическому здоровому малышу ничего принимать не нужно.
- Психологический комфорт и отсутствие стресса. Стресс — один из мощнейших факторов подрыва иммунозащиты. Нервная система затрачивает много ресурсов на восстановление стабильного состояния, от чего страдают другие органы и системы, в том числе иммунная. Важно, чтобы стресса не было не только у ребенка, но и у мамы, а в доме сохранялась благоприятная обстановка. Если мама получает адекватное количество минералов и витаминов, но находится в постоянном стрессе и возбуждении, не факт, что полезные вещества дойдут до грудничка.
— Валерия Максимовна, какие ошибки допускают родители, когда начинают укреплять детский иммунитет?
— Фанатизм — самая огромная проблема. Бывает, что в доме для укрепления иммунитета стоит 1000 и 1 баночка, и ребенок получает огромные дозы витаминов. Все должно быть в меру, ведь проблемы возникают не только из-за недостатка, но и из-за избытка определенных веществ. Витаминные препараты и иммуномодуляторы принимаются в крайнем случае и только по рекомендации врача, а приоритетным будет правильное питание. Все рекомендации по физическим методам укрепления иммунитета также нужно выполнять аккуратно.
— Скажется ли на иммунитете младенца искусственное вскармливание?
— Некоторые факторы защиты малыш получит внутриутробно, но потом на искусственном вскармливании ему придется сложнее, чем малышу, получающему грудное питание. Вероятность заболеть у ребенка-искусственника выше, так как иммунитет еще несовершенен, и ему сложно вырабатывать нужные антитела. Болезнь может протекать более длительно и тяжело.
Дети ежедневно сталкиваются с массой всего нового. С грудным молоком им передаются не только специфические антитела к вирусам и бактериям, которые мама получила, пережив заболевания, но также факторы неспецифического иммунитета — те первые иммунные клетки, которые являются барьером между внешней и внутренней средой организма. У малышей на искусственном вскармливании такого не будет.
— Каким должен быть состав детской смеси для становления крепкого иммунитета?
— Этим вопросом озабочены все компании по производству детских смесей. В смесях нет специфических иммуноглобулинов, но присутствует адекватный состав витаминов и минералов, что очень важно для формирования иммунитета, а также лакто- и бифидофлора (кишечник — один из самых больших и важных иммунных органов).
Если состав молочной смеси максимально совпадает с грудным молоком, при формировании кишечника не запускаются аллергические механизмы. Ребенку такое питание будет комфортным, несмотря на чужеродный белок смеси.
При выборе смеси нужно учитывать:
- состав витаминов, минералов в физиологичной концентрации, которая соответствует дневной норме;
- наличие Омега-кислот, бифидо- или лактофлоры;
- отсутствие факторов (стабилизаторы, консерванты), вызывающих аллергические реакции в виде расстройства пищеварения, потому что при проблемах с кишечником возникнут проблемы и с иммунитетом.
Состав смеси МАМАКО® Premium очень хорошо подобран по возрастной норме, имеет нужные ребенку минералы, Омега-3 и Омега-6 жирные кислоты (для иммунитета, головного мозга), пре- и пробиотики (для формирования микрофлоры кишечника), а также козье молоко в основе (для профилактики аллергических реакций и питания детей с повышенной чувствительностью).
Иммунитет формируется во внутриутробный период, после рождения и на протяжении всей жизни. Основные механизмы, которые обеспечивают защиту малыша, вырабатываются к трехмесячному возрасту. До этого времени грудное молоко помогает организму сопротивляться болезням, микроорганизмам и вирусам. Для того чтобы укрепить иммунитет малыша на грудном вскармливании, кормящей маме достаточно сбалансированно и правильно питаться. Ребенок на искусственном вскармливании получает необходимые для иммунитета нутриенты из адаптированной молочной смеси. Если вы обеспокоены иммунитетом новорожденного, важно проконсультироваться с педиатром и ни в коем случае не применять поливитамины и комплексы для поддержки иммунной системы без назначения врача.
Врач-неонатолог
Валерия Максимовна Щелкунова
*Идеальным питанием для грудного ребенка является молоко матери. ВОЗ рекомендует исключительно грудное вскармливание в первые 6 мес. МАМАКО® поддерживает данную рекомендацию. Перед введением в рацион малыша новых продуктов проконсультируйтесь со специалистом.
Источник
