Лейкоциты крови гуморальный клеточный иммунитет
клеточным или гуморальным. Клеточный иммунитет обеспечивают иммунокомпетентные Т-лимфоциты, которые образуются из стволовых клеток, мигрирующих из красного костного мозга, в тимуса. Попадая в кровь, Т-лимфоциты создают большую часть лимфоцитов самой крови (до 80%), а также оседают в периферических органах иммуногенеза (прежде всего в лимфатических узлах и селезенке), образуя в них тимус-зависимые зоны, которые становятся активными точками пролиферации (размножения) Т-лимфоцитов вне тимуса. Дифференциация Т-лимфоцитов происходит в трех направлениях. Первая группа дочерних клеток способна при встрече с «чужим» белком-антигеном (возбудителем болезни, или собственным мутантом) вступать с ним в реакцию и уничтожать его. Такие лимфоциты называются Т-киллераш («убийцами») и характеризуются тем, что способны собственными силами, без предварительной иммунизации и без подключения антител и защитного комплемента плазмы крови (толкование этих понятий см. далее), осуществлять лизис (уничтожение путем растворения клеточных мембран и н Связывание белков) клеток-мишеней (носителей антигенов). Таким образом, Т-киллеры является отдельной ветвью дифференциации стволовых клеток (хотя их развитие, как будет описано далее, регулируемый Г-хелперов) и предназначены создавать как бы первичный барьер в противовирусном и противоопухолевый иммунитет организма.
Другие две популяции Т-лимфоцитов называются Т-хелперы и Т-супрессоры и осуществляют клеточный иммунный защиту через регуляцию уровня функционирования Т-лимфоцитов в системе гуморального иммунитета. Т-хелперы («помощники») в случае появления в организме антигенов способствуют быстрому размножению эффекторных клеток (исполнителей иммунной защиты). Различают два подтипа клеток хелперов: Т-хелперы-1, выделяющие специфические интерлейкины типа 1Л2 (гормоноподобные молекулы) и в-интерферон и связаны с клеточным иммунитетом (способствуют развитию Т-хелперов) Т-хелперы-2 выделяют интерлейкины типа ИЛ 4-1Л 5 и взаимодействуют преимущественно с Т-лимфоцитами гуморального иммунитета. Т-супрессоры способны регулировать активность В и Т-лимфоцитов в ответ на антигены.
Гуморальный иммунитет
Гуморальный иммунитет обеспечивают лимфоциты, которые дифференцируются из стволовых клеток мозга не в тимуса, а в других местах (в тонкой кишке, лимфатических узлах, глоточных миндалинах и т. д.) и называются В-лимфоцитами. Такие клетки составляют до 15% всех лейкоцитов. При первом контакте с антигеном чувствительны к нему Т-лимфоциты интенсивно размножаются. Некоторые из дочерних клеток дифференцируют в клетки иммунологической памяти и на уровне лимфоузлов в £-зонах превращаются в плазматические клетки, далее способны создавать гуморальные антитела. Способствуют этим процессам Т-хелперы. Антитела представляют собой большие протеиновые молекулы, имеющие специфическое родство к тому или иному антигену (на основе химической структуры соответствующего антигена) и называются иммуноглобулинов. Каждая молекула иммуноглобулина составлена из двух тяжелых и двух легких цепей связанных друг с другом дисульфидных связей и способных активизировать клеточные мембраны антигенов и присоединять к ним комплемент плазмы крови (содержит 11 протеинов, способных обеспечивать лизис или растворения клеточных мембран и свя Связывание белков клеток-антигенов). Комплемент плазмы крови имеет два пути активизации: классический (от иммуноглобулинов) и альтернативный (от эндотоксинов или ядовитых веществ и от лекарств). Выделяют 5 классов иммуноглобулинов (lg): G, A, M, D, E, различающихся по функциональным особенностям. Так, например, lg М привычно первым включается в иммунный ответ на антиген, активизирует комплемент и способствует поглощению этого антигена макрофагами или лизису клетки; lg А размещается в городах наиболее вероятного проникновения антигенов (лимфоузлах желудочно-кишечного тракта, в слезных, слюнных и потовых железах, в аденоидах, в молоке матери и т. д.) чем создает прочный защитный барьер, способствуя фагоцитозу антигенов; lg D способствует пролиферации (размножению) лимфоцитов при инфекциях, Т-лимфоциты «распознают» антигены при помощи включенных в мембрану гаммаглобулина, образующих антитело, связывая звена, конфигурация которых соответствует трехмерной структуре антигенных детерминированных групп (гаптенов или низкомолекулярных веществ, которые могут связываться с белками антитела, передючы им свойства белков антигена), как ключ соответствует замку (Г. Вильям, 2002; Г. Ульмер и др.., 1986). Активированные антигеном В-и Т-лимфоциты быстро размножаются, включаются в процессы защиты организма и массово погибают. В то же время не многие из активированных лимфоцитов превращаются в В-и Т-клетки памяти, которые имеют длительный срок жизни и при повторном инфицировании организма (сенсибилизации) В-и Т-клетки памяти «вспоминают» и распознают структуру антигенов и быстро превращаются в эффекторные (активные) клетки и стимулируют клетки плазмы лимфоузлов на изготовление соответствующих антител.
Повторные контакты с определенными антигенами могут иногда давать гиперергични реакции, сопровождающиеся повышенной проницательностью капилляров, усилением кровообращения, зудом, бронхоспазм и т. п.. Такие явления называются аллергическим реакциям.
Неспецифический иммунитет, обусловленный наличием в крови «естественных» антител, которые часто возникают при контакте организма с кишечной флорой. Насчитывают 9 веществ, которые вместе образуют защитный комплемент. Одни из таких веществ способны нейтрализовать вирусы (лизоцим), вторые (С-реактивный белок) подавляют жизнедеятельность микробов, третьи (интерферон) уничтожают вирусы и подавляют размножение собственных клеток в опухолях и др.. Неспецифический иммунитет обусловливают также специальные клетки-нейтрофилы и макрофаги, способные к фагоцитозу, т. е. к уничтожению (переваривания) чужеродных клеток.
Специфический и неспецифический иммунитет подразделяется на врожденный (передастся от матери), и приобретенный, который образуется после перенесенной болезни в процессе жизни.
Кроме этого существует возможность искусственной иммунизации организма, которая проводится либо в форме вакцинации (когда в организм вводят ослабленный возбудитель болезни и этим вызывают активизацию защитных сил что до образования соответствующих антител), либо в виде пассивной иммунизации, когда делают так называемое прививки против определенной болезни путем введение сыворотки (плазмы крови не содержащая фибриногена, или фактора ее свертывания, а зато имеет готовые антитела против определенного антигена). Такие прививки делают, например, против бешенства, после укусов ядовитых животных и так далее.
Как свидетельствует В. И. Бобрицкая (2004) у новорожденного ребенка в крови насчитывается до 20 тыс. всех форм лейкоцитов в 1 мм3 крови и в первые дни жизни их количество растет, даже, до 30 тыс. в 1 мм3, что связано с рассасыванием продуктов распада кровоизлияний в ткани ребенка, которые обычно происходят при рождении. Через 7-12 первых дней жизни количество лейкоцитов снижается до 10-12 тыс. в I мм3, что и сохраняется в течение первого года жизни ребенка. Далее количество лейкоцитов постепенно уменьшается и в 13-15 лет устанавливается на уровне взрослых (4-8 тыс. в 1 мм 3 крови). У детей первых лет жизни (до 7 лет) среди лейкоцитов преувеличивают лимфоциты и только в 5-6 лет их соотношение выравнивается. К тому же дети до 6-7 лет имеют большое количество незрелых нейтрофилов (юных, палочки — ядерных), что и обуславливает относительно низкие защитные силы организма детей младшего возраста против инфекционных заболеваний. Соотношение различных форм лейкоцитов в составе крови называется лейкоцитарной формулой. С возрастом у детей лейкоцитарная формула (табл. 9) значительно меняется: растет число нейтрофилах тогда как процент лимфоцитов и моноцитов уменьшается. В 16-17 лет лейкоцитарная формула принимает состав, характерный для взрослых.
Инвазия организма всегда приводит к возникновению воспаления. Острое воспаление обычно порождается реакциями антиген-антитело при которых активация комплемента плазмы крови начинается через несколько часов после иммунологических повреждений, достигает своей вершины через 24 часа, а угасает через 42-48 часов. Хроническое воспаление связано с влиянием антител на Т-лимфоцитарная систему, привычно проявляется через возрастная характеристика лейкоцитарной формулы
1-2 дня и достигает пика через 48-72 часа. В месте воспаления всегда повышается температура (связано с расширением сосудов); возникает припухлость (при остром воспалении обусловлено выходом в межклеточное пространство белков и фагоцитов, при хроническом воспалении — добавляется инфильтрация лимфоцитов и макрофагов); возникает боль (связано с повышением давления в тканях).
Болезни иммунной системы очень опасны для организма и зачастую приводят к летательным последствий, так как организм фактически становится незащищенным. Выделяют 4 основных групп таких болезней: первичная или вторичная иммунная недостаточность, нарушение функции; злокачественные заболевания, инфекции иммунной системы. Среди последних известным является вирус герпеса и угрожающе распространяясь в мире, в том числе и в Украине, вирус анти-HIV или anmiHTLV-lll/LAV, который вызывает синдром приобретенного иммуннодифицита (AIDS или СПИД). В основе клиники СПИД лежит вирусное повреждение Т-хелперных (Th) цепи лимфоцитарной системы, что ведет к значительному росту количества Т-супрессорах (Ts) и нарушение соотношения Th / Ts, которое становится 2:1 вместо 1:2, следствием чего является полное прекращение продукции антител и организм погибает от любой инфекции.
Состав крови
Кровеносная, она же сердечно-сосудистая система обеспечивает циркуляцию крови и лимфы в организме человека. Среди всех органов тела только поверхность глаз может получать кислород непосредственно из воздуха. Все остальные органы и ткани, даже кожа, получают кислород с током крови.
Кровь относится к соединительной ткани, клетки в ней занимают гораздо меньший объем, чем межклеточное вещество. Кровь состоит из жидкости с растворенными веществами (плазмы) и форменных элементов: лейкоцитов, эритроцитов и тромбоцитов. Плазма крови образует внутреннюю среду организма: жидкость из крови «выдавливается» в ткани и становится тканевой жидкостью, избыток тканевой жидкости попадает в лимфатические сосуды, становясь лимфой. Лимфа в итоге попадает в кровоток, возвращая жидкость в кровь.
Плазма крови содержит 0,9% хлорида натрия (поваренная соль), поэтому для внутривенных вливаний используют водный 0,9% раствор NaCl («физиологический», или изотонический раствор). Другие соли и органические вещества в сумме занимают около 9% массы плазмы. Большую роль играют белки плазмы, особенно альбумины.
Для поддержания постоянной кислотности в плазме присутствуют буферные системы. Водородный показатель крови человека (pH) в среднем равен 7,4. При его смещении в кислотную или основную сторону происходят химические реакции в буферных системах, которые уравновешивают изменения кислотности.
Поддерживать постоянство внутренней среды (гемостаз) необходимо для нормальной жизни клеток. Клеточная мембрана проницаема для молекул воды, поэтому если снаружи концентрация раствора повышается (гипертонический раствор), вода стремится выйти из клетки по закону осморегуляции. Клетка при этом скукоживается, становится неправильной формы, многие ее органеллы перестают правильно работать.
Если же концентрация соли в окружающем растворе слишком мала (гипотонический раствор), вода стремится внутри клетки, чтобы «разбавить» ее содержимое. В этом случае клетки разбухают, мембрана может не выдержать и лопнуть. Таким образом, изменение солености крови может привести к необратимым изменениям в организме.
Клетки составляют около 45% объема крови. Выделяют «белую» кровь – лейкоциты и «красную» кровь – эритроциты. Эритроциты имеют небольшой размер и двояковогнутую дисковидную форму. Такая форма дает большую площадь поверхности при минимальном объеме, что повышает эффективность газообмена. Эритроциты человека не имеют ядра, они теряют его в процессе созревания.
Эритроциты
В 1 мл крови содержится 4-6 млн эритроцитов. Их главная функция – перенос кислорода, за это отвечает крупный белок – гемоглобин. Одна молекула гемоглобина состоит из четырех полипептидных цепей (глобина) и железосодержащих групп (гема). Каждая молекула гемоглобина может перенести четыре молекулы кислорода, причем способность связывать и отдавать кислород зависит от условий среды: в более щелочной среде (легких) гемоглобин лучше связывает кислород, в то время как в более кислой среде (тканях), он лучше отдает его.
Механизм действия гемоглобина
Помимо кислорода с гемоглобином могут связываться другие газы, самым опасным из которых является угарный (СО). Он образуется при неполном сгорании органики в условиях нехватки кислорода и не имеет цвета и запаха. Сродство гемоглобина к угарному газу гораздо выше, чем к кислороду, поэтому, однажды связавшись с гемоглобином, угарный газ будет еще долго циркулировать в крови. При этом свободных сайтов связывания кислорода станет меньше и ткани начнут страдать от его нехватки. Тяжелое отравление угарным газом требует немедленной специализированной помощи.
Лейкоциты
Лейкоциты являются основой клеточного иммунитета, это сферические клетки с достаточно крупным ядром. 1 мл крови содержит 4-11 тысяч лейкоцитов. Из всех клеток организма они наиболее уязвимы к действию радиации.
В зависимости от свойств лейкоциты делятся на несколько типов: содержащие гранулы, или гранулоциты (эозинофилы, нейтрофилы, базофилы) и не содержащие – агранулоциты.
Тромбоциты
Также кровь содержит тромбоциты, которые представляют собой отшнуровавшиеся куски гигантской клетки. Сами тромбоциты клетками не являются, они выглядят как мелкие пластинки неправильной формы и содержат только цитоплазму с гранулами. В гранулах находятся ферменты свертывающей системы, которые активируются при повреждении сосуда: образуется сгусток крови (тромб), который закупоривает поврежденный участок. 1 мл крови содержит 200-500 тысяч тромбоцитов.
Начало всем форменным элементам крови дают стволовые клетки красного костного мозга. Клетки крови постоянно обновляются, но у разных типов клеток обновление происходит с разной периодичностью. Эритроциты могут циркулировать 120-130 суток, в то время как лейкоциты и тромбоциты обычно живут не дольше 5-7 суток.
Иммунитет
Иммунная система защищает организм от воздействия бактерий, вирусов, грибов и паразитов, вредных веществ. В случае сбоя в работе иммунитета могут возникать аутоиммунные заболевания, в организме человека есть несколько механизмов, чтобы их предотвратить.
Органы, участвующие в формировании иммунитета
Основными органами иммунной системы являются селезенка, тимус (вилочковая железа) и костный мозг, где появляются и начинают созревать иммунные клетки. Клетки иммунитета циркулируют с кровью, располагаются в лимфоузлах и тканях, особенно много их в местах контакта с внешней средой (кожа, ЖКТ, дыхательные пути). Некоторые органы защищены от иммунного ответа барьерами, они называются иммунологически привилегированными органами. Это мозг, камеры глаза, семенники, плацента и плод и т.д. При травмах иммунологически привилегированных органов, когда нарушается целостность барьера, могут возникнуть аутоиммунные реакции.
Макрофаги
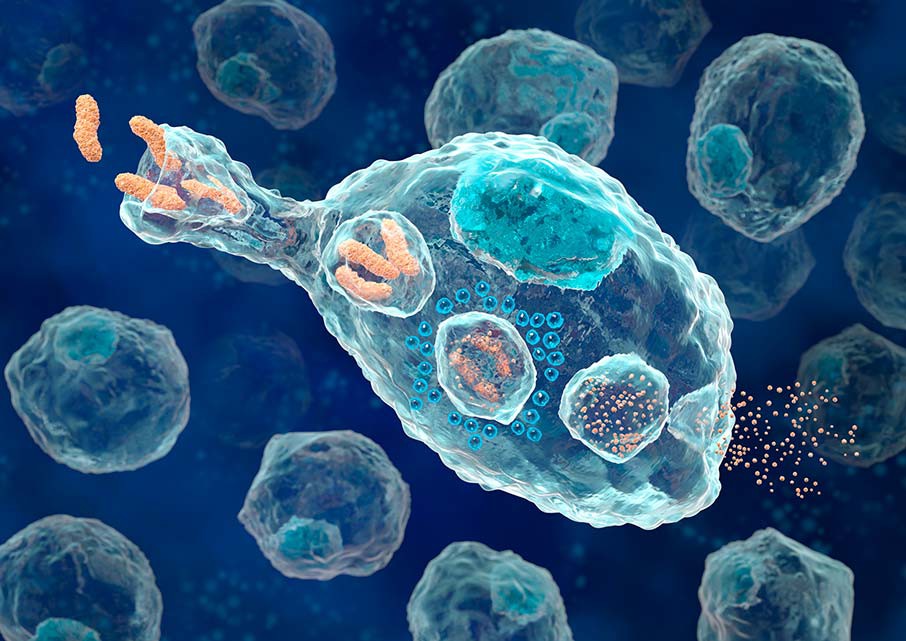
Другие клетки неспецифического иммунитета, которые первыми отвечают на воздействие, – макрофаги. Это крупные клетки, которые способны к активному передвижению и фагоцитозу, они пожирают бактерии и инородные тела. Самостоятельно распознавать чужеродные белки макрофаги не способны, их действие не избирательно. «Ориентируют» макрофагов на уничтожение конкретных клеток антитела.
Макрофаг, фагоцитирующий бактерии.
Другими клетками иммунитета являются нейтрофилы и эозинофилы. Они, как и макрофаги, являются фагоцитами (то есть способны к фагоцитозу). Кроме того, в их цитоплазме есть гранулы с едкими веществами, которые высвобождаются при активации клетки. Запускается каскад химических реакций, в ходе которых образуются активные формы кислорода, это называется кислородным взрывом. Нейтрофилы и эозинофилы, а также окружающие здоровые клетки тоже погибают в результате кислородного взрыва, их остатки фагоцитируют макрофаги. Эозинофилы играют основную роль в развитии аллергий.
Нейтрофил, эозинофил, базофил
Фагоциты способны к направленному движению (хемотаксису), их можно обнаружить во многих тканях и органах, даже на поверхности кожи. Благодаря их постоянной активности большая часть атакующих агентов не вызывает инфекции, то есть системного ответа организма. Инфекция возникает в том случае, если иммунитет ослаблен (переутомление, переохлаждение, голодание и т.д.) или если инфекционный агент не был вовремя распознан фагоцитами.
Различают два вида иммунитета: клеточный и гуморальный. Гуморальный иммунитет – это система комплемента и циркулирующие с плазмой крупные молекулы – антитела. Белки системы комплемента «помечают» чужеродные агенты, вызывая направленное движение клеток иммунитета. Также система комплемента может формировать поры в мембране бактерий, что будет вести к их разрушению.
Антитела
Каждое антитело имеет на конце вариабельные домены (участки), комплементарные к чужеродному белку и специфические для конкретного возбудителя. Они прикрепляются к комплементарным участкам белков, «помечая» их для других клеток иммунного ответа, например, для фагоцитов. Также антитела могут слипаться между собой, что вызывает агглютинацию возбудителя. Особенно эффективны антитела против бактерий.
На рисунке изображены молекулы антител. Каждая состоит из двух пар цепей, синим цветом нарисованы тяжелые цепи, коричневым – легкие.
Клеточный иммунитет состоит из Т и В-лимофцитов. Т-лимофоциты могут быть двух видов: Т-хелперы и Т-киллеры. Т-киллеры клетки-убийцы, они запускают процессы апоптоза, то есть запрограммированной гибели клеток, их самоуничтожения. Это необходимо, если клетки организма заражены вирусами или бактериями или если при делении в геноме появились мутации (то есть Т-киллеры борются также с раковыми клетками).
В-лимфоциты синтезируют антитела и таким образом управляют гуморальным иммунитетом. При миграции В-клеток из крови в ткань они дифференцируются в плазматические клетки.
Лимфоциты действуют избирательно, они «настроены» на уничтожение возбудителя с конкретными антигенами. Чтобы правильно «настроить» лимфоциты, нужны антиген-презентирующие клетки (АПК). АПК фагоцитируют чужеродных агентов и выставляют на своей поверхности участки их молекул в комплексе с МНС II (главный комплекс гистосовместимости II). Т-хелперы способны распознавать чужие молекулы на поверхности АПК и активировать иммунный ответ.
Специфический иммунитет очень эффективен, но требует времени на развертывание. От попадания возбудителя в кровь до выработки антител может пройти несколько дней.
К неспецифическому иммунитету относят в основном фагоциты, которые пытаются поглотить или разрушить любое инородное тело или подозрительную клетку, которую встречают.
Немаловажную роль в иммунной защите организма играет воспаление. Это сложный стадийный процесс, который имеет следующие признаки: отек, местное повышение температуры, покраснение, боль и утрата функции органа. Благодаря отеку затрудняется распространение возбудителей по организму, место проникновения ограничивается. При повышении температуры повышается активность некоторых белков гуморального иммунитета, в то время как активность бактерий и скорость их размножения снижаются. Воспалительный процесс особенно эффективен против паразитов.
N-киллеры (натуральные киллеры), как и Т-киллеры могут запускать процессы клеточной гибели. Однако они, в отличии от Т-клеток, не требуют специальной подготовки – презентации антигена и активации. N-киллеры хорошо борются с опухолями.
Интерфероны – белки крови, которые составляют основу противовирусного гуморального иммунитета. Вирусы проникают в клетки организма, после чего здоровые клетки перестают синтезировать необходимые белки и начинают воспроизводить белки и генетическую информацию вирусов. Чтобы остановить распространение вирусных частиц и выиграть время на формирование специфического иммунитета, интерфероны замедляют или даже останавливают синтез белка в зараженных клетках.
Неспецифический иммунитет не требует времени на развертывание, его действие начинается уже в первые минуты после воздействия. Однако и точность неспецифического иммунитета низкая, при развитии иммунного ответа могут страдать здоровые клетки.
Синтез клеток специфического иммунитета (лимфоцитов) включает в себя элемент случайности, только так можно достигнуть неимоверного разнообразия иммунных клеток. Чтобы в кровоток не выходили клетки, которые способны атаковать собственный организм, они проходят строгий отбор в органах иммунной системы, где происходит созревание лимфоцитов (тимус, лимфоузлы). Если в результате отбора оказывается, что юный лимфоцит распознает клетки своего организма в качестве «врагов», в нем запускается процесс апоптоза, самоуничтожения.
Группы крови. Гемотрансфузия.
На поверхности эритроцитов могут находиться белки-агглютиногены А и В. В зависимости от того, какие агглютиногены есть в организме, выделяют: I группу крови (без агглютиногенов), II (только А), III (только В) и IV (оба агглютиногена).
При гемотрансфузии (переливании крови) необходимо учитывать группу, чтобы избежать возникновения иммунного конфликта. Если человеку с I группой крови перелить любую другую, клетки его иммунитета распознают чужеродные белки-агглютиногены и выработают антитела. В результате все чужие эритроциты «слипнутся» (агглютинируют), что может быть очень опасно для организма хозяина. Поэтому людям с I группой крови можно переливать только кровь такой же группы.
Если же перелить кому-нибудь эритроциты I группы крови, не имеющие белков-агглютиногенов, реакции иммунитета не последует. Можно сказать, что обладатели I группы самые «щедрые», потому что могут поделиться своей кровью со всеми. Также их называют универсальными донорами.
Обратная ситуация с IV группой: в крови таких людей нет антител ни к агглютиногену А, ни к агглютиногену В, поэтому им можно перелить кровь любой группы. Однако при попадании эритроцита группы IV в организм с другой группой произойдет агглютинация, поэтому обладателей IV группы крови можно назвать самыми «жадными» или универсальными реципиентами. Соответственно, II группу крови нельзя перелить обладателю III и наоборот.
Помимо агглютиногенов А и В существует много других белков, которые могут привести к возникновению иммунного конфликта. Международное общество трансфузиологов в настоящее время признает всего 36 систем деления крови на группы. Наиболее часто применяют систему АВО, в которой также учитывают резус-фактор. Впервые этот белок был описан у макак-резусов, за что и получил свое название.
Большая часть людей резус-положительна (Rh+), то есть имеет на эритроцитах белок-резус. Им можно переливать кровь с любым резусом. Людям же с резус-отрицательной кровью (Rh-) можно переливать только резус-отрицательную кровь.
Резус-фактор может стать причиной резус-конфликта между матерью и плодом. Если у резус-отрицательной матери будет резус-положительный ребенок, то при попадании крови плода в кровоток матери сформируются антитела к Rh+ белку. Чаще всего смешение крови происходит при родах и не несет опасности для ребенка. Если же антитела каким-то образом появились до родов, они могут проникнуть через плаценту и вызвать агглютинацию эритроцитов плода, что приведет к его гибели. Такая опасность часто возникает при повторной беременности резус-отрицательных женщин.
Распространенность групп крови варьирует в разных популяциях. На картинке приведена частота встречаемость разных групп по системе АВО в мире.
Распространенность групп крови
