Лимфокины и роль в иммунитете
Ãëàâà 37
Ðîëü öèòîêèíîâ, ëèìôîêèíîâ, èíòåðëåéêèíîâ â ðåãóëÿöèè àêòèâíîñòè èììóííîé ñèñòåìû
Äëÿ âñåõ ôîðì èììóííîãî îòâåòà òðåáóåòñÿ ñîãëàñîâàííîå âçàèìîäåéñòâèå îñíîâíûõ ôàêòîðîâ èììóííîé ñèñòåìû: ìàêðîôàãîâ, Â-ëèìôîöèòîâ, Ò-ëèìôîöèòîâ, NK-êëåòîê, íóëåâûõ êëåòîê (Ê-êëåòîê), ñèñòåìû êîìïëåìåíòà, èíòåðôåðîíîâ, ãëàâíîé ñèñòåìû ãèñòîñîâìåñòèìîñòè, à òàêæå àíòèòåë. Âçàèìîäåéñòâèå ìåæäó íèìè îñóùåñòâëÿåòñÿ ñ ïîìîùüþ ðàçíîîáðàçíûõ ñèíòåçèðóåìûõ è ñåêðåòèðóåìûõ ìåäèàòîðîâ. Âñå èììóíîêîìïåòåíòíûå êëåòêè íåñóò íà ñâîèõ ìåìáðàíàõ óíèêàëüíûå ðåöåïòîðû, ñ ïîìîùüþ êîòîðûõ îíè ðàñïîçíàþò è âîñïðèíèìàþò ñèãíàëû îò äðóãèõ èììóííûõ êëåòîê, ïåðåñòðàèâàþò ñâîé ìåòàáîëèçì, ñèíòåçèðóþò èëè óñòðàíÿþò ñâîè ñîáñòâåííûå ðåöåïòîðû. Áëàãîäàðÿ ýòèì õèìè÷åñêèì ñèãíàëàì-ìåäèàòîðàì âñå êëåòêè èììóííîé ñèñòåìû ôóíêöèîíèðóþò êàê õîðîøî îòëàæåííûé ñèìôîíè÷åñêèé îðêåñòð, â êîòîðîì â êà÷åñòâå äèðèæåðîâ ïîñòîÿííî âûñòóïàþò òî îäíà, òî äðóãàÿ, à ÷àùå âñåãî îäíîâðåìåííî íåñêîëüêî åå ÷àñòåé. Áëàãîäàðÿ ïðÿìîé è îáðàòíîé ñâÿçè ìåæäó ðàçëè÷íûìè ñóáïîïóëÿöèÿìè êëåòîê èììóííîé ñèñòåìû, îñóùåñòâëÿåìîé êàê ïóòåì ïðÿìîãî êîíòàêòà, òàê è ÷åðåç ðàçëè÷íûå ôàêòîðû àêòèâàöèè, ïðîëèôåðàöèè, äèôôåðåíöèàöèè è ïðåçåíòàöèè (ïðåäñòàâëåíèÿ), îáåñïå÷èâàåòñÿ óñòîé÷èâûé ìåõàíèçì ñàìîðåãóëÿöèè âñåé èììóííîé ñèñòåìû. Ìåäèàòîðû, âûðàáàòûâàåìûå êëåòêàìè èììóííîé ñèñòåìû è ó÷àñòâóþùèå â ðåãóëÿöèè åå àêòèâíîñòè, ïîëó÷èëè îáùåå íàçâàíèå öèòîêèíîâ (ãðå÷. kytos êëåòêà, kineo ïðèâîäèòü â äâèæåíèå). Èõ ïîäðàçäåëÿþò íà ìîíîêèíû ìåäèàòîðû, ïðîäóöèðóåìûå ìîíîöèòàìè è ìàêðîôàãàìè, è ëèìôîêèíû ìåäèàòîðû, ñåêðåòèðóåìûå àêòèâèðîâàííûìè ëèìôîöèòàìè. Ëèìôîêèíû ïðåäñòàâëÿþò ñîáîé áåëêè è ïåïòèäû, íå îòíîñÿùèåñÿ ê èììóíîãëîáóëèíàì. Äëÿ òåõ ëèìôîêèíîâ, êîòîðûå õèìè÷åñêè èäåíòèôèöèðîâàíû è ïîëó÷åíû â ÷èñòîì âèäå, â 1979 ã. áûëî ïðåäëîæåíî íàçâàíèå èíòåðëåéêèíîâ, îíè îáîçíà÷àþòñÿ íîìåðàìè 1 20.
Èíòåðëåéêèíû ñåìåéñòâî áèîëîãè÷åñêè àêòèâíûõ ãîðìîíîïîäîáíûõ áåëêîâûõ ìîëåêóë, ðàçëè÷íûõ ïî ñòðóêòóðå è ôóíêöèÿì, êîòîðûå ó÷àñòâóþò â ðåãóëÿöèè èììóíèòåòà è âîñïàëèòåëüíûõ ïðîöåññîâ.  îòëè÷èå îò àíòèòåë èõ ñòðóêòóðà íå îïðåäåëÿåòñÿ ñòðóêòóðîé àíòèãåíà, èíäóöèðóþùåãî èõ ñèíòåç è ñåêðåöèþ. Ñèíòåç èíòåðëåéêèíîâ ïîáóæäàåòñÿ äåéñòâèåì íå òîëüêî àíòèãåíîâ, íî è äðóãèõ ôàêòîðîâ, â òîì ÷èñëå è ñàìèõ èíòåðëåéêèíîâ. Îíè ñèíòåçèðóþòñÿ ïðè ðàçëè÷íûõ èììóííûõ îòâåòàõ, èíôåêöèîííûõ ïðîöåññàõ, ïîâðåæäåíèè òêàíåé.
Âñå èíòåðëåéêèíû ïîëèôóíêöèîíàëüíû, à èõ äåéñòâèå îïîñðåäóåòñÿ ðàçëè÷íûìè êëåòî÷íûìè ïîâåðõíîñòíûìè ðåöåïòîðàìè. Íàèáîëåå ïîëíî èçó÷åíû ñëåäóþùèå èíòåðëåéêèíû.
Èíòåðëåéêèí-1 (IL-1). Áåëîê ñ ìîëåêóëÿðíîé ìàññîé 17,5 êÄ, ñèíòåçèðóåòñÿ ìàêðîôàãàìè, ìîíîöèòàìè, äåíäðèòíûìè, ýíäîòåëèàëüíûìè è ýïèòåëèàëüíûìè êëåòêàìè, NK-êëåòêàìè, ôèáðîáëàñòàìè, àñòðîöèòàìè. IL-1 ÿâëÿåòñÿ ôàêòîðîì àêòèâàöèè ëèìôîöèòîâ, êîôàêòîðîì ðîñòà è ñîçðåâàíèÿ Ò è Â-ëèìôîöèòîâ. Àêòèâèðóåò Ò è Â-ëèìôîöèòû, NK-êëåòêè, âûçûâàåò õåìîòàêñèñ ìàêðîôàãîâ, íåéòðîôèëîâ è ëèìôîöèòîâ, îáëàäàåò ïèðîãåííûì äåéñòâèåì. IL-1 èíäóöèðóåò ñèíòåç IL-2, IL-4, IL-6, ?-èíòåðôåðîíà, ýêñïðåññèþ ðåöåïòîðîâ IL-2. Ñóùåñòâóåò äâà âàðèàíòà èíòåðëåéêèíà-1 IL-1? è IL-1?; îíè êîäèðóþòñÿ ðàçíûìè ãåíàìè. Ñèíòåç IL-1 èíäóöèðóåòñÿ ËÏÑ, ìèòîãåíàìè, à òàêæå íåéðî è èììóíîïåïòèäàìè.
Èíòåðëåéêèí-2 (IL-2). Áåëîê ñ ìîëåêóëÿðíîé ìàññîé 15 êÄ. Ñèíòåçèðóåòñÿ òîëüêî àêòèâèðîâàííûìè Ò-êëåòêàìè, ñòèìóëèðóåò ðîñò è ñîçðåâàíèå àêòèâèðîâàííûõ Ò-êëåòîê è îáðàçîâàíèå èìè ëèìôîêèíîâ; ñòèìóëèðóåò àêòèâíîñòü Ò-öèòîòîêñè÷åñêèõ êëåòîê, NK-êëåòîê, ìîíîöèòîâ. ßâëÿåòñÿ êîôàêòîðîì ïðîëèôåðàöèè Â-ëèìôîöèòîâ, ñòèìóëèðóåò èõ ñîçðåâàíèå è çàùèùàåò êëåòêè îò àïîïòîçà.
Èíòåðëåéêèí-3 (IL-3). Ñèíòåçèðóåòñÿ àêòèâèðîâàííûìè Ò-êëåòêàìè. Ó ìûøåé èìååò ìîëåêóëÿðíóþ ìàññó 28 êÄ (ó ÷åëîâåêà îíà íå îïðåäåëåíà). IL-3 ñòèìóëèðóåò ðîñò ïîëèïîòåíòíûõ ñòâîëîâûõ êðîâåòâîðíûõ êëåòîê è èõ ñïåöèàëèçèðîâàííûõ ïîòîìêîâ. Ñòèìóëèðóåò «äûõàòåëüíûé âçðûâ» ôàãîöèòèðóþùèõ êëåòîê; íåîáõîäèì äëÿ ïîääåðæàíèÿ ðîñòà êëåòîê-ïðåäøåñòâåííèêîâ Â-ëèìôîöèòîâ è ìàñòîöèòîâ.
Èíòåðëåéêèí-4 (IL-4). Áåëîê, ó ìûøåé ñ ìîëåêóëÿðíîé ìàññîé 15 20 êÄ. Ñèíòåçèðóåòñÿ è âûäåëÿåòñÿ àêòèâèðîâàííûìè Ò-êëåòêàìè, ìàñòîöèòàìè, ëèíèåé Â-ëèìôîöèòîâ, ñëóæèò êîôàêòîðîì ñòèìóëÿöèè àíòèòåëîîáðàçîâàíèÿ; ÿâëÿåòñÿ ôàêòîðîì ðîñòà Ò-ëèìôîöèòîâ, ñòèìóëèðóåò àíòèãåíïðåäñòàâëÿþùèå ôóíêöèè ìàêðîôàãîâ è Â-ëèìôîöèòîâ, à òàêæå ÿâëÿåòñÿ ôàêòîðîì ðîñòà äëÿ ïðåäøåñòâåííèêîâ êðîâåòâîðíûõ êëåòîê.
Èíòåðëåéêèí-5 (IL-5). Áåëîê, ó ìûøåé ñ ìîëåêóëÿðíîé ìàññîé 45 60 êÄ. Ñèíòåçèðóåòñÿ Ò-êëåòêàìè. ßâëÿåòñÿ ôàêòîðîì, çàìåíÿþùèì Ò-õåëïåðíûå êëåòêè. Ñòèìóëèðóåò ïðîëèôåðàöèþ àêòèâèðîâàííûõ Â-ëèìôîöèòîâ è èõ ñîçðåâàíèå, à òàêæå ñåêðåöèþ àíòèòåë, ñòèìóëèðóåò ðîñò è ñîçðåâàíèå Ò-öèòîòîêñè÷åñêèõ ëèìôîöèòîâ, ðîñò è ñîçðåâàíèå ýîçèíîôèëîâ.
Èíòåðëåéêèí-6 (IL-6). Áåëîê ñ ìîëåêóëÿðíîé ìàññîé ó ÷åëîâåêà 19 34 êÄ. Ñèíòåçèðóåòñÿ Ò-ëèìôîöèòàìè, ìàêðîôàãàìè, ìîíîöèòàìè, ôèáðîáëàñòàìè, íåêîòîðûìè îïóõîëåâûìè êëåòêàìè, à òàêæå ãèáðèäîìàìè. ßâëÿåòñÿ ôàêòîðîì ðîñòà ïëàçìîöèòmîì è ãèáðèämîì. Ñòèìóëèðóåò îáðàçîâàíèå àíòèòåë Â-ëèìôîöèòàìè, ñèíòåç ìîëåêóë ÌÍÑ êëàññà I íà ôèáðîáëàñòàõ, ñèíòåç íåêîòîðûõ áåëêîâ êëåòêàìè ïå÷åíè, ÿâëÿåòñÿ êîôàêòîðîì ñòèìóëÿöèè ðîñòà Ò-ëèìôîöèòîâ.
Èíòåðëåéêèí-7 (IL-7). Èäåíòèôèöèðîâàí êàê ôàêòîð, ïîääåðæèâàþùèé ðîñò ïðå-Â-ëèìôîöèòîâ, ïîýòîìó ïîëó÷èë íàçâàíèå ëèìôîïîýòèíà 1. Áåëîê ñ ìîëåêóëÿðíîé ìàññîé ó ìûøåé 25 êÄ.
Èíòåðëåéêèí-8 (IL-8). Èäåíòèôèöèðîâàí êàê ãðàíóëîöèòíûé õåìîòàêñè÷åñêèé ôàêòîð. Ñòèìóëèðóåò àêòèâíîñòü íåéòðîôèëîâ. Áåëîê ñ ì. ì. 8,8 êÄ. Îñíîâíûå ïðîäóöåíòû ëèìôîèäíûå è ìàêðîôàãàëüíûå êëåòêè. Åãî ñèíòåç èíäóöèðóþò áàêòåðèàëüíûå àíòèãåíû, IL-1, ôàêòîð íåêðîçà îïóõîëåé.
Îñîáûé èíòåðåñ ñðåäè èíòåðëåéêèíîâ ïðåäñòàâëÿåò òàê íàçûâàåìûé íåéðîëåéêèí, èñïîëüçóåìûé íåðâíîé è èììóííîé ñèñòåìàìè. Íåéðîëåéêèí ïðîäóöèðóþò àêòèâèðîâàííûå Ò-ëèìôîöèòû; ÿâëÿÿñü ìåäèàòîðîì òðîôè÷åñêîé ñâÿçè ÷åðåç íåðâíî-ìûøå÷íûé ñèíàïñ, îí ñòèìóëèðóåò äèôôåðåíöèðîâêó Â-ëèìôîöèòîâ â àíòèòåëîîáðàçóþùèå êëåòêè, ò. å. âåäåò ñåáÿ êàê èíòåðëåéêèí. Ïî-âèäèìîìó, ñåìåéñòâî èíòåðëåéêèíîâ áóäåò ïîïîëíÿòüñÿ íîâûìè ïðåäñòàâèòåëÿìè, ñðåäè êîòîðûõ ìîãóò îêàçàòüñÿ ìåäèàòîðû, îïîñðåäóþùèå âçàèìîäåéñòâèå è âçàèìîðåãóëÿöèþ èììóííîé, íåðâíîé è ýíäîêðèííîé ñèñòåì.
 ïîñëåäíèå ãîäû óñòàíîâëåíî, ÷òî IL-1 ïðîäóöèðóþò íåéðîíû ãîëîâíîãî ìîçãà, ïåðèôåðè÷åñêèå ñèìïàòè÷åñêèå íåéðîíû è íîðàäðåíåðãè÷åñêèå êëåòêè ìîçãîâîãî âåùåñòâà íàäïî÷å÷íèêîâ. Îí àêòèâèðóåò ãèïîòàëàìî-ãèïîôèçàðíî-àäðåíîêîðòèêîòðîïíóþ ñèñòåìó è, ïî-âèäèìîìó, ñïîñîáåí èçìåíÿòü àêòèâíîñòü ðàçëè÷íûõ íåéðîãóìîðàëüíûõ ôàêòîðîâ.
Источник
Цитотоксические лимфокины LT составляют группу молекул, различающихся молекулярной массой в отношении нагревания, времени продукции активированными лимфоцитами. Предполагается, что они принимают участие в различных деструктивных процессах, протекающих в организме, таких, как реакция против трансплантата в противоопухолевом иммунитете, ГЗТ. В опытах in vitro показано, что они непосредственно вызывают лизис клеток.
Наконец, при исследовании лимфокинов были обнаружены факторы, способные активировать Т-лимфоциты путем усиления их ответа на митогены, а также поддержания длительного роста. Вначале они обозначались MF, однако в последнее время стало ясно, что эти активности обусловлены одним фактором и было предложено название интерлейкин-2.
Многие авторы надеются использовать свойство ИЛ-2 поддерживать длительный рост в культуре функционально активных, сенсибилизированных к определенному антигену Т-лимфоцитов в клинической практике при лечении некоторых опухолей.
Другая группа «гормонов» иммунной системы синтезируется моноцитами и живыми макрофагами и носит общее название — монокины. Они также разнородны по своим физико-химическим и биологическим свойствам. Среди них одним из важнейших является ИЛ-2. Этот термин был впервые введен в 1979 г. и заменил ряд наименований, которые присваивались различным феноменам, обнаруживаемым при изучении свойств надосадочной жидкости культуры стимулированных макрофагов, исходя из того, что каждая из биологических активностей индуцируется своим фактором: LAF, TRF, BAF, BCLF. Стимуляторами синтеза ИЛ-1 макрофагами могут служить эндотоксин, очищенный белковый дериват форбол-эстеразы, а также индукторы фагоцитоза. Некоторые Т-клеточные митогены опосредованно бывают стимуляторами синтеза ИЛ-1. В начале активирования Т-клетки продуцируют MAF, который затем индуцирует синтез ИЛ-1 макрофагами. ИЛ-1 имеет относительную молекулярную массу 12-18. В частности, он обладает способностью индуцировать к пролиферации Т-лимфоциты, однако ИЛ-1 не поддерживает длительный рост Т-клеток, в этом его принципиальное отличие от ИЛ-2. Стимулируя Т-клетки, ИЛ-1 побуждает их к синтезу ИЛ-2. Это наблюдение позволило высказать гипотезу о том, что пролиферация лимфоцитов зависит от каскада биологической активности ИЛ-1, согласно которой активация Т-клеток in vitro происходит, во-первых, за счет стимуляции антигеном или митогеном и, во-вторых, вследствие синтеза ИЛ-2 под влиянием ИЛ-1. Следовательно, ИЛ-1 рассматривается как сигнал, благодаря которому Т-клетка подготавливается к ответу на антигены. Такая связь между ИЛ-1 и ИТЛ-2 необходима для полной активации Т-клеток и проясняет роль данных медиаторов как амплификаторов иммунного ответа. И хотя большинство данных было получено в опытах in vitro, тот факт, что введение мышам, лишенным Т-клеток, ИЛ-2 приводит к индукции Т-клеточной цитотоксичности, по-видимому, свидетельствует о возможной роли данного лимфокина in vitro.
В последнее время с помощью техники моноклональных антител показано, что на В-клетках находятся рецепторы для ИЛ-1, полностью схожие с имеющимися на мембранах Т-лимфоцитов.
Человеческие макрофаги продуцируют также колониестимулирующий фактор, индуцирующий рост колоний моноцитов и гранулоцитов в костном мозге.
Монокин IDS, ингибирующий синтез ДНК, подавляет пролиферацию лимфоцитов и фибробластов на стадии G-клеточного цикла. Макрофаги продуцируют также некоторое количество интерферона, который связывается НК-клетками.
Выше описаны лимфокины и монокины, неспецифические в проявлении своих функций. Однако существует и описан, в большинстве случаев у мышей, но в том числе и у людей, ряд антигенспецифических факторов, контролируемых генами, локализующимися в МНС. Это, например, продуцируемые Т-клетками хелперные факторы для IgE, антигенспецифические хелперные, а также супрессорные факторы. Их синтез индуцируется при контакте клеток с антигеном, а активность проявляется только по отношению к индуцирующему антигену.
Источник
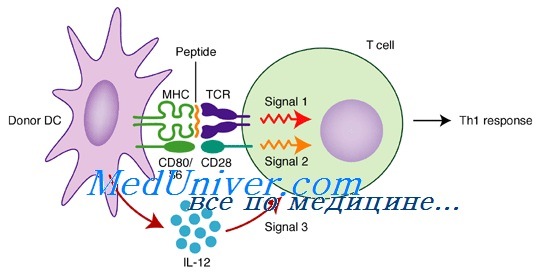
Лимфокин-активированные киллеры для иммунизации. Влияние лимфокин-активированных киллеров на врожденный иммунитетIL-2 или его экзогенные аналоги стимулируют пролиферацию естественных киллеров и усиливают их цитолитические функции, приводя к образованию так называемых лимфокин-активированных киллеров (ЛАК). По своей природе ЛАК являются цитотоксическими лимфоцитами, которые способны уничтожать клетки, зараженные вирусами или внутриклеточными бактериями и опухолевые клетки. В настоящее время возможности ЛАК-терапии исследуются при различных формах онкологических заболеваний. При инфекционных заболеваниях метод адоптивного переноса ЛАК практически не изучался. Лимфокин-активированные киллеры получали из МЛ селезенки мышей при культивировании в течение двух суток в среде RPMI-1640, содержащей 1000 МЕ/мл IL-2, затем клетки отмывали и использовали в эксперименте. Таким образом, при воздействии IL-2 на МЛ селезенок мышей происходила генерация ЛАК, характеризующаяся пролиферацией и активацией клеток лимфоидного ряда. Повышенная экспрессия активаци-онных антигенов, формирующая особенности иммунофенотипа ЛАК, также свидетельствовала о процессах активации лимфоцитов. Кроме того, нами было выявлено, что ЛАК обладали достоверно более высокой киллерной активностью по сравнению с интактными МЛ по отношению к NK-чувствительной линии клеток мышиной лимфомы YAC-1. Согласно сложившемуся мнению, NK — основная субпопуляция лимфоцитов, экспрессирующая р75р цепь рецептора IL-2 и селективно активирующаяся и пролиферирующая под его воздействием с образованием ЛАК, способных эффективно лизировать опухолевые клетки-мишени. Однако наряду с изложенными представлениями, имеются данные о существовании в популяции ЛАК NKT-клеток, экспрессирующих не только маркеры NK (CD16, CD56), но и Т-клеточные дифференцировочные антигены (CD3, CD4, CD8). Эти данные соответствуют высказанным ранее предположениям о NK-клетках, которые рассматривались не только как самостоятельная субпопуляция, но и как этап дифференцировки зрелых лимфоцитов. Из зрелых лимфоцитов при инкубации с IL-2 могут быть получены так называемые NK-ЛАК-клетки.
В наших экспериментах после культивирования МЛ селезенки мышей с IL-2, были получены ЛАК, экспрессирующие на своей мембране активационные молекулы (CD25) и молекулы главного комплекса гисто-совместимости МНС I, МНС II. В то же время, в популяции ЛАК, кроме NK, присутствовали клетки, экспрессирующие и Т-клеточные дифференцировочные антигены (CD3, CD4, CD8). Последние в таких же количествах были выявлены в исходной популяции МЛ. Использованная технология получения лимфокин-активированных киллеров обеспечила существенное увеличение NK-клеток с 1,5 до 20,3%, а также клеток, содержащих маркер CD25 и молекул антигенного представления МНС I и II. Полученную суспензию лимфокин-активированных киллеров вводили мышам внутрибрюшинно по 2,5 х 106 клеток в 0,5 мл 0,9% раствора натрия хлорида. Затем, внутрибрюшинно вводили по 250 клеток в объеме 0,5 мл К pneumoniae K2. В качестве контроля были использованы МЛ, культивировавшиеся в присутствии ФГА (10 мкг/мл). Лимфокин-активированные киллеры у инфицированных К. pneumoniae (100 LD50) мышей обеспечивали 100 % выживание животных при практически одновременном внутрибрюшинном введении киллерных и микробных клеток. МЛ, активированные ФГА, защищали в 50 % случаев при 100% гибели интактных мышей, получивших ту же заражающую дозу. При определении цитокинов в культуральной среде ЛАК выявлялось повышенное содержание IL-1 через 24 ч и 72 ч инкубации (254+12,3 пг/мл и 213±11,5 пг/мл, соответственно), через 72 ч — IL-6 (224±21,2 пг/мл) и IL-10 (150±10,5 пг/мл) по сравнению с культурой МЛ (содержание этих цитокинов в контроле не превышало 25-80 пг/мл), инкубированных без IL-2. Интересно отметить, что в культуральной среде ЛАК не увеличивалось содержание регуляторного IL-12, что мы в значительных количествах определяли в культуральной среде ДК. Цитотоксическую активность лимфокин-активированных киллеров, полученных из селезенки мышей (СВА), определяли на NK-зависимой линии клеток мышиной лимфомы YAC-1 в тесте восстановления 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ-тест). Опухолевые клетки (1 х 104 в 1 мл) инкубировали в культуральной среде с ЛАК в разных соотношениях и по оптической плотности при длине волны 540 нм, рассчитывали процент лизиса опухолевых клеток (процент цитотоксичности). При соотношении 1:5 ЛАК и опухолевых клеток мышиной лимфомы YAC-1 цитотоксическая активность киллеров увеличивалась в 6 раз по сравнению с МЛ. В данных условиях МЛ лизировали 15,5 % клеток линии К562, в то время как в аналогичных условиях ЛАК вызывали гибель 92,2 % опухолевых клеток (р < 0,01). В меньших соотношениях мишени/эффекторы (1:2 и 1:1) эти различия не столь значимы, хотя цитотоксическая активность ЛАК превышает таковую у МЛ интактных мышей. — Также рекомендуем «Регуляция иммунного ответа. Влияние интерлейкина-10 (IL-10) на имуннитет» Оглавление темы «Стимуляция врожденного иммунитета»:
|
Источник
Не все индуцированные антигеном В-лимфоциты подвергаются дифференцировке до конца. Часть из них после нескольких циклов деления перестает размножаться и образует субклон клеток памяти (из одной В-клетки образуется около 1000 клеток памяти, таким же образом образуются клетки памяти и из Т-лимфоцитов). Клетки памяти определяют продолжительность приобретенного иммунитета. При повторном контакте с данным антигеном они быстро превращаются в клетки-эффекторы. При этом В-клетки памяти обеспечивают синтез антител в более короткие сроки, в большем количестве и с более высоким сродством антител другого класса иммуноглобулинов — IgG вместо IgМ.
Таким образом, наиболее важными событиями дифференцировки В-лимфоцитов являются: 1) сборка гена иммуноглобулина из его фрагментов, содержащихся в ДНК эмбриональных клеток; 2) формирование пула клеток памяти; 3) возникновение новых вариантов генов в результате дополнительных класс-переключающих рекомбинаций; 4) вспышка соматических мутаций на строго определенной стадии дифференцировки. В результате этих событий происходит образование множества генетически стабильных клонов антителообразующих клеток (вероятно, не менее чем 108).
Происхождение и дифференцировка Т- и В-лимфоцитов и макрофагов из исходных стволовых клеток.
В соответствии с этой схемой, исходная костно-мозговая клетка (НSС) генерирует два типа предшественников: лимфоидную стволовую клетку (LSС), от которой происходят клетки-предшественники Т-лимфоцитов (РТС), клетки-предшественники В-лимфоцитов (РВС); и клетку, являющуюся предшественником клеток красной крови, от которой, в свою очередь, происходит предшественник лейкоцитов (СFUс) и берет начало система мононуклеарных макрофагов. Предшественники Т-лимфоцитов под влиянием тимуса превращаются в Т-лимфоциты и их субклассы.
В целом система В-лимфоцитов обеспечивает синтез антител, отвечает за иммунитет против большинства бактериальных и вирусных инфекций, анафилаксию и другие реакции гиперчувствительности немедленного типа, некоторые аутоиммунные болезни, за формирование клеток иммунной памяти и иммунологическую толерантность.
Система Т-лимфоцитов играет регуляторную роль по отношению к В лимфоцитам, отвечает за все реакции гиперчувствительности замедленного типа, иммунитет против вирусных и некоторых бактериальных инфекций (туберкулез, бруцеллез, туляремия и др.), осуществляет иммунологический надзор, отвечает за противоопухолевый иммунитет, иммунологическую толерантность, некоторые виды иммунопатологии.
Вместе с тем Т- и В-клетки являются двумя частями единой иммунной системы организма. Поэтому деление иммунитета на гуморальный и клеточный носит весьма условный характер, так как антитела синтезируются В-клетками. а Т-лимфоциты и другие клетки осуществляют свою иммунокомпетентность через синтезируемые ими гуморальные факторы (цитокины, лимфокины, интерлейкины и др.).
Координированное взаимодействие макрофагов, Т- и В-лимфоцитов при встрече с антигеном обеспечивает выдачу адекватного иммунного ответа.
Дата добавления: 2015-01-29; просмотров: 12; Нарушение авторских прав
Источник
