Механизмы неэффективности противоопухолевого иммунитета
Исследование противоопухолевого иммунитета и устранение факторов, вызывающих его ухудшение, являются важными проблемами в современной медицине. Злокачественные новообразования занимают одно из лидирующих мест среди причин смертности и инвалидизации населения в развитых странах. В норме баланс количества делящихся и отмирающих клеток регулируется естественным образом. Если размножение клеток приобретает неконтролируемый характер, то возникают злокачественные опухоли. Механизм контроля этого процесса со стороны иммунной системы зависит от нескольких факторов, подавляющих или стимулирующих процесс избыточного деления.
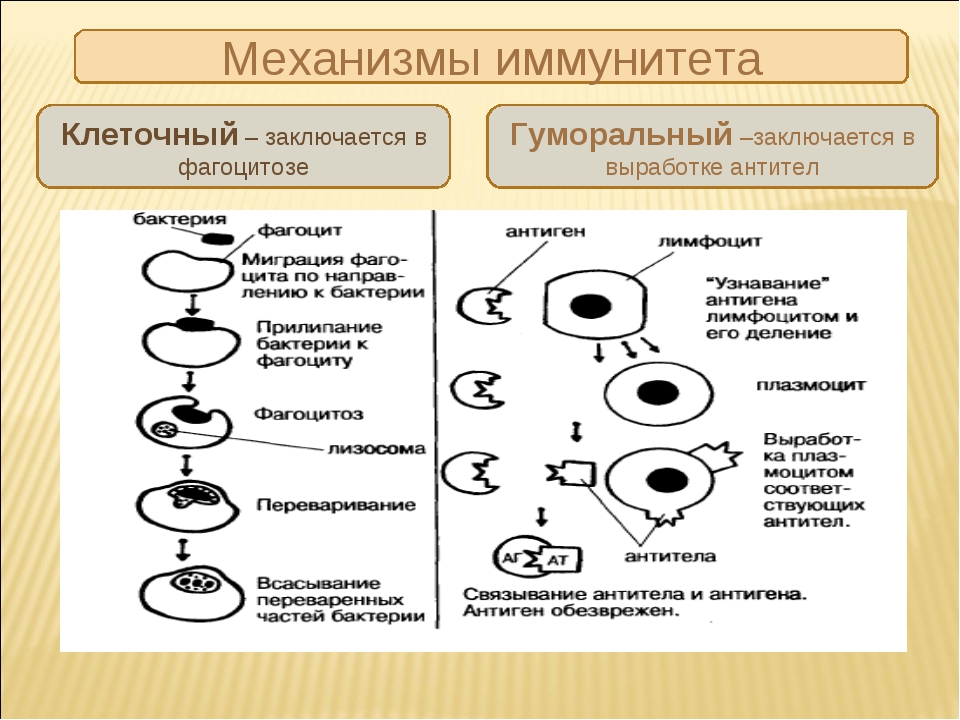
Общее описание
Под иммунитетом принято понимать совокупность защитных механизмов живого организма от негативного воздействия чужеродных агентов. Чаще всего эти процессы связаны с инфекционными (бактериальными, вирусными, грибковыми, протозойными) заболеваниями. Однако существуют и другие способы защиты, одним из которых является противоопухолевый иммунитет.
В деятельности любого живого организма возникают моменты, когда ему необходимо быстрое деление клеток (травма, воспалительный процесс и другие). При развитии определенного иммунного ответа количество клеток, чувствительных к воздействию антигена (молекулы, связанной с антителом), увеличивается в несколько тысяч раз. При нормальном течении процесса после завершения данной реакции ускоренное деление клеток останавливается.
Для злокачественной опухоли характерно нарушение этого механизма. Размножение клеток продолжается постоянно и имеет независимый характер. Постепенно происходит замещение нормальных тканей в пораженном органе и прорастание опухоли в окружающие области. Перемещаясь по кровяному руслу, клетки опухоли продолжают делиться и в другой локализации, что приводит к появлению метастаз. Этот дефект непрерывного деления наследуется всеми потомками опухолевых клеток. Их мембраны изменены таким образом, что человеческий организм воспринимает объекты как чужеродные.
С другой стороны, в организме имеется способ, который может остановить этот процесс, – противоопухолевый иммунитет. В иммунологии возникновение опухолей является свидетельством того, произошли нарушения естественного защитного механизма.
История открытия
Еще в 18 веке было замечено, что у некоторых больных, перенесших инфекционные болезни, исчезали злокачественные опухоли. В конце 19 века американский хирург-онколог Вильям Коли выявил взаимосвязь между заражением гемолитических стрептококком Streptococcus pyogenes и уменьшением (а в некоторых случаях – и полным исчезновением) опухолей злокачественного характера. Им была разработана противораковая вакцина на основе этих бактерий для лечения пациентов с саркомой. В то время еще не были известны механизмы противоопухолевого иммунитета в иммунологии, поэтому его работы подвергались сильной критике, а впоследствии были забыты почти на 100 лет.
В середине XX века было открыто, что введение макромолекул липосахарида, из которых состоят оболочки клеток микробов, может приводить к отмиранию опухолей. Однако в 70-е гг. XX в. ученые установили, что этот процесс вызывает не сам липосахарид, а белковый фактор (фактор некроза опухоли, или ФНО), вырабатываемый следующими типами клеток иммунной системы при контакте с микробами:
- активированные макрофаги;
- нейтрофилы;
- Т-лимфоциты;
- тучные клетки;
- астроциты;
- NK-клетки (натуральные киллеры).
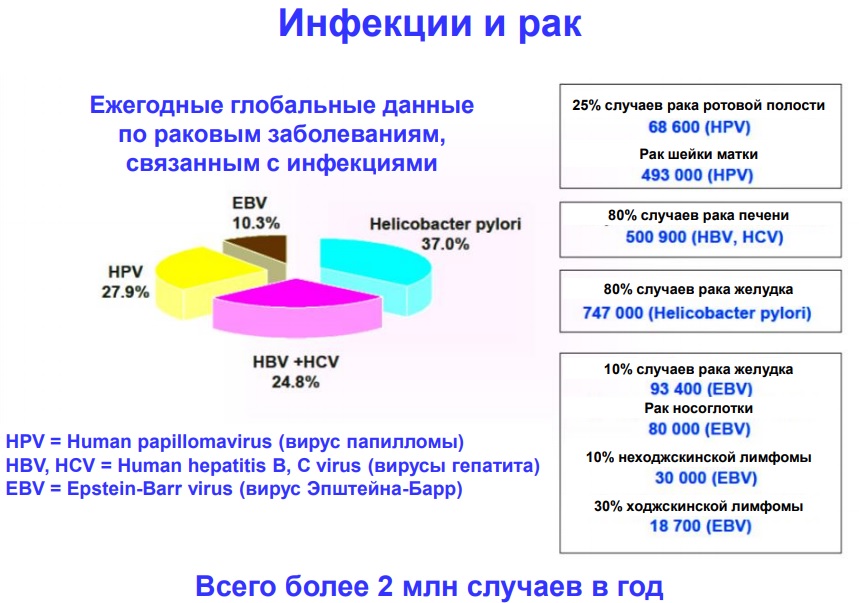
Взаимосвязь иммунитета и образования опухолей
В пользу наличия связи между состоянием иммунитета и развитием злокачественных опухолей свидетельствуют следующие факты:
- увеличенная распространенность таких новообразований у пациентов с иммунодефицитным состоянием, а также в пожилом возрасте (что связано со снижением защитных сил организма);
- выявление у больных специфических антител и Т-клеток, чувствительных к антигенам опухолей;
- возможность формирования противоопухолевого иммунитета и иммунопролиферативных заболеваний (при искусственном введении антител и подавлении иммунитета соответственно).
Защитная функция иммунитета заключается не только в уничтожении чужеродных агентов (вирусов, грибков и бактерий), но и клеток-мутантов, из которых образуются опухоли. Для них характерна антигенная специфичность, которая зависит от причины появления новообразования:
- вирусы (папилломы, лейкоза и другие);
- химические канцерогены (метилхолантрен, бензопирен, афлотоксины и другие);
- эндокринные нарушения (метаболическая иммунодепрессия);
- физические факторы окружающей среды (все виды излучений).
Естественный противоопухолевый иммунитет очень слабо влияет на уже сформировавшееся злокачественное новообразование. Это связывают со следующими факторами:
- быстрый рост опухоли, опережающий активизацию иммунных сил;
- выделение опухолевыми клетками антигенов, которые связывают соответствующие рецепторы на поверхности лимфоцитов-киллеров;
- подавление клеточного иммунитета со стороны новообразования.
Принцип действия
Механизм противоопухолевого иммунитета в медицинской науке еще мало изучен. Несмотря на то что выявлена его защитная функция, антитела могут отражать опухолевые антигены, не вызывая разрушения злокачественных клеток. В некоторых случаях иммунотерапия даже дает обратный эффект, способствуя увеличению новообразования.
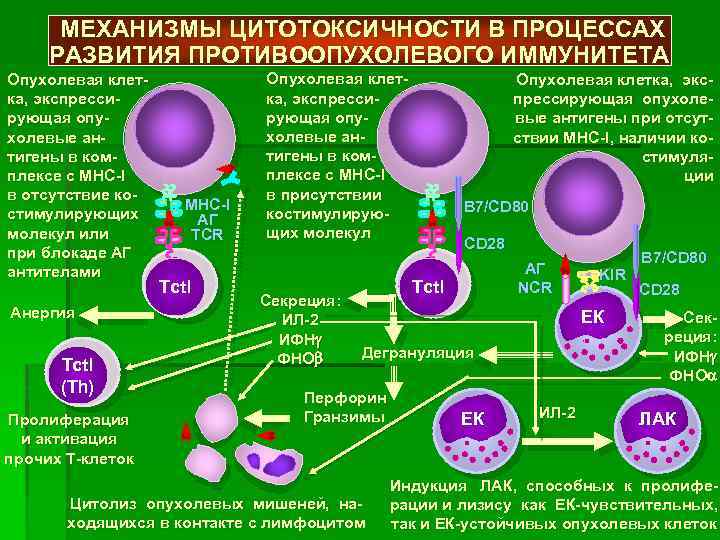
Согласно современным представлениям, ключевую роль в данном процессе играют активизированные макрофаги и клетки-киллеры. Особенностью противоопухолевого иммунитета является то, что он характеризуется сложным механизмом взаимодействия организма-хозяина и новообразования. Выделяют 4 основные группы факторов:
- Антибластомные – гуморальные и клеточные (Т-лимфоциты, ФНО, макрофаги, ЕК- и К-клетки, специфические антитела, интерфероны, интерлейкины), подавляющие развитие опухоли и разрушающие ее клетки.
- Иммунорезистентность новообразования, или его способность противостоять противоопухолевому иммунитету.
- Пробластомные: угнетающие иммунитет (вещества-супрессоры, вырабатываемые макрофагами и лимфоцитами; гормоноподобные соединения, интерлейкин-10, циркулирующие иммунные комплексы, протеины группы TGFβ, состоящие из антигенов, антител и компонентов комплемента); усиливающие иммунитет (ФНО, вырабатываемый макрофагами; гамма-интерферон, интерлейкины 2 и 6, фактор роста эндотелия; иммунодефицитные состояния).
Эффекторные механизмы
Основной функцией эффекторных механизмов противоопухолевого иммунитета является блокирование и уничтожение патогенов. Выделяют 2 группы рецепторов, избирательно связывающиеся со специфическими антигенами. На основании этого различают также 2 типа эффекторных механизмов:
- Гуморальный, функционирующий за счет растворимых (гуморальных) факторов – антител, которые связывают и удаляют антиген.
- Клеточный (антителонезависимый), реализующийся с участием клеток иммунной системы, важнейшими из которых являются Т-лимфоциты, макрофаги, NK-клетки. Они непосредственно разрушают чужеродные, инфицированные и опухолевые клетки.
Если патологически измененная клетка избежала гибели при воздействии эффекторных механизмов, то может наступить период равновесия между ее делением и подавляющим влиянием иммунитета. При прогрессировании злокачественного процесса происходит выход опухолевой ткани из-под контроля иммунных механизмов.
Важнейшую роль в подавлении деления клеток играют 2 типа лимфоцитов, запускающих процесс некроза – Т-лимфоциты и NK-клетки, распознающие стрессорные молекулы, которые выделяет новообразование. Т-лимфоциты формируются в течение более длительного времени, а их предшественники распознают опухолевые антигены. Th1-лимфоциты запускают механизм воспаления, что приводит к активизации макрофагов. Продукты секреции последних способствуют нарушению местного кровоснабжения тканей, что также влечет гибель тканей опухоли.
Участие Т-лимфоцитов проявляется в пропитывании злокачественного новообразования лимфоидными клетками, которые разрушают его клетки путем растворения, или цитолиза. Активизация лимфоцитов происходит под действием цитокинов – белковых информационных молекул, с которыми они вместе проникают в опухоль.
Большое значение среди внутренних факторов, присущих иммунной системе организма человека, имеет также гамма-интерферон. Его функции заключаются в следующем:
- Подавление деления опухолевых клеток.
- Активизация процесса их запрограммированной гибели.
- Стимулирование выработки цитокинов, которые привлекают в новообразование Т-лимфоциты.
- Активация макрофагов и развития Т-хелперов, необходимых для укрепления противоопухолевого иммунитета.
- Подавление образования новых кровеносных сосудов, что ухудшает питание опухоли и способствует более быстрой гибели ее клеток.
Противоопухолевый иммунитет: причины его низкой эффективности
Рост злокачественных новообразований и их устойчивость к иммунитету объясняются следующими причинами:
- слабая способность индуцирования иммунного ответа у опухолевых антигенов;
- выживание (естественный отбор) опухолевых клеток, устойчивых к иммунитету;
- постоянное видоизменение антигенов;
- наличие капсулы у опухоли;
- секреция опухолевых антигенов в растворимой форме, что приводит к подавлению иммунного ответа;
- расположение новообразования в местах, где возникновение антигена не приводит к воспалительному иммунному ответу (так называемая «привилегированная» локализация – костный мозг, нервная, эндокринная и половая система, тимус);
- утрата некоторых компонентов эффекторной системы в результате генетических или приобретенных (вторичных) иммунодефицитных состояний;
- производство опухолевыми клетками пробластомных факторов, подавляющих иммунитет и способствующих увеличению новообразования;
- у новорожденных – незрелость эффекторных систем, влекущее за собой нераспознавание опухолевых клеток.
Эти механизмы неэффективности противоопухолевого иммунитета приводят к тому, что новообразование становится мало иммуногенным и не воспринимается организмом как чужеродный элемент. В результате снижается защитная реакция. Иммунные механизмы не могут привести к отторжению уже сформировавшейся злокачественной опухоли.
Особенности
К особенностям противоопухолевого иммунитета относятся:
- Основную роль в иммунном ответе играют Т-лимфоциты, макрофаги и NK-клетки, разрушающие опухолевую ткань. Значение гуморального иммунитета значительно меньше.
- Раковые антигены распознаются или непосредственно макрофагами и дендритными клетками, отвечающими за врожденный и адаптивный иммунитет, или через Th1-хелперы.
- Взаимодействие организма и опухоли происходит по трем направлениям: естественная и приобретенная резистентность к злокачественным новообразованиям, иммунодепрессия со стороны опухоли. Совокупность этих факторов и составляет противоопухолевый иммунитет.
- Злокачественные клетки в процессе естественного отбора приобретают механизмы защиты против врожденного иммунитета. Формируется их новый фенотип, происходит эволюция новообразования.
Опухолеассоциированные антигены разделяют на 2 группы – первого типа (характерны для многих видов новообразований, имеют вирусное происхождение) и второго, очень специфичные и обнаруживаемые у всех пациентов, имеющих данный вид опухоли.
Одной из общих особенностей противовирусного и противоопухолевого иммунитета является то, что он носит как специфический характер, то есть направлен против определенных видов патогенов, так и неспецифический (уничтожает все чужеродное организму). Неспецифическими факторами служат мононуклеарные и NK-клетки, активизирующиеся под влиянием интерлейкина 2 и интерферонов, а также лимфокин-активированные киллерные клетки и цитокины.
Иммунодиагностика
В последние годы в медицине находит применение иммунодиагностика злокачественных новообразований. В ее основе лежит выявление в крови следующих белковых соединений:
- антигены, ассоциированные с опухолями;
- антитела;
- лимфоциты, восприимчивые к опухолевым антигенам.
Малоинвазивная иммунодиагностика позволяет выявить рак различных органов на ранней стадии развития опухоли по наличию специфических антигенов (в скобках указана локализация злокачественного новообразования):
- PSA (простата).
- P-53 (мочевой пузырь).
- SCC (легкие, пищевод, прямая кишка).
- СА-19-9 (поджелудочная железа).
- СА-125 (яичники).
- СА-15-3 (молочная железа).
Однако антитела к определенному антигену в крови пациентов с раком определяются нечасто (в 10 % случаев). Иммуноглобулины к опухолеассоциированных антигенов выявляют чаще – у 50 % больных. В настоящее время в медицинской научной среде ведутся поиски и других антигенов, помогающих в диагностике рака.
Иммунопрофилактика и лечение

Для повышения противоопухолевого иммунитета используют иммуномодуляторы, опосредованно активизирующие клетки иммунной системы:
- Интерлейкины 1 и 2. Эти белковые соединения относятся к группе провоспалительных цитокинов (информационных молекул) и являются биологически активными веществами, вырабатываемыми лейкоцитами. Интерлейкины – главные участники в процессе формирования иммунного ответа при внедрении патогенов в микробиологии. Противоопухолевый иммунитет активизируется за счет активного деления лимфоцитов (Т-киллеры, NK-клетки, Т-хелперы, Т-супрессоры и продуценты антител). Интерлейкин 2 также активизирует выработку фактора некроза опухолей.
- Препараты из группы интерферонов. Они стимулируют иммунный ответ путем представления Т-лимфоцитам антигенов, которые были захвачены макрофагами и дендритными клетками. Т-хелперы выделяют белковые информационные молекулы, активирующие работу других клеток иммунной системы. В результате происходит повышение противоопухолевого иммунитета. Отдельные виды интерферонов (гамма-интерферон) могут непосредственно воздействовать на макрофаги и киллеры.
- Адъюванты. Они вводятся вместе с основными иммунобиологическими медицинскими препаратами и служат для усиления ответа со стороны защитных сил организма. Чаще всего их используют для здоровых людей при вакцинации. Одной из особенностей противоопухолевого иммунитета в микробиологии, касающейся данного типа веществ, является то, что они могут концентрировать на своей поверхности антигены. Это обеспечивает более длительный эффект. Для целенаправленной доставки антигенов в органы лимфатической системы применяют липосомы – пузырьки с липидными биослоями. Наиболее распространенными веществами этой группы являются полный и неполный адъювант Фрейнда, гидроксид алюминия, коклюшная палочка, осажденная на алюминиевых квасцах; Полиоксидоний.
- Элементы клеток бактерий (иммуностимуляторы Продигиозан, Ликопид, Ромуртид и другие).
Проведенные на животных эксперименты показывают, что при введении опухолевых антигенов происходит формирование иммунологической памяти. В результате после этого отторгается трансплантируемая злокачественная опухоль. В последние годы в медицине ведутся активные разработки, которые дадут возможность создания противоопухолевой иммунной памяти путем вакцинации. Пока в этом направлении создан один тип прививок – для повышения иммунитета к вирусам папилломы человека, которые индуцируют возникновение рака шейки матки у женщин («Гардасил» и «Церварикс» зарубежного производства).
Виды опухолей
Иммунотерапия является эффективной в отношении следующих видов опухолей:
- меланома, возникающая из меланоцитов – пигментных клеток;
- неходжкинские лимфомы, происходящие из лимфоцитов;
- рак почек, прямой кишки, яичников;
- волосатоклеточный лейкоз (поражение В-лимфоцитов, белых клеток крови);
- глиома (опухоль мозга);
- саркома мягких тканей, происхождение которой связано с эпителиальными клетками и соединительной тканью.
Источник
При такой постоянной угрозе появления и размножения в организме генетически чужеродных клеток высшие организмы могут выживать только с помощью подавления мутантных клеток.
В настоящее время доказано, что иммунная система имеет решающее значение в борьбе со злокачественными опухолями.
Так, установлено, что у больных с врожденными иммунодефицитами раковые опухоли возникают в 1000 раз чаще по сравнению со здоровыми людьми.
Характерными особенностями злокачественных опухолей являются нерегулируемое размножение клеток, пониженная в цитологическом и антигеном отношении дифференциация, способность инвазировать в окружающие ткани, вызывать их деструкцию и дессиминировать.
1993г. Р. Вирхов высказал предположение, что причиной возникновения рака является изменения клеток некоторыми химическими веществами (канцерогенами).
П. Эрлих полагал, что появляющиеся в неонатальном и эмбриональном периоде клетки опухолей подавляются иммунной системой.
XX век 60-е годы Ф. Вернет создал учение об иммунологическом надзоре, как основной функции иммунной системы. Это учение основано на постулате об эволюционном формировании иммунитета для сохранения антигенного гомеостаза путем элиминации чужеродных в генетическом отношении клеток из организма.
Фенотипически чужеродность собственных тканей проявляется изменением антигенного состава. Иммунная система распознает чужеродные структуры и элиминирует их, способна разрушать бластомные зародышевые опухоли и предотвращать их возникновение.
Причиной возникновения злокачественных опухолей являются соматические мутации, возникающие под влиянием экзогенных или эндогенных факторов (канцерогенов).
Доказательством существования противоопухолевого иммунитета является:
Ø Реакции клеточного (Т эфф) и спец. антитела к антигенам опухолей;
Ø Подавление иммунологической реактивности (радиация, цитостатики) увеличивает частоту возникновения опухолей;
Ø Заболеваемость раком увеличивается с возрастом, т.е. параллельно с угасанием иммунологической реактивности;
Ø У новорожденных животных в эксперименте с незрелой иммунной системой экспериментальные опухоли индуцируются легче, чем у взрослых;
Ø Лимфатические узлы, дренирующие области роста неметастазирующих опухолей подвергаются гиперплазии, аналогично узлам, отвечающим на антигенное раздражение;
Ø Длительное угнетение иммунитета иммунодепрессантами у реципиентов почек, сердца повышает частоту возникновения злокачественных опухолей.
Злокачественные опухоли часто возникают в раннем детском возрасте, когда иммунная система еще не сформировалась, и в пожилом — когда она уже ослабла.
Необходимым условием или способствующим фактором возникновения злокачественных опухолей является иммунодепрессия, вызванная канцерогенами, опухолевые антигены.
В 1950-60гг. было доказано, что опухолевые клетки являются чужеродными в антигенном отношении и против них возникают иммунологические реакции.
Трудности доказательства опухолевых антигенов; их выявления были связаны с их особенностями, а именно малой антигенностью опухолей и малого отличия их от антигенов нормальных тканей, в которых возникла опухоль.
В опухолевых тканях содержатся свойственные данной ткани антигены и гетерогенные антигены, обнаруживаемые в других нормальных тканях, например, почечные антигены в опухолях печени. В опухолевых клетках обнаружено 4 группы антигенов.
Группы опухолевых антигенов:
ü Вирусоспецифические антигены;
ü Антигены, возникшие в результате взаимодействия химических канцерогенов с компонентами клетки;
ü Раково-эмбриональные антигены;
ü Гетероорганные антигены (антигены, которые в норме не обнаруживаются в данной ткани).
Вирусоспецифические антигены. Роль вирусов в этиологии рака была доказана еще в начале XX века.
1908г. — У. Элерман, О. Банг вызывали лейкемию у здоровых путем введения им фильтрата крови от больных лейкемией кур.
1933г. — Р. Шоуп доказал вирусную природу некоторых опухолей млекопитающих. В настоящее время известно ↑ 200 ДНК и РНК — содержащих вирусов, способных вызвать малигнизацию у животных. У человека онкогенные вирусы (доказано?) вызывают злокачественные трансформации нормальных клеток. Вирус Эпштейна-бар — возбудитель лимфомы Беркита у человека; ВПТ — карцинома шейки матки; ВГВ — гепатокарцинома.
Вирусная теория рака: раковая трансформация клетки возникает вследствие экспрессии ракового гена — онкогена в клетке хозяина.
В геноме онкогенных вирусов обнаружен специфический ген- онкоген, являющийся индуктором и стимулятором злокачественной трансформации клетки.
Интеграция онкогена в геном клетки хозяина является предпосылкой злокачественной трансформации клеток.
В настоящее время уже известно более 10 онкогенов. Антигены опухолей, индуцированных химическими канцерогенами. Химические канцерогены: бензпирен, нитраты и др. Отличительной особенностью антигенов опухолей, индуцированных химическими канцерогенами, является их низкая иммуногенность для организма опухоленосителя. Некоторые вещества сами не вызывают канцерогенного эффект, но этот эффект вызывают образующиеся в организме их производные. Например, нитраты не индукторы канцерогенеза, но в клетках они превращаются в нитриты, затем в нитрозамины, которые являются сильными канцерогенами.
Низкая чужеродность антигенов опухолей человека, вызванных химическими канцерогенами обусловлена тем, что они состоят из гликолипидного гаптена, присоединенного к неизмененному белку хозяина. Такой белок не способен активировать Т-хелперы и включить В- клетки в антителогенез раково-эмбриональные антигены (РЭА). К РЭА относят соединения, выявляемые в органах и тканях в период внутриутробного развития, а так же опухолях взрослых людей. В норме эти антитела отсутствуют, у больных они служат в качестве опухолевых антигенов. В период внутриутробного развития они являются дифференцировочными и необходимы для дифференцировки органов и тканей.
РЭА вырабатываются в опухолевых клетках вследствие реэкспрессии молчащих генов, вызванных раковой трансформацией. РЭА — фотопротен, 1-й белок, появляющийся во внутриутробном развитии, вырабатывается в желточном мешке гепатоцитами, у больных раком печени резко повышен (маркер перв. печени).
2-Ферроглобулин печени. Обнаруживается в печени плода, а также в других органах вплоть до конца II постнатального месяца. Уровень 2 ФГП ↑ у больных с гепатомой, нейро- и нефробластами, тератомой, лейкозами.
Хорионический гонадотропин человека (ХГ).
— этот гипофизарный гормон вырабатывается в плаценте на ранних сроках беременности. Уровень ХГ резко ↑ при трофобластических опухолях, особенно хориокарциноме (диагностический тест).
Гетерогенные антигены — это антигены, обнаруживаемые в других нормальных тканях, например, почечные антигены в опухолях печени.
В процессе малигнизации происходит изменение антигенных свойств тканей
Типы изменения антигенных свойств тканей при малигнизации — «антигенная альтерация».
1. Антигенное упрощение — утрата изоантигенов1 и снижение синтеза других антигенов.
Опухоли могут утрачивать антигены, характерные для нормальной ткани. Например, утрата специфичных для щитовидной железы микросомальных антигенов при cancer щитовидной железы. Таким образом, антигенная структура опухолевой ткани упрощается за счет утраты органоспецифических антигенов. Предполагается, что опухолевая ткань может утрачивать антигены HLA, что благоприятствует развитию опухоли. Недостаток в опухолевых клетках антигенов МНС 1кл коррелируется злокачественностью. Клетки, не содержащие антиген М1 1кл способны «ускользать», от цитотоксического действия Т-лимфоцитов
2. Антигенная дивергенция — приобретение данной опухолевой тканью некоторых антигенов, которые свойственны другим тканям. Так, в опухоли печени гепатоме выявляется антиген, в норме характерный для почки, а в опухоли почки (аденокарциноме) — антигены, типичные для печени и легких. Появление таких антигенов в опухолевой ткани связывают с нарушениям процессов дифференцировки. Гетероорганные антигены в опухолях не являются чужеродными для организма и поэтому не могут индуцировать противоопухолевый иммунитет.
3. Реверсия антигенов — появление антигенов, существовавших в данной ткани в эмбриональном периоде. Неэффективность противоопухолевого иммунитета объясняют естественной толерантностью к эмбриональным антигенам или их блокирующим действием.
Карциномоэмбриональные антигены — это нормальные структуры организма эмбриона, репрессирующиеся в процессе дифференцировки какого-либо органа, ткани, но дерепрессировавшиеся в процессе малигнизации. Таким образом, изменения поверхности опухолевых клеток характеризуется:
— потерей органоспецифических антигенов;
— уменьшением экспрессии (вплоть до полного отсутствия) антигенов МНС 1кл;
— наличием гетерогенных антигенов;
— РЭА (естественная толерантность? блокирующее действие?);
— сиаломуциновое покрытие антигенов опухоли (гликокаликс); маркировка антигенов опухолей инертными веществами; — низкая концентрация поверхностных рецепторов и антигенов. Все это делает опухоль малочужеродной и малоиммуногенной и приводит к тому, что опухолевые клетки вызывают слабую иммунную реакцию и становятся менее чувствительными к ЦТЛ.
Рост и развитие опухоли обусловлено рядом причин и прежде всего состоянием механизмов противоопухолевой защиты (противоопухолевым иммунитетом).
Механизмы противоопухолевой защиты:
— специфическая противоопухолевая защита:
Ø тимусзависимая: ЦТЛ — эфф., антитела.
Ø тимуснезависимая — NК, АЗКЦ (КК), мф).
Мф фагоцитируют опухолевые клетки, оказывают также на них цитотоксическое действие.
Система иммунной защиты при опухолях (противоопухолевый иммунитет). Если опухолевая клетка, обладая чужеродностью способна вызвать иммунный ответ, то тогда почему опухоль продолжает расти?
Несостоятельность иммунитета и причины роста опухоли.
1. Иммуноусиление — противоопухолевые антитела могут оказывать не только блокирующее (ингибирующее) действие на опухоль, но и усиливить их рост. Блокирующие антитела – 1IgM и lgG.
2. Иммуностимуляции (гипотеза) — слабая иммуногенность опухоли -слабый иммунный ответ (низкое соотношение лф и а/тел и опухолевых клеток в начальной стадии иммунного ответа) Позже — рост опухоли определяет развитие иммунного ответа.
Главная роль в защите опухолевых клеток от уничтожающего действия лимфоцитов принадлежит lgG2, которые обладают большим аффинитетом к опухолевым антигенам.
3. Маскирование опухолевых антигенов на поверхности клеток инертными веществами типа мукополисахаридов.
4. Иммунологическая толерантность (иммунный паралич) приобретенная — при опухолях, вызванных онкорнавирусами. Эти вирусы передаются вертикальным путем от матери — плоду, что спсобствует толерантности к их антигенам.
5. Иммуноселекция. Рак образуется из клона клеток, которые несут опухолевые антигены, в результате воспроизводства клеток (несколько поколений) может наступить мутация и на некоторых клетках образуется очень большое количество антигенов — стимул, образование антител — эти клетки гибнут; выживают клетки с более слабыми антигенами. В результате может образоваться колония клеток со слабыми антигенами — рост опухоли. Это явление способно даже привести к приобретенной толерантности.
6. Иммуносупрессия:
а) возникновение и активация Т-лф супр. (которое создаеьтся только в лимфоидных органах опухоленосителей, но не в тканях крови);
б) иммунодепрессивные факторы, продуцируемые опухолью, блоки-рующие активность NK, Т-лф и мф.
в) иммуносупрессия, вызываемая цитостатической терапией. Иммуносупрессия обусловлена клеточными механизмами (Т- супрессорами, макрофагами, ПЯЛ и др.); гуморальные иммуносупрессоры.
Источник
