Местный иммунитет иммуноглобулин а
Иммуноглобулины А, М, G, E
(Immunoglobulin A, M, G, E)
Что это:
Иммуноглобулины (ИГ) – ещё их называют антителами – гликопротеиды (белок + сахара), которые вырабатываются плазматическими клетками крови (сами плазматические клетки образуются из В-лимфоцитов в костном мозге, селезенке и лимфоузлах). Их задача – навешивать ярлыки на всяких незнакомцев, таких как вирусы, бактерии, паразиты, грибки. Вот этими ярлыками-мишенями и являются иммуноглобулины. Они метят определенного негодяя (патогена-антигена), а иммунная система прицельно направляет своих «киллеров» на их уничтожение, т.е. иммуноглобулины «вызывают огонь на себя». Это называется – эффекторная функция (вызывать реакцию иммунной системы). Вторая их функция – антигенсвязывающая, т.е., связываясь с поверхностью антигена (пришивая метку), они напрямую ослабляют его разрушающее действие на здоровые клетки (блокируют активные центры, снижают токсичность и подвижность микроорганизмов).
В чем суть:
В зависимости от времени, места и типа патогена, ИГ подразделяются на классы:
Иммуноглобулины А (IgA)
– находятся в двух формах: сывороточной (в крови, 10-15 % из общего числа ИГ) и секреторной (в слизистой бронхов и кишечника, поте, слезной жидкости, слюне, молозиве). Секреторный IgA – компонент барьерного иммунитета (наряду с другими его элементами, такими как фагоциты, лимфоциты, цитокины и система комплемента).
IgA – пограничные войска нашего организма, они дают первый бой всем врагам, нарушающим границы нашей родины-тела. Не менее 50% ресурсов иммунитета – барьерный иммунитет. «Ты не бойся ни жаpы и ни холода, закаляйся, как сталь!» – это про тренировку «пограничных войск» данного вида иммунитета. IgA также защищают наши слизистые от действия протеаз (ферменты, расщепляющие белковые связи, содержатся в ЖКТ, а также выделяются микробами).
IgA составляют 10-15 % от общего числа ИГ в крови.
Норма: 0.7 – 4 г/л (могут быть разные референтные значения в лабораториях).
Повышение:
- онкология (карциномы – опухоль из эпителиальных клеток, миеломная болезнь – опухоль из плазматических клеток, хронический лимфоцитоз – опухоль из В-лимфоцитов);
- аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит, гломерулонефрит);
- хронические инфекции;
- алкогольный цирроз печени.
Снижение:
- селективный иммунодефицит IgA (1:400 в популяции);
- целиакия;
- отсутствие селезенки;
- СПИД;
- врождённая телеангиэктазия (стойкое расширение сосудов кожи).
Иммуноглобулины М (IgМ)
– образуются, когда В-лимфоциты впервые встречают врага-антиген и от удивления говорят: это ещё что, мать вашу?! То есть это первичный ответ на антиген (видимо, матом, поэтому и называют их М). IgМ состоят из пяти мономеров (а не одного или двух, в отличие от других ИГ), один из них в виде буквы Y, вот им он и поднимает антиген «на вилы», образуя с ним комплекс. IgM повышаются в первые недели инфекции, а затем их заменяют IgG, которые обеспечивают защиту на долгий срок. Таким образом IgM – главный показатель недавней (новой) инфекции.
IgM составляют 5-10% от общего числа ИГ в крови.
Норма: 0.5-2.5 г/л (могут быть разные референтные значения в лабораториях)
Повышение:
- болезни печени;
- первичный билиарный цирроз;
- хронические инфекции (особенно грибковые);
- хронический и острый лимфолейкоз.
Снижение:
- период новорожденности (примерно до 6 месяцев);
- амилоидоз;
- миеломная болезнь (не-IgM);
- лечение цитостатиками.
Иммуноглобулины G (IgG)
– обеспечивают длительную защиту при повторной инфекции. Если IgM при первичной инфекции метят все антигены торопливо и неточно (а это затратно), то IgG, с помощью Т-лимфоцитов памяти, обучены метить определенный возбудитель (краснуха ветрянка, корь и т.д.) неторопливо и точно. Их производство более ювелирно и требует большего времени, поэтому они появляются на несколько недель позже, чем IgM. IgG постоянно циркулируют в крови и при повторной инфекции их количество увеличивается. Благодаря малым размерам, IgG единственный из всех ИГ проходит плаценту и обеспечивает иммунитет плода и новорожденного до 6 месяцев.
Являются показателем уже перенесенной (знакомой) инфекции.
IgG составляют 70-80 % от общего числа ИГ в крови.
Норма: 7-16 г/л (могут быть разные референтные значения в лабораториях).
Повышение:
- выздоровление после первичной инфекции;
- хронические инфекции;
- заболевания печени;
- аутоиммунные заболевания;
- хронический лимфоцитоз;
- саркоидоз (узелки-гранулемы, чаще в легких и печени).
Снижение:
- общий вариабельный иммуннодефицит;
- белководефицитные синдромы;
- удаление селезенки;
- беременность.
Иммуноглобулины Е (IgЕ)
— у них две основные функции:
- участие в аллергических реакциях атопического типа (наследственная предрасположенность);
- формирование иммунного ответа на паразитарную инфекцию.
IgA – рисковые ребята, садятся на тучные клетки, которые как, мины, начинены взрывчаткой (гистамином, серотонином, простогландинами и др.) и когда происходит повторная встреча этих ребят (IgE) c уже знакомыми патогенами-антигенами, они сцепляются в драчливый клубок, как коты (образуется комплекс антиген-антитело), и мины (тучные клетки) взрываются с высвобождением гистамина, серотонина и других медиаторов, т.е. развивается аллергическая реакция в разных видах (аллергический ринит, бронхиальная астма, атопический дерматит и др.). IgE cоставляют 0.004% от общего числа ИГ в крови – мизер, но мал клоп, да вонюч (когда при аллергии и паразитах количество IgE возрастает в разы)!
Норма: до 100 МЕ/мл (могут быть разные референтные значения в лабораториях).
Повышение:
- аллергические заболевания и реакции, включая ангионевротический отек;
- паразитарные инфекции.
Снижение:
- вторичные или первичные иммунодефициты;
- атаксия-телеангиоэктазия.
Существуют ещё Иммуноглобулины D (IgD), роль которых пока не очень изучена, предполагается их участие в аутоиммунных реакциях. IgD составляют 1% от общего числа ИГ в крови.
Что с этим делать и на что обратить внимание:
– основная задача врача – ответить на вопрос: доктор, часто простываю, у меня, что – иммунитет ослаб?!
Самые частые иммунодефициты, связанные с нарушением функции ИГ:
- селективный дефицит иммуноглобулина А;
- общий вариабельный иммунодефицит;
- транзиторная гипогаммаглобулинемия у детей и другие, более редкие, иммунодефицитные состояния.
– наряду с другими исследованиями, определение уровня ИГ используется для дифференциальной диагностики заболеваний (аллергических, паразитарных, аутоиммунных);
– определение уровня ИГ – один из анализов иммунной системы наряду с такими исследованиями как:
- лейкоциты и их фагоцитарная активность;
- система комплемента;
- уровень Т-лимфоцитов и их субпопуляций.
Заметка из жизни: никогда не вырабатывается иммунитет на хамство. Будьте вежливы, не напрягайте себя!
Виктор Ямщиков, врач-минималист
Источник
// Главная  Лекарственные растения
Лекарственные растения  Записная книжка Лекаря
Записная книжка Лекаря  Местный иммунитет
Местный иммунитет
 Выдающийся иммунолог А. М. Безредка ввел в науку понятие «местный иммунитет». В переведенной на многие языки мира небольшой монографии, посвященной памяти его учителя и друга, великого ученого Ильи Ильича Мечникова, он определил местный иммунитет как формирование невосприимчивости к инфекциям отдельного органа, скажем, кожи или кишечника, без образования защитных белков-антител. А. М. Безредка считал, что местную устойчивость обеспечивают чувствительные клетки органа, привыкающие к ослабленным или убитым микроорганизмам. Они делают орган нечувствительным и к «диким», циркулирующим в природе возбудителям инфекции.
Выдающийся иммунолог А. М. Безредка ввел в науку понятие «местный иммунитет». В переведенной на многие языки мира небольшой монографии, посвященной памяти его учителя и друга, великого ученого Ильи Ильича Мечникова, он определил местный иммунитет как формирование невосприимчивости к инфекциям отдельного органа, скажем, кожи или кишечника, без образования защитных белков-антител. А. М. Безредка считал, что местную устойчивость обеспечивают чувствительные клетки органа, привыкающие к ослабленным или убитым микроорганизмам. Они делают орган нечувствительным и к «диким», циркулирующим в природе возбудителям инфекции.
Теоретические представления А. М. Безредки получили широкое распространение, однако испытания временем они не выдержали. Развитие учения о целостности организма и нейропуморальной регуляции различных проявлений его жизнедеятельности, прогресс в изучении клеточных и биохимических основ устойчивости к инфекционным заболеваниям отвели этим представлениям лишь историческое место. В то же время рекомендации А. М. Безредки о целесообразности введения профилактические вакцинных препаратов непосредственно в органы, являющиеся входными воротами возбудителей заразных заболеваний, остались в золотом фонде науки. Наиболее рельефное доказательство этого — профилактика полиомиелита с помощью вакцины из живых, специально ослабленных вирусов в виде драже или таблеток. За разработку метода и внедрение его в медицинскую практику известные советские ученые академики АМН СССР А. А. Смородинцев и М. П. Чумаков удостоены Ленинской премии.
Однако, хотя взгляды Безредки и были оставлены, сам термин «местный иммунитет» прочно вошел в специальную литературу и постепенно наполнился новым содержанием. Грипп, корь, трахома, холера, дизентерия и многие другие все еще распространенные на Земле заболевания принципиально различаются между собой природой возбудителей и характером течения инфекций. В то же время все они имеют общую важную особенность — воздействие микробов и вирусов, вызывающих болезни, на человеческий организм во всех случаях начинается на поверхности слизистых оболочек дыхательного и пищеварительного тракта, глаз и других органов. Здесь же формируется и первый очаг размножения различных возбудителей. Поэтому особое значение в развитии устойчивости к подобным заболеваниям приобретают защитные приспособления, способные обеззараживать микроорганизмы непосредственно в месте их проникновения. Они составляют «первую линию обороны» организма.
Итак, местный иммунитет, или, правильнее, местная невосприимчивость, — это комплекс приспособлений, защищающий поверхности, соприкасающиеся с внешней средой, от чужеродных биологических агентов. Тем самым местный иммунитет участвует в поддержании постоянства внутренней среды организма, его целостности и является неразрывной и соподчиненной частью общего иммунитета.
В то же время механизмы местного иммунитета отличаются значительным своеобразием. Поэтому он представляет собой достаточно хорошо очерченную, в известных пределах автономную систему организма человека и животных. Обеззараживание болезнетворных микробов и вирусов — далеко не единственная и, возможно, не главная функция местного иммунитета. Эта система участвует и в предупреждении распространения возбудителей заразных болезней от больных к здоровым. В связи с этим местному иммунитету принадлежит исключительно важное значение в популяционной устойчивости.
В полости носа, рта, в кишечнике постоянно обитают многочисленные микроорганизмы. Одни из них безвредны или даже полезны, другие становятся болезнетворными под влиянием воздействий, ослабляющих защитные приспособления организма. Общеизвестный пример такой бактериальной агрессивности — развитие осложнений, следующих за заболеванием гриппом. Контроль за размножением микрофлоры органов, сообщающихся с внешней средой, также одна из обязанностей местного иммунитета. Через пищеварительные и воздухоносные пути в организм непрерывно поступает большое количество разнообразных антигенов — веществ, способных вызвать ответную реакцию со стороны клеток, ответственных за постоянство состава внутренней среды. Если специфическая активность этих антигенов не будет нейтрализована защитными приспособлениями местной невосприимчивости, это может привести к развитию тяжелых болезней. Есть данные об участии местного иммунитета в устойчивости к раковым заболеваниям полости рта, кишечника и некоторых других органов.
Еще несколько лет назад считали, что основной (если не единственный) фактор местного иммунитета — антитела, содержащиеся во всех наружных секретах: слезах, слюне, жидкости среднего уха, женском молозиве и молоке и т. д.
Большинство этих антител относится к особой форме иммуноглобулина А, почти совсем отсутствующей в сыворотке крови. Исследования ученых, однако, убедительно доказывают, что местная устойчивость не может быть сведена только к действию антител и имеет сложную, комплексную природу. Ее основу составляют защитные приспособления, существенно отличающиеся между собой. Одни из них — врожденные и существуют постоянно, независимо от того, встречался ли организм с возбудителем данного заболевания или нет. К ним можно отнести, например, некоторые белки, содержащиеся в выделениях желез внутренней оболочки дыхательного и пищеварительного тракта. Белки эти способны подавлять (ингибировать) болезнетворную активность вирусов и бактерий. Такими приспособлениями можно считать и клетки, поглощающие и переваривающие различные микроорганизмы (макрофаги). Их удается обнаружить даже у животных, выращенных в лаборатории, в стерильных условиях. Надо, однако, заметить, что от встречи организма с возбудителем инфекции существенно зависит активность этих врожденных защитных приспособлений — в выделениях желез повышается концентрация белков-ингибиторов, макрофаги энергичнее захватывают и разрушают микробы.
Что касается приспособлений другого типа, то они до встречи с микробом отсутствуют. Организм животных и человека наследует лишь способность более или менее активно их формировать в ответ на внедрение чужеродных биологических агентов или на появление собственных веществ и клеток с измененной структурой. К приспособлениям такого рода принадлежат специфически реагирующие клетки — Т-лимфоциты и особый тип белков — антитела, обладающие свойством специфически нейтрализовать микробные яды, вирусы и некоторые бактерии. Если из-за дефектов развития организм утрачивает эту способность, развиваются тяжелые заболевания, требующие весьма сложного, длительного лечения. Без такого лечения они приводят к трагедии уже в первые месяцы и годы жизни. Причиной смерти часто бывают вирусные и бактериальные заболевания дыхательной системы. Это с очевидностью доказывает жизненную необходимость всего комплекса механизмов иммунитета. В зависимости от состояния организма, свойств возбудителя, условий, при которых протекает их взаимодействие между собой, ведущее значение может приобрести одно какое-либо или группа этих приспособлений.
Все сказанное удобнее рассмотреть на примере местной устойчивости дыхательной системы к острым инфекционным заболеваниям. Она складывается из трех основных комплексов: структурно-физиологических приспособлений устойчивости, неспецифических факторов иммунитета и специфических факторов иммунитета.
Первый тип защитных приспособлений — структура и функции верхних дыхательных путей. Нос и носоглотка представляют собой совершеннейший кондиционер, очищающий воздух, согревающий и увлажняющий его. Другое приспособление того же порядка — внутренние поверхности воздухоносных путей, выстланные реснитчатым эпителием. Непрерывно колеблющиеся реснички и покрывающая их жидкость — это эскалатор, работающий днем и ночью. Верхний его участок — нос и носоглотка, нижний — трахея и бронхи. Оба участка транспортируют жидкость вместе с микроорганизмами и другими частицами в одном и том же направлении — к глотке. Табачный дым и другие мелкие частички загрязнения воздуха, болезнетворные микроорганизмы подавляют движения ресничек, ослабляя тем самым устойчивость дыхательной системы.
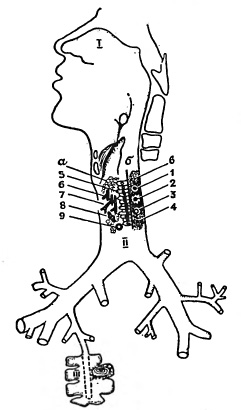
Схема местных защитных приспособлений дыхательной системы: I — носовые раковины и носовые ходы, II — трахея и бронхи, III — альвеолы и альвеолярные макрофаги: а — слизь, б — базальная мембрана, в — собственная ткань слизистой оболочки; 1) Т-лимфоциты, 2) макрофаги, 3) В-лимфоциты, 4) клетки секреторного эпителия, 5) клетки реснитчатого эпителия, 6) молекулы иммуноглобулина Е, 7) молекулы иммуноглобулина А, 8) молекулы ингибитора, 9) молекулы интерферона.
Защитное действие подобных приспособлений лишено строгой направленности. Они в равной мере предохраняют дыхательную систему от холодного воздуха и пыли, удаляют пылинки и микроорганизмы.
Другая группа защитных приспособлений — вещества и клетки, обладающие антибактериальной и вирусной активностью. Но она также не имеет строго прицельного действия. При заболеваниях, вызываемый вирусами, первое место среди них принадлежит низкомолекулярному белку — интерферону. Синтезируется интерферон в ответ на вирусную инфекцию или введение в организм специальных веществ-индукторов лимфоцитами и макрофагами. Интерферон не обладает непосредственной вирус — нейтрализующей активностью. Он не препятствует также прикреплению вирусов к чувствительным клеткам. Замечательное свойство этого вещества состоит в его способности предупреждать размножение в клетках вирусов.
Структура молекулы иммуноглобулина А.
Другое вещество из этой группы — белки, подавляющие активность различных вирусов (ингибиторы). Синтезируются ингибиторы клетками многочисленных желез, протоки которых открываются на внутреннюю поверхность воздухоносных путей. К той же группе защитных приспособлений принадлежат и различные клетки, расположенные в дыхательной системе. Среди них следует в первую очередь назвать клетки альвеол, обладающие поглотительной и переваривающей активностью — так называемые альвеолярные макрофаги. Они обеспечивают устойчивость легких к заболеваниям, вызываемым бактериями. Если у животного «выключить» макрофаги, то чувствительность легких к болезнетворным микробам повысится в большей степени, чем если «выключить» движение ресничек. Вирус гриппа и другие вирусы подавляют активность макрофагов. Это одна из основных причин развития поражений легких, осложняющих грипп.
Третья группа защитных приспособлений — факторы специфического иммунитета. К ним относятся антитела и один из типов клеток крови и лимфоидной ткани — Т-клетки. Как уже упоминалось, большая часть антител в выделениях дыхательных путей относится к иммуноглобулину А.
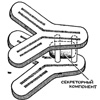
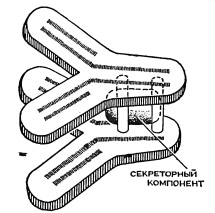
В электронном микроскопе под увеличением в десятки и сотни раз молекула этого иммуноглобулина имеет вид своеобразного бутерброда. Она состоит из двух симметричных структур, форма которых напоминает латинскую букву Т, и упакованного между ними дополнительного белка, так называемого секреторного компонента. На концах зубцов вилки расположены структуры, с помощью которых антитела взаимодействуют с различными веществами, входящими в состав вирусов и бактерий. Всего молекула антител этого типа обладает четырьмя такими структурами. Наличие молекулы секреторного компонента в иммуноглобулине А имеет глубокий биологический смысл. Она обеспечивает особую устойчивость к различным ферментам, образует прочные комплексы между антителами и другими белками, а также между антителами и клетками. После воздействия антител такого типа бактерии теряют способность прикрепляться к поверхности слизистой оболочки и удаляются.
При заболеваниях, вызываемых возбудителями, размножающимися внутри клеток (вирусами, бациллами туберкулеза и другими), важная роль в специфическом иммунитете принадлежит Т-клеткам. Они содержатся в стенках воздухоносных путей на всем их протяжении и располагаются непосредственно под выстилающим их эпителием. Т-клетки активизируют выработку антител, привлекают в очаги размножения микроорганизмов макрофаги, повышают устойчивость макрофагов к ядовитым продуктам микроорганизмов, усиливают способность макрофагов поглощать и разрушать эти микроорганизмы. Помимо этого, Т-клетки сами разрушают клетки организма, зараженные вирусами.
Родоначальники Т-клеток, как и других клеток крови, расположены в костном мозге. Но Т-клетки проходят своеобразную тренировку в вилочковой железе и приобретают особые функции, имеющие жизненно важное значение. Именно они разрушают собственные клетки организма с генетическими нарушениями). Эти же клетки играют ведущую роль в отторжении чужеродных тканей при пересадках и т. п.
Уникальные факты для понимания значения Т-клеток в местном иммунитете дыхательной системы были получены в наблюдениях за людьми с различными врожденными дефектами иммунной системы. Мальчики, неспособные к выработке антител, благополучно выздоравливают от кори и становятся устойчивыми к повторному заражению. Напротив, при заболевании корью детей, у которых Т-клетки отсутствуют, развивается воспаление легких.
Врачей, естественно, прежде всего интересует удельное значение различных защитных приспособлений в устойчивости к тому или иному заболеванию. Оказалось, что получить однозначный ответ на этот вопрос очень сложно. При гриппе и других острых вирусных инфекциях дыхательной системы, например, устойчивость организма зависит от концентрации антител в сыворотке крови и выделениях дыхательных путей, от активности синтеза интерферона, от количества ингибиторов, содержащихся в сыворотке и на поверхности слизистых оболочек, и многого другого.
Механизмы, обеспечивающие невосприимчивость, находятся в теснейшем взаимодействии. Можно различить три уровня такого взаимодействия. Первый обеспечивается особенностями строения и функций органов дыхательной системы; второй — синтезом белков и формированием клеток, составляющих материальный субстрат неспецифической и специфической устойчивости этой системы; третий — взаимодействием различных механизмов в защите организма от бактерий и вирусов.
О примере взаимодействия первого типа мы уже упоминали выше, когда рассказывали об особенностях строения и функции носа и о взаимодействии реснитчатого эпителия с покрывающей его жидкостью.
Пример второго типа взаимодействия — выработка антител, относящихся к иммуноглобулину А. В этом процессе последовательно и согласованно участвуют четыре системы клеток, отличающихся друг от друга по происхождению, строению и функциям. Макрофаги, находящиеся между эпителиальными клетками слизистой оболочки и под ними, захватывают микроорганизмы и выдают информацию, необходимую для запуска выработки антител в других системах. Т-клетки воспринимают эту информацию и освобождают вещества, активизирующие макрофаги и третью систему клеток — В-клетки. Последние уже через короткий срок превращаются в так называемые плазмоциты, представляющие собой одноклеточные «фабрики» антител. Однако дело этим не ограничивается. Четвертый тип клеток — секреторный эпителий — синтезирует особый белок. Он также встраивается в молекулу антитела. На территории эпителиальной клетки происходит окончательная сборка сложной по строению большой молекулы секреторного иммуноглобулина.
Другие формы того же типа взаимодействия состоят в том, что одни и те же клетки принимают участие в разных проявлениях специфического иммунитета и неспецифической устойчивости. Например, как уже отмечалось, макрофаги и лимфоциты участвуют в выработке антител, но они же и синтезируют интерферон. Эпителиальные клетки наряду с белком, входящим в структуру антител, вырабатывают ингибиторы и другие белки, обеспечивающие неспецифическую устойчивость к вирусам и бактериям.
Менее всего, к сожалению, изучена третья форма взаимодействия — кооперация разных по природе защитных приспособлений для обеспечения устойчивости организма к вирусам и бактериальным инфекциям дыхательной системы. Все же некоторые факты из этого ряда ученым удалось получить. Оказалось, что решающее значение в устойчивости дыхательной системы к туберкулезу имеет взаимодействие Т-клеток и макрофагов. При гриппе антитела, содержащиеся в выделениях слизистой оболочки дыхательных путей, предупреждают развитие их поражений, а антитела сыворотки крови — общие проявления болезни. Наиболее полно защищает от гриппа совместное действие обоих типов антител.
Ученые установили еще одну форму взаимодействия. Выяснилось, что молекулы иммуноглобулина А обладают сродством к клеткам реснитчатого эпителия дыхательных путей и прочно фиксируются на их поверхности. Это повышает устойчивость эпителиальных клеток к вирусам.
Профессор Я. Шварцман
См. также:
- Иммунная система человека
- Как укрепить иммунитет?
- Профилактика иммунодефицитных состояний
Источник
