Мкб 10 мрт головного мозга
Лейкодистрофия – группа заболеваний с поражением мозжечка, белого вещества, полушарий головного мозга с сохранностью корковых структур.
Нейродегенерация мозговой ткани сопровождается накоплением внутри спинного и головного мозга метаболические соединений, разрушающих миелин. Повреждение оболочки нейронов приводит к необратимым заболеваниям, сопровождающимся двигательными расстройствами, нарушением психомоторной функции, поражение слуха и зрении, эпилепсией, судорогами, неврологическими расстройствами, эпилептическими приступами.
Лейкострофии МРТ
Классификация по МКБ 10
Международная классификация болезней 10 пересмотра относит лейкодистрофии к сфинголипидозам – заболеваниям, сопровождающимся избыточным отложением патологических жиров (липидов). Код нозологии – «E 75».
Нарушения обмена ганглиозидов кодируются «GM 2»:
- Ювенильная форма;
- Лейкодистрофия взрослых;
- Болезнь Сендхоффа;
- Синдром Тея-Сакса.
Другие ганглиозидозы («E 75.1»):
- Муколипидоз IV;
- Ганлиозидозы GM3, GM1.
Другие сфинголипидозы («E 75.2»):
- Недостаточность сульфатазы;
- Метахроматическая лейкодистрофия;
- Болезнь Нимана-Пика;
- Синдром Краббе;
- Синдром Фабера;
- Болезни Фабри-Андерсона.
Неуточненный сфинголипидоз – «E 75.3». К категории относятся все формы этиологические факторы, которых установить не удалось. Липофусциноз нейронов – «E 75.4». Избыточное образование атипичных жировых части приводит к нарушению передачи нервных сигналов. Неклассифицированные состояния («E 75.5»):
- Болезнь Волмана;
- Холестероз Ван-Богарта-Шерера.
Дисбаланс метаболических соединений внутри головного мозга обеспечивает атипичную клинику.
Неуточненная болезнь накопления липидов – «E 75.6».
Международная классификация МКБ 10 принята во всем мире для унификации перечная нозологических форм. Стандартизации тактики лечения.
Виды лейкодистрофии
Перечень биохимических изменений, приводящих к лейкодистрофии мозжечка, стволовых структур головного и спинного мозга, не выявлен. Ученые считают патологию вариантом повреждения лизосом. Научные исследования не выявили ферменты, отвечающие за клинические проявления нозологии.
Лизосомальные виды лейкодистрофий:
- Галлерводена-Шпатца;
- Краббе;
- Пелициуса-Мерцбахера.
Большинство форм лейкодистрофий возникает в раннем возрасте, но обнаруживается патология и у взрослых. При всех разновидностях возникают неврологические и пирамидальные расстройства, экстрапирамидальная ригидность, демиелинизация нервных волокон. Перечень лабораторных изменений при лейкодистрофиях – увеличение белка, усиленный плеоцитоз.
Метахроматическая лейкодистрофия
Проявляется у взрослых после 21 года. Преимущественно встречается нозология у мужчин. Наследуется по аутосомно-рецессивному механизму. Метахроматическая лейкодистрофия головного мозга развивается постепенно. До выраженных клинических симптомов может пройти более двадцати лет. Особенности проявлений психоза:
- Забывчивость;
- Снижение академических возможностей;
- Неразумные действия;
- Странности поведения;
- Излишняя подозрительность.
Аналогичные клинические симптомы возникают при шизофрении. Присоединение неврологических симптомов мозжечковой атаксии, пирамидальных расстройств, неловкость движений пациента провоцирует психическую деградацию личности. Беспомощность, отсутствие контакта с окружающими людьми, прикованность к постели обеспечивает быстрое прогрессирование клиники из-за ряда метаболических изменений:
- Падение активности лейкоцитарных ферментов (арилсульфатазы A);
- Усиленное выделение сульфатидов с уриной;
- Дисбаланс проведения нервного импульса по поврежденным волокнам;
- Перераспределение пигментного вещества.
Метахроматическая лейкодистрофия у детей (Гринфилда) сопровождается судорогами, атаксией, нистагмом. Признаки терминальной стадии лейкодистрофии у детей:
- Децеребрационная ригидность;
- Бульбарные расстройства;
- Тетраплегия.
Причиной метахромного вида является избыточное скопление липидов. Патогенетическим механизмом формирования патологии является недостаточность фермента цереброзидсульфатазы. Развивается нозология позже форм Краббе или Тея-Сакса. Примерно в 5 лет у ребенка нарушается походка из-за повышенного тонуса мускулатуры. Постепенно утрачивается рефлекторная активность, иннервация сухожилий.
Клинические симптомы лейкодистрофии
Большинство видов возникает в детском возрасте. Сразу после рождения патологических изменений у ребенка не прослеживается. Через несколько месяцев или лет прослеживается неврологическая или психическая симптоматика, которая постепенно усугубляется.
Признаки ранних стадий лейкодистрофии:
- Патология зрения;
- Олигофрения;
- Мышечный спазм;
- Подергивания конечностей;
- Гипертонус;
- Тонические судороги;
- Признаки экстрапирамидальной патологии (шаткая походка);
- Падение интеллекта.
Множественные чувствительные расстройства, патология глотания, глухота диагностируются у дошкольников.
Симптомы лейкодистрофии мозга у грудничков второго года жизни:
- Замедленное психомоторное развитие (олигофрения);
- Патология походки.
Клинические проявления, начинающиеся с третьего года жизни:
- Потеря слуха и зрения;
- Гипертермический синдром;
- Тетраплегия;
- Гипертермия (повышение температуры).
Тяжелая симптоматика появляется через 10 лет после начала первичных изменений головного мозга.
Первичные изменения мозга сопровождаются спастичностью, миоклонией, задержкой развития, мышечным тремором. У взрослых прогрессирующая форма сопровождается быстрой потерей свойств личности, расстройствами речи, патологическим мышлением. Постепенное прогрессирование сопровождается разнообразными изменениями слизистой оболочки с развитием спастичности, мышечными судорогами, гипертонусами.
Вариант метахроматической лейкодистрофии сопровождается психозом, деменцией, эмоциональной неустойчивостью, расстройством речи, мышлением.
Томограммы метахроматической лейкодистрофии
Первые признаки лейкодистрофии у ребенка
При большинстве лейкодистрофий первые симптомы появляются на четвертом году жизни. Диагностировать нозологию удается по следующим признакам:
- Повышенный мышечный тонус;
- Сильная нервная возбудимость;
- Психомоторное развитие не соответствует возрасту;
- Кулаки ребенка сжаты.
Поздние проявления:
- Атрофия зрительных нервов вплоть до слепоты;
- Усиление сухожильных рефлексов;
- Мышечный спастический тетрапарез;
- Миоклонические судороги;
- Общая двигательная реакция.
Периферическая нейропатия встречается только у отдельных детей. Летальный исход у детей прослеживается в возрасте от семи месяцев до трех лет.
Волокнистая лейкодистрофия Александера
Патогенетический механизм развития болезни Александера – дефект гена, отвечающего за выработку протеина GFAP. Дефект провоцирует избыточное скопление белка внутри глиальной ткани головного мозга. Уникальная структура протеина позволяет диагностировать нозологию посредством обнаружения специальных волокон Розенталя.
Неонатальная форма приводит к летальному исходу через 1 год после начала.
Менее опасен инфантильный вид, при котором возникают пороки развития, гидроцефалия, атаксия, парезы, спастическое сокращение мускулатуры. В большинстве случаев смерть возникает через пару лет.
Ювенильная дистрофия Александера появляется у школьников в возрасте 4-10 лет. Стволовая симптоматика длится долго. Симптоматика прогрессирует на протяжении 10-20 лет. Манифестация во взрослом периоде имеет медленное течение. Общая продолжительность заболевания свыше 10 лет.
Лейкодистрофия Галлервордена-Шпатца
Начинается заболевания у детей в возрасте 10 лет.
Клинические симптомы патологии:
- Эпилептические приступы;
- Тетрапарез;
- Дисфункция стриопаллидарной сферы;
- Ретинит пигментный;
- Гимералопия.
Поздняя форма, возникающая у детей в школьные годы. Длительность нозологии до полного появления клинических проявлений – около десяти лет.
Основные признаки:
- Эпилептические припадки;
- Судорожные подергивания;
- Ригидность мускулатуры;
- Гиперкинетические состояния.
Передается патология по аутосомно-рецессивному типу. Возникает у лиц женского и мужского пола. Сопровождается выраженным слабоумием, полной обездвиженностью пациентов. Патоморфологические изменения:
- Избыточное накопление железа внутри тканей;
- Инфильтративные скопления в глиальном слое;
- Дегенеративные поражения аксонов;
- Повышенная пигментация таламуса, мозжечка, коры большого мозга, субталамических структур;
- Расстройство пигментно-липидного обмена;
- Дисбаланс катехоламинов.
Паталогоанатомическое обследование выявляет морфологические признаки.
Наследуется по аутосомно-рецессивному механизму.
Болезнь Нимана-Пика
Сфингомиелиновые расстройства типов A и B возникают по причине недостаточности фермента – сфингомиелиназы. Соединение необходимо для разрушения сфингомиелина.
Симптомы болезни Нимана-Пика:
- Расширение селезенки, поджелудочной железы, печени;
- Покраснение внутриглазной сетчатки;
- Неврологические расстройства;
- Ожирение внутренних органов.
Сфингомиелиновый жировой липидоз приводит к постепенному поражению паренхиматозных структур (почки, печень, селезенка).
Болезнь Гоше
Нозология характеризуется липидозом, сопровождающимся недостаточностью фермента глюкозилцерамидазы. Ранние стадии сопровождаются гепатоспленомегалией. Болевых ощущений, другой симптоматики не возрастает до тех пор, пока размеры органов не станут огромными.
Прогрессирующие неврологические расстройства обуславливают ранний летальный исход.
Разновидность патологии у взрослых людей обусловлена аутосомно-рецессивным механизмом передачи. Передача из поколения в поколение не доказана, но практика показывает вероятность информации.
Болезнь Гоше относится к категории взрослых заболеваний, но первые изменения появляются у детей в возрасте 10 лет. В более раннем или позднем возрасте симптоматика возникает значительно реже. Гиперспления, патологические переломы, асептические некрозы головки бедренной кости, псевдоостеомиелит – распространенные вторичные состояния на фоне первичной лейкодистрофии Гоше.
При всех разновидностях нозологии в костномозговом пунктате выявляются специальные «нагруженные клетки».
Болезнь Фабри
Патология встречается из-за дефекта фермента альфа-галактозидазы. В тканях избыточно скапливается вещество – тригексозид. Наследуется нозология по Х-хромосоме, поэтому часто встречается у мужчин.
Обычно формируется патология в пожилом возрасте. Клиническое проявление нозологии – болевая нейропатия. Магнитно-резонансная томография головного мозга не выявляет патологических изменений до возникновения прогрессирующего поражения почек. Средний возраст пациентов – 20-40 лет.
Артериальные тромбозы при болезни возникают в детском возрасте. Летальный исход формируется из-за выраженной недостаточности почек.
Болезнь Вольмана
Развивается у детей раннего возраста. Вначале прослеживается гепатоспленомегалия, затем присоединяются вторичные проявления:
- Рвотный рефлекс;
- Анемический синдром;
- Кальцинация надпочечников;
- Повышение концентрации холестерина;
- Фиброз печени.
Болезнь Вольмана передается по аутосомно-рецессивному типу.
Болезнь Краббе-Бенеке
Наследственная болезнь – лейкодистрофия Краббе передается аутосомно-рецессивным путем. Формируется нозология в детском возрасте, характеризуется рядом клинических признаков:
- Снижение слуха, зрения вплоть до полной слепоты;
- Деменция;
- Спастический паралич;
- Судороги мускулатуры;
- Децеребрационная ригидность.
Морфологические проявления нозологии сопровождаются демиелинизацией нервных оболочек, нарушением выработки церебролизидов. Лейкодистрофия Краббе генетически детерминирована. Клинические симптомы:
- Слепота;
- Снижение слуха;
- Мышечные спазмы;
- Судорожные припадки.
Носительство аномального гена обнаружить не удается. Отсутствует эффективное лечение.
Синонимы: диффузный инфантильный склероз, болезнь Краббе-Бенеке, глобоидно-клеточная лейкодистрофия.
Суданофильная лейкодистрофия Пелицеуса-Мерцбахера
Возникает нозология преимущественно у мальчиков, так как локализуется патологический ген в Х-хромосоме. Ученые не изучили патогенетические механизмы патологии. Диффузная демиелинизация обуславливает клинические проявления на первом году жизни. Возникает поражение стволовых структур головного и спинного мозга, мозжечка. Повреждение миелиновой оболочки приводит к разрушению центральных и периферических нервных волокон. На первом году жизни у человека возникают специфические признаки:
- Внутриглазной нистагм;
- Кивательное подергивание головы;
- Мышечные гипо- и гиперклонии;
- Паркинсонический синдром;
- Дегенерация волокон зрительного нерва;
- Снижение интеллектуальной функции.
Диффузная демиелинизация Пелицеуса-Мерцбахера наследуется по аутосомно-рецессивному механизму. Изменения серого вещества сопровождается повреждением осевых цилиндров.
Диагностика патологии на ранней стадии основана на первичных признаках:
- Нистагм;
- Нарушение координации;
- Дрожание головы.
Позднее присоединяется атрофия зрительного нерва, снижение интеллекта, мышечный гипертонус, нарушение речи. Тяжелая стадия патологии сопровождается нарастающей деменцией, паркинсоническим синдромом, гиперкинезами.
Перивентрикулярная лейкомаляция
Заболевание сопровождается повреждением белого вещества головного мозга. Характеризуется появлением некротических очагов с локализацией в перивентрикулярных сегментах. Сопровождается возникновением очагов некроза в полушариях, перивентрикулярных областях. Причина морфологических нарушений – гипоксически-ишемическая энцефалопатия. Клинические проявления нозологии:
- Задержка дыхания сразу после рождения;
- Снижение артериального давления;
- Повреждение белого вещества.
Возникновению нозологии у детей способствуют ишемические изменения. Возникает гипоксия, гипокапния, ацидоз у новорожденных детей из-за внутриутробной инфекции, длительных родов. Недостаток кислорода приводит к формированию очагов некроза с локализацией между вентрикулопетальными и вентриклофагальными артериальными ветвями.
Болезнь Канавана-ван-Богарта-Бертрана
Прогрессирующее повреждение нервных клеток головного мозга приводит к нейродегенеративным заболеваниям. Заболевание относится к ряду генетических изменений, приводящих к разрушению оболочки нейронов. Демиелинизация запускается геном, расположенным в семнадцатой хромосоме.
Комплекс морфологических изменений болезни Канавана провоцируется накоплением дефектного белка ASPA из-за недостатка фермента аспартоацилазы.
Симптомы лейкодистрофии:
- Умственная отсталость;
- Потеря моторной активности;
- Дефекты мышечного тонуса;
- Зрительная слепота;
- Трудности удержания головы в физиологической позиции.
Диагностика лейкодистрофии
Первоначальные признаки болезни выявляют клинические специалисты – педиатры, терапевты, неврологи, офтальмологи, отоларингологи.
Генетическое консультирование выявляет аномальные гены, провоцирующие сфинголипидозы головного мозга.
Клинические методы эхо-энцефалографии, нейросонографии выявляют увеличение внутричерепного давления. Исследование цереброспинальной жидкости проводится с целью обнаружения повышенной концентрации протеина.
Нарушение метаболизма выявляется биохимическими анализами крови.
МРТ головного мозга ребенку делают для определения очагов демиелинизации головного мозга. Исследование позволяет верифицировать патологические изменения ранней стадии.
Самый точный способ диагностики – инновационная ДНК-диагностика глобоидно-клеточной, метахроматической лейкодистрофии.
Источник
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Лечение
- Прогноз
- Профилактика
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Герминома головного мозга.

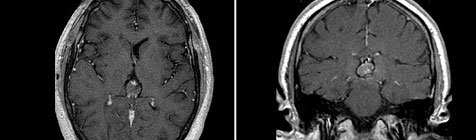
Герминома (МРТ)
Описание
Герминома головного мозга. Дисонтогенетическая опухоль чаще злокачественного характера, локализующаяся в глубинных структурах головного мозга. Герминома головного мозга может проявляться сочетанием клинических признаков гидроцефалии с нарушениями зрения, расстройствами психо-эмоциональной сферы и/или различными нейроэндокринными синдромами. Диагностируется герминома головного мозга путем комплексного сопоставления клинических данных, результатов КТ или МРТ головного мозга, анализа крови на наличие биохимических маркеров опухоли и гистологического исследования образца опухолевой ткани. Герминома головного мозга относится к рентген- и химиочувствительным опухолям, поэтому эти методы успешно применяются в ее лечении. Методом выбора является хирургическое удаление герминомы.
Дополнительные факты
Герминома головного мозга составляет лишь 2% от всех внутримозговых опухолей, однако она является самой часто встречающейся опухолью глубинных структур головного мозга (пинеальной области, шишковидного тела, III желудочка и гипофизарной области). На долю гермином головного мозга, расположенных в пинеальной области, приходится около 56%. Герминомы головного мозга, локализующиеся в области гипофиза, составляют 25%. В 75% случаев герминома головного мозга представляет собой единичную опухоль, в 25% случаев она носит множественный характер.
Возникает герминомы головного мозга в основном в период от 10 до 20 лет жизни. По некоторым данным этот вид опухолей чаще отмечается у лиц мужского пола. Герминома головного мозга зачастую носит злокачественный характер и склонна к диссеминированному росту в окружающие ее мозговые ткани. Однако около ¼ гермином головного мозга являются доброкачественными новообразованиями.
Причины
Наряду с тератомами, хориоидкарциномой, краниофарингиомой, коллоидной кистой III желудочка и тд новообразованиями герминома головного мозга относится к дизонтогенетическим опухолям, причиной возникновения которых являются различные нарушения эмбрионального развития. И хотя дизонтогенетическая теория возникновения гермином головного мозга окончательно не доказана, молодой возраст заболевших говорит в ее пользу. Согласно этой теории герминома головного мозга появляется вследствие нарушений тканевой дифференцировки и миграции тканей на начальных этапах развития эмбриона (I триместр беременности).
Факторами, вызывающими эмбриональные нарушения, являются различные неблагоприятные воздействия, влияющие на плод опосредованно через организм матери. Например, радиоактивное облучение, различные интоксикации, контакт с канцерогенными веществами, инфекционные заболевания (герпес, корь, тяжелый грипп, хламидиоз и пр. ).
Симптомы
Поскольку герминома головного мозга локализуется вблизи III желудочка и имеет тенденцию к разрастанию вдоль ликворных путей, значительно нарушая ликвороотток, в ее клинической картине на первый план зачастую выходят симптомы гидроцефалии. Как правило, пациенты жалуются на интенсивную головную боль распирающего характера, чувство давления в глазах, не связанную с едой тошноту и даже рвоту.
Гиперпролактинемия. Обонятельные галлюцинации. Персеверация. Рвота. Тонико-клонические судороги. Тошнота. Тремор рук.
Диагностика
Первый шаг в диагностике герминомы головного мозга — это тщательный опрос и неврологическое обследование пациента, которые позволяют неврологу выявить не только симптомы гидроцефалии, но и признаки поражения серединных структур. Диагностировать повышение внутричерепного давления помогает эхо-энцефалография, в случае большого размера опухоли при ее проведении определяются эхо-признаки смещения серединных структур мозга.
Следующим звеном в диагностике герминомы головного мозга является применение КТ и МРТ головного мозга. Томографические методы исследования позволяют установить опухолевый характер образования, его размеры и расположение. Примерно у 40% больных с герминомой головного мозга выявляется характерный для этой опухоли признак — опухолевая инфильтрация зрительных бугров и наличие расположенного в середине петрификата (симптом бабочки). В пользу герминомы могут говорить распространение опухолевого процесса по боковым желудочкам и метастазирование в инфундибулярную область III желудочка.
Вспомогательное значение в диагностике герминомы и в оценке состояния заболевания имеет определение в крови биохимических маркеров: хорионического гонадотропина (ХГЧ), альфа-фетопротеина (АФП) и плацентарной щелочной фосфатазы (ПЩФ).
Окончательный диагноз «герминома головного мозга» можно установить по результатам исследования материала опухоли, полученного путем проведения стереотаксической биопсии. Но из-за значительной неоднородности опухоли этот метод диагностики не всегда имеет достаточную достоверность. Более точные результаты дает тщательное морфологическое исследование различных участков опухоли после ее удаления. Однако, учитывая высокую радиочувствительность, которой обладает герминома головного мозга, и определенные сложности оперативных вмешательств на серединных структурах мозга, многие нейрохирурги считают целесообразным проведение стереотаксической биопсии при подозрении на герминому головного мозга.
Герминома головного мозга нуждается в дифференцировке от других опухолей головного мозга (астроцитомы, глиомы, ганглионевромы, гематобластомы, гломусной опухоли, медуллобластомы), а также от абсцесса головного мозга, внутримозговой гематомы, коллоидной кисты III желудочка.
Лечение
Поскольку герминома головного мозга является радио- и химиочувствительной опухолью основной лечебной тактикой при ее диагностировании является проведение лучевой терапии. Облучение опухоли противопоказано в детском возрасте из-за негативного влияния ионизирующего излучения на развивающиеся мозговые ткани. Поэтому у детей и при невозможности радикальной лучевой терапии из-за обширного опухолевого процесса прибегают к проведению полихимиотерапии. Лучевая и химиотерапия применяются также как дополнение к хирургическому лечению в случае злокачественного характера герминомы.
Удаление гермином и других опухолей серединных структур до настоящего времени является одной из самых сложных задач неврологии и нейрохирургии. Основная проблема связана с осуществлением доступа к опухолям такой глубинной локализации. Оптимизация применяемых доступов, возможность спланировать ход операции с помощью нейровизуализирующих методов, появление более совершенных хирургических инструментов привели к тому, что в наше время для пациентов с диагнозом герминома головного мозга хирургическое лечение является методом выбора.
Герминома головного мозга удаляется различными операционными доступами, выбор которых осуществляется нейрохирургом после тщательного изучения локализации и размеров опухоли. При наличии показаний удаление герминомы сопровождается одним из видов шунтирующих операций: вентрикулоперинеостомией или вентрикулоцистерностомией. Хирургическое лечение противопоказано, если герминома головного мозга характеризуется диссеминированным ростом или неоперабельным расположением. Герминома головного мозга небольшого размера может быть эффективно удалена при помощи стереотаксической радиохирургии, заключающейся в однократном локальном облучении опухоли высокой дозой излучения.
Прогноз
Герминома головного мозга отличается относительно благоприятным прогнозом как лучевой терапии, так и оперативного лечения. Пятилетняя выживаемость пациентов достигает 95%, а десятилетняя — 88%.
Профилактика
К профилактическим мероприятиям, направленным на предупреждение возникновения герминомы, относится в первую очередь исключение различных неблагоприятных воздействий на организм матери. Ранняя постановка на учет и соответствующие разъяснения со стороны акушера-гинеколога, осуществляющего ведение беременности, могут помочь женщине уберечься от влияния различных тератогенных факторов (медикаментозных, производственных ).
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
