Молекулярный механизм противовирусного иммунитета
Отличие вируса от большинства видов организмов в том, что он не способен к размножению вне чужой живой клетки. Вирусов известно много: Rabies Virus, Adenovirus, Ebola Virus, HIV, Hepatitis B и C, Papillomaviridae, Herpes Viridae, Influenza Virus и мн. др.
Они предпочитают разные клетки, атакуют нас по-разному, но всем им присуще нечто общее – структура жизненного цикла:
- проникновение в клетку с помощью присоединения к какому-либо типу рецепторов,
- транскрипция вирусной ДНК / РНК (в зависимости от вида вируса),
- встраивание в клеточный аппарат репликации генома,
- репликация вируса и его распространение за пределы клетки.
Врождённый иммунитет человека, формирующийся ещё до рождения, знает этот механизм. Ещё до первых контактов с патогенами мы имеем представление, как с ними бороться, и врождённые инструменты борьбы.
Как неспецифический иммунитет борется с инфекциями?
В распоряжении неспецифического иммунитета имеются естественные клетки-киллеры, запрограммированные уничтожать всё, что не отвечает критерию биологической идентичности геному организма хозяина.
В течение жизни эти клетки занимаются проверкой каждой клетки, каждого микроорганизма, который они встречают. Чтобы пройти контроль, клетки предъявляют молекулярный «паспорт» – главный комплекс гистосовместимости (ГКГС). Считывая его, как штрихкод, киллер отпускает здоровую клеточку – на свободу с извинениями.
Такие проверяющие клетки не умеют определять, инфицирована клетка или нет. Но когда вирус проникает в клетку и встраивает чужеродный геном в её реплицирующий комплекс, ГКГС нарушается и клетка не проходит контроль. Киллер впрыскивает в неё ферменты клеточного «пищеварения» и разрушает, а её остатки, как и остатки вирусов, подъедают фагоциты.
Типология клеток крови
При этом имеет место и иммунологическая толерантность, например, к компонентам нормального микробиома человека – при условии, что он найден в соответствующем месте. Так, кишечной палочке ничего не угрожает со стороны иммунитета хозяина в кишечнике, но, обнаружив её где-то ещё, клетка-киллер уничтожит эту бактерию как условный патоген. И будет права.
Как работает специфический иммунитет человека?
Специфический, или адаптивный, иммунитет человека работает на распознавание инфекций. В том числе новых. Ещё до первого контакта с возбудителем, до появления первых заражённых клеток и запуска соответствующего сигналинга иммунные клетки могут распознать патоген по т. н. паттернам патогенности – молекулярным (чаще всего белковым) комплексам, которые свойственны в принципе – вирусам, в принципе – бактериям, в принципе – грибам и т. д.
Когда патоген проник и развернул атаку, специфический иммунитет приступает к сложному мероприятию по его улавливанию и обезвреживанию. В его распоряжении имеются альфа-, бета- и гамма-интерфероны, которые:
- тормозят репликацию ДНК и РНК в клетке, не давая вирусу размножаться,
- запускают апоптоз – самоубийство заражённой клетки на благо организма.
В момент проникновения вируса клетка распознаёт инфицирование и успевает вывесить на мембране «флажки», которые привлекут внимание Т-хелперов, Т-киллеров, В-лимфоцитов и другие войска специфического иммунитета.Т-хелперы обеспечат исследование и запоминание патогена, В-лимфоциты займутся выработкой антител, которые обклеят (опсонизируют) вирусные фрагменты, сделав их неспособными к репликации. А фагоциты соберут остатки патогена и погибшей клетки. Затем «осколки» вируса затем попадут через кровь в лимфу, где отфильтруются в лимфоузлах и будут тщательно изучены. Затем молодым, т. н. наивным клеткам-лимфоцитам будут предъявлены антигены, и они смогут распознавать угрозы, которые «лично» никогда не встречали. Таким образом тренируется иммунная память.
Что ещё делает интерфероновый сигналинг? Интерфероны присоединяются к оболочкам здоровых клеток, не давая вирусу присоединиться и проникнуть сквозь клеточную мембрану.
Они же разрешают общие провоспалительные реакции, которые сопровождаются хорошо знакомыми клиническими симптомами усталости, разбитого состояния, высокой температуры, ломоты в суставах, сонливости, мышечной боли и т. п.
Всё это говорит о том, что красный костный мозг получил чёткий, конкретный сигнал – продуцировать больше специальных, «профессиональных» клеток: моноцитов, дендритных клеток, лимфоцитов, лейкоцитов и др.
Повышенные лимфо- и лейкоциты мы увидим в общем анализе крови – если, конечно, сам вирус не вызывает лейкоцито- или лимфоцитопению, поразив органы и клетки иммунной системы.
Таким образом, интерфероны оказывают аутокринный, паракринный и эндокринный эффект. И это, с одной стороны, хорошо, а с другой не очень, потому что военную мощь нашего иммунитета вирусы учатся обманывать и даже обращать против нас. И со стимуляцией иммунного ответа следует быть очень аккуратными.
Получить более подробную информацию об этом можно в статье от иммунологов онлайн-академии UniProf «Противовирусный иммунитет человека: как вирусы обманывают его и что с этим делать?»
А полное практические рекомендации, как пациенту подружиться с иммунитетом, а врачу – эффективно использовать иммунологические знания в любом направлении клинической практики,можно в рамках интенсива «Коронный иммунитет».
Лекции читают ведущие российский иммунологи и спикеры Академии UniProf. Регистрируйтесь на обучение, получайте актуальные и необходимые экспертные знания, чтобы быть здоровыми и вести пациентов на принципиально новом профессиональном уровне.
Источник
Глава 16. Противовирусный иммунитет
ЗАЩИТНЫЕ МЕХАНИЗМЫ С УЧАСТИЕМ Т- И В-КЛЕТОК
При отсутствии Т-клеток организм-хозяин весьма восприимчив к атакам вирусов. Так, у бестимусных мышей (мыши nude — голые, или бесшерстные) с врожденным отсутствием зрелых Т-клеток вирус простого герпеса (HSV, от herpes simplex virus), введенный в кожу, вызывает распространяющееся поражение и в конце концов, проникая в центральную нервную систему, гибель животных. Чтобы защитить этих мышей, достаточно вскоре после заражения перенести им HSV-специфичные Т-клетки. Важное значение Т- и В-клеток, противодействующих вирусным инфекциям, будет рассмотрено ниже.
Антитела и комплемент способны ограничить распространение вируса и предотвратить повторную инфекцию
Антитела могут нейтрализовать инфекционность вирусов. Если вирусу удается преодолеть барьеры врожденного иммунитета, он вызывает развитие адаптивного (специфического) иммунного ответа с появлением цитотоксических Т-клеток, хелперных Т-клеток и противовирусных антител. Антитела служат главным препятствием для распространения вируса в другие клетки и ткани, особенно для проникновения его в кровоток. В лимфоидной ткани слизистых оболочек образуются преимущественно антитела класса IgA, предотвращающие повторную инфекцию.
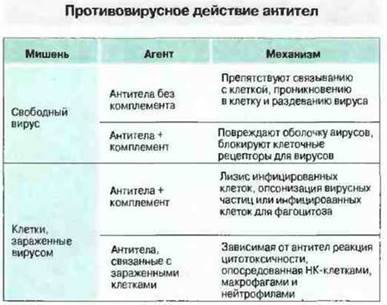
Антитела могут быть направлены против любого вирусного антигена, синтезируемого в инфицированной клетке, однако сдерживание инфекции обеспечивают только те из антител, которые специфичны к гликопротеинам, экспрессированным на оболочке вирусов иди на мембране инфицированных клеток. Механизмы гуморального противовирусного иммунитета могут быть различными. Так, способ устранения инфекционности вирусных частиц зависит от их локализации — внеклеточной или внутриклеточной (рис. 16.5). О действии in vivo защитных механизмов, перечисленных на рис. 16.5, свидетельствует то, что инъекция моноклональных вирус-нейтрализующих антител весьма эффективно угнетает репродукцию вирусов. Присутствие в кровотоке нейтрализующих вирус антител — это и важный фактор предотвращения повторной инфекции.

Рис. 16.5. Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
Комплемент участвует в нейтрализации внеклеточных вирусов некоторых видов. Комплемент также способен повреждать оболочку вируса — осуществлять виролиз. Некоторые вирусы непосредственно вызывают активацию комплемента по классическому или альтернативному пути. Тем не менее комплемент не рассматривают как главный фактор защиты против вирусов, поскольку при недостаточности компонентов системы комплемента не отмечено предрасположенности к тяжелым вирусным инфекциям у человека.
Антитела мобилизуют комплемент и/или эффекторные клетки для разрушения инфицированных вирусами клеток организма. Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. В результате его активации происходит сборка лизирующего мембрану комплекса и лизис зараженных клеток (см. гл. 4). Комплемент-зависимый цитолиз возможен лишь при высокой плотности экспрессии вирусных антигенов па клеточной мембране (примерно 5 х 106на клетку). В противоположность этому, для лизиса по механизму АЗКЦ необходимо присутствие на поверхности клетки-мишени лишь 103 молекул IgG — такое количество обеспечивает связывание с ней НК-клеток. Эти клетки связываются с нагруженной антителами мишенью через FcγRIII (CD16) и быстро разрушают ее посредством перфоринов (см. гл. 10). Насколько важен in vivo каждый из этих механизмов, пока трудно понять. Лучшее доказательство в пользу АЗКЦ получено на мышах при изучении защитного эффекта противовирусных моноклональных антител; не проявляя нейтрализующей активности in vitro, они оказались способны защитить С5-дефицитных животных при введении им высокой дозы вируса. (Эта линия мышей была использована для того, чтобы исключить антивирусный эффект терминальных компонентов системы комплемента.)
Т-клетки участвуют в формировании и действии противовирусного иммунитета несколькими путями
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Образование антител в ответ на большинство антигенов зависит от тимуса, поскольку для переключения изотипа и созревания аффинности необходимо участие Т-клеток CD4+. Кроме того, эти клетки помогают в индукции цитотоксических Т-клеток CD8+, а также в привлечении макрофагов в очаг вирусной инфекции и в их активации.
Цитотоксические Т-клетки CD8+. Это главная Т-клеточная система для осуществления в организме противовирусного иммунологического надзора, и действует она весьма эффективно и избирательно. Цитотоксические Т-клетки CD8+, рестриктированные по антигенам МНС класса I, скапливаются в очагах размножения вирусов и разрушают инфицированные ими клетки. Данный механизм иммунологического надзора, по-видимому, весьма важен, так как фактически все клетки тела экспрессируют молекулы МНС класса I.
Процессинг и презентация вирусных белков. Вероятно, любой вирусный белок может быть процессирован в цитоплазме АПК с образованием пептидов, которые затем транспортируются к эндоплазматическому ретикулуму и ассоциируют с молекулами МНС класса I. Для организма-хозяина это создает определенные преимущества, так как белки вируса, экспрессируемые клеткой в начале цикла его размножения, становятся доступными для Т-клеточного распознавания задолго до появления нового поколения вирусных частиц. Например, Т-клеточный иммунитет к цитомегаловирусной инфекции у мыши специфичен в отношении наиболее раннего вирусного белка рр89. Его протективный эпитоп определен как пептид Lb, состоящий из девяти аминокислотных остатков и презентируемый молекулой МНС класса I. Иммунизация мышеи рекомбинантным вирусом коровьей оспы, несущим ген рр89, полностью защищает их от инфекции CMV. Делеция участка ДНК, кодирующего нано-пептид Ld, лишает белок рр89, экспрессируемый вирусом коровьей оспы, протективной активности.
Важность Т-клеточных механизмов в противовирусном иммунитете in vivo установлена различными способами:
• путем адоптивного переноса антигенспецифичных субпопуляций или клонов Т-клеток зараженным животным для проверки на способность устранения вируса;
• на животных, лишенных Т-клеток CD4+или CD8+путем введения специфических моноклональных антител, и
• на мышах, избирательно лишенных эмбриональных генов CD4, CD8 и β2-микроглобулина методом генного нокаута.
Как установлено, мыши, лишенные методом генного нокаута определенных субпопуляций лимфоцитов, сохраняют способность к иммунному ответу на вирусную инфекцию. Можно рассматривать это как хорошую иллюстрацию многократного функционального дублирования, вероятно свойственного иммунной системе. Например, Т-клетки CD4+в отсутствие Т-клеток CD8+могут компенсировать иммунологическую недостаточность и устранять инфекцию.
Т-клетки CD4+ способны выполнять важные эффекторные функции в иммунном ответе на вирусную инфекцию. В иммунном ответе на инфекцию эпителиальных покровов, вызванную вирусом простого герпеса I типа (HSV-I), главной эффекторной клеточной популяцией служат Т-клетки CD4+. Они, как и в реакциях гиперчувствительности замедленного типа (см. гл. 26), мобилизуют и привлекают макрофаги, и эго ускоряет ликвидацию вируса. Макрофаги служат важными участниками этого процесса (рис. 16.6). В качестве ключевых цитокинов в ответе на герпесвирусную инфекцию действует ИФγ, необходимый для активации моноцитов, и фактор некроза опухолей (ФИО), оказывающий ряд противовирусных эффектов, сходных с эффектами ИФγ, но осуществляемых иными путями.

Рис. 16.6. При кожной герпесвирусной (HSV) инфекции в качестве защитных факторов действуют Т-клетки СD4+, макрофаги и ИФγ. Т-клетки CD4+получали от мышей, зараженных HSV за 8 сут до опыта, и переносили сингенным мышам, вскоре после этого зараженным HSV внутрикожно. Одной группе этих мышей вводили антитела к CR3 (чтобы блокировать миграцию макрофагов в место заражения), другой — антитела к ИФγ (чтобы блокировать активацию макрофагов), остальные животные служили контролем. Мышей дополнительной контрольной группы заражали, но не переносили им Т-клетки CD4+. Через 5 сут после заражения определяли количество оставшегося инфекционного вируса. Результаты показывают, что протективный эффект Т-клеток CD4+реализуется при участии макрофагов и ИФγ.
Цитотоксические Т-клетки CD4+. При заражении вирусом кори в организме образуются цитотоксические Т-клетки CD4+, которые распознают и лизируют инфицированные вирусом клетки-мишени, экспрессирующие молекулы МНС класса II. Это указывает, что процессинг и презентация антигенов вируса кори происходят обычным способом — путем фагоцитоза и расщепления (см. гл. 9). Однако существует, предположительно, и другой, еще неизвестный механизм, посредством которого белки или пептиды вируса кори перемещаются из цитозоля в везикулы класса II.
Защитные противовирусные механизмы обобщенно представлены на рис. 16.7, а динамика их индукции — на рис. 16.8.

Рис. 16.7. Проникновению вирусов в клетки слизистой оболочки препятствуют антитела IgA. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФα и ИФβ) и приобретенного (ИФγ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и НК-клетки — для разрушения инфицированных вирусом клеток-мишеней. (АЗКЦ — антителозависимая клеточноопосредованная цитотоксичность.)

Рис. 16.8. Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и в инфицированных тканях раньше всего выявляются НК-клетки и интерферон. Затем в регионарных лимфоузлах или селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). После этого в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
Источник
4. Особенности противовирусного иммунитета
Противовирусный иммунитет начинается со стадии презентации вирусного антигена Т-хелперами.
Сильными антигенпрезентирующими свойствами при вирусных инфекциях обладают дендритные клетки, а при простом герпесе и ретровирусных инфекциях – клетки Лангерганса.
Иммунитет направлен на нейтрализацию и удаление из организма вируса, его антигенов и зараженных вирусом клеток. Антитела, образующиеся при вирусных инфекциях, действуют непосредственно на вирус или на клетки, инфицированные им. В этой связи выделяют две основные формы участия антител в развитии противовирусного иммунитета:
1) нейтрализацию вируса антителами; это препятствует рецепции вируса клеткой и проникновению его внутрь. Опсонизация вируса с помощью антител способствует его фагоцитозу;
2) иммунный лизис инфицированных вирусом клеток с участием антител. При действии антител на антигены, экспрессированные на поверхности инфицированной клетки, к этому комплексу присоединяется комплемент с последующей его активацией, что и обуславливает индукцию комплементзависимой цитотоксичности и гибель инфицированной вирусом клетки.
Недостаточная концентрация антител может усиливать репродукцию вируса. Иногда антитела могут защищать вирус от действия протеолитических ферментов клетки, что при сохранении жизнеспособности вируса приводит к усилению его репликации.
Вируснейтрализующие антитела действуют непосредственно на вирус лишь в том случае, когда он, разрушив одну клетку, распространяется на другую.
Когда вирусы переходят из клетки в клетку по цитоплазматическим мостикам, не контактируя с циркулирующими антителами, то основную роль в становлении иммунитета играют клеточные механизмы, связанные прежде всего с действием специфических цитотоксических Т-лимфоцитов, Т-эффекторов и макрофагов. Цитотоксические Т-лимфоциты непосредственно контактируют с клеткой-мишенью, повышая ее проницаемость и вызывая осмотическое набухание, разрыв мембраны и выход содержимого в окружающую среду.
Механизм цитотоксического эффекта связан с активацией мембранных ферментных систем в зоне прилипания клеток, образованием цитоплазматических мостиков между клетками и действием лимфотоксина. Специфические Т-киллеры появляются уже через 1–3 дня после заражения организма вирусом, их активность достигает максимума через неделю, а затем медленно понижается.
Одним из факторов противовирусного иммунитета является интерферон. Он образуется в местах размножения вируса и вызывает специфическое торможение транскрипции вирусного генома и подавление трансляции вирусной мРНК, что препятствует накоплению вируса в клетке-мишени.
Стойкость противовирусного иммунитета вариабельна. При ряде инфекций (ветряной оспе, паротите, кори, краснухе) иммунитет достаточно стойкий, а повторные заболевания встречаются крайне редко. Менее стойкий иммунитет развивается при инфекциях дыхательных путей (гриппе) и кишечного тракта.
Данный текст является ознакомительным фрагментом.
Похожие главы из других книг:
1. Клональная теория иммунитета
Принципиальные отличия клональной теории Барнетта от всех предыдущих становятся понятнее, если антиген сравнить с замком, а антитело к нему — с ключом, которое отпирает именно этот замок, выбирая его из множества других. Трудность решения
2. Клеточные механизмы иммунитета
Иммунитет осуществляется лимфоцитами, которые, как и все клетки крови, образуются из одного источника — стволовых клеток крови в костном мозге и селезенке. Начальным этапом образования лимфоцитов являются полустволовые клетки —
Армия иммунитета
Пришла пора выяснить, какое оружие и кто солдаты непобедимой армии иммунитета. Именно непобедимой, не возражайте. Не приводите в качестве примеров ужасающие и опустошительные эпидемии «черной смерти» (чумы) в Западной Европе XIV века. Помнит автор и про
5.2. Особенности эволюции
Понятие хаоса в противоположность понятию космоса было известно древним грекам. Синергетики называют хаотическими все системы, которые приводят к несводимому представлению в терминах вероятностей. Другими словами, такие системы нельзя описать
Какие дефекты иммунитета известны науке?
— Какие же формы иммунодефицитов известны науке?
— Чтобы ответить на этот вопрос, необходимо вспомнить устройство и работу иммунной системы.
Иммунный ответ организма на любое чужеродное вторжение складывается из двух
Рак, аллергия и другие промахи иммунитета
Раковые клетки возникают из клеток собственного тела. Значит, они свои, а не чужие. Значит, иммунная система не может их «увидеть».
— Иммунная система организма направлена на то, чтобы уничтожать любые клетки, которые были или
Что делают для стимуляции противоракового иммунитета.
— Наверное, это еще не умеют?
— Да, в отношении раковых антигенов не умеют.
— А что же делают, чтобы стимулировать противораковый иммунитет?
Когда произносишь слово «история», возникают представления
Аллергия — еще один промах иммунитета.
— По–моему, опасность преувеличена. Если повторное введение чужеродных белков может принести вред, не надо их вводить.
— Повышенная чувствительность к чужеродным белковым веществам не была бы серьезной медицинской
Иммунная система состоит из тысячи лимфоцитных клонов. Теория иммунитета.
— Что такое клон и обязательно ли он вреден?
— Нет, иммунная система состоит из тысячи лимфоцитарных клонов.
— Из тысячи?
— Может быть, и больше.
Кажется, уже все привыкли, что
18. Предмет иммунологии. Виды иммунитета
Иммунология – это наука, предметом изучения которой является иммунитет.Инфекционная иммунология изучает закономерности иммунной системы по отношению к микробным агентам, специфические механизмы противомикробной защиты.Под
1. Понятие об иммунитете. Виды иммунитета
Иммунология – это наука, предметом изучения которой является иммунитет.Инфекционная иммунология изучает закономерности иммунной системы по отношению к микробным агентам, специфические механизмы противомикробной защиты.Под
2.7. Особенности метода ССП
В последние десятилетия разработаны методы регистрации активности мозга, обладающие значительными исследовательскими возможностями (см. также гл. 2). Однако и при разработке новых методов исследований активности мозга, и при верификации
Течка. Особенности. Поведение.
Самки домашней собаки обычно регулярно «текут» дважды в год, в то время как самки некоторых диких собачьих и примитивные породы собак часто имеют течки только один раз в год. Время наступления половой зрелости различно для разных пород, но у
4.3.1. Особенности почвы
Почва представляет собой рыхлый тонкий поверхностный слой суши, контактирующий с воздушной средой. Несмотря на незначительную толщину, эта оболочка Земли играет важнейшую роль в распространении жизни. Почва представляет собой не просто твердое
Сенсорные особенности
В полном соответствии с высокоразвитыми эффекторными системами высших позвоночных находится и высокий уровень их сенсорных способностей. Наибольшее значение имеют органы слуха и равновесия (внутреннее ухо, начиная с земноводных — дополнительно
Индивидуальные особенности
Следует помнить, что описанная схема поведения является только схемой. Реальный организм всегда обладает индивидуальностью, т. е. конкретный человек отличается от всех остальных удельным весом отдельных компонентов поведенческого акта. Мы
Источник
