Мукозальный иммунитет в полости
Барьерный (мукозальный) иммунитет
Иммунитет такая штука (на этом, как правило, точные знания о нём заканчиваются), которую все хотят поднять, так как считают, что опустится эта штука сама. Где тонко, там и рвётся!
Что это:
Микробиота – «общага» для живых бактерий, грибов и вирусов, обитающих в кишечном тракте, во всём их генетическом разнообразии (в 150 раз больше по сравнениию с геномом человека).
Антибиотики – противобактериальные препараты, но кто у нас различает бактерию и вирус? Например, из всех бронхитов максимум 15% имеют бактериальную природу, но при таком диагнозе антибиотики, как правило, назначают всем. Доводы: а вдруг чё там? Лишним не будет! Я не назначу, другой врач назначит, а я как дурак… В прошлый раз ведь помогло!
Что такое мукозальный иммунитет?
Мукозой называют внутреннюю оболочку полых органов, сообщающихся с внешней средой (желудок, кишечник, мочевой пузырь, влагалище и пр.). Её функция – защита от проникновения внешних «врагов» с помощью физического барьера, противомикробных (воспалительных) белков и иммунных ответов. Вся иммунная борьба в барьерных тканях (если прибавить сюда кожу) и будет называться мукозальный (барьерный) иммунитет.
Основные симптомы, которые появляются в начале заболевания (насморк, кашель, боль в горле, изжога, диарея, воспаление кожных покровов) и есть «бои на границе», в барьерных тканях.
В чем суть:
Каковы взаимоотношения этих «трёх поросят» – микробиоты (микрофлоры), барьерного (мукозального) иммунитета и антибиотиков?
Иммунитет слизистых реализуется через единую систему, название которой – mucosa-associated lymphoid tissue – MALT, ещё есть SALT – skin…кожа (дерма). Это половина всей иммунной системы, где на площади 400 кв.м (4 сотки) расположены 50% иммунных клеток. То есть половина всех «защитников родины» находится в приграничной зоне.
Ранее считалось, что эпидермис является непроницаемым физическим барьером, но сейчас выяснилось, что в коже и слизистых существуют специальные клетки (дендритные и М-клетки), функцией которых является контролируемый трафик чужеродных агентов через биологический барьер (кожа, слизистая). Своего рода разведчики берут «языка», переводят его через «линию фронта», выведывают его «буржуинские» тайны и обучают этим хитростям новобранцев (свежие иммунные клетки, они так и называются – наивные лимфоциты).
Кроме того, клетки кожи и слизистых включают рецепторы, которые запускают контролируемую воспалительную (атомную) реакцию с выделением цитокинов (пептиды; их 3 типа – противо- и провоспалительные, и регуляторы иммунитета). Таким образом, иммунная система барьерных тканей всё время находится в состоянии «тлеющей» активации, что позволяет при проникновении патогена давать быстрый иммунный ответ «обученными бойцами». Обучение-то они, конечно, прошли, но метко стрелять ещё не умеют – это называется адаптивный иммунитет.
Как это работает?
Его представительством в тканях (подэпителиальная, подслизистая рыхлая ткань) являются изолированные лимфоидные фолликулы, в которых находятся «бойцы», в том числе В-лимфоциты, продуцирующие IgA. Эта система «местного» иммунитета связана региональными лимфоузлами, миндалинами, пейеровыми бляшками, аппендиксом и переводит иммунный ответ с местного уровня на системный (федеральный), что позволяет вводить в действие высокоспецифические антитела (высокоточное оружие) на конкретный патоген– это называется приобретенный иммунитет. Так работают прививки и вакцины на конкретное заболевание.
Как организм новорожденного распознает, что можно «всосать», а что надо «выплюнуть»? Один из путей идет через недавно открытые сигнальные рецепторы врожденного иммунитета (signal pattern recognizing receptor – SPRR). Каждый патоген имеет «отличительный знак», так называемый патоген-ассоцированный молекулярный образ (patogen-associated molecular patterns – PAMP). Обычно это бактериальный липополисахарид или ДНК, двуспиральная РНК, глюканы грибков и другие названия подобных «образов», которые запомнить невозможно. Клетки распознают «чужаков» по этим знакам и начинают «мочить их в сортире» с помощью фагоцитоза (поглощения), продукцией активных форм кислорода, усиливая экспрессию генами провоспалительных пептидов (цитокинов). Такая реакция во многом паническая, неумелая, но на первоначальном этапе приводит к задержке «противника» на границе – это называется врождённый иммунитет.
А с какого бока-припёка здесь микрофлора? Дело в том, что внутрикишечная флора имеет «договор» с нашим организмом – мы сдаём ей в аренду площади (слизистые, кожа), взамен она помогает переваривать пищу, продуцирует витамины, а главное – защищает от патогенных микроорганизмов. Микрофлора образует биопленку на поверхности слизи, которая, как пограничный контроль, проверяет паспорта – гражданин ли ты данной страны. Кроме того, поддерживает адаптивный иммунитет в «тлеющем» состоянии (а наш бронепоезд на запасном пути), сохраняя золотую середину между иммуноагрессией/супрессией через сигнальные рецепторы врожденного иммунитета.
Как влияют антибиотики на иммунный ответ?
На экспериментальных животных и у человека в клинике многократно подтверждено, что антибиотики приводят к изменению микробиоты. Например, клиндамицин в виде 7-дневного курса почти на 2 года меняет у человека видовой состав бактерий рода Bacteroides. 5-дневный курс ципрофлоксацина приводит к изменению микробиоты у человека почти на 30%. Для частичного восстановления микробиоты после курса ципрофлоксацина требуется около месяца.
Кроме того, антибиотики «мочат» всех без разбора, и часть погибшей микрофлоры замещается патогенами – например, грибками (привет, молочница). На уровне эпителия наблюдаются снижение продукции слизи и истончение «пассивного» барьера. Одновременно уменьшается секреция противомикробных пептидов, то есть «пограничная полоса» становится уже и перебежать её легче. Рецепторы SPRR, видя такой «балаган», реагируют бурным выбросом провоспалительных агентов, а золотой (защитной) середины уже нет, и данное воспаление распространяется системно по организму, и если кто-то хоть как-то похож на «врага», по нему наносится удар (аутоимунная реакция), что может провоцировать развитие язвенного колита, болезни Крона, ревматоидного артрита, васкулитов, нейродермита и т.д.
Как помочь?
- трансплантация фекальной микробиоты (ТФМ) Промышленное масштабирование ТФМ является весьма проблематичным, и процедура сегодня используется (и, очевидно, будет использоваться) как крайняя мера, когда невозможно уничтожить патоген другими способами – например, в случае антибиотикорезистентных штаммов. В настоящее время эффективность ТФМ (80–100%) была продемонстрирована в случае инфицирования Clostridium difficile в качестве меры борьбы с псевдомембранозным колитом.
- использование пробиотиков, добавляя, что ни один из пробиотиков не может полностью воспроизвести состав нормофлоры, а значит, не способен восстановить нормальный баланс кишечной микробиоты.
- использовать минимальные биологически активные фрагменты (МБАФ) – это фрагменты патогенных микробов, а также нормофлоры, на которые реагируют рецепторы врожденного иммунитета (SPRR), стимулируя барьерный (адаптивный) иммунитет.
Что с этим делать и на что обратить внимание:
– главный вывод этой статьи: НЕФИГ назначать антибиотики направо и налево. Например, в Голландии назначить антибиотик, особенно ребёнку, целая история. Тем не менее одна из самых здоровых (и длинных) наций в Европе;
– умеренно-грязные руки у ребёнка – хорошо (но, приучать мыть после посещения туалета), отдавать в садик рано – хорошо (хоть и болеет, в среднем, раз в три недели первый год), прививки делать – хорошо. Всё это тренирует адаптивный и приобретенный иммунитет, и затем в подростковом возрасте значительно меньше аллергических и аутоиммунных заболеваний. Кстати, в США запретили производство антибактериального мыла.
Следите за своим здоровьем – будете знать, куда оно ушло!
Виктор Ямщиков, врач-минималист
Написано на основе статьи из Русского медицинского журнала (в блоге www.rmj.ru/blog/)
Источник
Автор: ООО «Замбон Фарма»
Статья без опроса для врачейМатериал посетили: 616Добавлена: 27.01.2020
Тизер: Обсудим защитную функцию слизистых оболочек и понятие мукозального иммунитета. Также озвучим факторы, которые ухудшают качество местной иммунной защиты, и возможности подстраховать ребёнка от сбоев в мукозальном иммунитете в период эпидемии ОРВИ.
Мукозальный иммунитет респираторного тракта: его особенности и роль в защите от ОРВИ
Слизистые оболочки многих систем организма, в особенности дыхательной и пищеварительной, постоянно подвергаются воздействию патогенных микробов, аллергенов и химических соединений. Поэтому в процессе эволюции в них сформировалась мощная система иммунной защиты. Все её механизмы реализуются через так называемую «мукозоассоциированную лимфоидную ткань» (МАЛТ). Это самая большая часть иммунной системы общей площадью 400 м2. Именно в ней располагается около 50% иммунокомпетентных клеток. Там присутствуют как клетки врожденного, так и приобретённого иммунитета. Кроме клеток в МАЛТ есть и другие механизмы защиты, которые различаются в зависимости от системы органов (1).
Структура и особенности мукозального иммунитета респираторного тракта у детей
Местный иммунитет слизистых оболочек начинает формироваться у ребёнка ещё до рождения. Однако после родов процесс не заканчивается: развитие и формирование мукозального иммунитета у детей младшего возраста продолжается. Незрелость систем мукозальной части иммунной системы может стать причиной её дисфункции у маленьких пациентов. Последствиями такой дисфункции, по данным исследователей, бывают как частые заболевания респираторными инфекциями, так и проявления аллергии (1,2,3).
Мукозальный иммунитет дыхательных путей представляет собой сложную многоуровневую систему защиты:
- Верхний уровень – «инертный» барьер – это слой слизи, который формирует физическое препятствие для проникновения микроорганизмов. Другие защитные факторы, действующие на этом уровне, — противомикробные пептиды, секреторный IgA, компоненты системы комплемента и микробиота. Уже на этом уровне начинает происходить частичное разрушение чужеродных микроорганизмов.
- Эпителиальные клетки – не только создают ещё один барьер, но и отвечают за формирование рецепторов, которые запускают выработку противомикробных пептидов при взаимодействии с чужеродными микроорганизмами.
- Собственная пластинка (lamina propria). В собственной пластинке находятся «изолированные лимфоидные фолликулы», тесно связанные с регионарными лимфатическими образованиями: пейеровыми бляшками, миндалинами и т. д., которые позволяют перевести иммунный ответ с местного уровня на системный (1).
Слизистая дыхательных путей вынуждена постоянно сталкиваться с инфекционными и неинфекционными аллергенами, биотоксинами, воздействиями химических и физических факторов из вдыхаемого воздуха. Учитывая объём вдыхаемого воздуха, который у человека составляет 7-12 л/ минуту, нагрузка на местный мукозальный иммунитет очень велика. Поэтому механизм иммунной защиты слизистой может давать сбои – развивается дисфункция мукозального иммунитета, результатом которой может быть заражение ОРВИ или развитие хронического заболевания, например, астмы (2).
Что может ухудшить работу мукозального иммунитета
- Патологические состояния, связанные с наличием хронического рецидивирующего воспалительного процесса (например, по данным исследований, при хроническим полипозном риносинусите выявляется дисфункция мукозального иммунитета) (2).
- Стрессы
- Сверхвысокие физические нагрузки
- Химические воздействия на дыхательные пути
- Воздействие радиации и др. (2)
- Проживание в экологически неблагоприятных регионах (например, наличие вредных производств по соседству)
- Отклонения в иммунологическом и аллергическом статусе (2).
Столкнуться с факторами, способными ухудшить качество работы мукозального иммунитета дыхательных путей, может практически каждый ребёнок, особенно живущий в городских условиях и посещающий организованные коллективы. Поэтому идея усиления мукозального иммунитета остаётся актуальной, тем более в сезон эпидемий гриппа и ОРВИ (1,2). Барьерный назальный спрей может стать средством, подходящим различным категориям маленьких пациентов, благодаря своей натуральности, безопасности и способности усиливать природную защиту слизистых оболочек дыхательных путей (3).
Барьерный спрей как средство усиления мукозального иммунитета
Назальный спрей Назаваль плюс создан на основе натуральной микронизированной целлюлозы. При впрыскивании в носовые ходы взвесь частиц спрея равномерно распределяется по поверхности слизистых оболочек верхних дыхательных путей и превращается в гелеобразную плёнку. Плёнка формирует ещё одно физическое препятствие на пути проникновения в организм патогенных микробных агентов (4,5,6). Таким образом, применение спрея Назаваль плюс может дополнительно «усилить» первый (инертный) слой многоуровневой защиты респираторного тракта.
Эффективность барьерной функции микронизированной целлюлозы научно подтверждена. В одном из исследований проводилось сравнение абсорбирующих свойств агарного геля и геля на основе порошка целлюлозы. Через 360 минут экспозиции агарный гель пропустил через себя 100% потенциально вредного антигена, в то время как средство на основе целлюлозы пропустило не более 14% того же антигена (6).
В состав Назаваль плюс входит также экстракт дикого чеснока, который обогащает созданную защитную плёнку фитонцидами. Эти вещества способны подавлять увеличение численности микроорганизмов и нарушать их жизнедеятельность. В результате первый уровень защиты слизистых оболочек усиливается не только механически, но и химически (4,6).
При этом все компоненты Назаваль плюс не всасываются в кровь и не вызывают системных побочных эффектов. Также есть данные, что применение микронизированной целлюлозы не мешает слизистым оболочкам реализовать другие функции – не ухудшается мукоцилиарный клиренс и сохраняется свободный ток воздуха по дыхательным путям (4,5,6).
Таким образом, мукозальный иммунитет – это эффективная защита организма от чужеродных агентов (бактерий и вирусов). Однако из-за сложности и разнообразия механизмов данный вид иммунной защиты может нарушаться под влиянием внешних факторов. Усиление внешнего слоя мукозального иммунитета у детей с помощью барьерного спрея представляется безопасным и эффективным элементом профилактики ОРВИ в эпидемический сезон, в том числе и у детей с атопией и бронхиальной астмой, склонных к тяжёлому протеканию респираторных инфекций и развитию осложнений.
- Козлов И.Г. Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия. Регулярные выпуски «РМЖ». 2018. №8(I):19-27
- Хаитов М.Р., Ильина Н.И., Лусс Л.В., Бабахин А.А. Мукозальный иммунитет респираторного тракта и его роль при профессиональных патологиях // Медицина экстремальных ситуаций. 2017. №3 (61).
- Szczawinska-Poplonyk A. Development of mucosal immunity in children: a rationale for sublingual immunotherapy?. J Allergy (Cairo). 2012;2012:492761. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3205711/
- Ерофеева М.К., Максакова В.Л., Шелехова С.Е., Позднякова М.Г. Возможность применения препарата Назаваль Плюс для профилактики острых респираторных заболеваний у детей. Инфекция и иммунитет. 2012. №1-2.
- Отчет о научно-исследовательской работе по теме: «Оценка эффективности применения медицинского изделия «Назаваль Плюс» с целью профилактики гриппа и других острых респираторных заболеваний»/ Ерофеева М.К., Максакова В.Л., Позднякова М.Г. и др. /Санкт-Петербург, 2011.
- Ненашева Н.М. Эффективная защита слизистой носа против аллергенов и вирусов. Астма и аллергия. 2013. (1):9-15. Доступно по ссылке: https://cyberleninka.ru/article/n/effektivnaya-zaschita-slizistoy-nosa-protiv-allergenov-i-virusov.
Источник
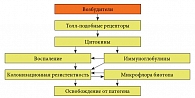
На презентативном объеме клинических исследований показано, что взаимодействие микробиоценозов слизистых открытых полостей макроорганизма носит динамический характер, обеспечивает жизненно необходимый оптимальный уровень реактивности макроорганизма и его антиинфекционную резистентность. Тем самым подтверждена роль микроорганизмов в обучении защитных систем макроорганизма в процессе онтогенеза. Взаимодействие микроорганизмов биотопов слизистых и возбудителей инфекционных заболеваний с толл-подобными рецепторами является необходимым фактором запуска инфекционного процесса. Впервые представлен алгоритм функционирования колонизационной резистентности слизистых как интегральной составляющей местной антиинфекционной резистентности и мукозального иммунитета в целом. Предложенный запатентованный способ оценки колонизационной резистентности слизистых позволяет объективно оценивать степень нарушения микробиоценозов; его можно рассматривать как полуколичественный метод объективной оценки и их мукозального иммунитета. Регистрация показателей уровней толл-подобных рецепторов, цитокинов и иммуноглобулинов слизистых имеет диагностическое и прогностическое значение, а также позволяет судить об эрадикации патогена.

Рис. Алгоритм функционирования колонизационной резистентности слизистых
Введение
Микрофлора человека является основой его микроэкологии и оказывает непосредственное влияние на жизнедеятельность и состояние макроорганизма. Микробиоценоз открытых полостей макроорганизма – динамическая микроэкологическая система, которая выполняет или регулирует многочисленные функции макроорганизма. В систему микробиоценоза входит макроорганизм, его микрофлора (совокупность типичных для определенного биологического вида и конкретного биотопа ассоциаций микроорганизмов) и окружающая среда. Для окружающей среды характерны единство и способность к саморегуляции, она является интегральной частью организма хозяина и, в частности, местного иммунитета. Человеку свойственен только ему присущий микроэкологический гомеостаз. Показатели состояния микробиоценозов отражают состояние реактивности макроорганизма – способности организма отвечать на воздействия внешней среды изменением своей жизнедеятельности, тем самым адаптироваться к различным условиям обитания.
Единство системы микробиоценозов слизистых открытых полостей и мукозального иммунитета
Слизистые открытых полостей макроорганизма представляют собой единую систему. Их барьерная функция определяется состоянием колонизационной резистентности – способностью микрофлоры и макроорганизма совместно защищать экосистему слизистых от патогенных микроорганизмов; является показателем состояния микробиоценоза биотопа [1–5].
Под местным (мукозальным) иммунитетом подразумевается комплекс клеточных и секреторных неспецифических и специфических реакций, включающий барьерные функции клеток кожи и слизистых оболочек, фагоцитарную активность нейтрофилов и макрофагов, Т-клеточный иммунитет, антитела, антимикробные белки внешних секретов, ингибиторы ферментов, цитокины. Местный иммунитет не отождествляется с секреторным иммунитетом, но в качестве его центрального звена рассматривается В-клеточный ответ лимфоидной ткани слизистых оболочек с участием железистого эпителия, поставляющего секреторный компонент.
Понятие местного иммунитета в настоящее время включает совокупность реагирования всех клеток лимфоидного ряда, заселяющих слизистые оболочки, совместно с макрофагами, нейтрофильными и эозинофильными гранулоцитами, тучными клетками и другими клетками соединительной ткани и эпителия [3, 6–11]. Следовательно, микробиоценозы слизистых открытых полостей и мукозальный иммунитет можно рассматривать как интегральную структурно-функциональную систему организма.
Взаимодействие микрофлоры биотопа с толл-подобными рецепторами
При изучении урогенитальных хламидиоза и уреаплазмоза, острых инфекционных заболеваний верхних дыхательных путей, в том числе острых и хронических бронхитов, установлена взаимосвязь толл-подобных рецепторов (Toll-like receptor, TLR) и микрофлоры биотопа. TLR контролируют запуск цитокинового каскада местной антиинфекционной резистентности, через который активируются иммуноглобулиновое звено и воспалительная реакция. Микрофлора биотопа определяет колонизационную резистентность слизистых (рис.), характеризующую течение инфекционного процесса, выраженность клинических и лабораторных проявлений и исход заболевания (излечение, хронизация). Колонизационная резистентность выступает как неотъемлемая часть мукозального иммунитета [7, 8, 12–19].
Функцию TLR оценивали оригинальным запатентованным методом определения уровня экспрессии генов TLR с помощью полимеразной цепной реакции (ПЦР) в реальном времени с обратной транскрипцией с использованием специфических праймеров. Предложенный метод оценки TLR можно рассматривать как дополнительный лабораторный тест, уточняющий клинические формы и прогнозирующий исход заболевания [8, 14, 20–22].
Установлено, что патогенные и условно-патогенные микроорганизмы (УПМ), попадая на слизистые, взаимодействуют с TLR эпителиальных клеток и запускают через активизацию цитокиновой системы воспалительную реакцию. TLR-2 и TLR-4 реагируют на бактериальные патогены, а TLR-3 и TLR-8 – на вирусные. При взаимодействии возбудителя с чувствительными для него клеточными элементами слизистых TLR клеток отвечают экспрессией генов как на патогенные, так и на условно-патогенные микроорганизмы, а при взаимодействии возбудителя с нечувствительными для него клетками эпителия слизистых – только на УПМ.
При остром и хроническом инфекционных процессах ведущими этиологическими факторами инфекционного процесса являются ассоциации из бактериальных и вирусных патогенов, а также УПМ. Различные уровни активации экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 зависят от качественного состава микробных сообществ (в частности, от превалирования грамположительных или грамотрицательных возбудителей или вирусных патогенов), присутствующих на слизистых оболочках открытых полостей организма. Активация экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 происходит более выраженно в ответ на патогенные и условно-патогенные микроорганизмы и менее выраженно – на нормофлору. Показатели уровней обсемененности УПМ прямо коррелируют с показателями уровней экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8. Уровни экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 служат критериями оценки выраженности урогенитального хламидиоза и воспалительного процесса. Повышение экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 коррелирует с тяжестью клинических проявлений, а при выздоровлении их снижение свидетельствует об эрадикации возбудителя. Естественная или приобретенная супрессия генов TLR-2, TLR-4, TLR-3, TLR-8 обусловливает хроническое течение инфекции. При остром инфекционном процессе выявление низких уровней TLR-2, TLR-4, TLR-3, TLR-8 указывает на начало хронизации инфекционного процесса.
При инфекционных поражениях открытых полостей организма родовой и видовой состав патогенных и условно-патогенных микроорганизмов, выделенных от больных, служит дополнительным объективным критерием тяжести течения инфекционного процесса, а также позволяет дифференцированно судить об эффективности проводимой антибактериальной терапии и вносить необходимые коррективы в нее. Острое течение инфекционного процесса сопровождается достоверным снижением уровней индигенной микрофлоры в пристеночном и просветном биотопах слизистых, повышенной колонизацией их УПМ, многократным повышением уровней экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8, цитокинов (интерлейкин (ИЛ)-1-бета, ИЛ-8, интерфенон (ИФН) гамма), фактора некроза опухоли (ФНО) альфа, иммуноглобулинов (Ig) IgG, IgA, sIgA, IgM и секреторного компонента (sc) и выраженностью местной воспалительной реакции (выявлена достоверная корреляционная зависимость между изменениями уровней перечисленных факторов), что свидетельствует о хорошей местной антиинфекционной резистентности. Хроническое течение инфекционного процесса, по сравнению с острым течением, сопровождается при обострении менее выраженными достоверными снижением уровней индигенной микрофлоры в пристеночном и просветном биотопах слизистых, повышением УПМ, повышением уровней экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8, цитокинов ИЛ-1-бета, ИЛ-8, ИФН-гамма, ФНО-альфа, иммуноглобулинов IgG, IgA, sIgA, IgM и sc и слабо выраженной местной воспалительной реакцией, что свидетельствует о нарушении и снижении мукозальной антиинфекционной резистентности [8, 15, 22–25].
С учетом приведенных выше сведений и положений для оценки колонизационной резистентности слизистых открытых полостей организма была предложена оригинальная методология оценки нарушений их микробиоценозов [16, 26–31, 32, 33]*. При оценке состояния мукозального иммунитета предлагается следующая трактовка показателей выраженности нарушений микробиоценозов (дисбактериозов): высокая степень нарушения микробиоценоза свидетельствует о хорошем состоянии мукозального иммунитета и антиинфекционной резистентности. Чем ниже степень нарушения микробиоценоза, тем хуже состояние мукозального иммунитета и антиинфекционной резистентности (происходит хронизация инфекционного процесса и удлиняется период выздоровления).
Оценка выраженности нарушений микробиоценоза влагалища
Нормоценоз влагалища. Наличие на поверхности эпителиоцитов менее 25 бактериальных клеток, представленных грамположительными палочками. Количество лейкоцитов менее 10 в поле зрения. Отсутствие ключевых клеток (I степень чистоты мазка). Содержание в отделяемом 6–8 lg КОЕ/г лактобацилл. Содержание в соскобном материале 7–10 lg КОЕ/г лактобацилл. Отсутствие в отделяемом и в соскобном материале условно-патогенной факультативно-анаэробной и облигатно-анаэробной микрофлоры. Концентрация в смыве IgA 0 мкг/мл, sIgA ≤ 10 мкг/мл, IgM 0 мкг/мл, sc ≤ 10 мкг/мл.
Промежуточный тип микробиоценоза влагалища. Наличие на поверхности эпителиоцитов 25–50 бактериальных клеток, представленных грамположительными палочками, единичными грамположительными кокками и грамотрицательными палочками. Количество лейкоцитов 10–20 в поле зрения. Отсутствие ключевых клеток (II степень чистоты мазка). Содержание в отделяемом 4–5 lg КОЕ/г лактобацилл, 3–4 lg КОЕ/г условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и/или содержание в соскобном материале 5–6 lg КОЕ/г лактобацилл, 1–2 lg КОЕ/г условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры. Концентрация в смыве IgA ≤ 10 мкг/мл, sIgA 11–15 мкг/мл, IgM ≤ 10 мкг/мл, sc 10–25 мкг/мл.
Дисбиоз влагалища. Наличие на поверхности эпителиоцитов 50–100 бактериальных клеток, представленных грамположительными палочками, грамположительными кокками и грамотрицательными палочками, при количестве лейкоцитов 20–40 в поле зрения. Наличие ключевых клеток менее 5 в поле зрения (III степень чистоты мазка). Содержание в отделяемом 1–3 lg КОЕ/г лактобацилл, 5–7 lg КОЕ/г условно-патогенной факультативно-анаэробной микрофлоры и 3–4 lg КОЕ/г условно-патогенной облигатно-анаэробной микрофлоры и/или содержание в соскобном материале 3–4 lg КОЕ/г лактобацилл, 3–4 lg КОЕ/г условно-патогенной факультативно-анаэробной микрофлоры и 5–7 lg КОЕ/г условно-патогенной облигатно-анаэробной микрофлоры. Концентрация в смыве IgA 11–15 мкг/мл, sIgA 16–30 мкг/мл, IgM 11–20 мкг/мл, sc 26–50 мкг/мл.
Бактериальный вагинит. Наличие на поверхности эпителиоцитов не менее 100 бактериальных клеток, представленных единичными грамположительными палочками и обильной грамотрицательной и грамположительной палочковой и кокковой флорой, при количестве лейкоцитов не менее 40 в поле зрения. Количество ключевых клеток не менее 5 в поле зрения (IV степень чистоты мазка). Отсутствие в отделяемом лактобацилл. Содержание в отделяемом 5–6 lg КОЕ/г монокультуры условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и/или содержание в соскобном материале 1–3 lg КОЕ/г лактобацилл, 6–8 lg КОЕ/г монокультуры условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры. Концентрация в смыве IgA > 15 мкг/мл, sIgA > 30 мкг/мл, IgM > 20 мкг/мл, sc > 50 мкг/мл.
Оценка выраженности нарушений микробиоценоза цервикального канала
Нормоценоз микробиоценоза цервикального канала. Количество лейкоцитов
Промежуточный тип микробиоценоза цервикального канала. Количество лейкоцитов 8–10 в поле зрения. Содержание в соскобном материале 2–3 lg КОЕ/г УПМ. Концентрация в смыве IgG 10–13 мкг/г белка, sIgA 11–14 мкг/г белка, sc 13–19 мкг/г белка.
Дисбиоз микробиоценоза цервикального канала. Количество лейкоцитов 14–40 в поле зрения. Содержание в соскобном материале 3–4 lg КОЕ/г УПМ. Концентрация в смыве IgG 30–40 мкг/г белка, sIgA 20–30 мкг/г белка, sc 30–40 мкг/г белка.
Бактериальный вагинит микробиоценоза цервикального канала. Количество лейкоцитов > 40 в поле зрения. Содержание в соскобном материале > 4 lg КОЕ/г УПМ. Концентрация в смыве IgG > 40 мкг/г белка, sIgA > 30 мкг/г белка, sc > 40 мкг/г белка.
Оценка выраженности нарушений микробиоценоза ротоглотки
Нормоценоз. Микроэкологические нарушения отсутствуют. Наличие индигенной микрофлоры: Streptococcus spp. в количестве 5–6 lg КОЕ/г, Neisseria spp. – 4–6 lg КОЕ/г при концентрации в слюне IgA
Промежуточный тип (I степень дисбиотических нарушений). Характеризуется нарастанием нормофлоры (Streptococcus spp. – до 6–7 lg КОЕ/г, Neisseria spp. – 6–7 lg КОЕ/г) и появлением УПМ в количестве до 3–4 lg КОЕ/г при концентрации в слюне IgA 20–50 мкг/мл, sIgA 20–50 мкг/мл, IgM
Дисбиоз (II степень дисбиотических нарушений) ротоглотки. Повышение количества нормофлоры (Streptococcus spp. – 6–7 lg КОЕ/г, Neisseria spp. – 6–7 lg КОЕ/г), повышение уровня факультативно-анаэробной УПМ до 4–5 lg КОЕ/мл, появление вирулентных вариантов УПМ, характеризующихся выраженными факторами патогенности, при концентрации в слюне IgA 50–100 мкг/мл, sIgA 50–100 мкг/мл, IgM 10–30 мкг/мл, IgG 100–200 мкг/мл, sc 100–200 мкг/мл.
Выраженный воспалительный процесс (III степень дисбиотических нарушений). Характеризуется значительным повышением содержания Streptococcus spp. – 7–8 lg КОЕ/г, Neisseria spp. – 7–8 lg КОЕ/г, УПМ и количества вирулентных микроорганизмов до 6–8 lg КОЕ/мл при концентрации в слюне IgA > 100 мкг/мл, sIgA > 100 мкг/мл, IgM > 30 мкг/мл, IgG > 200 мкг/мл, sc > 200 мкг/мл.
Оценка выраженности нарушений микробиоценоза кишечника
Нормоценоз. Содержание кишечной палочки ≥ 8 lg КОЕ/г, лактобацилл ≥ 7 lg КОЕ/г, бифидобактерий ≥ 9 lg КОЕ/г, отсутствие УПМ при содержании в копрофильтратах IgA
I степень дисбактериоза кишечника. Характеризуется повышенным или пониженным содержанием кишечной палочки (≥ или ≤ 8 lg КОЕ/г), снижением содержания лактобацилл (≤ 6 lg КОЕ/г) и бифидобактерий (≤ 9 lg КОЕ/г) при содержании в копрофильтратах IgA ≤ 10 мкг/мл, sIgA ≤ 10 мкг/мл, IgM ≤ 5 мкг/мл, IgG 10–20 мкг/мл, sc ≤ 10 мкг/мл.
II степень дисбактериоза кишечника. Характеризуется сниженным содержанием кишечной палочки (≤ 8 lg КОЕ/г), лактобацилл (≤ 6 lg КОЕ/г) и бифидобактерий (≤ 8 lg КОЕ/г), появлением УПМ в количестве ≥ 4 lg КОЕ/г, при содержании в копрофильтратах IgA 10–20 мкг/мл, sIgA 10–20 мкг/мл, IgM 5–10 мкг/мл, IgG 20–40 мкг/мл, sc 10–20 мкг/мл.
III степень дисбактериоза кишечника. Характеризуется значительным снижением содержания кишечной палочки с неизмененными ферментативными свойствами (≤ 6 lg КОЕ/г), появлением слабоферментирующей и/или гемолизирующей кишечной палочки (≥ 4 lg КОЕ/г), значительным содержанием лактозонегативных энтеробактерий, грамотрицательных, глюкозу не ферментирующих бактерий, кокковой флоры (≥ 6 lg КОЕ/г), резким снижением содержания лактобацилл и бифидобактерий – ≤ 5 lg КОЕ/г и ≤ 7 lg КОЕ/г соответственно, при содержании в копрофильтратах IgA > 20 мкг/мл, sIgA > 20 мкг/мл, IgM > 10 мкг/мл, IgG > 40 мкг/мл, sc > 20 мкг/мл.
Заключение
Впервые выявлено, что взаимодействие микробиоценозов слизистых открытых полостей макроорганизма носит динамический характер, обеспечивает жизненно необходимый оптимальный уровень реактивности макроорганизма и его антиинфекционную резистентность. Это подтверждает роль микроорганизмов в обучении защитных систем макроорганизма в процессе онтогенеза. Установлено, что запуск инфекционного процесса невозможен без взаимодействия микроорганизмов биотопов слизистых и возбудителей инфекционных заболеваний с TLR.
Впервые представлен алгоритм функционирования колонизационной резистентности слизистых как интегральной составляющей местной антиинфекционной резистентности и мукозального иммунитета в целом. Благодаря предложенному запатентованному способу оценки колонизационной резистентности слизистых представляется возможным объективно оценивать степень нарушения микробиоценозов. Регистрация показателей уровней TLR, цитокинов и иммуноглобулинов слизистых имеет диагностическое и прогностическое значение, а также позволяет судить об эрадикации патогена.
Источник
