Недоношенный малыш и иммунитет
Энциклопедия / Заболевания / Осложнения беременности и родов / Недоношенные дети
Автор статьи — Созинова А.В., практикующий врач акушер-гинеколог. Стаж по специальности с 2001 года.
Недоношенностью считается рождение ребенка до окончания гестационного периода, то есть в сроке от 22 до 37 недель, с массой тела меньше 2500гр., а длиной менее 45см.
У недоношенных детей отмечаются расстройства терморегуляции, дыхания со склонностью к апноэ (прекращение дыхательных движений), слабый иммунитет и явные антропометрические и клинические признаки.
Классификация недоношенных детей по степеням связана с массой тела ребенка (срок беременности условен):
1 степень – масса тела 2001-2500гр. (срок соответствует 35-37 неделям);
2 степень – масса тела 1501-2000гр. (срок соответствует 32-34 неделям);
3 степень – 110-1500гр. (срок беременности 29-31 неделя);
4 степень – вес ребенка менее 1000гр., что соответствует сроку гестации менее 29 недель (экстремально недоношенные).
Причины преждевременных родов многочисленны и представлены с трех сторон:
Материнские факторы:
- хронические заболевания женщины (патология сердечно-сосудистой системы, эндокринные заболевания, патология почек):
- острые инфекции во время беременности;
- гинекологические заболевания;
- отягощенный акушерский анамнез (аборты, кесарево сечение);
- внутриматочная спираль;
- травмы;
- истмико-цервикальная недостаточность;
- возраст (младше 17 и старше 30);
- резус-конфликтная беременность;
- вредные привычки;
- патология плаценты (предлежание, отслойка);
- вредные условия труда;
- осложнения беременности (гестоз).
Отцовские факторы:
- возраст (старше 50 лет);
- хронические заболевания.
Плодовые факторы:
- внутриутробные пороки развития;
- многоплодная беременность;
- эритробластоз (гемолитическое заболевание);
- внутриутробная инфекция.
Недоношенные дети имеют ярко выраженную клиническую картину. Отмечается диспропорция частей тела, мозговой череп преобладает над лицевым. Кости черепа мягкие, помимо родничков наблюдается незаращение черепных швов. Также характерны мягкие ушные раковины.
У недоношенных детей слабо развит подкожножировой слой, они не могут «держать» температуру (нестабильность терморегуляции). Недоразвитие легких при недоношенности обусловлено отсутствием сурфанктанта, который обеспечивает раскрытие легочных альвеол на вдохе, что проявляется нарушением дыхания и периодическими апноэ (остановка дыхания).
Кожные покровы морщинистые, имеют в первые сутки ярко-красную окраску, отмечается слабый мышечный тонус или полное его отсутствие.
Физиологические рефлексы (сосательный, поисковый и прочие) слабо выражены.
У недоношенных мальчиков яички не опущены в мошонку, а у девочек недоразвиты большие половые губы. Характерны для недоношенных детей гипертензионный и гидроцефальный синдромы.
Из-за недоразвитости век выражено пучеглазие (экзофтальм).
Отмечается недостаточная функция печени, что проявляется ядерной желтухой. Из-за слаборазвитой иммунной системы у недоношенных детей высок риск инфицирования. Недоношенные дети склонны к срыгиванию. Кроме того, у таких детей недоразвиты ногтевые пластинки и могут достигать лишь середины кончиков пальцев.
Ведением и лечением недоношенных детей занимается врач-неонатолог.
Детям, рожденным до срока, требуется определенные условия существования. Температура окружающего воздуха должна быть 25°C, а влажность не менее 55-60%. С этой целью недоношенных детей держат в кувезах (специальные инкубаторы).
В кувезах находятся младенцы с весом ниже 2000гр. Выписка здоровых недоношенных детей осуществляется на 8-10 сутки, при условии достижения их массы тела 2кг.
В случае, если недоношенный ребенок в течение 14 дней не достиг веса в 2000гр., его переводят на второй этап выхаживания (проводится в реанимационной палате детского отделения/больницы). Таких детей размещают в кувезах, куда подается кислород.
Купать недоношенных малышей начинают с 2-хнедельного возраста (при условии заживления пуповинного остатка). Гуляют с детьми при исполнении им 3-4 недель и весе 1700-1800гр.
Выписка здоровых недоношенных детей проводится при достижении ими веса 1700гр.
Кормление ребенка сцеженным грудным молоком начинают через 2-6 часов после рождения при условии отсутствия противопоказаний и большого срока беременности (34-37 недель).
Детям, которые находятся в тяжелом состоянии или глубоко недоношенным назначается парентеральное питание через зонд (через рот или нос) в течение первых 24-48 часов жизни.
К груди прикладывать начинают ребенка весом 1800-2000гр. при наличии активного сосания. В 1 день объем одного кормления составляет 5-10 мл, во 2 день 10-15 мл, а в 3-й – 15-20 мл.
Кроме того, недоношенным детям показано введение витаминов:
- викасол (витамин К) с целью предупреждения внутричерепных кровоизлияний;
- аскорбиновая кислота (витамин С), витамины В1, В2;
- витамин Е (токоферол);
- профилактика рахита (витамин Д);
- витамины В6 и В5, липоевая кислота при глубокой недоношенности;
Прогноз для жизни у недоношенных детей зависит от многих факторов. В первую очередь от срока беременности и веса при рождении. В случае рождения ребенка в сроке 22-23 недели прогноз зависит от интенсивности и качества терапии. Риск летального исхода увеличивается в следующих случаях:
- дородовое кровотечение;
- роды в тазовом предлежании;
- многоплодная беременность;
- асфиксия в родах;
- низкая температура ребенка;
- респираторный дистресс-синдром.
Отдаленные последствия недоношенности (вероятность возникновения данных осложнений опять же зависит от многих факторов; при прочих благоприятных условиях данные осложнения довольно редки):
- отставание в умственном и физическом развитии;
- детский церебральный паралич;
- судорожный и гидроцефальный синдромы;
- миопия, астигматизм, глаукома, отслойка сетчатки;
- склонность к частым инфекциям;
- нарушение слуха;
- нарушение менструального цикла, генитальный инфантилизм и проблемы с зачатием у девочек.
Источник: diagnos.ru
Источник
От нуля до букваряАникеева Лариса Шиковна
Особенности иммунитета у недоношенных детей
Находясь в утробе матери, ребенок получает через плаценту антитела от многих болезней, которые надежно защищают его в первые полгода жизни. Наибольшее количество антител и иммуноглобулинов поступает в организм ребенка при сроке беременности от 32 до 35 недель. Следовательно, преждевременно родившийся ребенок недополучил значительное количество защитных тел, что, несомненно, сказывается на состоянии его иммунитета.
Собственная иммунная система недоношенного функционирует очень слабо: продуцировать иммуноглобулины она почти не способна, В-лимфоцитов вырабатывается мало, функциональная активность Т-лимфоцитов низкая.
Секреторных иммуноглобулинов, которые находятся в слизистых оболочках дыхательных путей и пищеварительного тракта и первыми встречают нашествие «неприятеля», у недоношенных почти нет. Поэтому возбудители респираторных и кишечных заболеваний легко проникают через слизистые во внутреннюю среду организма.
Выработка макроглобулинов, которые должны первыми появляться после иммунизации, у недоношенных затруднена. Поэтому нет смысла в профилактических прививках в первое полугодие жизни.
Неспецифическая защита также несовершенна: снижен уровень лизоцима, мало вырабатывается интерферона, активность комплемента незначительна, пищеварительные ферменты малоактивны, проницаемость кишечной стенки повышена, обезвреживающая функция печени почти не выражена.
Все эти факты свидетельствуют о несовершенстве иммунитета у недоношенного ребенка и подчеркивают необходимость его повышения всеми способами.
Профилактические прививки детям, родившимся с весом 1500 г и менее, проводят по истечении первого года жизни с учетом состояния здоровья.
Недоношенным 1–2 степени прививки разрешаются с 5–6 месяцев при условии стабильного нарастания веса и хорошего физического развития. В связи с высокой частотой развития рахита у недоношенных из-за дефицита кальция и фосфора в костной системе, специфическая профилактика рахита витамином Д начинается с 2-недельного возраста.
Все недоношенные дети должны регулярно наблюдаться педиатром, а в возрасте 2 месяцев им необходима консультация невропатолога, хирурга и ортопеда.
Данный текст является ознакомительным фрагментом.
Похожие главы из других книг:
Особенности речевого развития детей 2–4 лет
Начиная со второго полугодия третьего года жизни речь ребенка становится понятной для окружающих вне конкретной ситуации и речевого контекста, а это свидетельствует о том, что после 2 лет 6 месяцев малыш овладевает необходимым
Особенности психического развития детей
Веракса Н.Е., Веракса А.Н. Развитие ребенка в дошкольном детстве. – М.: Мозаика-Синтез, 2006.Веракса Н.Е., Веракса А.Н. Зарубежные психологи о развитии ребенка-дошкольника. – М.: Мозаика-Синтез, 2006.Диагностика готовности ребенка к школе
Особенности ознакомления детей с художественной литературой
На многих занятиях, представленных в данном пособии, предусмотрена работа с произведениями художественной литературы.Среди программных произведений особое место занимают народные песенки, потешки, стихи. И
Особенности обучения детей в дошкольном возрасте
Обучение детей в младшем дошкольном возрасте характеризуется тем, что они учатся постоянно, в любое время, в любом месте. Приобретение опыта, удачного и неудачного, любое впечатление – все способствует их
Психологические особенности детей дошкольного возраста
Дошкольный возраст – это особая эпоха человеческого развития. Нередко одно только упоминание о «нежном возрасте» вызывает у взрослых людей улыбку умиления. Это пора искренности и непосредственности, наивности и
Особенности развития детей раннего возраста
Для детей первых лет жизни характерен быстрый темп развития. С этим связано повышение работоспособности детского организма. Новорожденный ребенок в состоянии бодрствовать в течение 5–7 минут. К году длительность одного
Особенности массажа и гимнастики для детей от 1,5 до 3 месяцев
• С первого дня жизни и до 2 месяцев ребенок очень много спит. Его сон может продолжаться до 22 часов в сутки. Поэтому, чтобы организм ребенка развивался правильно, во время его бодрствования следует делать ему
Особенности гимнастики и массажа детей от 7 до 9 месяцев
• Когда ребенку исполняется 7 месяцев, он может самостоятельно сидеть, переворачиваться с живота на спину и наоборот. Если его потянуть за руки, он будет делать попытки встать на ноги.• К этому времени он, как правило,
Особенности гимнастики и массажа детей от 9 до 12 месяцев
• В 9-месячном возрасте ребенок умеет свободно ползать, сидеть, делает первые попытки ходить как с помощью взрослых, так и самостоятельно. Это позволяет усложнить многие гимнастические упражнения, ввести в
Особенности иммунитета у детей
У новорожденных и детей первых месяцев жизни защитные функции осуществляются антителами (IgG), полученными от матери через плаценту и грудное молоко.Поэтому дети, находящиеся на естественном вскармливании, до 6 месяцев не восприимчивы к
Глава 5
Идентичность детей в учреждении: особенности формирования
Идентичность можно определить как устойчивое представление о себе и своем месте в социуме и мире. Это не просто знание о разных гранях своей личности, но и принятие себя таким, какой есть, с критическим
Особенности обучения детей постарше
Даже если мы начали обучать ребенка гигиене с раннего возраста, за ним в дальнейшем все равно придется тщательно следить, поддерживая график и навык осуществления заученных действий. Это совершенно необходимо, так как дети быстро,
Особенности психомоторного развития у недоношенных детей
Современная медицина заметно повысила показатель выживаемости младенцев. Однако участились и случаи преждевременных родов, увеличившись за последние несколько лет с 10 % от общего числа новорожденных до 15–30 %
Другие особенности поведения грудных детей
Со временем ваш ребенок наверняка проявит некоторые «черты характера», описанные выше. Точно так же не удивляйтесь, если столкнетесь с одной или более из нижеследующих моделей поведения на том или ином этапе грудного
Источник
Анализ состояния здоровья новорожденных: развитие инфекционных заболеваний и незрелость иммунной системы недоношенного ребенка. Характеристика гуморального иммунного ответа недоношенных новорожденных с очень низкой (ОНМТ) и экстремально низкой массой тела (ЭНМТ), в зависимости от действия анте- и постнатальных факторов риска. Эффективность иммуномодулирующей терапии в комплексном лечении.
Перцева В.А., Захарова Н.И.
Анализ состояния здоровья новорожденных свидетельствует о неуклонном росте инфекционной заболеваемости, которая у недоношенных детей в 4,5 раза выше, чем у доношенных, и составляет около 780 на 1000 недоношенных, родившихся
живыми [1–3].
Инфекционно–воспалительные заболевания являются ведущей причиной смертности маловесных новорожденных и занимают второе место после гипоксии и асфиксии в родах [4]. Иммунная система, наряду с ЦНС и эндокринной системой, участвует в поддержании гомеостаза организма ребенка и установлении оптимального баланса во взаимоотношениях с окружающей средой.
Считают, что в основе развития инфекционных заболеваний лежит относительная незрелость иммунной системы недоношенного ребенка. Это касается системного (гуморального и клеточного) и местного иммунитета [1,5–9]. Основной формой иммунологического ответа на введение генетически чужеродных веществ и инфекцию является образование неспецифических факторов защиты. Гуморальные факторы защиты недоношенного ребенка в основном представлены материнскими антителами, однако наибольшее поступление иммуноглобулина G (IgG) через плаценту происходит после 34 нед. гестации. Иммуноглобулины классов А и М в организме недоношенного практически отсутствуют [1,10].
У новорожденных в качестве противоинфекционной защиты возрастает роль фило– и онтогенетически более ранних неспецифических факторов защиты, в первую очередь системы интерферона, который играет важную роль в формировании иммунитета [11,12]. Степень зрелости морфологического субстрата иммунной системы недоношенных детей к моменту рождения зависит от гестационного возраста ребенка, антигенной нагрузки, патологических воздействий, которым подвергается плод при осложненном течении беременности и нарушении иммунологической взаимосвязи в системе мать – плод – новорожденный [13– 15].
В ряде работ [16,17] доказана взаимосвязь инфекционной патологии матери, осложненного течения родов, развития ишемии–реперфузии в различных органах и тканях с противоинфекционной резистентностью ребенка. Считают, что в основе нарушений формирования и созревания иммунной системы плода лежит ее угнетение вследствие избыточной антигенной стимуляции в ответ на инфекционные факторы и другие чужеродные антигены, поступающие от матери. В связи с этим изучение особенностей формирования иммунной системы плода в зависимости от характера течения гестационного периода имеет большое практическое и теоретическое значение. Наибольший практический интерес представляют анализ взаимосвязи гестационного возраста, внутриутробной инфекции, патологии фетоплацентарного комплекса, уровней иммуноглобулинов и гамма–интерферона как показателей, отражающих уровень противоинфекционной резистентности недоношенного ребенка, и оценка целесообразности применения иммунотропных средств для лечения этой категории пациентов.
Цель: дать характеристику гуморального иммунного ответа недоношенных новорожденных с очень низкой (ОНМТ) и экстремально низкой массой тела (ЭНМТ) в зависимости от действия анте– и постнатальных факторов риска и оценить эффективность иммуномодулирующей терапии в комплексном лечении.
Материалы и методы
Всего обследовано 65 недоношенных новорожденных с ОНМТ и ЭНМТ при рождении. В качестве иммуномодулирующего препарата был выбран Кипферон® суппозитории для вагинального или ректального введения (Кипферон®). Из общего числа включенных в исследование детей сформировано три группы. В 1–ю группу вошло 25 детей. Кипферон® применяли с первых сутокжизни по ½ cуппозитория 1 раз/сут. (250000 МЕ в перерасчете на ИФН) в течение 14 дней. Во 2–ю – 20 человек (Кипферон® назначали в той же дозе после первого курса антибактериальной терапии или при клиническом ухудшении, обусловленном нозокомиальной инфекцией), 3–ю группу (группу сравнения) составили 20 недоношенных ново- рожденных (получали стандартную комплексную терапию без иммуномодуляторов).
Новорожденные дети в сформированных группах были сопоставимы по гестационному возрасту, массе тела при рождении и существенно не различались по данным антенатального анамнеза и состоянию при рождении. Все дети с рождения находились в условиях неонатальной реанимации, с первых суток жизни получали инфузионную, антибактериальную терапию и энтеральное питание, которое в течение первых 2–3 сут. жизни в связи с тяжестью состояния было представлено адаптированной молочной смесью для недоношенных детей. Всем детям проводился стандартный объем лабораторных и инструментальных исследований согласно протоколу ведения и выхаживания недоношенных новорожденных в условиях перинатального центра.
Кровь для исследований брали на третьи и двадцатые сутки жизни, у детей 2–й группы – на третьи и тридцатые. Биологическим субстратом для исследования являлись сыворотка крови и копрофильтраты. Сыворотку получали путем центрифугирования цельной крови при 3000 оборотах в течение 15 мин. Для получения копрофильтратов 1 г свежих фекалий смешивали с 1 мл физиологического раствора. Взвесь центрифугировали при 3000 оборотах в течение 15 мин. Образцы надосадочной жидкости сразу после получения замораживались и хранились при температуре – 20°С, до исследования иммуноглобулинов (Ig). Cывороточные (IgG, IgA, IgM) и секреторные иммуноглобулины (IgG, IgA, IgM, sIgA) определяли методом радиальной иммунодиффузии (РИД) по Манчини (1965). Гамма–интерферон в сыворотке крови и копрофильтратах определяли методом трехфазного иммуноферментного анализа с использованием коммерческих тест–систем (ООО «Цитокин», Санкт–Петербург) с учетом рекомендаций производителя.
Цифровой материал обрабатывался стандартными методами вариационной статистики с использованием программы Statistica v. 7.0 (StatSoft, США, 2001). Определяли средние величины исследуемых показателей (М), стандартную ошибку средних (m), уровни статистической значимости (р) различий между значениями показателей в разных группах оценивали по критерию Стьюдента. Различия считали значимыми при p<0,05; p<0,01.
Результаты и обсуждение
При анализе анамнестических данных установлено, что абсолютное большинство матерей имели высокий уровень общей экстрагенитальной (84%) и урогенитальной (76,4%) патологии. В структуре экстрагенитальной патологии преобладали сочетание инфекционно–соматической патологии (47,6%) и изолированная патология сердечно– сосудистой системы (38,3%). Среди урогенитальной патологии чаще регистрировалась хроническая воспалительная патология: эрозии, аднексит, сальпингоофорит, кольпит.
Во всех случаях отмечалось осложненное течение беременности. Патология II и III триместров во всех группах диагностирована у более чем 90% женщин, нередко в сочетании с обострением инфекционного процесса (35%). По мере прогрессирования беременности возрастал удельный вес патологии за счет тяжелых форм гестоза, фетоплацентарной недостаточности (ФПН), задержки развития плода (70,7%). У более чем 40% бере- менных женщин преждевременные роды связаны с нарастанием тяжести гестоза и декомпенсацией ФПН.
По результатам исследования сыворотки крови, взятой на 3–4 сут. жизни, IgA определялся у 10 детей (15,4%) в средней концентрации 0,08±0,02 г/л (при норме в пуповинной крови 0,03 г/л). Из 10 детей у двух IgA определялся в концентрации 0,02 г/л. Эти дети имели срок гестации 32 нед., что соответствует данным литературы о том, что синтез IgA плодом в следовых количествах возможен в норме с 30–й нед. гестации, а при антигенной стимуляции инфекционными агентами – начиная с 13–14–й нед. внутриутробного развития [18,19].
IgA у детей с ЭНМТ и сроком гестации менее 30 нед. не определялся. Выявлено отрицательное влияние на синтез IgA длительного безводного периода (0,13±0,04 г/л), инфекций, передающихся половым путем (ИППП), выявленных во время беременности (0,13±0,04 г/л). Кроме того, IgA в сыворотке крови чаще определялся у детей, которые впоследствии реализовали внутриутробную инфекцию (ВУИ). Сопоставляемые показатели по сравнению с детьми без реализации инфекции составили соответственно 30 и 15%.
IgM определялся в сыворотке крови у всех детей в средней концентрации 0,22±0,03 г/л. У 6 детей уровень сывороточного IgM был выше 0,4 г/л, а у 4 детей – выше 1,0 г/л. Матери детей с концентрацией IgM >1,0 г/л имели в анамнезе воспалительное заболевание урогенитального тракта в последнем триместре беременности. Обращает на себя внимание тот факт, что высокий уровень IgM коррелирует с высоким уровнем IgA в сыворотке крови и длительным безводным периодом, что косвенно подтверждает роль инфекционного фактора. Самостоятельный синтез плодом IgM начинается с 12–15–й нед. внутриутробного раз- вития, а к моменту рождения его содержание со- ставляет 5–20% величины взрослого. Иммунная система плода при его контакте с чужеродными антигенами реагирует увеличением синтеза IgM. По данным Д.В. Стефании, Ю.В. Вельтищева, повышение концентрации IgM при рождении более 200–300 мг/л свидетельствует об антигенной сти- муляции плода или о его внутриутробном инфи- цировании, что соответствует результатам нашего исследования.
IgG в сыворотке крови определялся у всех детей в средней концентрации 4,132±0,2 г/л. Отмечена взаимосвязь уровня IgG с гестационным возрастом, массой тела при рождении (4,55±0,3 г/л у детей с ОНМТ и 2,857±0,2 г/л у детей с ЭНМТ; p<0,01) и наличием острого инфекционного процесса во время беременности (3,46±0,3 г/л в сравнении с 4,49±0,2 г/л; p<0,05), у детей без обострения инфекции во время течения гестационного процесса.
К концу 1–го месяца жизни во всех группах детей отмечено увеличение частоты встречаемости и уровня сывороточного IgA и IgM в среднем в 1,5–2 раза. Во 2–й группе (Кипферон® применяли после развития госпитального инфекционного процесса) сывороточный IgA выявляли в 2 раза чаще (66,7%), чем в 1–й (31,2%) и контрольной (33,3%) группах (p<0,05). IgM достоверно чаще выявляли у заболевших детей (p<0,05). У всех недоношенных детей к концу неонатального периода в сыворотке крови снижался IgG без значимой разницы в группах.
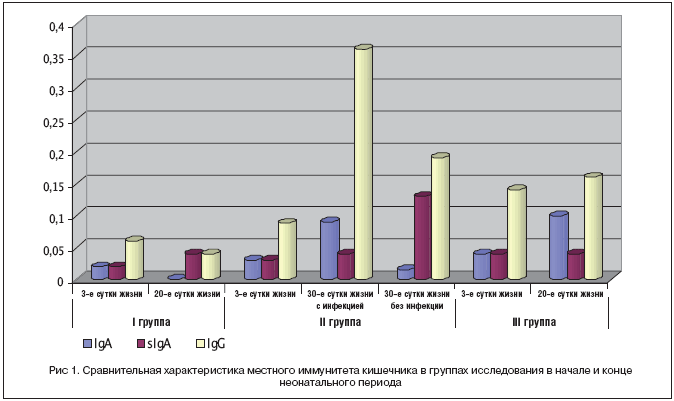
Секреторный иммуноглобулин А (sIgA) в копрофильтратах определялся у 5 детей на третьи сутки жизни в следовых концентрациях, сывороточный IgA – у 11 детей, причем у 10 детей из 11 развился впоследствии острый инфекционный процесс. Выявлена значимая взаимосвязь уровня IgA в копрофильтратах с инфекционным процессом (0,06±0,01 г/л) и обострением ИППП во время бе- ременности (0,04±0,01 г/л).
IgG в копрофильтратах глубоко недоношенных детей выявлены у 49 детей (75%). Установлена зависимость концентрации IgG от гестационного возраста и массы тела при рождении (0,15±0,03 г/л у детей с ЭНМТ и сроком гестации менее 30 нед. и 0,07±0,01 г/л у детей с ОНМТ и сроком гестации более 30 нед.), наличия острого инфекционного процесса, обострения ИППП во время беременности и уровня IgG в сыворотке крови.
На 20–30 сут. жизни отмечено нарастание частоты выявления sIgA в копрофильтратах в среднем в 4–5 раз у всех детей. При этом у детей, получавших Кипферон®, выявлено также увеличение уровня sIgA – в среднем в 2 раза в 1–й группе (с 0,02 до 0,04 г/л) и во 2–й (с 0,04 до 0,13 г/л; p<0,05).
IgA не определялся у детей, получавших Кипферон® с первых суток жизни и у которых не развился постнатальный инфекционный процесс к концу неонатального периода. Во 2–й группе с развитием инфекционного процесса отмечено снижение уровня с 0,03 до 0,015 г/л и выявления IgA с 35 до 26,7%; p<0,05. У детей 1–й и 2–й групп также выявлено достоверное снижение концентрации и частоты выявления IgG в копрофильтратах. В то же время у детей группы сравнения, не получавших Кипферон®, к концу 1–го месяца жизни выявлены увеличение частоты встречаемости IgA с 10 до 50% и повышение уровня IgG в копрофильтратах (рис. 1).
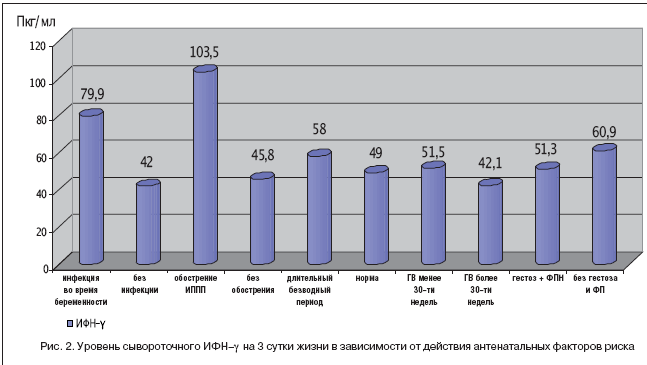
Интерферон–гамма (ИФН–γ) в сыворотке крови на 3 сут. жизни определялся у всех новорожденных с ОНМТ и ЭНМТ в средней концентрации 86,5 пкг/мл, что в 2,5 раза превышает аналогичный показатель у здоровых доношенных новорожденных. По данным литературы известно, что наличие у матерей в период беременности и родов острых или обострения хронических воспалительных заболеваний сопровождается у здоровых недоношенных детей существенным увеличением (до 6 раз) способности лимфоцитов к продукции гамма–интерферона. Это является отражением внутриутробной антигенной стимуляции под влиянием неблагоприятных факторов, воздействующих на плод, и указывает на достаточно высокие компенсаторные возможности иммунной защиты у этих детей [Малиновская В.В., Кешишьян Е.С., 2006]. Выявлена зависимость уровня ИФН–γ от наличия острого инфекционного процесса во время беременности, выявленных ИППП, длительного безводного периода (рис.2).
Известна зависимость показателей системы интерферона от степени тяжести инфекционного процесса. По результатам исследования выявлена тенденция к угнетению интерфероногенеза при развитии внутриутробных и нозокомиальных инфекционных заболеваний. Так, отмечено снижение уровня гамма–интерферона к 20 сут. жизни в контрольной группе с 83,2 до 33,2 пкг/мл. Однако в группе детей, получавших Кипферон® на 7–10 сут. жизни, ИФН–γ оставался на высоком уровне – 71,4 пкг/мл. У детей 1–й группы, в которой Кипферон® назначался с профилактической целью, с первых суток жизни отмечалось нарастание уровня ИФН–γ – с 17,4 до 24,4 пкг/мл. Такая динамика рассматривалась нами как положительный ответ иммунной системы на препарат. Гамма– интерферон в копрофильтратах на 3 сут. жизни определился у 3 детей, средний показатель – 31,9±7,8. Все эти дети родились у матерей с тяжелым гестозом, ФПН и обострением урогенитальной инфекции во время настоящей беременности. Дети к моменту забора анализов находились в очень тяжелом состоянии. Можно предположить, что данный факт является отражением стимуляции интерфероногенеза плодом в ответ на внутриутробную инфекцию и неблагоприятные факторы беременности. На 20–30 сут. жизни гамма–интерферон в копрофильтратах не выявлен ни у одного ребенка.

Выводы
Гуморальный иммунитет обследованных новорожденных с ОНМТ и ЭНМТ характеризуется низким уровнем IgG и IgM.
Значимыми факторами, которые антенатально влияют на синтез иммуноглобулинов и гамма–интерферона, являются: острый инфекционный процесс во время беременности, обострение ИППП, тяжелое течение гестоза, декомпенсированная ФПН, наличие соматической и урогенитальной патологии у женщи- ны до беременности.
Установлено, что иммунная система плода при его контакте с инфекционными антигенами отвечает увеличением синтеза IgM и позже (с 30 нед. гестации) синтезом IgA.
Выявлена взаимосвязь уровня сывороточного IgA и sIgA копрофильтратов (p<0,05) с наличием и тяжестью инфекционного процесса в постнатальном периоде, что подтверждается выявлением IgA в первые трое суток после рождения.
К концу неонатального периода во всех группах маловесных новорожденных выявлено нарастание концентрации сывороточных IgA и IgM и снижение IgG, что, по–видимому, обусловлено разрушением IgG, полученных от матери, и синтезом собственных иммунных белков.
В группах детей, получавших Кипферон®, отмечены нормализация уровня sIgA, IgA и IgG в копрофильтратах и положительное влияние препарата на системный интерфероногенез.
Литература
- Яцык Г.В. и др. Руководство по неонатологии / Под ред. Г.В. Яцык. М.: Гардарики, 2004. С.138–144.
- Суханова Л.П. Здоровье новорожденных детей России. М.: Канон»+РООИ «Реабилитация». 2007. 320 с.
- Шабалов Н.П. Неонатология. М.: МЕДпресс–информ, 2006. С. 17–18.
- Воробьева В.А. и соавт. Иммунология и аллергология Практическая медицина. Нижний Новгород, 2008. С. 72–74.
- Останин А.А., Макогон А.В., Леплина О.Ю., Пасман Н.М., Черных Е.Р. Показатели иммунитета плода в ранней диагностике внутриутробной инфекции. // Медицинская иммунология. 2001. Т. 3. № 4. С. 515–524.
- Таболин В.А., Петрухин А.С. и др. Этапное лечение и реабилитация детей с перинатальной патологией // Педиатрия. 1987. № 4. С. 22–27.
- Барышников А.Ю., Торубарова Н.А., Алымкулова Э.Д. Иммунологическая характеристика ранних предшественников лимфоидных клеток человека // Гематология и трансфузиология. 1985. № 11. С. 45–49.
- Ботвиньева В.В. Онтогенетические особенности иммунной системы. Физиология роста и развития детей и подростков / Под ред. А.А. Баранова, Л.А. Щеплягиной. М., 2000. С. 83.
- ГОУ ВУНМЦ МЗ РФ Протоколы диагностики, лечения и профилактики внутриутробных инфекций у новорожденных детей. М., 2001. 96 с.
- Володин Н.Н., Дегтярев Д.Н., Байбарина Е.Н. Неонатология: Учебное пособие. М., 2008. С. 116–122.
- Е.С. Кешишян, В.В. Малиновская. Вестник педиатрической фармакологии и нутрициологии. 2006. Т. 3. № 3. С. 212–214.
Малиновская В.В. Система интерферона в норме и при патологии. М: Медицина, 1996. С. 117–134. - Вельтищев Е.Ю. Иммунитет новорожденного и повышенная чувствительность к некоторым вирусным инфекциям. // Российский вестник перинаталогии и педиатрии. 1993. № 5. С. 9–11.
- Студеникин В.М. Становление лимфоидной системы и особенности мембранных рецепторов иммунокомпетентных клеток в раннем онтогенезе: Автореф. дис. докт. мед. наук. М., 1997. 37 с.
- Торубарова Н.А., Кошель И.В., Яцык Г.В. Кроветворение плода и новорожденного. М.: Медицина, 1993. С. 59.
- Bourin P., Lataillade J.J., Satanine P. et al. Differential expression of VLA chains on СD 34+ cells from three sources // Hem. Journ. 2000. Vol. 1 (suppl.1). Р. 8..
- Durandy A., De Saint Basile G., Lisowska–Grospierre B., Gauchat J.F., Forveille M., Kroczek R.A., Bonnefoy J.Y., Fischer A. Undetectable CD40 ligand expression on T cells and low B cell responses to CD40 binding agonists in human newborns. // J Immunol. 1995 Feb 15. Vol. 154 (4). Р. 1560–8.
- Стефании Д.В., Вельтищев Ю.Е. Иммунология и иммунопатология детского возраста. М.: Медицина,1996. С. 36–40.
- Цинзерлинг В.А., Мельникова В.Ф. Перинатальные инфекции. (Вопросы патогенеза, морфологической диагностики и клинико–морфологических сопоставлений): Практическое руководство. СПб: Элби СПб, 2009. С. 112–123.
Источник
