Первые работы по иммунитету
Как устроен иммунитет: Объясняем по пунктам
Наш организм непрерывно меняется, но при этом очень «любит» постоянство и может нормально работать только при определенных параметрах своей внутренней среды. Например, нормальная температура тела колеблется между 36 и 37 градусами по Цельсию. Вспомните последнюю простуду и то, как плохо вы себя чувствовали, стоило температуре подняться всего на полградуса. Такая же ситуация и с другими показателями: артериальным давлением, рН крови, уровнем кислорода и глюкозы в крови и другими. Постоянство значений этих параметров называется гомеостазом, а поддержкой его стабильного уровня занимаются практически все органы и системы организма: сердце и сосуды поддерживают постоянное артериальное давление, легкие — уровень кислорода в крови, печень — уровень глюкозы и так далее.
Иммунная же система отвечает за генетический гомеостаз. Она помогает поддерживать постоянство генетического состава организма. То есть ее задача — уничтожать не только все чужеродные организмы и продукты их жизнедеятельности, проникающие извне (бактерии, вирусы, грибки, токсины и прочее), но также и клетки собственного организма, если «что-то пошло не так» и, например, они превратились в злокачественную опухоль, то есть стали генетически чужеродными.
Как клетки иммунной системы уничтожают «врагов»?
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
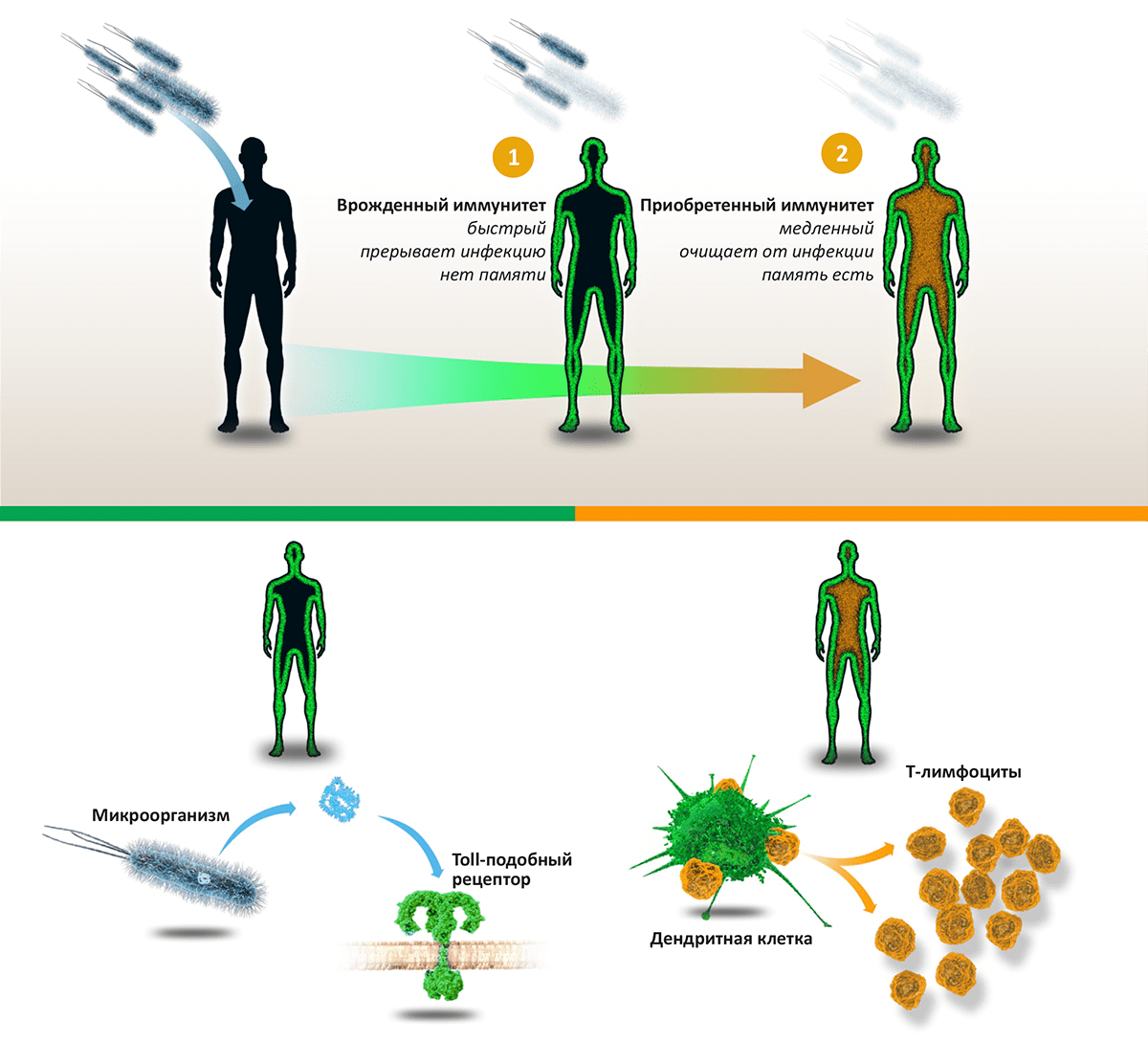
Иммунитет бывает врожденным (он же неспецифический) и приобретенным (он же адаптивный, или специфический). Врожденный иммунитет одинаков у всех людей и идентичным образом реагирует на любых «врагов». Реакция начинается немедленно после проникновения микроба в организм и не формирует иммунологическую память. То есть, если такой же микроб проникнет в организм снова, система неспецифического иммунитета его «не узнает» и будет реагировать «как обычно». Неспецифический иммунитет очень важен — он первым сигнализирует об опасности и немедленно начинает давать отпор проникшим микробам.
Однако эти реакции не могут защитить организм от серьезных инфекций, поэтому после неспецифического иммунитета в дело вступает приобретенный иммунитет. Здесь уже реакция организма индивидуальна для каждого «врага», поэтому «арсенал» специфического иммунитета у разных людей различается и зависит от того, с какими инфекциями человек сталкивался в жизни и какие прививки делал.
Специфическому иммунитету нужно время, чтобы изучить проникшую в организм инфекцию, поэтому реакции при первом контакте с инфекцией развиваются медленнее, зато работают гораздо эффективнее. Но самое главное, что, один раз уничтожив микроба, иммунная система «запоминает» его и в следующий раз при столкновении с таким же реагирует гораздо быстрее, часто уничтожая его еще до появления первых симптомов заболевания. Именно так работают прививки: когда в организм вводят ослабленных или убитых микробов, которые уже не могут вызвать заболевание, у иммунной системы есть время изучить их и запомнить, сформировать иммунологическую память. Поэтому, когда человек после вакцинации сталкивается с реальной инфекцией, иммунная система уже полностью готова дать отпор, и заболевание не начинается вообще или протекает гораздо легче.
Кто отвечает за работу различных видов иммунитета?
- Костный мозг. Это центральный орган иммуногенеза. В костном мозге образуются все клетки, участвующие в иммунных реакциях.
- Тимус (вилочковая железа). В тимусе происходит дозревание некоторых иммунных клеток (Т-лимфоцитов) после того, как они образовались в костном мозге.
- Селезенка. В селезенке также дозревают иммунные клетки (B-лимфоциты), кроме того, в ней активно происходит процесс фагоцитоза — когда специальные клетки иммунной системы ловят и переваривают проникших в организм микробов, фрагменты собственных погибших клеток и так далее.
- Лимфатические узлы. По своему строению они напоминают губку, через которую постоянно фильтруется лимфа. В порах этой губки есть очень много иммунных клеток, которые также ловят и переваривают микробов, проникших в организм. Кроме того, в лимфатических узлах находятся клетки памяти — это специальные клетки иммунной системы, которые хранят информацию о микробах, уже проникавших в организм ранее.
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.
- Т-лимфоциты. Названы так, потому что после образования в костном мозге дозревают в вилочковой железе — тимусе. Разные подвиды Т-лимфоцитов отвечают за разные функции. Например, Т-киллеры могут убивать зараженные вирусами клетки, чтобы остановить развитие инфекции, Т-хелперы помогают иммунной системе распознавать конкретные виды микробов, а Т-супрессоры регулируют силу и продолжительность иммунной реакции.
- B-лимфоциты. Название их происходит от Bursa fabricii (сумка Фабрициуса) — особого органа у птиц, в котором впервые обнаружили эти клетки. В-лимфоциты умеют синтезировать антитела (иммуноглобулины). Это специальные белки, которые «прилипают» к микробам и вызывают их гибель. Также антитела могут нейтрализовывать некоторые токсины.
- Натуральные киллеры. Эти клетки находят и убивают раковые клетки и клетки, пораженные вирусами.
- Нейтрофилы и макрофаги умеют ловить и переваривать микробов — осуществлять фагоцитоз. Кроме того, макрофаги выполняют важнейшую роль в процессе презентации антигена, когда макрофаг знакомит другие клетки иммунной системы с кусочками переваренного микроба, что позволяет организму лучше бороться с инфекцией.
- Эозинофилы защищают наш организм от паразитов — обеспечивают антигельминтный иммунитет.
- Базофилы — выполняют главным образом сигнальную функцию, выделяя большое количество сигнальных веществ (цитокинов) и привлекая этим другие иммунные клетки в очаг воспаления.
Как клетки иммунной системы отличают «своих» от «чужих» и понимают, с кем нужно бороться?
В этом им помогает главный комплекс гистосовместимости первого типа (MHC-I). Это группа белков, которая располагается на поверхности каждой клетки нашего организма и уникальна для каждого человека. Это своего рода «паспорт» клетки, который позволяет иммунной системе понимать, что перед ней «свои». Если с клеткой организма происходит что-то нехорошее, например, она поражается вирусом или перерождается в опухолевую клетку, то конфигурация MHC-I меняется или же он исчезает вовсе. Натуральные киллеры и Т-киллеры умеют распознавать MHC-I рецептор, и как только они находят клетку с измененным или отсутствующим MHC-I, они ее убивают. Так работает клеточный иммунитет.
Но у нас есть еще один вид иммунитета — гуморальный. Основными защитниками в этом случае являются антитела — специальные белки, синтезируемые B-лимфоцитами, которые связываются с чужеродными объектами (антигенами), будь то бактерия, вирусная частица или токсин, и нейтрализуют их. Для каждого вида антигена наш организм умеет синтезировать специальные, подходящие именно для этого антигена антитела. Молекулу каждого антитела, также их называют иммуноглобулинами, можно условно разделить на две части: Fc-участок, который одинаков у всех иммуноглобулинов, и Fab-участок, который уникален для каждого вида антител. Именно с помощью Fab-участка антитело «прилипает» к антигену, поэтому строение этого участка молекулы зависит от строения антигена.
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
Рассмотрим этот процесс на примере развития бактериальной инфекции. Например, вы поцарапали палец. При повреждении кожи в рану чаще всего попадают бактерии. При повреждении любой ткани организма сразу же запускается воспалительная реакция. Поврежденные клетки выделяют большое количество разных веществ — цитокинов, к которым очень чувствительны нейтрофилы и макрофаги. Реагируя на цитокины, они проникают через стенки капилляров, «приплывают» к месту повреждения и начинают поглощать и переваривать попавших в рану бактерий — так запускается неспецифический иммунитет, но до синтеза антител дело пока еще не дошло.
Расправляясь с бактериями, макрофаги выводят на свою поверхность разные их кусочки, чтобы познакомить Т-хелперов и B-лимфоцитов со строением этих бактерий. Этот процесс называется презентацией антигена. Т-хелпер и B-лимфоцит изучают кусочки переваренной бактерии и подбирают соответствующую структуру антитела так, чтобы потом оно хорошо «прилипало» к таким же бактериям. Так запускается специфический гуморальный иммунитет. Это довольно длительный процесс, поэтому при первом контакте с инфекцией организму может понадобиться до двух недель, чтобы подобрать структуру и начать синтезировать нужные антитела.
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Источник
Иммунная система позволяет нам существовать в мире, полном патогенных микроорганизмов — вирусов, бактерий, грибов. Нобелевская премия по физиологии и медицине 2011 года вручена за открытия в области активации врожденного иммунитета (половину премии разделили Брюс Бётлер и Жюль Хоффман) и за изучение роли дендритных клеток в приобретенном иммунитете (вторая половина премии присуждена Ральфу Стайнману, к сожалению, скончавшемуся 30 сентября). Эти достижения не только дали понимание того, как слаженная работа врожденного и адаптивного иммунитета защищает организм, но и открыли новые перспективы в лечении инфекций, рака и воспалительных заболеваний.
Две линии иммунной обороны
Мы обитаем в мире, буквально кишащем патогенными микроорганизмами (бактериями, грибами, вирусами и паразитами), однако наши организмы оснащены совершенной системой защиты, позволяющей (в норме) не замечать опасного соседства. «Первая линия» иммунной обороны — врожденный иммунитет — уничтожает вторгшиеся в организм патогены на основе технологии «свой—чужой», распознавая черты, всегда присутствующие у «захватчиков», но отсутствующие в собственном организме. Если же инфекции удается прорваться, вступает в работу «вторая линия» — приобретенный, или адаптивный, иммунитет. Основанный на согласованной работе B- и T-лимфоцитов, он действует посредством специфических к конкретной инфекции антител и клеток-«убийц», уничтожающих зараженные клетки и саму инфекцию. В отличие от врожденного иммунитета, способность к распознаванию патогенов которого закодирована генетически, приобретенный иммунитет обучается распознавать новые «образы» врага и сохраняет память о нем, мгновенно «вспоминая», встретившись вновь.
Однако, обеспечивая необходимую защиту, иммунные механизмы скрывают и опасность: если «активационный барьер» слишком низок, иммунитет может активироваться собственными молекулами, что приводит к развитию аутоиммунных и воспалительных заболеваний.
Организация иммунной системы изучалась в течение XX века постепенно; в частности, нобелевскими премиями отмечены изучение строения антител и определение механизма распознавания Т-клетками инородных веществ. Однако только с работами Бётлера, Хоффмана и Стайнмана стали понятны механизмы, активирующие врожденный иммунитет и связывающие его с иммунитетом приобретенным.
Открытие сенсоров врожденного иммунитета
Пионерское открытие Жюля Хоффмана было сделано в 1996 году, когда он с коллегами исследовал, как дрозофила сопротивляется инфекциям [1]. Они работали на линиях мух, мутантных по нескольким генам, включая ген Toll, участвующий в эмбриональном развитии (за открытие роли этого гена также вручена Нобелевская премия в 1995 году). Хоффман с коллегами открыли, что мухи с мутантным геном Toll погибали при заражении бактериями или грибами, в то время как «дикий тип» чувствовал себя вполне сносно. В результате их работ был сделан вывод, что продукт этого гена — Toll-рецептор — «чувствует» патогенные микроорганизмы и запускает механизмы врожденного иммунитета.
Брюс Бётлер с коллегами, со своей стороны, искали рецепторы, которые могли бы активироваться элементом клеточной стенки бактерий липополисахаридом (ЛПС), который при попадании в кровь вызывает септический шок (чрезмерная активация иммунной системы, грозящая смертью). В 1998 году они обнаружили, что мыши, не реагирующие на введение ЛПС, имели мутации в гене, гомологичном Toll у дрозофил. Продукт этого гена — Toll-подобный рецептор — и оказался искомым сенсором липополисахарида [2]. Связывание ЛПС (обозначающее присутствие бактерий) активирует иммунитет и запускает воспаление, а чрезмерная концентрация ЛПС приводит к септическому шоку. Это открытие показало, что и членистоногие, и млекопитающие используют схожие стратегии противостояния бактериальным инвазиям.
Открытия Хоффмана и Бётлера фактически положили начало новой «горячей» области биологии: впоследствии было открыто более 10 Toll-подобных рецепторов, каждый распознающий свой «образ», характерный для разных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней.

Рисунок 1. Схема работы иммунитета. Проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует «две линии» иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Врожденный иммунитет: компоненты микроорганизмов, такие как липополисахарид, связываются с Toll-подобными рецепторами, находящимися на поверхности многих клеток организма. Это запускает врожденный иммунитет, активирующий воспалительную реакцию и уничтожающий «захватчиков». Приобретенный иммунитет: Дендритные клетки активируют T-лимфоциты, лежащие в основе каскада иммунных реакций, приводящих к синтезу антител и уничтожению патогенов и зараженных клеток.
Новый игрок в команде адаптивного иммунитета
Еще в 1973 году Ральф Стайнман открыл новый тип клеток иммунитета с длинными отростками, названный им дендритными клетками. Его предположение было — что эти клетки активируют T-лимфоциты, играющие ключевую роль в приобретенном иммунитете и иммунной памяти. Это предположение блестяще подтвердилось в клеточных экспериментах, где добавление дендритных клеток к популяции Т-лимфоцитов способствовало формированию иммунитета [3–5].
Дальнейшие работы Стайнмана и других исследователей были направлены на то, чтобы понять, как приобретенный иммунитет определяет, — надо ли реагировать на то или иное вещество, или можно этого не делать. Обнаружилось, что дендритные клетки воспринимают сигналы от системы врожденного иммунитета, и это управляет их способностью активировать T-клетки. Это позволяет нашему иммунитету прицельно бороться с патогенными микроорганизмами, «не обращая внимания» на молекулы нашего собственного тела.
Фундаментальные науки — медицине
Достижения нобелевских лауреатов 2011 года пролили свет на подробности работы систем врожденного и приобретенного иммунитета. Это знание легло в основу создания новых стратегий лечения многих болезней, — например, новых вакцин против инфекций и попыток «натравить» собственную иммунную систему на раковые опухоли. В дополнение к этому, стало понятно, почему организм иногда начинает атаковать свои собственные ткани, что приводит к воспалительным и аутоиммунным заболеваниям.
Горькая ирония
Как известно, Нобелевская премия не вручается посмертно. Однако этот год стал исключением: 30 сентября после продолжительной борьбы с раковой опухолью скончался Ральф Стайнман, — буквально за несколько дней до объявления лауреатов премии. Нобелевский комитет не знал об этом, и обнародовал свое решение 3 октября. Несмотря на этот печальный казус, решение менять не будут. Работы Стайнмана легли в основу терапии дендритными клетками — перспективного способа лечения воспалительных и онкологических заболеваний. К сожалению, самому ему оказалось суждено стать жертвой такого заболевания [6], [7].
И снова мимо!..
Сегодня интернет пестрит сообщениями, что опять — в который уже раз! — Нобелевский комитет обошел своим решением российских ученых. Речь идет о российском эмигранте Руслане Меджитове [8], который, вместе со своим (ныне уже покойным) учителем Чарльзом Дженуэем показал, что и у людей существуют Toll-подобные рецепторы [9]. Если бы Дженуэй был жив, то, скорее всего, именно он был бы третьим лауреатом премии (вместо Стайнмана), а сама премия была бы конкретно за врожденный иммунитет.
По материалам пресс-релиза Нобелевского комитета [10].
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- A. Poltorak. (1998). Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene. Science. 282, 2085-2088;
- R. M. Steinman. (1973). IDENTIFICATION OF A NOVEL CELL TYPE IN PERIPHERAL LYMPHOID ORGANS OF MICE: I. MORPHOLOGY, QUANTITATION, TISSUE DISTRIBUTION. Journal of Experimental Medicine. 137, 1142-1162;
- R. M. Steinman, M. D. Witmer. (1978). Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice.. Proceedings of the National Academy of Sciences. 75, 5132-5136;
- G. Schuler. (1985). Murine epidermal Langerhans cells mature into potent immunostimulatory dendritic cells in vitro. Journal of Experimental Medicine. 161, 526-546;
- Нобелевскую премию присудили только что умершему от рака ученому. Но другого выбирать уже не будут. (2011). NewsRu;
- Воронин Е. (2011). Ральф Стайнман. shvarz.livejournal.com;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- The Nobel Prize in Physiology or Medicine 2011. (2011). The Nobel Prize.
Источник
