Продукция антител это реакция иммунитета
Основными формами иммунного ответа на попадание антигена в организм являются: биосинтез антител, образование клеток иммунной памяти, реакция гиперчувствительности немедленного типа, реакция гиперчувствительности замедленного типа, иммунологическая толерантность, идиотип- антиидиотипические отношения.
Для гуморального иммунитета характерна выработка специфических антител (иммуноглобулинов).
Антитела — специфические белки гамма- глобулиновой природы, образующиеся в организме в ответ на антигенную стимуляцию и способные специфически взаимодействовать с антигеном (in vivo, in vitro). В соответствии с международной классификацией совокупность сывороточных белков, обладающих свойствами антител, называют иммуноглобулинами.
Уникальность антител заключается в том, что они способны специфически взаимодействовать только с тем антигеном, который вызвал их образование.
Иммуноглобулины ( Ig ) разделены в зависимости от локализации на три группы:
— сывороточные (в крови);
— секреторные ( в секретах- содержимом желудочно- кишечного тракта, слезном секрете, слюне, особенно- в грудном молоке) обеспечивают местный иммунитет (иммунитет слизистых);
— поверхностные ( на поверхности иммунокомпетентных клеток, особенно В- лимфоцитов).
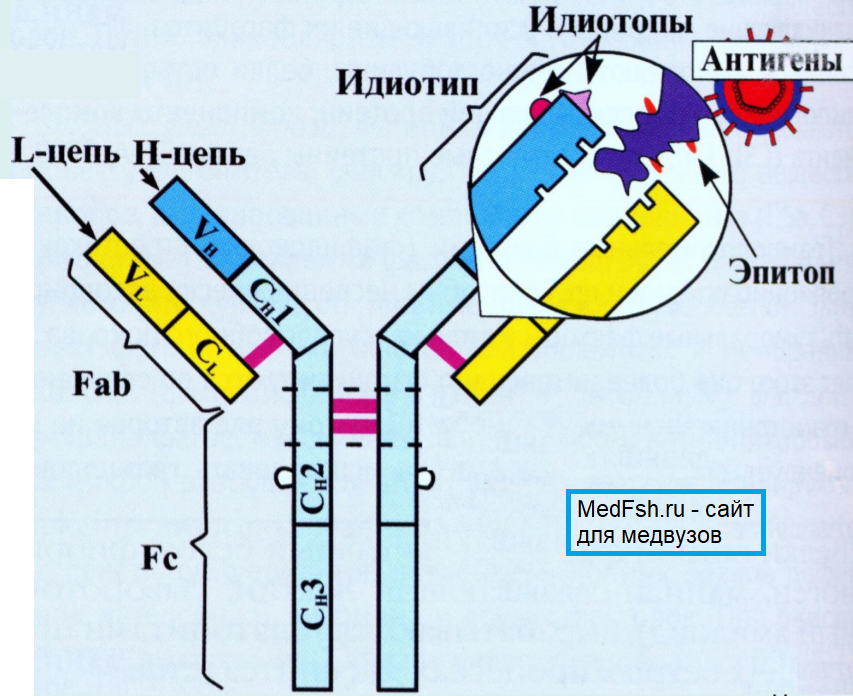
Любая молекула антител имеет сходное строение ( Y- образную форму) и состоит из двух тяжелых ( Н ) и двух легких ( L ) цепей, связанных дисульфидными мостиками. Каждая молекула антител имеет два одинаковых антигенсвязывающих фрагмента Fab ( fragment antigen binding ), определяющих антительную специфичность, и один Fc ( fragment constant ) фрагмент, который не связывает антиген, но обладает эффекторными биологическими функциями. Он взаимодействует со “своим” рецептором в мембране различных типов клеток ( макрофаг, тучная клетка, нейтрофил).
Концевые участки легких и тяжелых цепей молекулы иммуноглобулина вариабельны по составу ( аминокислотным последовательностям ) и обозначаются как VL и VH области. В их составе выделяют гипервариабельные участки, которые определяют структуру активного центра антител (антигенсвязывающий центр или паратоп). Именно с ним взаимодействует антигенная детерминанта (эпитоп) антигена. Антигенсвязывающий центр антител комплементарен эпитопу антигена по принципу “ключ — замок” и образован гипервариабельными областями L- и Н- цепей. Антитело свяжется антигеном (ключ попадет в замок) только в том случае, если детерминантная группа антигена полностью вместится в щель активного центра антител.
Легкие и тяжелые цепи состоят из отдельных блоков- доменов. В легких ( L ) цепях — два домена- один вариабельный ( V ) и один константный ( C ), в тяжелых ( H ) цепях- один V и 3 или 4 ( в зависимости от класса иммуноглобулина ) C домена.
Существуют легкие цепи двух типов- каппа и лямбда, они встречаются в различных пропорциях в составе различных (всех) классов иммуноглобулинов.
Выявлено пять классов тяжелых цепей- альфа ( с двумя подклассами), гамма ( с четырьмя подклассами), эксилон, мю и дельта. Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов- А, G, E, M и D.
Именно константные области тяжелых цепей, различаясь по аминокислотному составу у различных классов иммуноглобулинов, в конечном результате и определяют специфические свойства иммуноглобулинов каждого класса.
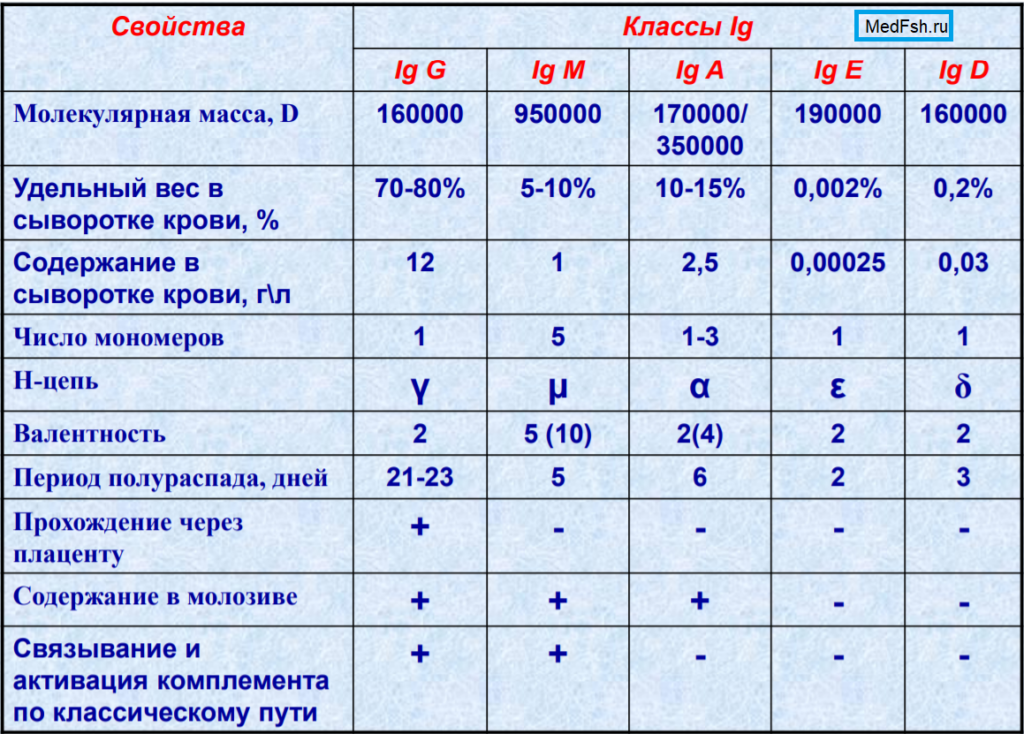
Известно пять классов иммуноглобулинов, отличающихся по строению тяжелых цепей, молекулярной массе, физико- химическим и биологическим характеристикам: IgG, IgM, IgA, IgE, IgD. В составе IgG выделяют 4 подкласса ( IgG1, IgG2, IgG3, IgG4 ), в составе IgA- два подкласса (IgA1, IgA2 ).
Структурной единицей антител является мономер, состоящий из двух легких и двух тяжелых цепей. Мономерами являются IgG, IgA ( сывороточный), IgD и IgE. IgM- пентамер (полимерный Ig). У полимерных иммуноглобулинов имеется дополнительная j ( joint) полипептидная цепь, которая объединяет ( полимеризует) отдельные субъединицы (в составе пентамера IgM, ди- и тримера секреторного IgA).
Основные биологические характеристики антител.
1. Специфичность — способность взаимодействия с определенным (своим) антигеном (соответствие эпитопа антигена и активного центра антител).
2. Валентность- количество способных реагировать с антигеном активных центров ( это связано с молекулярной организацией- моно- или полимер). Иммуноглобулины могут быть двухвалентными ( IgG ) или поливалентными (пентамер IgM имеет 10 активных центров). Двух- и более валентные антитела навывают полными антителами. Неполные антитела имеют только один участвующий во взаимодействии с антигеном активный центр ( блокирующий эффект на иммунологические реакции, например, на агглютинационные тесты). Их выявляют в антиглобулиновой пробе Кумбса, реакции угнетения связывания комплемента.
3. Афинность — прочность связи между эпитопом антигена и активным центром антител, зависит от их пространственного соответствия.
4. Авидность — интегральная характеристика силы связи между антигеном и антителами, с учетом взаимодействия всех активных центров антител с эпитопами. Поскольку антигены часто поливалентны, связь между отдельными молекулами антигена осуществляется с помощью нескольких антител.
5. Гетерогенность — обусловлена антигенными свойствами антител, наличием у них трех видов антигенных детерминант:
— изотипические — принадлежность антител к определенному классу иммуноглобулинов;
— аллотипические- обусловлены аллельными различиями иммуноглобулинов, кодируемых соответствующими аллелями Ig гена;
— идиотипические- отражают индивидуальные особенности иммуноглобулина, определяемые характеристиками активных центров молекул антител. Даже тогда, когда антитела к конкретному антигену относятся к одному классу, субклассу и даже аллотипу, они характеризуются специфическими отличиями друг от друга (идиотипом). Это зависит от особенностей строения V- участков H- и L- цепей, множества различных вариантов их аминокислотных последовательностей.
Понятие о поликлональных и моноклональных антителах будет дано в следующих разделах.
Характеристика основных классов иммуноглобулинов.
Ig G. Мономеры, включают четыре субкласса. Концентрация в крови- от 8 до 17 г/л, период полураспада- около 3- 4 недель. Это основной класс иммуноглобулинов, защищающих организм от бактерий, токсинов и вирусов. В наибольшем количестве IgG- антитела вырабатываются на стадии выздоровления после инфекционного заболевания (поздние или 7S антитела), при вторичном иммунном ответе. IgG1 и IgG4 специфически (через Fab- фрагменты) связывают возбудителей (опсонизация), благодаря Fc- фрагментам IgG взаимодействуют с Fc- рецепторам фагоцитов, способствуя фагоцитозу и лизису микроорганизмов. IgG способны нейтрализовать бактериальные экзотоксины, связывать комплемент. Только IgG способны транспортироваться через плаценту от матери к плоду (проходить через плацентарный барьер) и обеспечивать защиту материнскими антителами плода и новорожденного. В отличие от IgM- антител, IgG- антитела относятся к категории поздних- появляются позже и более длительно выявляются в крови.
IgM.Молекула этого иммуноглобулина представляет собой полимерный Ig из пяти субъединиц, соединенных дисульфидными связями и дополнительной J- цепью, имеет 10 антиген- связывающих центров. Филогенетически это наиболее древний иммуноглобулин. IgM- наиболее ранний класс антител, образующихся при первичном попадании антигена в организм. Наличие IgM- антител к соответствующему возбудителю свидетельствует о свежем инфицировании (текущем инфекционном процессе). Антитела к антигенам грамотрицательных бактерий, жгутиковым антигенам- преимущественно IgM- антитела. IgM- основной класс иммуноглобулинов, синтезируемых у новорожденных и младенцев. IgM у новорожденных- это показатель внутриутробного заражения (краснуха, ЦМВ, токсоплазмоз и другие внутриутробные инфекции), поскольку материнские IgM через плаценту не проходят. Концентрация IgM в крови ниже, чем IgG- 0,5- 2,0 г/л, период полураспада- около недели. IgM способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент, активизировать фагоцитоз, связывать эндотоксины грамотрицательных бактерий. IgM обладают большей, чем IgG авидностью (10 активных центров), аффинность (сродство к антигену) меньше, чем у IgG.
IgA. Выделяют сывороточные IgA (мономер) и секреторные IgA (IgAs). Сывороточные IgA составляют 1,4- 4,2 г/л. Секреторные IgAs находятся в слюне, пищеварительных соках, секрете слизистой носа, в молозиве. Они являются первой линией защиты слизистых, обеспечивая их местный иммунитет. IgAs состоят из Ig мономера, J-цепи и гликопротеина (секреторного компонента). Выделяют два изотипа- IgA1 преобладает в сыворотке, субкласс IgA2 — в экстраваскулярных секретах.
Секреторный компонент вырабатывается эпителиальными клетками слизистых оболочек и присоединяется к молекуле IgA в момент прохождения последней через эпителиальные клетки. Секреторный компонент повышает устойчивость молекул IgAs к действию протеолитических ферментов. Основная роль IgA- обеспечение местного иммунитета слизистых. Они препятствуют прикреплению бактерий к слизистым, обеспечивают транспорт полимерных иммунных комплексов с IgA, нейтрализуют энтеротоксин, активируют фагоцитоз и систему комплемента.
IgE. Представляет мономер, в сыворотке крови находится в низких концентрациях. Основная роль- своими Fc- фрагментами прикрепляется к тучным клеткам (мастоцитам) и базофилам и опосредует реакции гиперчувствительности немедленного типа. К IgE относятся “антитела аллергии”- реагины. Уровень IgE повышается при аллергических состояниях, гельминтозах. Антигенсвязывающие Fab- фрагменты молекулы IgE специфически взаимодействует с антигеном (аллергеном), сформировавшийся иммунный комплекс взаимодействует с рецепторами Fc- фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки. Это является сигналом для выделения гистамина, других биологически активных веществ и развертывания острой аллергической реакции.
IgD.Мономеры IgD обнаруживают на поверхности развивающихся В- лимфоцитов, в сыворотке находятся в крайне низких концентрациях. Их биологическая роль точно не установлена. Полагают, что IgD участвуют в дифференциации В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах.
С целью определения концентраций иммуноглобулинов отдельных классов применяют несколько методов, чаще используют метод радиальной иммунодиффузии в геле (по Манчини)- разновидность реакции преципитации и ИФА.
Определение антител различных классов имеет важное значение для диагностики инфекционных заболеваний. Обнаружение антител к антигенам микроорганизмов в сыворотках крови- важный критерий при постановке диагноза- серологический метод диагностики. Антитела класса IgM появляются в остром периоде заболевания и относительно быстро исчезают, антитела класса IgG выявляются в более поздние сроки и более длительно (иногда- годами) сохраняются в сыворотках крови переболевших, их в этом случае называют анамнестическими антителами.
Выделяют понятия: титр антител, диагностический титр, исследования парных сывороток. Наибольшее значение имеет выявление IgM- антител и четырехкратное повышение титров антител (или сероконверсия— антитела выявляют во второй пробе при отрицательных результатах с первой сывороткой крови) при исследовании парных— взятых в динамике инфекционного процесса с интервалом в несколько дней- недель проб.
Реакции взаимодействия антител с возбудителями и их антигенами (реакция “антиген- антитело”) проявляется в виде ряда феноменов- агглютинации, преципитации, нейтрализации, лизиса, связывания комплемента, опсонизации, цитотоксичности и могут быть выявлены различными серологическими реакциями.
Динамика выработки антител. Первичный и вторичный иммунный ответ.
Первичный ответ- при первичном контакте с возбудителем (антигеном), вторичный- при повторном контакте. Основные отличия:
— продолжительность скрытого периода (больше- при первичном);
— скорость нарастания антител (быстрее- при вторичном);
— количество синтезируемых антител (больше- при повторном контакте);
— последовательность синтеза антител различных классов (при первичном более длительно преобладают IgM, при вторичном- быстро синтезируются и преобладают IgG- антитела).
Вторичный иммунный ответ обусловлен формированием клеток иммунной памяти. Пример вторичного иммунного ответа- встреча с возбудителем после вакцинации.
Роль антител в формировании иммунитета.
Антитела имеют важное значение в формировании приобретенного постинфекционного и поствакцинального иммунитета.
1. Связываясь с токсинами, антитела нейтрализуют их, обеспечивая антитоксический иммунитет.
2. Блокируя рецепторы вирусов, антитела препятствуют адсорбции вирусов на клетках, участвуют в противовирусном иммунитете.
3. Комплекс антиген- антитело запускает классический путь активации комплемента с его эффекторными функциями (лизис бактерий, опсонизация, воспаление, стимуляция макрофагов).
4. Антитела принимают участие в опсонизации бактерий, способствуя более эффективному фагоцитозу.
5. Антитела способствуют выведению из организма (с мочой, желчью) растворимых антигенов в виде циркулирующих иммунных комплексов.
IgG принадлежит наибольшая роль в антитоксическом иммунитете, IgM- в антимикробном иммунитете (фагоцитоз корпускулярных антигенов), особенно в отношении грамотрицательных бактерий, IgA- в противовирусном иммунитете (нейтрализация вирусов), IgAs- в местном иммунитете слизистых оболочек, IgE- в реакциях гиперчувствительности немедленного типа.
Источник
Теория по иммунологии. Антитела, их функции, виды. Строение и функции иммуноглобулинов. Динамика антителообразования. Использование моноклональные антител.
При создании данной страницы использовалась лекция по соответствующей теме, составленная Кафедрой репродуктивного здоровья человека ИДПО с курсом иммунологии
Навигация:
- Основные функции антител
- Структура молекулы иммуноглобулина
- Классы иммуноглобулинов, их свойства и строение
- Иммуноглобулин класса G
- Иммуноглобулин класса А
- Иммуноглобулин класса М
- Иммуноглобулин класса Е
- Иммуноглобулин класса D
- Динамика образования антител
- Виды антител
Антитела – белки (гликопротеины) сыворотки крови, образующиеся в ответ на введение антигена и обладающие способностью специфически взаимодействовать с антигенами, которые вызвали их образование.
Функции антител в организме
- Взаимодействие с комплементарными структурами антигена с целью его нейтрализации и последующей элиминации.
- Обеспечение кооперации иммунокомпетентных клеток.
- Участвуют в различных защитных реакциях организма (активации комплемента, фагоцитозе – опсонизирующее действие, аллергии, иммунологической памяти и толерантности).
- Антитоксический эффект.
- Цитотоксический эффект.
- Иммунорегулирующие свойства.
- Образование циркулирующих иммунных комплексов (ЦИК).
Структура молекулы иммуноглобулина
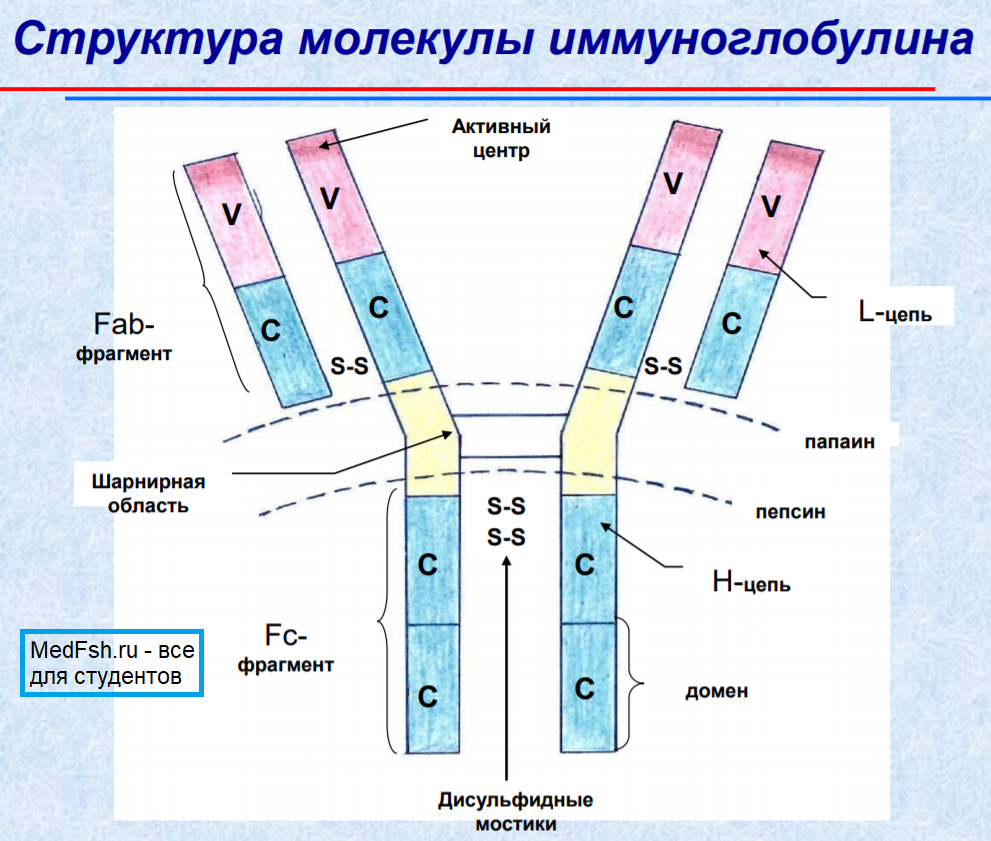
Характеристики иммуноглобулинов:
- Валентность – количество активных (антигенсвязывающих) центров антител. Полные антитела как минимум 2-валентны. Неполные – содержат один антигенсвязывающий центр.
- Аффинность – сродство антигенной детерминанты с активным центром антитела, зависит от степени комплементарности структуры антигенсвязывающего центра и антигенной детерминанты.
- Авидность – скорость и прочность связывания антитела с соответствующим антигеном.
- Разнообразие Ig определяет антигенную специфичность.
3 типа антигенных детерминант:
- Изотипические детерминанты (изотипы) – структуры характерные для индивидуумов одного вида. Гетерогенность изотипов связана со структурными различиями константных участков легких и тяжелых цепей. Эти различия обуславливают деление Ig на классы, подклассы. Н-цепи делятся на 5 классов: μ-мю, γ-гамма, αальфа, δ-дельта, ε-эпсилон; L-цепи делятся на 2 типа: κкаппа, λ-лямбда.
- Аллотипические детерминанты (аллотипы) – структуры, характерные для некоторых индивидуумов внутри вида.
- Идиотипические детерминанты (идиотипы) – структуры, характерные только для определенных Ig одного индивидуума. Определяют специфичность взаимодействия данного иммуноглобулина с определенным антигеном.
Классы иммуноглобулинов, их свойства и строение
Антитела относятся к γ–глобулиновой фракции белков сыворотки крови. На долю γ–глобулинов приходится 15-25% белков сыворотки крови, и они получили название иммуноглобулинов.
Строение и природа антител
Антитела ― это иммуноглобулины, вырабатываемые в ответ на введение антигена, способные специфически связываться с антигеном и участвовать во многих иммунологических реакциях.рис расположение антигена
Молекулы иммуноглобулинов всех классов универсальны. Она имеет две полипептидные цепи: 2 ― тяжелые, 2 ― легкие, которые соединены дисульфидными связями.
Иммуноглобулины обладают выраженной специфичностью и подходят к антигенам как ключ к замку, формируя два антигенсвязывающего центра.
Иммуноглобулин класса G
Среди всех классов иммуноглобулинов в количественном отношении доминирует Ig G. В сыворотке млекопитающих он составляет около 75% от общего количества этих белков.
Биологическая роль Ig G разнообразна. Это и антибактериальная защита через механизм комплементзависимого лизиса микробной клетки, и проникновение через плаценту с той же защитной для развивающегося зародыша функцией, и «армирование» макрофагов (цитофильность к макрофагам), в результате чего они становятся цитотоксическими для трансплантатов и опухолей, и участие в повышенной реактивности аллергического типа.
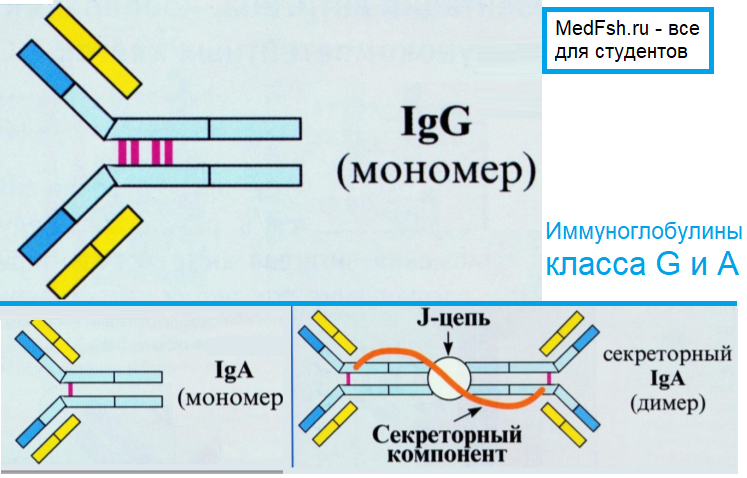
Иммуноглобулин класса А
Имеет две формы:
- сывороточная (циркулирует в виде мономера);
- секреторная (циркулирует в виде димера и обеспечивает местный иммунитет слизистых дыхательных, половых, мочевыделительных путей, ЖКТ).
Является доминирующим иммуноглобулином секретов организма (слюны, пищеварительного сока, выделений слизистой носа и молочной железы). В сыворотке крови его содержание незначительно и составляет всего 10-15% от общего количества всех иммуноглобулинов.
Функционально Ig A выступает в качестве первой линии защиты на слизистых поверхностях, препятствуя проникновению вирусов в организм. Хотя Ig A не связывает комплемент и в силу этого не обладает бактерицидной активностью, он играет важную роль в нейтрализации бактериальных токсинов. Кроме того, у млекопитающих, включая человека, секреторный Ig A хорошо представлен в молозиве и обеспечивает таким образом специфический иммунитет новорожденных.
Иммуноглобулин класса М
Самая крупная молекула из пяти классов. Является пентамером, валентность равна 10. Имеет десять антигенсвязывающих центров. В процессе гуморального иммунного ответа наиболее ранние антитела относятся к Ig М-классу. Они же первыми появляются в онто- и филогенезе. Наибольшую активность Ig М проявляет в антибактериальном иммунитете и при некоторых аутоиммунных заболеваниях.
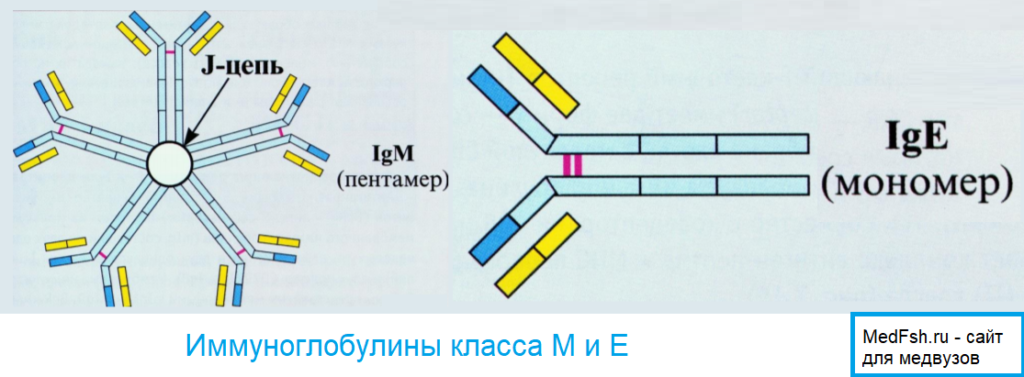
Иммуноглобулин класса Е
Содержание Ig E в сыворотке крайне мало, хотя удельный вес этих иммуноглобулинов в аллергических реакциях является доминирующим.
Функциональная активность Ig E проявляется в развитии аллергических реакций. Данный иммуноглобулин способен взаимодействовать с тучными клетками и базофилами посредством Fc – области и соответствующего рецептора на этих клетках. После связи Ig E с антигеном (аллергеном) тучные клетки получают сигнал к секреции вазоактивных аминов и других фармакологически значимых соединений, что, собственно и приводит к развитию аллергических реакций.
Иммуноглобулин класса D
Иммуноглобулин D был открыт как необычный миеломный белок. Затем его обнаружили в сыворотке крови в очень небольшом количестве.
Данный иммуноглобулин совместно с мономерным Ig М экспрессируется на поверхности В-клеток.
Вопрос о форме участия Ig D в иммунных процессах остается открытым. Содержится в сыворотке крови в очень малых количествах. Известно, что Ig D продуцируют клетками миндалин и аденоидов. Ig D не связывает комплемент, не проходит через плацентарный барьер.

Динамика образования антител при первичном иммунном ответе
Периоды:
- Латентный (3-5 дней) — скрытые процессы восприятия антигенного раздражения, завершаюшиеся поступлением в кровь Ig М.
- Логарифмический (продуктивный) (7-15 дней) — концентрация антител в сыворотке крови резко возрастает — титры Ig M и G достигают максимума.
- Стационарный (максимума и стабилизации) (15-30 дней) — поддерживается максимальный стабильный уровень Ig M и G в крови.
- Снижения (14 дней и более) — концентрация антител в крови постепенно снижается.
Особенности вторичного иммунного ответа:
- Укороченный латентный период (от нескольких часов до 1-2 дней).
- Синтезируются сразу Ig G.
- Более быстрый подъем концентрации антител.
- Большие значения максимальной концентрации антител.
- Высокая скорость образования антител.
- Индукция меньшими дозами антигенов.
Основные типы антител по действию на антиген:
- Антитоксические – нейтрализуют или флоккулируют антигены.
- Агглютинирующие – агрегируют антигены.
- Преципитирующие – образуют комплекс с растворимыми антигенами только в растворах или гелях;
- Лизирующие – вызывают разрушение клетокмишеней.
- Опсонизирующие – взаимодействуют с поверхностными структурами клеток микробов, способствуя поглощению их фагоцитами.
- Нейтрализующие – инактивируют антигены, лишая их возможности проявлять патогенное действие.
Виды антител
- Изоантитела – антитела к изоантигенам. Например, антитела к изоантигенам эритроцитов человека (АВО).
- Нормальные (естественные) антитела – антитела, обнаруживаемые в сыворотке крови без предварительного воздействия антигена. Титры их низкие, а вопрос об их происхождении до конца не решен.
- Аутоантитела – антитела к молекулам веществ, входящих в состав собственных клеток и тканей организма.
- Гетероантитела – антитела, образующиеся в ответ на введение гетероантигена.
- Моноклональные антитела – антитела одной специфичности, синтезируемые искусственно полученным клоном плазмоцитов.
Метод получения моноклональных антител состоит в слиянии сенсибилизированных лимфоцитов с клетками миеломы для получения клеточных гибридов (гибридом). Гибридомы обладают способностью синтезировать антитела и, в то же время, они представляют собой опухолевые клетки, способные к непрерывной пролиферации.
В отличие от поликлональных гетерогенных сывороток, содержащих большое разнообразие антител, отличающихся своей специфичностью, аффинитетом и физикохимическими свойствами, препараты моноклональных антител содержат продукт единственного клона плазматических клеток, направленный к строго определенной антигенной детерминанте и обладающий всегда одинаковыми физико-химическими характеристиками и сродством к антигену.
Получение гибридом включает этапы:
- Получение миеломной линии.
- Получение селезеночных клеток от иммунизированного организма (плазмоциты, синтезирующие Ig определенной специфичности).
- Создание в культуре условий для того, чтобы хотя бы некоторые клетки одной и другой популяции могли слиться.
- Выделение слившихся клеток и накопление их клонов.
- Отбор интересующего клона, его накопление и использование. Накопление клона осуществляют in vitro или путем введения животным.
Использование моноклональные антител:
- идентификация субпопуляций лимфоцитов человека,
- истощение клеточных популяций,
- выделение клеток,
- установление функций молекул клеточной поверхности,
- определение группы крови,
- диагностика опухолей и локализация опухолей,
- иммунорадиометрический анализ,
- анализ сложных смесей антигенов,
- анализ эмбрионального развития,
- анализ иммунного ответа,
- искусственные ферменты.
За последние 15 лет около 30 терапевтических моноклональных антител были утверждены. Большинство из них молекулы IgG1. Некоторые причины успеха этого класса Ig обусловлены тем, что они обладают долгим временем полу-жизни в сыворотке, а также эффекторными функциями их Fc регионов.
Моноклональные антитела химерные — константная часть мышиных антител замещена соответствующей константной областью иммуноглобулина человека и в своей структуре имеют более 65% человеческого иммуноглобулина. Гуманизированные моноклональные антитела – до 95% состоят из человеческого иммуноглобулина. Кроме того, трансгенные технологии (фаговый дисплей) были использованы для создания полностью человеческих моноклональных антител (Fully human monoclonal antibodies)
Моноклональные антитела
Названия всех моноклональных антител оканчиваются на «–mab» (от monoclonal antibody). Если антитело получено от мыши, добавляется буква «о», и окончание у таких антител «-omab». Химерные антитела получили окончание «-ximab». Гуманизированные антитела имеют окончание «-zumab», полностью человеческие – «-umab».
Производство моноклональных антител является наиболее быстро развивающимся сегментом фармацевтической индустрии, составляющим третью часть всех биотехнологических продуктов. По итогам 2010 г. два моноклональных антитела — Rituxan/MabThera и Remicade — вошли в Toп-5 блокбастеров среди биотехнологических препаратов. В 2015 г. все существующие на рынке препараты (60 млрд. долл. ежегодных продаж) утратят патентную защиту, и рынок продаж подобных биотехнологических препаратов значимо увеличится.
Трастузумаб (Trastuzumab, Герцептин)
Трастузумаб (Trastuzumab, Герцептин) – рекомбинантное МкАТ, которое избирательно связывается с рецептором HER2 на поверхности опухолевых клеток многих солидных опухолей. Препарат Herceptin (Trastuzumab) был разработан компанией Genentech и введен в клиническую практику в 1998 году. Применение Герцептина радикально изменило лечение рака молочной железы, в руках онкологов появилось новое эффективное лекарство, позволяющее вылечить или продлить жизни многочисленных пациентов.
Рецептор HER2 — белковая молекула, расположенная на поверхности опухолевых клеток. Примерно в 25 % случаев рака молочной железы злокачественные клетки содержат повышенное количество данных рецепторов (HER2 — позитивный рак молочной железы). При HER2 — позитивном раке молочной железы происходит постоянная стимуляция злокачественного роста за счет присоединения выделяемого самой опухолью вещества, известного как эпидермальный фактор роста, к рецептору HER2. Герцептин блокирует рецептор HER2, что не позволяет эпидермальному фактору роста стимулировать процесс деления злокачественных клеток.
Ритуксимаб (Ритуксан, Мабтера)
Ритуксимаб (Ритуксан, Мабтера) представляет собой химерные моноклональные антитела мыши/человека специфически связывающиеся с CD20+ антигеном. Этот антиген локализуется на поверхности пре-В-лимфоцитов и зрелых B лимфоцитов, но отсутствует на стволовых гемопоэтических клетках, нормальных плазматических клетках и здоровых клетках других тканей. Этот антиген экспрессируется более чем в 90% В-клеточных неходжкинских лимфом. Механизм действия Ритуксана связан с развитием опосредованной антитело–зависимой клеточной и комплемент–зависимой цитотоксичности, что вызывает гибель клеток лимфомы, положительных по CD20. Происходит снижение уровня циркулирующих CD20+ В–лимфоцитов, как лимфомных, так и нормальных.
Ритуксимаб — это химерное моноклональное антитело, имеющее вариабельный мышиный и константный человеческий регион, специфически связанное с антигеном CD20 на В-лимфоцитах и инициирующее иммунологические реакции, которые опосредуют лизис В-клеток. В последние годы препарат зарегистрирован еще для лечения широкого круга аутоиммунных заболеваний с гиперфункцией В-клеток.
Алемтузумаб (Кампат, Кэмпас, Campath)
Еще одним высокоэффективным препаратом для лечения хронического лимфолейкоза (наиболее частого вида лейкоза у взрослых) являются антитела против CD52 антигена. Препарат Алемтузумаб (Кампат, Кэмпас, Campath) – гуманизированное МКА, связывающееся с CD52. Антиген CD52 экспрессируется на мембране большинства зрелых нормальных и опухолевых Т- и В-лимфоцитов с очень высокой плотностью — примерно 500 000 молекул на клетку (по сравнению с антигеном CD20, плотность экспрессии которого составляет около 8000 молекул на клетку). Этим объясняется чрезвычайно высокая активность алемтузумаба в отношении хронического лимфолейкоза и Тклеточных лимфом. Алемтузумаб (Кампат, Кэмпас, Campath)
Важно отметить данный антиген обнаружен на поверхности незначительной части (менее 5%) гранулоцитов и отсутствует на эритроцитах и тромбоцитах. Не повреждает стволовые кроветворные клетки и клеткипредшественники. Другое название препарата Лемтрада (Lemtrada).
В последние годы Кэмпас используется для уменьшения реакции «трансплантат против хозяина» при аллогенной трансплантации стволовых кроветворных клеток (им предварительно очищают трансплантат).
Радиоиммунотоксины на основе анти-CD20 антител
Два препарата на основе МКА к CD20 антигену, меченные радиоактивными изотопами, разрешены к клиническому применению при неходжкинской лимфоме.
Ибритумомаб (ibritumomab, Зевалин) является конъюгатом Мабтеры (МкАТ против CD20) с радиоактивным изотопом иттрия–90 (Y90). Показаниями к использованию Зевалина является рецидивирующая неходжкинская лимфома, в том числе и при прогрессировании после Мабтеры.
Бексар (J131Tositumomab, Bexxar) – конъюгат мышиного МкАТ против CD20 антигена с радиоактивным изотопом йода J131. Период полураспада данного изотопа составляет 8 дней. J 131-тозитумомаб обладает способностью к специфическому связыванию с CD20, тем самым обусловливая лизис клеток, экспрессирующих данный антиген, а также способствует гибели соседних клеток.
Отдельную группу терапевтических моноклональных антител составляют препараты, действие которых направлено на воспалительный процесс. Наиболее важной “мишенью” для “антицитокиновой” терапии МкАТ является “провоспалительный” цитокин – фактор некроза опухоли (ФНО)–α. ФНО-α играет ведущую роль в развитии самых разнообразных проявлений, характерных для многих воспалительных заболеваний человека.
Ремикейд (инфликсимаб) — Infliximab (REMICADE)
Ремикейд (инфликсимаб) представляет собой моноклональные антитела к одному из ключевых цитокинов, вовлеченных в развитие воспалительных процессов, — фактору некроза опухоли (tumor necrosis factor alpha — TNF-alpha). Как полагают исследователи, TNF также играет важную роль не только в развитии ревматоидного артрита, но и псориаза.
Действие Ремикейда, как биологического агента, направлено на ключевую молекулу воспалительных и иммунологических процессов, лежащих в основе ревматоидного артита — на фактор некроза опухоли альфа (ФНО-α ). Доказано, что Ремикейд предотвращает деструкцию суставов. Ремикейд, возможно, первый антиревматический препарат, приостанавливающий прогрессирование заболевания, при этой патологии он в большей степени изучен.
3
0
Источник
