Противоопухолевый иммунитет механизмы его неэффективности
Исследование противоопухолевого иммунитета и устранение факторов, вызывающих его ухудшение, являются важными проблемами в современной медицине. Злокачественные новообразования занимают одно из лидирующих мест среди причин смертности и инвалидизации населения в развитых странах. В норме баланс количества делящихся и отмирающих клеток регулируется естественным образом. Если размножение клеток приобретает неконтролируемый характер, то возникают злокачественные опухоли. Механизм контроля этого процесса со стороны иммунной системы зависит от нескольких факторов, подавляющих или стимулирующих процесс избыточного деления.
Общее описание
Под иммунитетом принято понимать совокупность защитных механизмов живого организма от негативного воздействия чужеродных агентов. Чаще всего эти процессы связаны с инфекционными (бактериальными, вирусными, грибковыми, протозойными) заболеваниями. Однако существуют и другие способы защиты, одним из которых является противоопухолевый иммунитет.
В деятельности любого живого организма возникают моменты, когда ему необходимо быстрое деление клеток (травма, воспалительный процесс и другие). При развитии определенного иммунного ответа количество клеток, чувствительных к воздействию антигена (молекулы, связанной с антителом), увеличивается в несколько тысяч раз. При нормальном течении процесса после завершения данной реакции ускоренное деление клеток останавливается.
Для злокачественной опухоли характерно нарушение этого механизма. Размножение клеток продолжается постоянно и имеет независимый характер. Постепенно происходит замещение нормальных тканей в пораженном органе и прорастание опухоли в окружающие области. Перемещаясь по кровяному руслу, клетки опухоли продолжают делиться и в другой локализации, что приводит к появлению метастаз. Этот дефект непрерывного деления наследуется всеми потомками опухолевых клеток. Их мембраны изменены таким образом, что человеческий организм воспринимает объекты как чужеродные.
С другой стороны, в организме имеется способ, который может остановить этот процесс, – противоопухолевый иммунитет. В иммунологии возникновение опухолей является свидетельством того, произошли нарушения естественного защитного механизма.
История открытия
Еще в 18 веке было замечено, что у некоторых больных, перенесших инфекционные болезни, исчезали злокачественные опухоли. В конце 19 века американский хирург-онколог Вильям Коли выявил взаимосвязь между заражением гемолитических стрептококком Streptococcus pyogenes и уменьшением (а в некоторых случаях – и полным исчезновением) опухолей злокачественного характера. Им была разработана противораковая вакцина на основе этих бактерий для лечения пациентов с саркомой. В то время еще не были известны механизмы противоопухолевого иммунитета в иммунологии, поэтому его работы подвергались сильной критике, а впоследствии были забыты почти на 100 лет.
В середине XX века было открыто, что введение макромолекул липосахарида, из которых состоят оболочки клеток микробов, может приводить к отмиранию опухолей. Однако в 70-е гг. XX в. ученые установили, что этот процесс вызывает не сам липосахарид, а белковый фактор (фактор некроза опухоли, или ФНО), вырабатываемый следующими типами клеток иммунной системы при контакте с микробами:
- активированные макрофаги;
- нейтрофилы;
- Т-лимфоциты;
- тучные клетки;
- астроциты;
- NK-клетки (натуральные киллеры).
Взаимосвязь иммунитета и образования опухолей
В пользу наличия связи между состоянием иммунитета и развитием злокачественных опухолей свидетельствуют следующие факты:
- увеличенная распространенность таких новообразований у пациентов с иммунодефицитным состоянием, а также в пожилом возрасте (что связано со снижением защитных сил организма);
- выявление у больных специфических антител и Т-клеток, чувствительных к антигенам опухолей;
- возможность формирования противоопухолевого иммунитета и иммунопролиферативных заболеваний (при искусственном введении антител и подавлении иммунитета соответственно).
Защитная функция иммунитета заключается не только в уничтожении чужеродных агентов (вирусов, грибков и бактерий), но и клеток-мутантов, из которых образуются опухоли. Для них характерна антигенная специфичность, которая зависит от причины появления новообразования:
- вирусы (папилломы, лейкоза и другие);
- химические канцерогены (метилхолантрен, бензопирен, афлотоксины и другие);
- эндокринные нарушения (метаболическая иммунодепрессия);
- физические факторы окружающей среды (все виды излучений).
Естественный противоопухолевый иммунитет очень слабо влияет на уже сформировавшееся злокачественное новообразование. Это связывают со следующими факторами:
- быстрый рост опухоли, опережающий активизацию иммунных сил;
- выделение опухолевыми клетками антигенов, которые связывают соответствующие рецепторы на поверхности лимфоцитов-киллеров;
- подавление клеточного иммунитета со стороны новообразования.
Принцип действия
Механизм противоопухолевого иммунитета в медицинской науке еще мало изучен. Несмотря на то что выявлена его защитная функция, антитела могут отражать опухолевые антигены, не вызывая разрушения злокачественных клеток. В некоторых случаях иммунотерапия даже дает обратный эффект, способствуя увеличению новообразования.
Согласно современным представлениям, ключевую роль в данном процессе играют активизированные макрофаги и клетки-киллеры. Особенностью противоопухолевого иммунитета является то, что он характеризуется сложным механизмом взаимодействия организма-хозяина и новообразования. Выделяют 4 основные группы факторов:
- Антибластомные – гуморальные и клеточные (Т-лимфоциты, ФНО, макрофаги, ЕК- и К-клетки, специфические антитела, интерфероны, интерлейкины), подавляющие развитие опухоли и разрушающие ее клетки.
- Иммунорезистентность новообразования, или его способность противостоять противоопухолевому иммунитету.
- Пробластомные: угнетающие иммунитет (вещества-супрессоры, вырабатываемые макрофагами и лимфоцитами; гормоноподобные соединения, интерлейкин-10, циркулирующие иммунные комплексы, протеины группы TGFβ, состоящие из антигенов, антител и компонентов комплемента); усиливающие иммунитет (ФНО, вырабатываемый макрофагами; гамма-интерферон, интерлейкины 2 и 6, фактор роста эндотелия; иммунодефицитные состояния).
Эффекторные механизмы
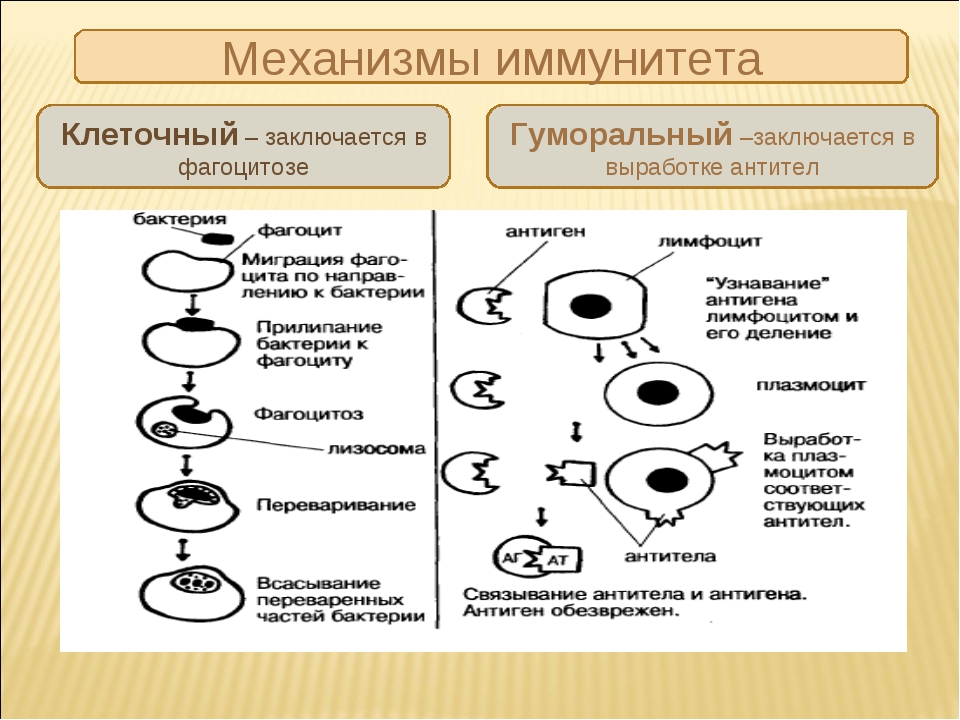
Основной функцией эффекторных механизмов противоопухолевого иммунитета является блокирование и уничтожение патогенов. Выделяют 2 группы рецепторов, избирательно связывающиеся со специфическими антигенами. На основании этого различают также 2 типа эффекторных механизмов:
- Гуморальный, функционирующий за счет растворимых (гуморальных) факторов – антител, которые связывают и удаляют антиген.
- Клеточный (антителонезависимый), реализующийся с участием клеток иммунной системы, важнейшими из которых являются Т-лимфоциты, макрофаги, NK-клетки. Они непосредственно разрушают чужеродные, инфицированные и опухолевые клетки.

Если патологически измененная клетка избежала гибели при воздействии эффекторных механизмов, то может наступить период равновесия между ее делением и подавляющим влиянием иммунитета. При прогрессировании злокачественного процесса происходит выход опухолевой ткани из-под контроля иммунных механизмов.
Важнейшую роль в подавлении деления клеток играют 2 типа лимфоцитов, запускающих процесс некроза – Т-лимфоциты и NK-клетки, распознающие стрессорные молекулы, которые выделяет новообразование. Т-лимфоциты формируются в течение более длительного времени, а их предшественники распознают опухолевые антигены. Th1-лимфоциты запускают механизм воспаления, что приводит к активизации макрофагов. Продукты секреции последних способствуют нарушению местного кровоснабжения тканей, что также влечет гибель тканей опухоли.
Участие Т-лимфоцитов проявляется в пропитывании злокачественного новообразования лимфоидными клетками, которые разрушают его клетки путем растворения, или цитолиза. Активизация лимфоцитов происходит под действием цитокинов – белковых информационных молекул, с которыми они вместе проникают в опухоль.
Большое значение среди внутренних факторов, присущих иммунной системе организма человека, имеет также гамма-интерферон. Его функции заключаются в следующем:
- Подавление деления опухолевых клеток.
- Активизация процесса их запрограммированной гибели.
- Стимулирование выработки цитокинов, которые привлекают в новообразование Т-лимфоциты.
- Активация макрофагов и развития Т-хелперов, необходимых для укрепления противоопухолевого иммунитета.
- Подавление образования новых кровеносных сосудов, что ухудшает питание опухоли и способствует более быстрой гибели ее клеток.
Противоопухолевый иммунитет: причины его низкой эффективности
Рост злокачественных новообразований и их устойчивость к иммунитету объясняются следующими причинами:
- слабая способность индуцирования иммунного ответа у опухолевых антигенов;
- выживание (естественный отбор) опухолевых клеток, устойчивых к иммунитету;
- постоянное видоизменение антигенов;
- наличие капсулы у опухоли;
- секреция опухолевых антигенов в растворимой форме, что приводит к подавлению иммунного ответа;
- расположение новообразования в местах, где возникновение антигена не приводит к воспалительному иммунному ответу (так называемая «привилегированная» локализация – костный мозг, нервная, эндокринная и половая система, тимус);
- утрата некоторых компонентов эффекторной системы в результате генетических или приобретенных (вторичных) иммунодефицитных состояний;
- производство опухолевыми клетками пробластомных факторов, подавляющих иммунитет и способствующих увеличению новообразования;
- у новорожденных – незрелость эффекторных систем, влекущее за собой нераспознавание опухолевых клеток.
Эти механизмы неэффективности противоопухолевого иммунитета приводят к тому, что новообразование становится мало иммуногенным и не воспринимается организмом как чужеродный элемент. В результате снижается защитная реакция. Иммунные механизмы не могут привести к отторжению уже сформировавшейся злокачественной опухоли.
Особенности
К особенностям противоопухолевого иммунитета относятся:
- Основную роль в иммунном ответе играют Т-лимфоциты, макрофаги и NK-клетки, разрушающие опухолевую ткань. Значение гуморального иммунитета значительно меньше.
- Раковые антигены распознаются или непосредственно макрофагами и дендритными клетками, отвечающими за врожденный и адаптивный иммунитет, или через Th1-хелперы.
- Взаимодействие организма и опухоли происходит по трем направлениям: естественная и приобретенная резистентность к злокачественным новообразованиям, иммунодепрессия со стороны опухоли. Совокупность этих факторов и составляет противоопухолевый иммунитет.
- Злокачественные клетки в процессе естественного отбора приобретают механизмы защиты против врожденного иммунитета. Формируется их новый фенотип, происходит эволюция новообразования.
Опухолеассоциированные антигены разделяют на 2 группы – первого типа (характерны для многих видов новообразований, имеют вирусное происхождение) и второго, очень специфичные и обнаруживаемые у всех пациентов, имеющих данный вид опухоли.
Одной из общих особенностей противовирусного и противоопухолевого иммунитета является то, что он носит как специфический характер, то есть направлен против определенных видов патогенов, так и неспецифический (уничтожает все чужеродное организму). Неспецифическими факторами служат мононуклеарные и NK-клетки, активизирующиеся под влиянием интерлейкина 2 и интерферонов, а также лимфокин-активированные киллерные клетки и цитокины.
Иммунодиагностика
В последние годы в медицине находит применение иммунодиагностика злокачественных новообразований. В ее основе лежит выявление в крови следующих белковых соединений:
- антигены, ассоциированные с опухолями;
- антитела;
- лимфоциты, восприимчивые к опухолевым антигенам.
Малоинвазивная иммунодиагностика позволяет выявить рак различных органов на ранней стадии развития опухоли по наличию специфических антигенов (в скобках указана локализация злокачественного новообразования):
- PSA (простата).
- P-53 (мочевой пузырь).
- SCC (легкие, пищевод, прямая кишка).
- СА-19-9 (поджелудочная железа).
- СА-125 (яичники).
- СА-15-3 (молочная железа).
Однако антитела к определенному антигену в крови пациентов с раком определяются нечасто (в 10 % случаев). Иммуноглобулины к опухолеассоциированных антигенов выявляют чаще – у 50 % больных. В настоящее время в медицинской научной среде ведутся поиски и других антигенов, помогающих в диагностике рака.
Иммунопрофилактика и лечение
Для повышения противоопухолевого иммунитета используют иммуномодуляторы, опосредованно активизирующие клетки иммунной системы:
- Интерлейкины 1 и 2. Эти белковые соединения относятся к группе провоспалительных цитокинов (информационных молекул) и являются биологически активными веществами, вырабатываемыми лейкоцитами. Интерлейкины – главные участники в процессе формирования иммунного ответа при внедрении патогенов в микробиологии. Противоопухолевый иммунитет активизируется за счет активного деления лимфоцитов (Т-киллеры, NK-клетки, Т-хелперы, Т-супрессоры и продуценты антител). Интерлейкин 2 также активизирует выработку фактора некроза опухолей.
- Препараты из группы интерферонов. Они стимулируют иммунный ответ путем представления Т-лимфоцитам антигенов, которые были захвачены макрофагами и дендритными клетками. Т-хелперы выделяют белковые информационные молекулы, активирующие работу других клеток иммунной системы. В результате происходит повышение противоопухолевого иммунитета. Отдельные виды интерферонов (гамма-интерферон) могут непосредственно воздействовать на макрофаги и киллеры.
- Адъюванты. Они вводятся вместе с основными иммунобиологическими медицинскими препаратами и служат для усиления ответа со стороны защитных сил организма. Чаще всего их используют для здоровых людей при вакцинации. Одной из особенностей противоопухолевого иммунитета в микробиологии, касающейся данного типа веществ, является то, что они могут концентрировать на своей поверхности антигены. Это обеспечивает более длительный эффект. Для целенаправленной доставки антигенов в органы лимфатической системы применяют липосомы – пузырьки с липидными биослоями. Наиболее распространенными веществами этой группы являются полный и неполный адъювант Фрейнда, гидроксид алюминия, коклюшная палочка, осажденная на алюминиевых квасцах; Полиоксидоний.
- Элементы клеток бактерий (иммуностимуляторы Продигиозан, Ликопид, Ромуртид и другие).
Проведенные на животных эксперименты показывают, что при введении опухолевых антигенов происходит формирование иммунологической памяти. В результате после этого отторгается трансплантируемая злокачественная опухоль. В последние годы в медицине ведутся активные разработки, которые дадут возможность создания противоопухолевой иммунной памяти путем вакцинации. Пока в этом направлении создан один тип прививок – для повышения иммунитета к вирусам папилломы человека, которые индуцируют возникновение рака шейки матки у женщин («Гардасил» и «Церварикс» зарубежного производства).
Виды опухолей
Иммунотерапия является эффективной в отношении следующих видов опухолей:
- меланома, возникающая из меланоцитов – пигментных клеток;
- неходжкинские лимфомы, происходящие из лимфоцитов;
- рак почек, прямой кишки, яичников;
- волосатоклеточный лейкоз (поражение В-лимфоцитов, белых клеток крови);
- глиома (опухоль мозга);
- саркома мягких тканей, происхождение которой связано с эпителиальными клетками и соединительной тканью.
Источник
При рассмотрении противоопухолевого иммунитета следует учитывать «историю» формирования опухоли: между появлением трансформированной клетки и образованием опухоли должно произойти несколько событий, обозначаемых опухолевой прогрессией и знаменующих приобретение клеткой все большей автономии. После этого опухолевые клетки формируют своеобразный орган с собственной стромой и внутренней иерархией клеток. Эти процессы сопровождаются не столько приобретением новых антигенных свойств, сколько антигенным упрощением (уменьшением интенсивности и разнообразия экспрессируемых антигенов). Кроме того, постепенное развитие опухоли способствует формированию иммунологической толерантности организма к неоантигенам. Тем не менее на экспериментальных моделях не только показана возможность развития иммунного ответа на опухолевые антигены, но и детально проанализированы его механизмы.
Одна из современных концепций предлагает трехстадийную динамику иммунологических взаимоотношений между опухолью и организмом. В соответствии с обозначением этих стадий — удаление (elimination), равновесие (equilibrium) и ускользание (escape) — она может быть обозначена как «концепция трех Е». На стадии элиминации срабатывают механизмы иммунологического отторжения чуждых по антигенному составу клеток.
Успешная элиминация трансформированных клеток предотвращает развитие опухоли. Если малигнизированная клетка избегает гибели под влиянием эффекторных механизмов иммунитета, наступает длительный период равновесия между сдерживающим влиянием иммунной системы и пролиферативным потенциалом опухолевых клеток. Прогрессирование опухолевого процесса приводит к наступлению последней фазы, когда опухоль полностью выходит из-под контроля иммунных механизмов.
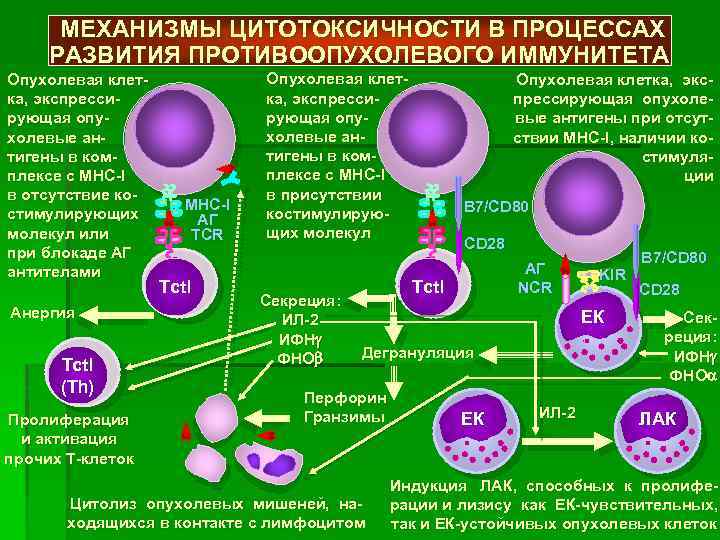
По данным исследований в модельных системах и косвенных свидетельств, полученных из опыта иммунотерапии опухолей человека, ключевую роль в иммунном повреждении опухолевых клеток играют 2 типа цитотоксических лимфоцитов — естественные киллеры (NK-клетки) и цитотоксические Т-лимфоциты (рис. 4.4). Первые распознают стрессорные молекулы MICA и MICB, экспрессируемые опухолевыми клетками, реагируют поликлонально без предварительной дифференцировки. Вторые образуются в результате достаточно длительного иммунного ответа. Их предшественники (CD8+ Т-лимфоциты) распознают опухолевые анти-

Рис. 4.4. Стадии эффективного иммунного ответа на антигены опухолевой клетки. Показан ход успешного иммунного ответа на опухолевые антигены, возможный на стадии становления опухоли или при использовании эффективного вакцинного препарата
гены, презентируемые дендритными клетками в составе молекул МНС-I; при этом активируются клетки ограниченного числа клонов, в соответствии со специфичностью их TCR. Механизм действия цитотоксических клеток сходен: они используют классический перфорин-гранзимовый механизм контактного цитолиза, а также Fas-зависимую индукцию апоптоза опухолевых клеток (см. разделы 2.4.4.3 и 3.6.5.1). При противоопухолевой иммунной защите большую роль играет индукция апоптоза, опосредованная через взаимодействие молекулы TRAIL (TNF-related apoptosis inducing ligand) и ее рецептора DR5 (Death domain 5). TRAIL спонтанно экспрессируется на NK-клетках, а под влиянием интерферонов I и II типов еще и на моноцитах и дендритных клетках. DR5 экспрессируется на опухолевых клетках. Контактное взаимодействие клеток упомянутых типов с опухолевой клеткой обеспечивает передачу летального сигнала в опухолевую клетку.
В активации CD8+ Т-клеток и экспансии их клонов принимают участие CD4+ Т-лимфоциты, а точнее — TW-клетки. Сами по себе Th1-лимфоциты вносят вклад в защиту, инициируя «иммунное воспаление», сопровождающееся активацией макрофагов, продукты которых способствуют местным нарушениям кровотока и формированию тромбов. Это приводит к нарушению трофики и служит косвенной причиной гибели опухолевых клеток. Четвертая разновидность лимфоцитов, участвующих в иммунной защите от опухолевых клеток — у5Т-клетки. Хотя механизм их противоопухолевого действия не выяснен (вероятнее всего, это прямой цитолиз), факт их участия в противоопухолевой защите подтвержден повышением частоты индукции опухолей у мышей с нокаутом генов у- или 5-цепей TCR (причем оно выражено даже сильнее, чем при выключении генов apTCR).
Показатель вовлечения Т-лимфоцитов в противоопухолевую защиту — инфильтрация опухоли лимфоидными клетками, называемыми лимфоцитами, инфильтрирующими опухоль — TIL (Tumor-infiltrating lymphocytes). Это преимущественно CD8+ Т-клекти с признаками активации. Однако подавляющее большинство этих клеток функционально инертны, поскольку в них блокирована экспрессия цепей TCR-комплекса — обычно Z-, реже е-цепи. После инкубации in vitro с цитокинами (IL-2 и другими) экспрессия цепей восстанавливается, и туморинфильтрирующие лимфоциты проявляют высокую противоопухолевую активность. Предполагается также присутствие в окружении опухоли активированной формы естественных киллеров — LAK-клеток, для которых характерна (по данным опытов in vitro) не только более высокая активность, но и более широкий спектр клеток-мишеней (см. раздел 2.4.5).
Среди эндогенных противоопухолевых факторов прежде всего следует назвать IFNy. При иммунных процессах его раньше всего продуцируют NKT-клетки, несколько позже — NK- и TW-клетки. Противоопухолевая активность IFNy имеет множество проявлений. Он подавляет пролиферацию опухолевых клеток (через индукцию белков р21 и р27, ослабляющих экспрессию циклинзависимых киназ — соответственно Cdk2 и Cdk4, обеспечивающих продвижение клеток по циклу. IFNy способствует развитию апоптоза опухолевых клеток, индуцируя экспрессию каспазы 1, а также Fas-рецептора на опухолевых клетках и Fas-лиганда на цитотоксических
Т-лимфоцитах. Этот цитокин индуцирует выработку опухолевыми и стромальными клетками хемокинов CXCL9 (MIG) и CXCL10 (IP-10), которые привлекают в опухоль Т-лимфоциты, экспрессирующие рецептор для этих хемокинов — CXCR3. Кроме того, IFNy подавляет ангиогенез, что влияет на трофику опухоли и усиливает гибель опухолевых клеток по механизму некроза. Наконец, IFNy — мощный активатор макрофагов и индуктор развития TM-клеток — Т-хелперов, необходимых для развития и усиления противоопухолевого иммунитета.
Иммунная реакция на опухолевые антигены включает также гуморальный иммунный ответ, однако он не имеет протективного характера. Вероятно, это связано с неэффективностью комплемента, компоненты которого разрушаются факторами, представленными на поверхности всех клеток организма, включая опухолевые. Неэффективность Fc-зависимого привлечения макрофагов и других фагоцитирующих клеток связана, по- видимому, со слабым уровнем активации клеток врожденного иммунитета и отсутствием должного провоспалительного фона для развития эффективной защитной реакции. Способность антител блокировать антигены- мишени приводит к защите опухолевой клетки от клеточных эффектор- ных факторов. Это защитное действие было описано достаточно давно и обозначено термином «эффект усиления опухолевого роста» (enhancing effect). Таким образом, антитела к опухолеассоциированным антигенам, образуемые при росте опухолей, в лучшем случае сигнализируют о наличии опухолевого процесса. Как отмечалось выше, антитела к конкретному антигену выявляют в сыворотке больных раком не очень часто (около 10% случаев), но антитела к одному из нескольких опухолеассоциированных антигенов появляются примерно у половины больных, что позволяет успешно использовать их определение с диагностической целью. На основе таких антител разрабатывают иммунотерапевтические препараты — иммунотоксины (см. раздел 4.8.3.2)
В экспериментах на мышах показано формирование иммунологической памяти при ответе на опухолевые антигены. Наличие Т-клеточной памяти у экспериментальных животных обеспечивает эффективное отторжение повторно трансплантируемой опухоли. Устойчивость к перевивке сингенных опухолей может быть перенесена с Т-клетками интактным реципиентам. При этом активность проявляют как CD8+, так и CD4+ Т-клетки, однако CD8+ более эффективны. Возможность формирования эффективной противоопухолевой иммунологической памяти вселяет надежды на возможность ее индукции путем вакцинации, реализовать которую пока не удается (см. раздел 4.8.3.3).
Таким образом, при успешном запуске противоопухолевого иммунного ответа в его осуществление вовлекаются почти все звенья врожденного и адаптивного иммунитета. В то же время основной эффект защитной реакции (гибель опухолевых клеток) реализуют преимущественно киллер- ные клетки — естественные киллеры и цитотоксические Т-лимфоциты. Иммунные механизмы не способны вызвать отторжение сформировавшейся опухоли. Это обусловлено как их недостаточной эффективностью, так и способностью опухолевых клеток избегать действия эффекторных факторов иммунитета.
Источник
