Противовирусный иммунитет т клетки

Отличие вируса от большинства видов организмов в том, что он не способен к размножению вне чужой живой клетки. Вирусов известно много: Rabies Virus, Adenovirus, Ebola Virus, HIV, Hepatitis B и C, Papillomaviridae, Herpes Viridae, Influenza Virus и мн. др.
Они предпочитают разные клетки, атакуют нас по-разному, но всем им присуще нечто общее – структура жизненного цикла:
- проникновение в клетку с помощью присоединения к какому-либо типу рецепторов,
- транскрипция вирусной ДНК / РНК (в зависимости от вида вируса),
- встраивание в клеточный аппарат репликации генома,
- репликация вируса и его распространение за пределы клетки.
Врождённый иммунитет человека, формирующийся ещё до рождения, знает этот механизм. Ещё до первых контактов с патогенами мы имеем представление, как с ними бороться, и врождённые инструменты борьбы.
Как неспецифический иммунитет борется с инфекциями?
В распоряжении неспецифического иммунитета имеются естественные клетки-киллеры, запрограммированные уничтожать всё, что не отвечает критерию биологической идентичности геному организма хозяина.
В течение жизни эти клетки занимаются проверкой каждой клетки, каждого микроорганизма, который они встречают. Чтобы пройти контроль, клетки предъявляют молекулярный «паспорт» – главный комплекс гистосовместимости (ГКГС). Считывая его, как штрихкод, киллер отпускает здоровую клеточку – на свободу с извинениями.
Такие проверяющие клетки не умеют определять, инфицирована клетка или нет. Но когда вирус проникает в клетку и встраивает чужеродный геном в её реплицирующий комплекс, ГКГС нарушается и клетка не проходит контроль. Киллер впрыскивает в неё ферменты клеточного «пищеварения» и разрушает, а её остатки, как и остатки вирусов, подъедают фагоциты.
Типология клеток крови
При этом имеет место и иммунологическая толерантность, например, к компонентам нормального микробиома человека – при условии, что он найден в соответствующем месте. Так, кишечной палочке ничего не угрожает со стороны иммунитета хозяина в кишечнике, но, обнаружив её где-то ещё, клетка-киллер уничтожит эту бактерию как условный патоген. И будет права.
Как работает специфический иммунитет человека?
Специфический, или адаптивный, иммунитет человека работает на распознавание инфекций. В том числе новых. Ещё до первого контакта с возбудителем, до появления первых заражённых клеток и запуска соответствующего сигналинга иммунные клетки могут распознать патоген по т. н. паттернам патогенности – молекулярным (чаще всего белковым) комплексам, которые свойственны в принципе – вирусам, в принципе – бактериям, в принципе – грибам и т. д.
Когда патоген проник и развернул атаку, специфический иммунитет приступает к сложному мероприятию по его улавливанию и обезвреживанию. В его распоряжении имеются альфа-, бета- и гамма-интерфероны, которые:
- тормозят репликацию ДНК и РНК в клетке, не давая вирусу размножаться,
- запускают апоптоз – самоубийство заражённой клетки на благо организма.
В момент проникновения вируса клетка распознаёт инфицирование и успевает вывесить на мембране «флажки», которые привлекут внимание Т-хелперов, Т-киллеров, В-лимфоцитов и другие войска специфического иммунитета.Т-хелперы обеспечат исследование и запоминание патогена, В-лимфоциты займутся выработкой антител, которые обклеят (опсонизируют) вирусные фрагменты, сделав их неспособными к репликации. А фагоциты соберут остатки патогена и погибшей клетки. Затем «осколки» вируса затем попадут через кровь в лимфу, где отфильтруются в лимфоузлах и будут тщательно изучены. Затем молодым, т. н. наивным клеткам-лимфоцитам будут предъявлены антигены, и они смогут распознавать угрозы, которые «лично» никогда не встречали. Таким образом тренируется иммунная память.
Что ещё делает интерфероновый сигналинг? Интерфероны присоединяются к оболочкам здоровых клеток, не давая вирусу присоединиться и проникнуть сквозь клеточную мембрану.
Они же разрешают общие провоспалительные реакции, которые сопровождаются хорошо знакомыми клиническими симптомами усталости, разбитого состояния, высокой температуры, ломоты в суставах, сонливости, мышечной боли и т. п.
Всё это говорит о том, что красный костный мозг получил чёткий, конкретный сигнал – продуцировать больше специальных, «профессиональных» клеток: моноцитов, дендритных клеток, лимфоцитов, лейкоцитов и др.
Повышенные лимфо- и лейкоциты мы увидим в общем анализе крови – если, конечно, сам вирус не вызывает лейкоцито- или лимфоцитопению, поразив органы и клетки иммунной системы.
Таким образом, интерфероны оказывают аутокринный, паракринный и эндокринный эффект. И это, с одной стороны, хорошо, а с другой не очень, потому что военную мощь нашего иммунитета вирусы учатся обманывать и даже обращать против нас. И со стимуляцией иммунного ответа следует быть очень аккуратными.
Получить более подробную информацию об этом можно в статье от иммунологов онлайн-академии UniProf «Противовирусный иммунитет человека: как вирусы обманывают его и что с этим делать?»
А полное практические рекомендации, как пациенту подружиться с иммунитетом, а врачу – эффективно использовать иммунологические знания в любом направлении клинической практики,можно в рамках интенсива «Коронный иммунитет».
Лекции читают ведущие российский иммунологи и спикеры Академии UniProf. Регистрируйтесь на обучение, получайте актуальные и необходимые экспертные знания, чтобы быть здоровыми и вести пациентов на принципиально новом профессиональном уровне.
Источник
• Противобактериальный • Противовирусный •
• При паразитных болезнях • Возрастные особенности у детей •
• В пожилом и старческом возрасте •
Противовирусный иммунитет. Отличие противовирусного И. от других видов И. (против бактерий, простейших, грибков и т.д.) связано со своеобразием структуры и размножения вирусов, особенностями патогенеза вирусных инфекций. Видовой противовирусный И. обусловлен отсутствием у клеток данного вида организмов рецепторов для прикрепления (адсорбции) соответствующих вирусов или их неспособностью репродуцироваться после проникновения в клетку, наличием неспецифических ингибиторов и нуклеаз в сыворотке крови, множеством других факторов. Немаловажную роль в защите от вирусов играет воспалительная реакция, направленная на ограничение распространения вирусов в организме и фиксацию их в воротах инфекции. При этом помимо клеток крови (макрофагов, естественных киллеров) противовирусный эффект оказывают такие универсальные реакции на внедрение вирусов, как общее или локальное повышение температуры и увеличение кислотности среды.
Приобретенный противовирусный И. формируется в результате перенесенного заболевания или иммунизации организма с помощью вакцин. Он определяется сочетанием специфических факторов (иммуноглобулинов, В- и Т-лимфоцитов) и факторов неспецифической (естественной) резистентности (воспалительной реакции, интерферонов, противовирусных ингибиторов, естественных киллеров, макрофагов и др.). Так, термолабильные сывороточные b-ингибиторы (b-липопротеины) обладают инактивирующим действием против широкого круга вирусов. Уровень содержания в сыворотке этих ингибиторов взаимосвязан с резистентностью организма к вирусному заражению. У новорожденных и детей первого года жизни он низок, чем в известной степени восприимчивость объясняется к вирусам.
Та же закономерность характерна для интерферонов — важнейших факторов неспецифической резистентности. Практически все вирусы обусловливают выработку интерферонов, их образование является одной из первых защитных реакций организма на внедрение вирусов. Интерфероны в отличие от антител подавляют внутриклеточные этапы репродукции вирусов в зараженных клетках и обеспечивают невосприимчивость к вирусам окружающих здоровых клеток. Попадая из ворот инфекции в кровь, интерфероны распределяются по организму, предотвращая последующую диссеминацию вирусов.
Таким образом, факторы неспецифической резистентности в сочетании с медиаторами воспаления способны разрушать инфицированные вирусами клетки. Если этого не происходит и вирусы размножаются, наступает вторая (специфическая) стадия противовирусного И., связанная с продукцией вируснейтрализующих антител В-лимфоцитами и активацией регуляторных Т-лимфоцитов (Т-хелперов, Т-супрессоров, цитотоксических лимфоцитов), а также обширного круга Т-лимфоцитов — эффекторов лимфоцитарно-моноцитарного ряда. Интенсивность противовирусного И. определяется сложной системой межклеточных и медиаторных отношений, меняющейся в зависимости от индивидуального иммунного статуса человека и особенностей конкретного возбудителя.
При острых (явных) инфекциях (гриппе, полиомиелите и др.) вскоре после контакта вирусов с клетками начинается разрушение последних. В этих случаях болезнь развивается быстро. При латентных (хронических, дремлющих, медленных инфекциях) вирусы могут оставаться в клетках неопределенно долгое время, не оказывая характерного повреждающего действия. Одним из механизмов такой персистенции может быть интеграция или встраивание генетическою материала (ДНК, РНК) вирусов в геном клетки. Под влиянием провоцирующих факторов (охлаждение, воздействие ионизирующего излучения, стрессы и др.) скрытая бессимптомная инфекция переходит в явное заболевание. Между этими двумя крайними видами взаимодействия вирусов с клетками существует множество переходных форм.
Наблюдается широкая индивидуальная вариабельность и способности организма к иммунному ответу. Уровень специфической и неспецифической резистентности помимо возможных врожденных дефектов определяется множеством других факторов (возраст, стрессы, питание, суточный биоритм, время года и т.д.). В отдельных случаях вирусы несколько видоизменяются и т.о. избегают нейтрализующего действия антител и других специфических механизмов иммунной защиты. Это явление, называемое антигенным дрейфом, особенно хорошо изучено в отношении вируса гриппа. В большинстве случаев основная роль в развитии противовирусного И. принадлежит регуляторным Т-лимфоцитам, осуществляющим контроль за антителообразующими В-лимфоцитами и эффекторными Т-лимфоцитами. Способность многих вирусов размножаться и разрушать клетки иммунной системы или подавлять их функции приводит к иммуносупрессии и может способствовать переходу острой инфекции в хроническую форму. Так, поражение вирусами макрофагов вызывает подавление их антигенпрезенттирующей функции и приостанавливает дальнейший иммунный ответ; взаимодействие вирусов с антигенными детерминантами главного комплекса гистосовместимости изменяет клеточные мембраны и вызывает дефектность цитотоксических микроцитов; заражение В-лимфоцитов вирусами герпеса может вызвать их поликлональную активацию и резкое увеличение числа инфицированных клеток. Другим результатом поликлональной стимуляции В-лимфоцитов является образование полиспецифических иммуноглобулинов классов G и М, которые могут взаимодействовать с клетками и тканями внутренних органов и провоцировать развитие аутоиммунного процесса. Наконец, поражение вирусами делящихся Т-хелперов при ВИЧ-инфекции резко снижает, вплоть до полного выключения, иммунную защиту. Более того, вирусы могут подавлять образование лимфокинов и тем самым нарушать нормальное функционирование иммунной системы.
Повышение невосприимчивости к вирусным инфекциям достигается вакцинацией, использованием интерферонов и их индукторов, иммуномодуляторов, с помощью различных химиопрепаратов. Исторически первым и надежным способом, приводящим к активации иммунитета, является вакцинация. Продолжительность противовирусного И. при вакцинации широко варьирует Наиболее длительную защиту обеспечивают вакцины против кори и желтой лихорадки (более 15 лет, возможно, пожизненно); эффект вакцин против полиомиелита, краснухи и эпидемического паротита сохраняется 5—8 лет, меньше длительность И. при гриппе (1—2 года). Однако возможности противовирусной вакцинации не беспредельны, т.к. большое число прививок может вести к развитию аллергических реакций, а при заболеваниях, вызываемых множеством вирусов (например, причиной острых респираторных заболеваний являются около 150 вирусов различных таксономических групп), вакцинация не дает желаемого эффекта. В этих случаях на первое место выдвигаются способы повышения неспецифической резистентности.
Интерфероны, иммуномодуляторы и химиопрепараты, не обладающие узкой специфичностью вакцин, можно использовать в тех случаях, когда вакцины отсутствуют или их применять поздно (заражение уже произошло). Как правило, эффект лечения тем выше, чем раньше оно начато, поэтому перечисленные препараты следует вводить при появлении первых признаков вирусного заболевания (в 1—2-й дни болезни). Интерфероны, их индукторы и иммуномодуляторы оказывают выраженное активирующее влияние на систему И., принимая участие практически во всех его реакциях; они могут увеличивать образование антител, стимулировать фагоцитоз, усиливать цитотоксическую активность лимфоцитов, подавлять гиперчувствительность замедленного типа, влиять на процессы реализации иммунологической памяти.
• Противобактериальный • Противовирусный •
• При паразитных болезнях • Возрастные особенности у детей •
• В пожилом и старческом возрасте •
Об Иммунитете
Источник: «Малая медицинская энциклопедия»
Источник
Глава 16. Противовирусный иммунитет
ЗАЩИТНЫЕ МЕХАНИЗМЫ С УЧАСТИЕМ Т- И В-КЛЕТОК
При отсутствии Т-клеток организм-хозяин весьма восприимчив к атакам вирусов. Так, у бестимусных мышей (мыши nude — голые, или бесшерстные) с врожденным отсутствием зрелых Т-клеток вирус простого герпеса (HSV, от herpes simplex virus), введенный в кожу, вызывает распространяющееся поражение и в конце концов, проникая в центральную нервную систему, гибель животных. Чтобы защитить этих мышей, достаточно вскоре после заражения перенести им HSV-специфичные Т-клетки. Важное значение Т- и В-клеток, противодействующих вирусным инфекциям, будет рассмотрено ниже.
Антитела и комплемент способны ограничить распространение вируса и предотвратить повторную инфекцию
Антитела могут нейтрализовать инфекционность вирусов. Если вирусу удается преодолеть барьеры врожденного иммунитета, он вызывает развитие адаптивного (специфического) иммунного ответа с появлением цитотоксических Т-клеток, хелперных Т-клеток и противовирусных антител. Антитела служат главным препятствием для распространения вируса в другие клетки и ткани, особенно для проникновения его в кровоток. В лимфоидной ткани слизистых оболочек образуются преимущественно антитела класса IgA, предотвращающие повторную инфекцию.
Антитела могут быть направлены против любого вирусного антигена, синтезируемого в инфицированной клетке, однако сдерживание инфекции обеспечивают только те из антител, которые специфичны к гликопротеинам, экспрессированным на оболочке вирусов иди на мембране инфицированных клеток. Механизмы гуморального противовирусного иммунитета могут быть различными. Так, способ устранения инфекционности вирусных частиц зависит от их локализации — внеклеточной или внутриклеточной (рис. 16.5). О действии in vivo защитных механизмов, перечисленных на рис. 16.5, свидетельствует то, что инъекция моноклональных вирус-нейтрализующих антител весьма эффективно угнетает репродукцию вирусов. Присутствие в кровотоке нейтрализующих вирус антител — это и важный фактор предотвращения повторной инфекции.
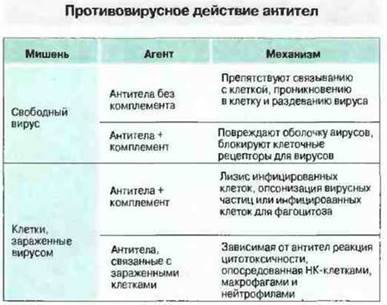
Рис. 16.5. Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
Комплемент участвует в нейтрализации внеклеточных вирусов некоторых видов. Комплемент также способен повреждать оболочку вируса — осуществлять виролиз. Некоторые вирусы непосредственно вызывают активацию комплемента по классическому или альтернативному пути. Тем не менее комплемент не рассматривают как главный фактор защиты против вирусов, поскольку при недостаточности компонентов системы комплемента не отмечено предрасположенности к тяжелым вирусным инфекциям у человека.
Антитела мобилизуют комплемент и/или эффекторные клетки для разрушения инфицированных вирусами клеток организма. Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. В результате его активации происходит сборка лизирующего мембрану комплекса и лизис зараженных клеток (см. гл. 4). Комплемент-зависимый цитолиз возможен лишь при высокой плотности экспрессии вирусных антигенов па клеточной мембране (примерно 5 х 106на клетку). В противоположность этому, для лизиса по механизму АЗКЦ необходимо присутствие на поверхности клетки-мишени лишь 103 молекул IgG — такое количество обеспечивает связывание с ней НК-клеток. Эти клетки связываются с нагруженной антителами мишенью через FcγRIII (CD16) и быстро разрушают ее посредством перфоринов (см. гл. 10). Насколько важен in vivo каждый из этих механизмов, пока трудно понять. Лучшее доказательство в пользу АЗКЦ получено на мышах при изучении защитного эффекта противовирусных моноклональных антител; не проявляя нейтрализующей активности in vitro, они оказались способны защитить С5-дефицитных животных при введении им высокой дозы вируса. (Эта линия мышей была использована для того, чтобы исключить антивирусный эффект терминальных компонентов системы комплемента.)
Т-клетки участвуют в формировании и действии противовирусного иммунитета несколькими путями
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Образование антител в ответ на большинство антигенов зависит от тимуса, поскольку для переключения изотипа и созревания аффинности необходимо участие Т-клеток CD4+. Кроме того, эти клетки помогают в индукции цитотоксических Т-клеток CD8+, а также в привлечении макрофагов в очаг вирусной инфекции и в их активации.
Цитотоксические Т-клетки CD8+. Это главная Т-клеточная система для осуществления в организме противовирусного иммунологического надзора, и действует она весьма эффективно и избирательно. Цитотоксические Т-клетки CD8+, рестриктированные по антигенам МНС класса I, скапливаются в очагах размножения вирусов и разрушают инфицированные ими клетки. Данный механизм иммунологического надзора, по-видимому, весьма важен, так как фактически все клетки тела экспрессируют молекулы МНС класса I.
Процессинг и презентация вирусных белков. Вероятно, любой вирусный белок может быть процессирован в цитоплазме АПК с образованием пептидов, которые затем транспортируются к эндоплазматическому ретикулуму и ассоциируют с молекулами МНС класса I. Для организма-хозяина это создает определенные преимущества, так как белки вируса, экспрессируемые клеткой в начале цикла его размножения, становятся доступными для Т-клеточного распознавания задолго до появления нового поколения вирусных частиц. Например, Т-клеточный иммунитет к цитомегаловирусной инфекции у мыши специфичен в отношении наиболее раннего вирусного белка рр89. Его протективный эпитоп определен как пептид Lb, состоящий из девяти аминокислотных остатков и презентируемый молекулой МНС класса I. Иммунизация мышеи рекомбинантным вирусом коровьей оспы, несущим ген рр89, полностью защищает их от инфекции CMV. Делеция участка ДНК, кодирующего нано-пептид Ld, лишает белок рр89, экспрессируемый вирусом коровьей оспы, протективной активности.
Важность Т-клеточных механизмов в противовирусном иммунитете in vivo установлена различными способами:
• путем адоптивного переноса антигенспецифичных субпопуляций или клонов Т-клеток зараженным животным для проверки на способность устранения вируса;
• на животных, лишенных Т-клеток CD4+или CD8+путем введения специфических моноклональных антител, и
• на мышах, избирательно лишенных эмбриональных генов CD4, CD8 и β2-микроглобулина методом генного нокаута.
Как установлено, мыши, лишенные методом генного нокаута определенных субпопуляций лимфоцитов, сохраняют способность к иммунному ответу на вирусную инфекцию. Можно рассматривать это как хорошую иллюстрацию многократного функционального дублирования, вероятно свойственного иммунной системе. Например, Т-клетки CD4+в отсутствие Т-клеток CD8+могут компенсировать иммунологическую недостаточность и устранять инфекцию.
Т-клетки CD4+ способны выполнять важные эффекторные функции в иммунном ответе на вирусную инфекцию. В иммунном ответе на инфекцию эпителиальных покровов, вызванную вирусом простого герпеса I типа (HSV-I), главной эффекторной клеточной популяцией служат Т-клетки CD4+. Они, как и в реакциях гиперчувствительности замедленного типа (см. гл. 26), мобилизуют и привлекают макрофаги, и эго ускоряет ликвидацию вируса. Макрофаги служат важными участниками этого процесса (рис. 16.6). В качестве ключевых цитокинов в ответе на герпесвирусную инфекцию действует ИФγ, необходимый для активации моноцитов, и фактор некроза опухолей (ФИО), оказывающий ряд противовирусных эффектов, сходных с эффектами ИФγ, но осуществляемых иными путями.

Рис. 16.6. При кожной герпесвирусной (HSV) инфекции в качестве защитных факторов действуют Т-клетки СD4+, макрофаги и ИФγ. Т-клетки CD4+получали от мышей, зараженных HSV за 8 сут до опыта, и переносили сингенным мышам, вскоре после этого зараженным HSV внутрикожно. Одной группе этих мышей вводили антитела к CR3 (чтобы блокировать миграцию макрофагов в место заражения), другой — антитела к ИФγ (чтобы блокировать активацию макрофагов), остальные животные служили контролем. Мышей дополнительной контрольной группы заражали, но не переносили им Т-клетки CD4+. Через 5 сут после заражения определяли количество оставшегося инфекционного вируса. Результаты показывают, что протективный эффект Т-клеток CD4+реализуется при участии макрофагов и ИФγ.
Цитотоксические Т-клетки CD4+. При заражении вирусом кори в организме образуются цитотоксические Т-клетки CD4+, которые распознают и лизируют инфицированные вирусом клетки-мишени, экспрессирующие молекулы МНС класса II. Это указывает, что процессинг и презентация антигенов вируса кори происходят обычным способом — путем фагоцитоза и расщепления (см. гл. 9). Однако существует, предположительно, и другой, еще неизвестный механизм, посредством которого белки или пептиды вируса кори перемещаются из цитозоля в везикулы класса II.
Защитные противовирусные механизмы обобщенно представлены на рис. 16.7, а динамика их индукции — на рис. 16.8.

Рис. 16.7. Проникновению вирусов в клетки слизистой оболочки препятствуют антитела IgA. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФα и ИФβ) и приобретенного (ИФγ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и НК-клетки — для разрушения инфицированных вирусом клеток-мишеней. (АЗКЦ — антителозависимая клеточноопосредованная цитотоксичность.)

Рис. 16.8. Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и в инфицированных тканях раньше всего выявляются НК-клетки и интерферон. Затем в регионарных лимфоузлах или селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). После этого в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
Источник
