Работы по изучению активации врожденного иммунитета
Иммунная система позволяет нам существовать в мире, полном патогенных микроорганизмов — вирусов, бактерий, грибов. Нобелевская премия по физиологии и медицине 2011 года вручена за открытия в области активации врожденного иммунитета (половину премии разделили Брюс Бётлер и Жюль Хоффман) и за изучение роли дендритных клеток в приобретенном иммунитете (вторая половина премии присуждена Ральфу Стайнману, к сожалению, скончавшемуся 30 сентября). Эти достижения не только дали понимание того, как слаженная работа врожденного и адаптивного иммунитета защищает организм, но и открыли новые перспективы в лечении инфекций, рака и воспалительных заболеваний.
Две линии иммунной обороны
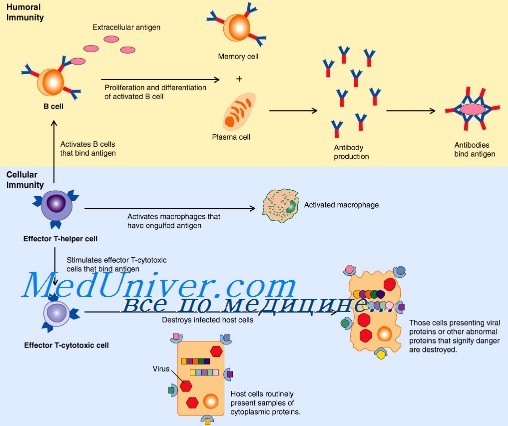
Мы обитаем в мире, буквально кишащем патогенными микроорганизмами (бактериями, грибами, вирусами и паразитами), однако наши организмы оснащены совершенной системой защиты, позволяющей (в норме) не замечать опасного соседства. «Первая линия» иммунной обороны — врожденный иммунитет — уничтожает вторгшиеся в организм патогены на основе технологии «свой—чужой», распознавая черты, всегда присутствующие у «захватчиков», но отсутствующие в собственном организме. Если же инфекции удается прорваться, вступает в работу «вторая линия» — приобретенный, или адаптивный, иммунитет. Основанный на согласованной работе B- и T-лимфоцитов, он действует посредством специфических к конкретной инфекции антител и клеток-«убийц», уничтожающих зараженные клетки и саму инфекцию. В отличие от врожденного иммунитета, способность к распознаванию патогенов которого закодирована генетически, приобретенный иммунитет обучается распознавать новые «образы» врага и сохраняет память о нем, мгновенно «вспоминая», встретившись вновь.
Однако, обеспечивая необходимую защиту, иммунные механизмы скрывают и опасность: если «активационный барьер» слишком низок, иммунитет может активироваться собственными молекулами, что приводит к развитию аутоиммунных и воспалительных заболеваний.
Организация иммунной системы изучалась в течение XX века постепенно; в частности, нобелевскими премиями отмечены изучение строения антител и определение механизма распознавания Т-клетками инородных веществ. Однако только с работами Бётлера, Хоффмана и Стайнмана стали понятны механизмы, активирующие врожденный иммунитет и связывающие его с иммунитетом приобретенным.
Открытие сенсоров врожденного иммунитета
Пионерское открытие Жюля Хоффмана было сделано в 1996 году, когда он с коллегами исследовал, как дрозофила сопротивляется инфекциям [1]. Они работали на линиях мух, мутантных по нескольким генам, включая ген Toll, участвующий в эмбриональном развитии (за открытие роли этого гена также вручена Нобелевская премия в 1995 году). Хоффман с коллегами открыли, что мухи с мутантным геном Toll погибали при заражении бактериями или грибами, в то время как «дикий тип» чувствовал себя вполне сносно. В результате их работ был сделан вывод, что продукт этого гена — Toll-рецептор — «чувствует» патогенные микроорганизмы и запускает механизмы врожденного иммунитета.
Брюс Бётлер с коллегами, со своей стороны, искали рецепторы, которые могли бы активироваться элементом клеточной стенки бактерий липополисахаридом (ЛПС), который при попадании в кровь вызывает септический шок (чрезмерная активация иммунной системы, грозящая смертью). В 1998 году они обнаружили, что мыши, не реагирующие на введение ЛПС, имели мутации в гене, гомологичном Toll у дрозофил. Продукт этого гена — Toll-подобный рецептор — и оказался искомым сенсором липополисахарида [2]. Связывание ЛПС (обозначающее присутствие бактерий) активирует иммунитет и запускает воспаление, а чрезмерная концентрация ЛПС приводит к септическому шоку. Это открытие показало, что и членистоногие, и млекопитающие используют схожие стратегии противостояния бактериальным инвазиям.
Открытия Хоффмана и Бётлера фактически положили начало новой «горячей» области биологии: впоследствии было открыто более 10 Toll-подобных рецепторов, каждый распознающий свой «образ», характерный для разных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней.
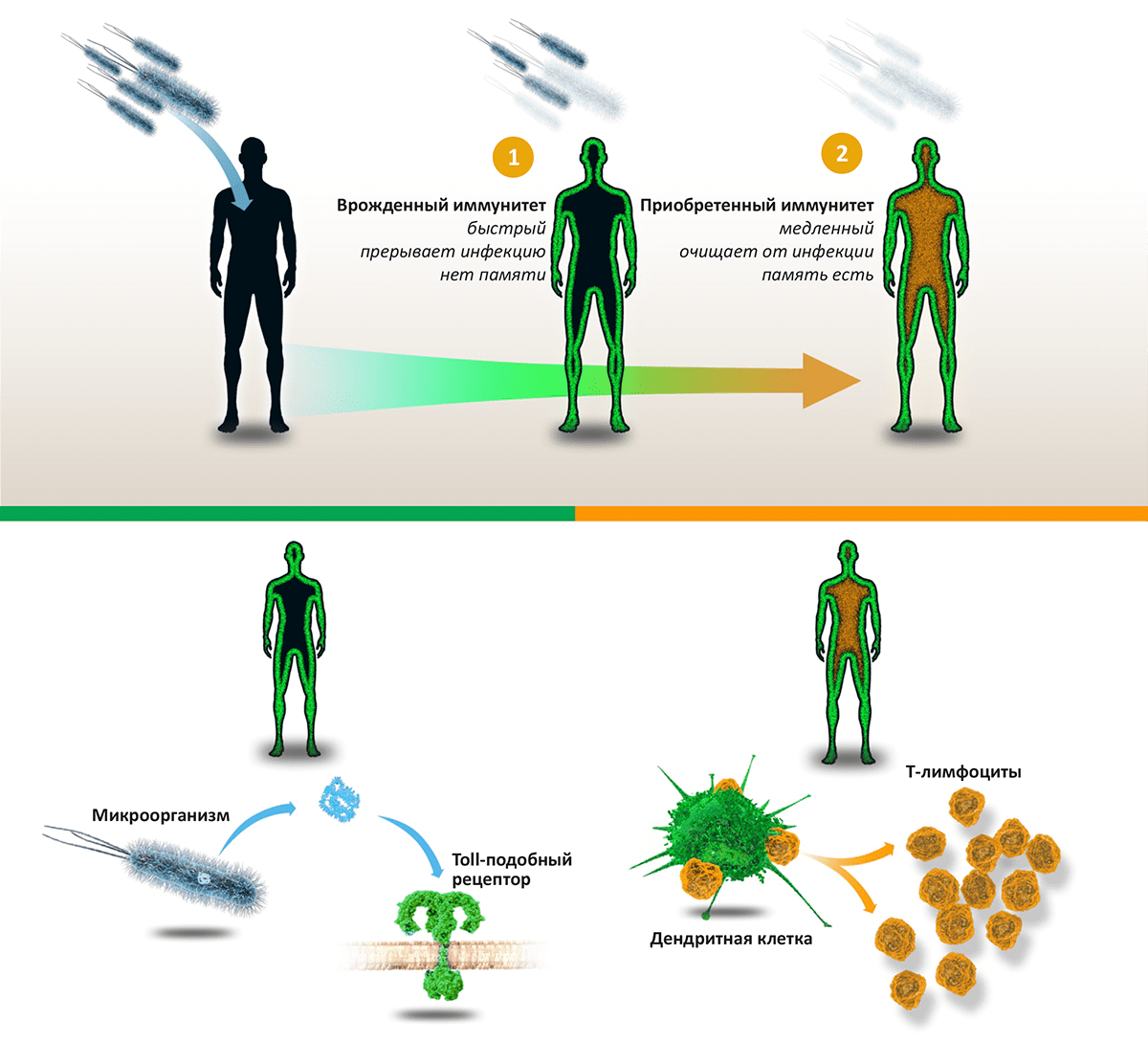
Рисунок 1. Схема работы иммунитета. Проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует «две линии» иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Врожденный иммунитет: компоненты микроорганизмов, такие как липополисахарид, связываются с Toll-подобными рецепторами, находящимися на поверхности многих клеток организма. Это запускает врожденный иммунитет, активирующий воспалительную реакцию и уничтожающий «захватчиков». Приобретенный иммунитет: Дендритные клетки активируют T-лимфоциты, лежащие в основе каскада иммунных реакций, приводящих к синтезу антител и уничтожению патогенов и зараженных клеток.
Новый игрок в команде адаптивного иммунитета
Еще в 1973 году Ральф Стайнман открыл новый тип клеток иммунитета с длинными отростками, названный им дендритными клетками. Его предположение было — что эти клетки активируют T-лимфоциты, играющие ключевую роль в приобретенном иммунитете и иммунной памяти. Это предположение блестяще подтвердилось в клеточных экспериментах, где добавление дендритных клеток к популяции Т-лимфоцитов способствовало формированию иммунитета [3–5].
Дальнейшие работы Стайнмана и других исследователей были направлены на то, чтобы понять, как приобретенный иммунитет определяет, — надо ли реагировать на то или иное вещество, или можно этого не делать. Обнаружилось, что дендритные клетки воспринимают сигналы от системы врожденного иммунитета, и это управляет их способностью активировать T-клетки. Это позволяет нашему иммунитету прицельно бороться с патогенными микроорганизмами, «не обращая внимания» на молекулы нашего собственного тела.
Фундаментальные науки — медицине
Достижения нобелевских лауреатов 2011 года пролили свет на подробности работы систем врожденного и приобретенного иммунитета. Это знание легло в основу создания новых стратегий лечения многих болезней, — например, новых вакцин против инфекций и попыток «натравить» собственную иммунную систему на раковые опухоли. В дополнение к этому, стало понятно, почему организм иногда начинает атаковать свои собственные ткани, что приводит к воспалительным и аутоиммунным заболеваниям.
Горькая ирония
Как известно, Нобелевская премия не вручается посмертно. Однако этот год стал исключением: 30 сентября после продолжительной борьбы с раковой опухолью скончался Ральф Стайнман, — буквально за несколько дней до объявления лауреатов премии. Нобелевский комитет не знал об этом, и обнародовал свое решение 3 октября. Несмотря на этот печальный казус, решение менять не будут. Работы Стайнмана легли в основу терапии дендритными клетками — перспективного способа лечения воспалительных и онкологических заболеваний. К сожалению, самому ему оказалось суждено стать жертвой такого заболевания [6], [7].
И снова мимо!..
Сегодня интернет пестрит сообщениями, что опять — в который уже раз! — Нобелевский комитет обошел своим решением российских ученых. Речь идет о российском эмигранте Руслане Меджитове [8], который, вместе со своим (ныне уже покойным) учителем Чарльзом Дженуэем показал, что и у людей существуют Toll-подобные рецепторы [9]. Если бы Дженуэй был жив, то, скорее всего, именно он был бы третьим лауреатом премии (вместо Стайнмана), а сама премия была бы конкретно за врожденный иммунитет.
По материалам пресс-релиза Нобелевского комитета [10].
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- A. Poltorak. (1998). Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene. Science. 282, 2085-2088;
- R. M. Steinman. (1973). IDENTIFICATION OF A NOVEL CELL TYPE IN PERIPHERAL LYMPHOID ORGANS OF MICE: I. MORPHOLOGY, QUANTITATION, TISSUE DISTRIBUTION. Journal of Experimental Medicine. 137, 1142-1162;
- R. M. Steinman, M. D. Witmer. (1978). Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice.. Proceedings of the National Academy of Sciences. 75, 5132-5136;
- G. Schuler. (1985). Murine epidermal Langerhans cells mature into potent immunostimulatory dendritic cells in vitro. Journal of Experimental Medicine. 161, 526-546;
- Нобелевскую премию присудили только что умершему от рака ученому. Но другого выбирать уже не будут. (2011). NewsRu;
- Воронин Е. (2011). Ральф Стайнман. shvarz.livejournal.com;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- The Nobel Prize in Physiology or Medicine 2011. (2011). The Nobel Prize.
Источник
Активация врожденного иммунитета. Стадия активации врожденного иммунитетаВрожденная иммунная защита первично нацелена на распознавание и элиминацию чужеродных структур. Инфекционные агенты располагают многими факторами вирулентности, воздействие которых может быть разрушительным для защитных механизмов врожденного иммунитета. Организм хозяина выработал уникальные стратегии распознавания патогенных структур микроорганизмов, процессинга их и презентации антигенов Т-лимфоцитам. Активация врожденного иммунитета, обеспечивающая оптимальное развитие специализированных эффекторных механизмов, может быть концептуально разделена на две стадии: 1 — фаза детекции, в течение которой комбинация поверхностных рецепторов распознает присутствие чужеродных структур при вторжении микрорганизмов, и 2 — фаза трансмиссии этой сенсорной информации на язык, понятный для клеток адаптивной иммунной системы, например, через продукцию хемокинов и цитокинов. Универсальная стратегия распознавания микроорганизмов эффекторами врожденного иммунитета основана на детекции доменных структур, которые называются патоген-ассоциированными молекулярными образами — PAMPs (pathogen-associated mollecular patterns), а распознающие их рецепторы врожденной иммунной системы — образраспознающими рецепторами — PRRs (pattern-recognition receptors). PAMPs — консервативные (неспецифические, невариабельные) структуры микроорганизмов общие для разных патогенов, их нет у млекопитающих, поэтому они распознаются иммунной системой как «чужое» с помощью паттерн-распознающих рецепторов (PRRs), включая семейство сигнальных Toll-подобных рецепторов (TRL). Существуют еще и альтернативные рецепторы врожденного иммунитета, такие как нуклеотид-связывающий олигомеризующийся домен (nucleotide-binding oligomerization domain — NOD), локализующийся внутриклеточно. NOD распознают РАМР независимо от участия TLR, активируют ядерный фактор KB (NF-kB) и усиливают продукцию IFN-y.
Эти эволюционно законсервированные рецепторы распознают PAMPs, включающие различные компоненты бактериальной стенки, среди которых наиболее известные — это липополисахариды, пептидогликан, липотейхоевые кислоты, маннаны, флагеллин, бактериальная ДНК, вирусные двуспиральные РНК, глюканы. До недавнего времени рассматривалось, что PAMPs обычно экспрессируются на поверхностях микробов и отсутствуют на клетках организма хозяина, однако в последнее время появляются работы, демонстрирующие наличие паттернов хозяина, распознаваемых рецепторами этого класса. В настоящее время известно два типа рецепторов врожденного иммунитета, обеспечивающих информирование организма о проникновении патогена. К первому типу относятся растворимые рецепторы для патогенов: C1q комплемента, ЛПС-связывающий белок, маннозосвязывающий лектин, С-рективный белок. Второй тип рецепторов для патогенов — рецепторы, экспрессирующиеся клетками врожденного иммунитета. Закодированные в геноме, рецепторы врожденной иммунной системы имеют ряд отличий от рецепторов лимфоцитов. Они экспресси-руются на эффекторных клетках врожденной иммунной системы, осуществляющих первую линию защиты, а также на профессиональных антигенпрезентирующих клетках (макрофагах, дендритных клетках и В-лимфоцитах). — Также рекомендуем «Варианты образраспознающих рецепторов PRRs. Toll-подобные рецепторы» Оглавление темы «Врожденный иммунитет»:
|
Источник
САНКТ-ПЕТЕРБУРГ, 9 июля. /Корр. ИТАР-ТАСС Наталия Михальченко/. Одним из самых значительных событий 38-го конгресса Федерации биохимических обществ, который проходит в Петербурге с 6 по 11 июля, стало выступление и участие в научных симпозиумах Нобелевского лауреата по физиологии и медицине Жюля Хоффмана. С лекцией о механизмах активации врожденного иммунитета у насекомых он выступил на конгрессе первым среди 10 участвующих в конгрессе коллег-лауреатов Нобелевской премии. Жюль Хоффман среди них самый «свежий» лауреат. Наипрестижнейшая международная награда нашла его в 2011 году.
Жюль Хоффман рассказал, что его исследовательской группе удалось обнаружить у мухи-дрозофилы рецепторы, отвечающие за включение имунного ответа организма на инфекцию. А также выявить и изучить сами субстанции, которые живой организм направляет на сражение с инфекцией. По мнению Председателя комитета Госдумы по науке и наукоемким технологиям Валерия Черешнева, работа группы Хоффмана находится на вершине айсберга исследований иммунитета, у основания которого стояли Нобелевские лауреаты Эмиль Беринг /1901 г/, Илья Мечников /1908 г, совместно с Паулем Эрлихом/. «Уже 100 лет назад было понятно, в каком направлении надо идти, но указать вектор и дойти до цели — это принципиально разные вещи. Работа Жюля Хоффмана достигает такой глубины, которая вызывает восхищение перед силой человеческой мысли», — отметил Валерий Черешнев.
В интервью ИТАР-ТАСС ученый рассказал, что интерес к насекомым появился у него еще в детстве, затем уже в 15 лет он решил посвятить свою жизнь науке, работал во Франции, Страсбурге, где в лаборатории профессора Пьера Жоли велась научная работа по изучению саранчи. Его исследования шли успешно, по окончании университетского курса Жюля Хоффмана пригласили в Национальный центр научных исследований Франции /CNRS/, где он работает и сейчас. В последние годы команда Жюля Хоффмана пополнилась американскими учеными Чарльзом Джейнвеем и Брюсом Бётлером, получившим Нобелевскую премию вместе с Хоффманом в 2011 году, а они изучали млекопитающих. Благодаря этому появилась возможность сравнить иммунные реакции, возникающие у насекомых и млекопитающих, и выявить у человека механизмы иммунного ответа на инфекцию, сходные с теми, что возникают у крошечной плодовой мушки дрозофилы. Параллельные исследования разных отрядов животных позволили ученым открыть вторую линию обороны организма от инфекций — адаптивный иммунитет, который отсутствует у дрозофилы. Именно он является фабрикой для выработки антител, позволяет живому организму запоминать информацию о повстречавшихся инфекциях, и тем самым, создает возможность для вакцинации.
На вопрос корр. ИТАР-ТАСС о том, как изменилась его жизнь после получения Нобелевской премии, ученый ответил, что «собственно жизнь и работа не изменились совершенно, но очень сильно изменилось отношение окружающих». При этом он заметил, что на протяжении всей жизни старался не приносить жертв науке. «Жизнь удивительная и очень сложная, многослойная штука, я стараюсь строить ее равномерно. Несмотря на горячую увлеченность исследованиями, я сумел уделить много внимания своей семье», — рассказал ученый.
Источник
Иммуноло́гия (от лат. immunis — свободный, освобождённый, избавленный от чего-либо + греч. λόγος — знание) — медико-биологическая наука, изучающая реакции организма на чужеродные структуры (антигены): механизмы этих реакций, их проявления, течение и исход в норме и патологии, а также разрабатывающая методы исследования и лечения.
Предмет изучения иммунологии[править | править код]
- Строение иммунной системы;
- Закономерности и механизмы развития иммунных реакций;
- Механизмы контроля и регуляции иммунных реакций;
- Болезни иммунной системы и её дисфункции;
- Условия и закономерности развития иммунопатологических реакций и способы их коррекции;
- Возможность использования резервов и механизмов иммунной системы в борьбе с инфекционными и неинфекционными заболеваниями;
- Иммунологические проблемы репродукции;
- Иммунологические проблемы трансплантации органов и тканей.
Направления иммунологии[править | править код]
Общая иммунология[править | править код]
Общая иммунология изучает клеточные и молекулярные основы иммунных реакций, их регуляцию, генетический контроль, а также роль иммунных механизмов в процессах индивидуального развития.
Частная иммунология[править | править код]
Частная иммунология носит прикладной характер; к основным направлениям её относятся: иммунопатология, молекулярная иммунология, иммунология эмбриогенеза, аллергология, трансплантационная иммунология, инфекционная иммунология, иммунохимия, иммуноморфология, нейроиммунология.
Клиническая иммунология или иммунопатология — клиническая и лабораторная дисциплина, которая занимается обследованием, диагностикой и лечением больных с заболеваниями или патологическими процессами, развивающимися в результате нарушения иммунных механизмов, а также теми случаями, когда иммунологические манипуляции являются важной частью терапии и/или профилактики.
Инфекционная иммунология — раздел иммунологии, изучающий иммунный ответ при инфекционных болезнях человека и животных и разрабатывающий методы специфической профилактики, диагностики и лечения этих болезней.
Неинфекционная иммунология — совокупность разделов иммунологии, изучающих иммунный ответ организма на антигены, не связанные с возбудителями инфекционных и инвазионных болезней, например, на изоантигены, опухолевые антигены и т. д.
Молекулярная иммунология — раздел иммунологии, изучающий молекулярные механизмы иммунного ответа.
Радиационная иммунология — раздел иммунологии, изучающий изменения иммунного ответа под воздействием ионизирующих излучений, разрабатывающий методы их использования для подавления трансплантационного иммунитета, методы восстановления системы иммунитета при лучевых поражениях и т. д.
Иммунология эмбриогенеза или иммунология репродукции — раздел иммунологии и эмбриологии, изучающий процессы становления антигенной структуры тканей и органов в ходе эмбрионального развития и иммунологические взаимоотношения организма матери и плода.
Иммуноморфология — раздел иммунологии, изучающий клеточные основы иммунитета.
Иммунохимия — раздел иммунологии, изучающий химические основы иммунного ответа.
Трансплантационная иммунология изучает иммунную несовместимость тканей, отторжение трансплантатов, условия и способы преодоления несовместимости.
Микробиологическая иммунология
История иммунологии[править | править код]
Древний мир и Средние Века[править | править код]
1000 г. до н. э. — первые инокуляции содержимого оспенных папул здоровым людям с целью их защиты от острой формы заболевания проводились в Китае, а затем распространились в Индию, Европу, Малую Азию, на Кавказ.[источник?]
1546 г. — выходит книга итальянского врача Джироламо Фракасторо «Зараза» (лат. On Contagion et Contagiosis Morbis), в которой он развивает теорию приобретённого иммунитета, выдвинутую ещё в XI веке Авиценной. Авиценна и Фракасторо полагали, что все болезни вызываются мелкими «семенами», переносимыми от человека к человеку. Разные «семена заразы» имеют различное сродство к разным растениям и животным, а внутри организма — к различным органам и жидкостям тела.
Первые вакцины[править | править код]
С 1701 вариоляция (прививание от оспы) получает распространение в Константинополе, откуда распространяется в Европу.
В 1722 принц и принцесса Уэльские привили оспу двум своим дочерям, чем подали монарший пример жителям Англии.
В Лондоне в 1746 был открыт специальный госпиталь Святого Панкраса, в котором всем желающим прививали оспу.
12 октября 1768 один из лучших врачей — инокуляторов Томас Димсдейл произвел оспопрививание императрице Екатерине II и её сыну Павлу.
В 1796 после тридцати лет исследований Эдвард Дженнер опробовал метод прививания людей коровьей оспой на 8-летнем мальчике, а затем ещё на 23 людях. В 1798 г. он опубликовал результаты своих исследований. Дженнер разработал врачебную технику оспопрививания, которую назвал вакцинацией (от лат. vaccus — корова).
Иммунологическая революция[править | править код]
В 1880 г. выходит в свет статья Луи Пастера о защите кур от холеры путём их иммунизации патогеном со сниженной вирулентностью.
В 1881 г. Пастер проводит публичный эксперимент по прививке 27 овцам сибиреязвенной вакцины, а в 1885 г. успешно испытывает вакцину от бешенства на мальчике, укушенном бешеной собакой. Эти события знаменуют собой зарождение инфекционной иммунологии и начало эры вакцинации.
В 1883 г. иммунолог Илья Мечников сделал первое сообщение по фагоцитарной теории иммунитета на съезде врачей-естествоиспытателей в Одессе. Именно Мечников стоял у истоков познания вопросов клеточного иммунитета. Мечников показал, что в организме человека присутствуют особые амебоидные подвижные клетки — нейтрофилы и макрофаги, которые поглощают и переваривают патогенные микроорганизмы. Именно им он отдавал первичную роль в защите организма.
В 1890 г. немецкий врач Эмиль фон Беринг совместно с Сибасабуро Китасато показал, что в крови людей, переболевших дифтерией или столбняком, образуются антитоксины, которые обеспечивают иммунитет к этим болезням как самим переболевшим, так и тем, кому такая кровь будет перелита. В том же году на основе этих открытий был разработан метод лечения кровяной сывороткой. Работы этих учёных положили начало изучению механизмов гуморального иммунитета. А в 1901 г. Эмилю фон Берингу была присуждена первая Нобелевская премия по физиологии и медицине «за работу по сывороточной терапии, главным образом за её применение при лечении дифтерии, что открыло новые пути в медицинской науке и дало в руки врачей победоносное оружие против болезни и смерти».
В 1891 г. выходит статья немецкого фармаколога Пауля Эрлиха, в которой он термином «антитело» обозначает противомикробные вещества крови. Параллельно с Мечниковым, Эрлих разрабатывал свою теорию иммунной защиты организма. Эрлих заметил, что основным свойством антител является их ярко выраженная специфичность. Пытаясь понять это явление специфичности, Эрлих выдвинул теорию «боковых цепей», в соответствии с которой антитела в виде рецепторов предшествуют на поверхности клеток. Позже эта в целом умозрительная теория подтвердилась с некоторыми изменениями.
Две теории — фагоцитарная (клеточная) и гуморальная — в период своего возникновения стояли на антагонистических позициях. В 1908 г. Мечников и Эрлих разделили Нобелевскую премию в области медицины, а позже выяснилось, что их теории дополняют друг друга.
В 1900 г. австрийский врач — иммунолог Карл Ландштейнер открыл группы крови человека, за что в 1930 г. был удостоен Нобелевской премии.
В 1904 г. известный химик Сванте Аррениус доказал обратимость взаимодействия антиген — антитело и заложил основы иммунохимии.
В 1908 г. в Германии и Франции основаны первые научные журналы, публикующие статьи по иммунологии, — Zeitschrift für Immunitätsforschung[en] и Annales de I’lnstitut Pasteur, с 1916 г. в США выходит American Journal of Immunology.
В 1913 г. была организована Американская ассоциация иммунологов (англ. American Association of Immunologists).
К концу 40х гг. созданием целого набора вакцин против опаснейших инфекционных возбудителей (оспы, бешенства, холеры, чумы, брюшного тифа, желтой лихорадки, дифтерии, столбняка) завершается первый этап развития иммунологии.
Прорыв в теоретической иммунологии[править | править код]
Несмотря на успехи инфекционной иммунологии, экспериментальная и теоретическая иммунология в середине века оставались в зачаточном состоянии.
Новый этап развития иммунологии связан с именем австралийского вирусолога Фрэнка Макфарлейна Бернета. Он стал автором клонально-селективной теории иммунитета и первооткрывателем явления иммунотолерантности, за что в 1960 г. получил Нобелевскую премию.
Изучение иммуноглобулинов началось с работы по электрофорезу белков крови Арне Тиселиуса 1937 года.
Затем в течение 40х −60х гг. были открыты классы и изотипы иммуноглобулинов, а в 1962 г. Родни Портер предложил модель структуры молекул иммуноглобулинов, которая оказалась универсальной для иммуноглобулинов всех изотипов и совершенно верной и по сегодняшний день.
60-е — начало 80-х годов — этап выделения всевозможных факторов — гуморальных медиаторов иммунного ответа из супернатантов клеточных культур. С середины 80-х годов и по настоящее время в иммунологию вошли методы молекулярного клонирования, трансгенные мыши и мыши с удалением заданных генов (knokout).
В работах Джеймса Гованса 60-х годов XX в. показана роль лимфоцитов в организме. Гованс в опытах на крысах показал, что хронический дренаж грудного лимфатического протока, который физически «вынимает» лимфоциты из организма, приводит к утрате способности животных к развитию иммунного ответа.
В середине XX в. команда во главе с американским генетиком и иммунологом Джорджем Снеллом проводила опыты с мышами, которые привели к открытию главного комплекса гистосовместимости и законов трансплантации, за что Снелл и получил Нобелевскую премию в 1980 г.
В 2011 г. Нобелевскую премию по физиологии или медицине получил французский иммунолог Жюль Офман за работу «по исследованию активации врождённого иммунитета».
В XXI веке основными задачами иммунологии стали: изучение молекулярных механизмов иммунитета — как врождённого, так и приобретённого, разработка новых вакцин и методов лечения аллергии, иммунодефицитов, онкологических заболеваний.
Список Нобелевских лауреатов по физиологии и медицине за работы в области иммунологии[править | править код]
| Год присуждения премии | Лауреат | За что присуждена премия |
|---|---|---|
| 1901 | Эмиль Адольф фон Беринг | За открытие антитоксинов (антител), их применение при лечении дифтерии. |
| 1905 | Роберт Кох | За исследование туберкулёза. |
| 1908 | Илья Ильич Мечников и Пауль Эрлих | За труды по иммунитету, открытие фагоцитоза (Мечников) и гуморальную теорию иммунитета (Эрлих). |
| 1913 | Шарль Рише | В знак признания его работ по анафилаксии. |
| 1919 | Жюль Борде | За экспериментальные работы по комплементзависимому бактериолизу, специфическому гемолизу, за разработку метода фиксации комплемента для диагностики инфекционных болезней. |
| 1930 | Карл Ландштейнер | За открытие групп крови человека. |
| 1951 | Макс Тейлер | За создание вакцины против жёлтой лихорадки. |
| 1957 | Даниеле Бове | За открытие роли гистамина в патогенезе аллергических реакций и разработку антигистаминных фармакологических препаратов для лечения аллергических болезней. |
| 1960 | Макфарлейн Бёрнет и Питер Брайан Медавар | За открытие искусственной иммунной толерантности (переносимости). |
| 1972 | Джералд Эдельман и Родни Портер | За открытия, касающиеся химической структуры антител. |
| 1977 | Розалин Сасмен Ялоу | За развитие радиоиммунологических методов определения пептидных гормонов. |
| 1980 | Барух Бенасерраф, Жан Доссе и Джордж Снелл | За открытие генов и структур поверхности клеток главного комплекса гистосовместимости. |
| 1984 | Нильс Ерне, Георг Кёлер и Сезар Мильштейн | За открытие и разработку принципов выработки моноклональных антител с помощью гибридов. |
| 1987 | Судзуми Тонегава | За открытие генетического принципа для генерации разновидности антител. |
| 1996 | Питер Доэрти и Рольф Цинкернагель | За открытия в области иммунной системы человека, в частности её способности выявлять клетки, поражённые вирусом |
| 1997 | Стенли Прузинер | За открытие прионов, нового биологического принципа инфекции |
| 2011 | Ральф Стейнман | За открытие дендритных клеток и изучение их значения для приобретённого иммунитета |
| 2011 | Жюль Хоффман и Брюс Бётлер | За работы по изучению активации врождённого иммунитета |
| 2018 | Джеймс Эллисон и Тасуку Хондзё | За их открытия терапии рака путем ингибирования отрицательной иммунной регуляции |
Журналы по иммунологии[править | править код]
- Иммунология ISSN 02064952
- Клиническая иммунология. Аллергология. Инфектология (сайт журнала)
- Медицинская иммунология (сайт журнала) ISSN 15630625
- Российский аллергологический журнал (сайт журнала)
- Applied Immunohistochemistry & Molecular Morphology (сайт журнала) ISSN 10623345
- Current Opinion in Allergy and Clinical Immunology (сайт журнала) ISSN 15284050
- Internationals Journal of Immunogenetics (сайт журнала) ISSN 1744313X
- Immunogenetics (сайт журнала) ISSN 00937711
- Journal of Immunology ISSN 00221767
- Journal of Immunotherapy (сайт журнала) ISSN 15249557
- Nature Reviews Immunology ISSN 14741733
- Journal of Allergy Clinical Immunology (сайт журнала) ISSN 10976825
- Allergy (сайт журнала) ISSN 01054538
- Clinical & Experimental Allergy (сайт журнала) ISSN 13652222
- International Archives of Allergy and Immunology (сайт журнала) ISSN 10182438
- Pediatric Allergy and Immunology (сайт журнала) ISSN 09056157
- Annals of Allergy and Asthma Immunology (сайт журнала)
- Clinical Review of Allergy Immunology (сайт журнала) ISSN 10800549
- Contact Dermatitis(сайт журнала) ISSN 01051873
- Journal of Asthma (сайт журнала) ISSN 11786965
- Allergy Asthma Proceedings (сайт журнала) ISSN 15396304
- World Allergy Organization Journal (сайт журнала) ISSN 19394551
См. также[править | править код]
- Нейроиммунология
Литература[править | править код]
- Иммунология / под ред. Хаитова Р. М.. — М.: Медицина, 2000. — 425 с. — ISBN 522504543X.
- Галактионов В. Г. Иммунология: Учебник. — М.: Издательство МГУ, 1998. — 480 с. — ISBN 5-211-03717-0.
- Энциклопедический словарь медицинских терминов / под ред. Покровского В. И.. — М.: Советская энциклопедия, 1984. — С. 1591.
- Чепель Э. Основы клинической иммунологии / Перевод с англ. 5-е издание. — М.: ГЭОТАР-Медиа, 2008. — С. 416. — ISBN 978-1-4051-2761-5.
- Попов Н. Н. Клиническая иммунология и аллергология. — М.: Реинфор, 2004. — 524 с. — ISBN 5-94944-014-5.
- Доссе Ж. Иммуногематология, пер. с франц.. — М., 1959.
- Радиационная иммунология. — М., 1965.
- Лабораторные методы исследования в неинфекционной иммунологии / под ред. О. Е. Вязова. — М., 1967.
- Иоффе В. И. Клиническая и эпидемиологическая иммунология. — Л., 1968.
- Практическая иммунология / под ред. П. Н. Бургасова и И. С. Безденежных. — М., 1969.
- Уилсон Д. Тело и антитело / Пер. с англ. — М.: Мир, 1974.
- Дреслер К. Иммунология: Словарь = Immunologie / Карл Дреслер; Пер. с нем. Л. И. Мартыновой; Под ред. и с предисл. А. Е. Вершигоры. — Киев: Выща школа. Головное изд-во, 1988. — 224 с. — 24 000 экз. — ISBN 5-11-000318-1.
Ссылки[править | править код]
- Иммунология / А. Х. Канчурин, Н. В. Медуницын // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Материалы по иммунологии от Российской Академии Наук
- Материалы по иммунологии
- Материалы по истории иммунологии
- Элементы большой науки.
Источник
