Развитие иммунитета в онтогенезе
В отличие от системы специфического иммунитета факторы неспецифической защиты у новорожденных выражены хорошо. Они формируются раньше специфических и берут на себя основную функцию защиты организма плода и новорожденного. В околоплодных водах и в крови плода отмечается высокая активность лизоцима – неспецифического фактора защиты, которая сохраняется до рождения ребенка, а затем снижается. Способность к образованию интерферона сразу после рождения высока, на протяжении года она снижается, но с возрастом постепенно увеличивается и достигает максимума к 12–18 годам.
Новорожденный получает от матери значительное количество гамма-глобулинов. Такая неспецифическая защита оказывается достаточной при первоначальном столкновении организма с микрофлорой окружающей среды. К тому же у новорожденного отмечается физиологический лейкоцитоз – количество лейкоцитов в 2 раза выше, чем у взрослого; эго естественная подготовка организма к новым условиям существования. Однако многочисленные лимфоциты новорожденных представлены незрелыми формами и не способны синтезировать необходимое количество глобулинов и интерферона. Фагоциты тоже недостаточно активны. В результате этого детский организм менее подготовлен к встрече с болезнетворными бактериями, чем с вирусами, и отвечает на проникновение микроорганизмов генерализованным воспалением. Иногда такую реакцию вызывают микроорганизмы, безопасные для взрослого. Специфические иммунные системы и механизмы иммунной памяти в организме новорожденного не сформированы, поэтому очень важно кормление материнским молоком, в котором содержатся иммунные вещества. В возрасте от 3 до 6 месяцев специфическая иммунная система ребенка уже реагирует на вторжение микроорганизмов, но иммунная память еще не сформирована.
Второй год жизни ребенка выделяется как «критический» период в развитии иммунитета. В этом возрасте расширяются возможности и повышается эффективность иммунных реакций, однако система местного иммунитета еще недостаточно развита и дети особенно чувствительны к респираторным вирусным инфекциям. В возрасте 5–6 лет более зрелыми и активными становятся механизмы неспецифического клеточного иммунитета. Формирование собственной системы неспецифической гуморальной иммунной защиты завершается на 7-м году жизни, в результате чего заболеваемость респираторными вирусными инфекциями снижается.
Замечено, что у детей, воспитывающихся в коллективах, быстрее формируются иммунные реакции. Это объясняется тем, что в коллективе ребенок подвергается скрытой иммунизации: попадание от заболевших детей в организм ребенка малых доз возбудителя не всегда вызывает у него заболевание, но активирует выработку антител. Если это повторяется несколько раз, то приобретается иммунитет к данному заболеванию. К 10 годам иммунные свойства организма хорошо выражены и в дальнейшем они держатся на относительно постоянном уровне и начинают снижаться после 40 лет. Важную роль в формировании иммунных реакций организма играют профилактические прививки.
У новорожденного красный костный мозг занимает все костномозговые полости. Первые жировые клетки желтого костного мозга появляются через 1–6 месяцев после рождения. После 4–5 лет красный костный мозг в диафизах трубчатых костей начинает замещаться желтым. К 20–25 годам все костномозговые полости диафизов трубчатых костей полностью заполняются желтым костным мозгом, в плоских костях он составляет 50% объема костного мозга. В старческом возрасте костный мозг приобретает слизеподобную консистенцию и называется желатиновым костным мозгом.
Защитная активность миндалин формируется на протяжении всего детства и нередко проявляется в виде разрастания лимфоидной ткани – гипертрофии миндалин. Наибольшее количество лимфоидных узелков, выполняющих защитную роль, наблюдается до 16 лет. В возрасте 25–30 лет в миндалинах происходит разрастание соединительной ткани, и после 40 лет лимфоидные узелки в тканях миндалин встречаются редко.
Количество пейеровых бляшек по мере взросления постепенно снижается. В детском возрасте их около 50, в 16–17 лет – 33–37. После 40 лет их количество не более 20, а после 60 лет – 16. С возрастом в них уменьшается количество лимфоидной ткани и появляются прослойки из топких пучков соединительнотканных волокон. Лимфоидная ткань аппендикса с возрастом также редуцируется, после 60 лет лимфоидные узелки в стенках аппендикса практически не встречаются.
Тимус у человека формируется на 6-й неделе внутриутробной жизни, развиваясь из двух сегментов, которые объединяются и образуют единый орган, состоящий из двух долей. Наибольших размеров по отношению к весу тела тимус человека достигает к моменту рождения (около 15 г). Затем он продолжает расти, хотя уже гораздо медленнее, и в период полового созревания достигает максимального веса (примерно 35 г) и размеров (около 75 мм в длину). После 16 лет масса тимуса постепенно уменьшается и составляет: в 20 лет – 25 г, в 35 лет – 22 г. Полностью лимфоидная ткань тимуса не исчезает даже в старческом возрасте (после 50 лет се вес на уровне 13 г). В тимусе рано появляется жировая ткань. Если у новорожденного соединительная ткань в тимусе составляет всего 7%, то в 20 лет – 40%, после 50 лет – до 90%.
Источник
Развитие иммунитета в онтогенезе
В отличие от системы специфического иммунитета факторы неспецифической защиты у новорожденных выражены хорошо. Они формируются раньше специфических и берут на себя основную функцию защиты организма плода и новорожденного. В околоплодных водах и в крови плода отмечается высокая активность лизоцима, которая сохраняется до рождения ребенка, а затем снижается. Способность к образованию интерферона сразу после рождения высока, на протяжении года она снижается, но с возрастом постепенно увеличивается и достигает максимума к 12-18 годам.
Новорожденный получает от матери значительное количество гамма-глобулинов. Эта неспецифическая защита оказывается достаточной при первоначальном столкновении организма с микрофлорой окружающей среды. К тому же у новорожденного отмечается «физиологический лейкоцитоз» — количество лейкоцитов в 2 раза выше, чем у взрослого, как естественная подготовка организма к новым условиям существования. Однако многочисленные лимфоциты новорожденных представлены незрелыми формами и не способны синтезировать необходимое количество глобулинов и интерферона. Фагоциты тоже недостаточно активны. В результате этого детский организм отвечает на проникновение микроорганизмов генерализованным воспалением. Часто такую реакцию вызывает бытовая микрофлора, безопасная для взрослого. В организме новорожденного специфические иммунные системы не сформированы, иммунной памяти нет, неспецифические механизмы тоже еще не созрели. Поэтому столь важно кормление материнским молоком, в котором содержатся иммунореактивные вещества. В возрасте от 3 до 6 месяцев иммунная система ребенка уже реагирует на вторжение микроорганизмов, но практически не формируется иммунная память. В это время неэффективны прививки, заболевание не оставляет после себя стойкого иммунитета. Второй год жизни ребенка выделяется как «критический» период в развитии иммунитета. В этом возрасте расширяются возможности и повышается эффективность иммунных реакций, однако система местного иммунитета еще недостаточно развита и дети чувствительны к респираторным вирусным инфекциям. В возрасте 5-6 лет созревает неспецифический клеточный иммунитет. Формирование собственной системы неспецифической гуморальной иммунной защиты завершается на 7-м году жизни, в результате чего заболеваемость респираторными вирусными инфекциями снижается.
Развитие вестибулярного анализатора в онтогенезе
Вестибулярный аппарат созревает у детей раньше, чем другие анализаторы, и у 6-месячного плода он развит почти также, как у взрослого. Возбудимость его существует с рождения и тренируется у ребенка при его укачивании. Новорожденный может определить положение тела во внешней среде. У детей вестибулярный аппарат более возбудим, чем у взрослых, возбудимость его возвращается к норме у девочек к 10-11 годам, у мальчиков — к 12-14 годам. При регулярных занятиях спортом адаптация наступает на 2-3 года раньше.
Проприорецепция в онтогенезе
Возбудимость проприорецепторов увеличивается с возрастом: наименьшая — у младших школьников, наибольшая — у старших. Ее повышение наблюдается также у школьников на уроках труда, физической культуры, занятиях в спортивных залах, наименьшая возбудимость отмечается на общеобразовательных уроках, во время подготовки к занятиям. Возбудимость проприорецепторов повышается в первой половине дня и снижается во второй. У старших школьников умственная деятельность (30-минутное чтение художественной литературы) повышает возбудимость проприорецепторов, а это, в свою очередь, приводит к последующему возрастанию умственной активности, т.е. работоспособности. [26]
Источник
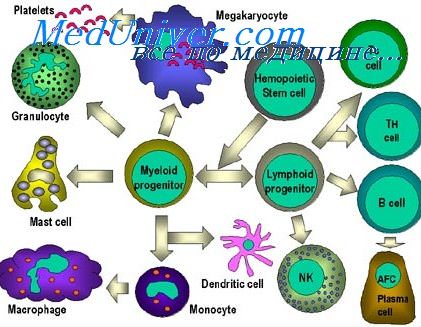
Клетки иммунной системы детей. Иммунная система детей в онтогенезеРодоначальницей всех клеток иммунной системы является кроветворная стволовая клетка, которая впервые появляется в желточном мешке, сообщающемся с кишечной полостью зародыша, а на более поздних стадиях развития переносится кровью в печень и селезенку, после чего навсегда поселяется в костном мозге [Prindull G., Prindull В., 1973]. В последние годы предложены морфологические критерии для дифференцировки Т- и В-лимфоцитов, с помощью которых выяснено, что в периферической крови количество Т-лимфоцитов колеблется в пределах 60—80% от общего количества лимфоидных клеток. Методом электронной микроскопии выяснено, что Т-лимфоциты богаты митохондриями и рибосомами, имеют микровыросты цитоплазмы, но в них никогда не образуется зернистая цитоплазматическая сеть. Электронно-микроскопически выявлено, что после антигенной стимуляции в В-лимфоцитах образуются полирибосомы и зернистая цитоплазматическая сеть, а зрелая плазматическая клетка (конечный результат генерации В-лимфоцита) имеет развитую сеть эргастоплазмы с расширенными цистернами. Наличие рецепторов (макромолекулярныс структуры клеточной поверхности, с помощью которых иммунокомпетентные клетки распознают антигены) на поверхностных мембранах свидетельствуют об активном функционировании Т- и В-лимфоцитов.
Макрофаги, или А-клетки (accessory — добавочные, или adherens — прилипающие), активно реагируют на чужеродные ткани, микроорганизмы, но неспецифически (вследствие физико-химических особенностей), в отличие от специфического распознавания лимфоцитами, и таким образом участвуют практически во всех иммунологических реакциях, поэтому можно говорить о «нсспецифичсском» и «специфическом» фагоцитозе. Макрофаги перерабатывают антиген для «предъявления» его Т- и В-лимфоцитам, и он может концентрироваться на их поверхности. Известно, что лимфоциты скапливаются вокруг макрофагов. Электронно-микроскопическн показаны контакт мембран этих клеток и образование между ними питоплазматических мостиков [Фаворская Ю. Н. и др., 1976]. В то же время высказаны предположения, что макрофаги участвуют во взаимодействии Т- и В-клсток на расстоянии, выделяя медиаторы [Erb P., 1975]. Таким образом, иммунный ответ на антигенную стимуляцию обеспечивается кооперированием трех типов зрелых Т-лимфоцитов, трех типов зрелых В-лимфоцитов и макрофагов [Петров Р. В., 1979]. Развитие и становление иммунной системы в онтогенезе происходит, по-видимому, в результате реализации генетической программы онтогенеза, но для окончательного созревания ее необходима внешняя или внутренняя стимуляция. Последняя может быть следствием развивающейся дифференцировки и гистогенеза плода. Первые лимфоциты появляются в тимусе на 9-й неделе внутриутробной жизни, а в селезенке вокруг центральных артерий — на 12—15-й неделе [August С, 1971]. После 20-й недели в аппендиксе наблюдается формирование фолликулов. Тимус закладывается на 2-м месяце внутриутробной жизни, лимфатические узлы — на 4-м, а формирование их стромы и синусов завершается в постнатальном периоде. Вопрос о самостоятельном синтезе антител плодом неоднократно обсуждался в связи с обнаружением в крови новорожденных антител, титры которых были выше соответствующих титров антител рожениц, и на основании морфологических данных. Уже на ранних стадиях развития плода среди лимфоцитов определяются Т- и В-клетки. Так, В-клетки, несущие на поверхности рецепторы IgM, IgG и IgA, выявляются в тканях 9-—12-недельного плода человека, а в 14-недельном возрасте содержание этих клеток в крови было равно уровню взрослых. Б. Б. Барышев (1980) обнаружил первые клетки с функцией Т-лимфоцитов в суспензии из тканей миндалин 13—14-недельного плода человека, а у 15—16-неделыюго плода их было 52,87%. — Также рекомендуем «Синтез иммуноглобулинов плодом. Иммунная реактивность иммунитета ребенка» Оглавление темы «Респираторные инфекции плода и новорожденного»: |
Источник
В отличие от системы специфического иммунитета факторы неспецифической защиты у новорожденных выражены хорошо. Они формируются раньше специфических и берут на себя основную функцию защиты организма плода и новорожденного. В околоплодных водах и в крови плода отмечается высокая активность лизоцима — неспецифического фактора защиты, которая сохраняется до рождения ребенка, а затем снижается. Способность к образованию интерферона сразу после рождения высока, на протяжении года она снижается, но с возрастом постепенно увеличивается и достигает максимума к 12—18 годам.
Новорожденный получает от матери значительное количество гамма- глобулинов. Такая неспецифическая защита оказывается достаточной при первоначальном столкновении организма с микрофлорой окружающей среды. К тому же у новорожденного отмечается физиологический лейкоцитоз — количество лейкоцитов в 2 раза выше, чем у взрослого; это естественная подготовка организма к новым условиям существования. Однако многочисленные лимфоциты новорожденных представлены незрелыми формами и не способны синтезировать необходимое количество глобулинов и интерферона. Фагоциты тоже недостаточно активны. В результате этого детский организм менее подготовлен к встрече с болезнетворными бактериями, чем с вирусами, и отвечает на проникновение микроорганизмов генерализованным воспалением. Иногда такую реакцию вызывают микроорганизмы, безопасные для взрослого. Специфические иммунные системы и механизмы иммунной памяти в организме новорожденного не сформированы, поэтому очень важно кормление материнским молоком, в котором содержатся иммунные вещества. В возрасте от 3 до 6 месяцев специфическая иммунная система ребенка уже реагирует на вторжение микроорганизмов, но иммунная память еще не сформирована.
Второй год жизни ребенка выделяется как «критический» период в развитии иммунитета. В этом возрасте расширяются возможности и повышается эффективность иммунных реакций, однако система местного иммунитета еще недостаточно развита и дети особенно чувствительны к респираторным вирусным инфекциям. В возрасте 5—6 лет более зрелыми и активными становятся механизмы неспецифического клеточного иммунитета. Формирование собственной системы неспецифической гуморальной иммунной защиты завершается на 7-м году жизни, в результате чего заболеваемость респираторными вирусными инфекциями снижается.
Замечено, что у детей, воспитывающихся в коллективах, быстрее формируются иммунные реакции. Это объясняется тем, что в коллективе ребенок подвергается скрытой иммунизации: попадание от заболевших детей в организм ребенка малых доз возбудителя не всегда вызывает у него заболевание, но активирует выработку антител. Если это повторяется несколько раз, то приобретается иммунитет к данному заболеванию. К 10 годам иммунные свойства организма хорошо выражены и в дальнейшем они держатся на относительно постоянном уровне и начинают снижаться после 40 лет. Важную роль в формировании иммунных реакций организма играют профилактические прививки.
У новорожденного красный костный мозг занимает все костномозговые полости. Первые жировые клетки желтого костного мозга появляются через 1—6 месяцев после рождения. После 4—5 лет красный костный мозг в диа- физах трубчатых костей начинает замещаться желтым. К 20—25 годам все костномозговые полости диафизов трубчатых костей полностью заполняются желтым костным мозгом, в плоских костях он составляет 50% объема костного мозга. В старческом возрасте костный мозг приобретает слизеподобную консистенцию и называется желатиновым костным мозгом.
Защитная активность миндалин формируется на протяжении всего детства и нередко проявляется в виде разрастания лимфоидной ткани — гипертрофии миндалин. Наибольшее количество лимфоидных узелков, выполняющих защитную роль, наблюдается до 16 лет. В возрасте 25—30 лет в миндалинах происходит разрастание соединительной ткани, и после 40 лет лимфоидные узелки в тканях миндалин встречаются редко.
Количество пейеровых бляшек по мере взросления постепенно снижается. В детском возрасте их около 50, в 16—17 лет — 33—37. После 40 лет их количество не более 20, а после 60 лет — 16. С возрастом в них уменьшается количество лимфоидной ткани и появляются прослойки из тонких пучков соединительнотканных волокон. Лимфоидная ткань аппендикса с возрастом также редуцируется, после 60 лет лимфоидные узелки в стенках аппендикса практически не встречаются.
Тимус у человека формируется на 6-й неделе внутриутробной жизни, развиваясь из двух сегментов, которые объединяются и образуют единый орган, состоящий из двух долей. Наибольших размеров по отношению к весу тела тимус человека достигает к моменту рождения (около 15 г). Затем он продолжает расти, хотя уже гораздо медленнее, и в период полового созревания достигает максимального веса (примерно 35 г) и размеров (около 75 мм в длину). После 16 лет масса тимуса постепенно уменьшается и составляет: в 20 лет — 25 г, в 35 лет — 22 г. Полностью лимфоидная ткань тимуса не исчезает даже в старческом возрасте (после 50 лет ее вес на уровне 13 г). В тимусе рано появляется жировая ткань. Если у новорожденного соединительная ткань в тимусе составляет всего 7%, то в 20 лет — 40%, после 50 лет — до 90%.
Источник
