Секреторные рецепторы врожденного иммунитета

Растворимые
рецепторы для патогенов. Это
белки крови, непосредственно связывающиеся
с различными консервативными,
повторяющимися углеводными или липидными
структурами микробной клетки
(pattern-структурами).
Эти белки обладают опсоническими
свойствами, некоторые из них активируют
комплемент.
Основную
часть растворимых рецепторов составляют
белки острой фазы. Концентрация этих
белков в крови быстро нарастает в ответ
на развитие воспаления при инфекции
или повреждении тканей. К белкам острой
фазы относятся:
• С-реактивный
белок (он составляет основную массу
белков острой фазы), получивший название
вследствие способности связываться с
фосфорилхолином (С-полисахаридом)
пневмококков. Образование комплекса
С-реактивный белок- фосфорилхолин
способствует фагоцитозу бактерий,
поскольку комплекс связывается с Clg и
активирует классический путь комплемента.
Белок синтезируется в печени, и его
концентрация быстро нарастает в ответ
на интерлейкин-б;
Липополисахарид-связывающий
белок (ЛСБ, англ. lipopolysaccharide binding protein,
LBP) — секретируемый белок, компонент
острой фазы воспаления, который связывает
с высокой афинностью бактериальный
липополисахарид и усиливает связывание
с ним CD14. Таким образом, ЛСБ обеспечивает
первый этап в процессе моноцитарного
иммунного ответа.
• сывороточный
амилоид Р близок по структуре и функции
к С-реактивному белку;
•
маннозосвязывающий
лектин активирует комплемент по
лектиновому пути, является одним из
представителей сывороточных
белков-коллектинов, распознающих
углеводные остатки и действующих как
опсонины. Синтезируется в печени;
• белки
сурфактанта легких также принадлежат
к семейству коллектинов. Обладают
опсоническим свойством, особенно в
отношении одноклеточного гриба Pneumocystis
carinii;
• другую
группу белков острой фазы составляют
белки, связывающие железо, — трансферрин,
гаптоглобин, гемопексин. Такие белки
препятствуют размножению бактерий,
нуждающихся в этом элементе.
9. Система комплемента
Комплемент
— система сывороточных белков и нескольких
белков клеточных мембран, выполняющих
3 важные функции: опсонизацию микроорганизмов
для дальнейшего их фагоцитоза, инициацию
сосудистых реакций воспаления и
перфорацию мембран бактериальных и
других клеток. Компоненты
комплемента обозначают
буквами латинского алфавита C, B и D с
добавлением арабской цифры (номер
компонента) и дополнительных строчных
букв. Компоненты классического пути
обозначают латинской буквой «С» и
арабскими цифрами (C1, C2 … C9), для
субкомпонентов комплемента и продуктов
расщепления к соответствующему
обозначению добавляют строчные латинские
буквы (C1q, C3b и т.д.). Активированные
компоненты выделяют чертой над литерой,
инактивированные компоненты — буквой
«i» (например, iC3b).
• Активация
комплемента В
норме, когда внутренняя среда организма
«стерильна» и патологического распада
собственных тканей не происходит,
уровень активности системы комплемента
невысок. При появлении во внутренней
среде микробных продуктов происходит
активация системы комплемента. Она
может происходить по трём путям:
альтернативному, классическому и
лектиновому.
—
Альтернативный путь активации. Его
инициируют непосредственно поверхностные
молекулы клеток микроорганизмов [факторы
альтернативного пути имеют буквенное
обозначение: P (пропердин), B и D].
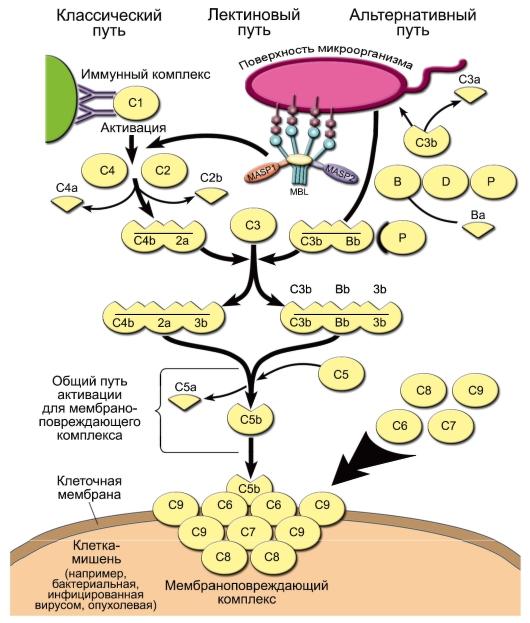
Из
всех белков системы комплемента в
сыворотке крови больше всего C3 — его
концентрация в норме составляет 1,2
мг/мл. При этом всегда имеется небольшой,
но значимый уровень спонтанного
расщепления C3 с образованием C3a и C3b.
Компонент C3b — опсонин, т.е. он способен
ковалентно связываться как с поверхностными
молекулами микроорганизмов, так и с
рецепторами на фагоцитах. Кроме того,
«осев» на поверхности клеток, C3b связывает
фактор В. Тот, в свою очередь, становится
субстратом для сывороточной сериновой
протеазы — фактора D, который расщепляет
его на фрагменты Ва и Bb. C3b и Bb образуют
на поверхности микроорганизма активный
комплекс, стабилизируемый пропердином
(фактор Р).
◊ Комплекс
C3b/Bb служит С3-конвертазой и значительно
повышает уровень расщепления С3 по
сравнению со спонтанным. Кроме того,
после связывания с C3 он расщепляет C5 до
фрагментов C5a и C5b. Малые фрагменты C5a
(наиболее сильный) и C3a — анафилатоксины
комплемента, т.е. медиаторы воспалительной
реакции. Они создают условия для миграции
фагоцитов в очаг воспаления, вызывают
дегрануляцию тучных клеток, сокращение
гладких мышц. C5a также вызывает повышение
экспрессии на фагоцитах CR1 и CR3.
◊ С
C5b начинается формирование «мембраноатакующего
комплекса», вызывающего перфорацию
мембраны клеток микроорганизмов и их
лизис. Сначала образуется комплекс
C5b/C6/ C7, встраивающийся в мембрану клетки.
Одна из субъединиц компонента C8 — C8b —
присоединяется к комплексу и катализирует
полимеризацию 10-16 молекул C9. Этот полимер
и формирует неспадающуюся пору в
мембране, имеющую диаметр около 10 нм. В
результате клетки становятся неспособными
поддерживать осмотический баланс и
лизируются.
—
Классический и лектиновый пути сходны
друг с другом и отличаются от альтернативного
способом активации C3. Главной C3конвертазой
классического и лектинового пути служит
комплекс C4b/C2a, в котором протеазной
активностью обладает C2a, а C4b ковалентно
связывается с поверхностью клеток
микроорганизмов. Примечательно, что
белок C2 гомологичен фактору В, даже их
гены расположены рядом в локусе MHC-III.
◊ При
активации по лектиновому пути один из
белков острой фазы — MBL — взаимодействует
с маннозой на поверхности клеток
микроорганизмов, а MBL-ассоциированная
сериновая протеаза (MASP
— Mannose-bindingprotein-Associated
Serine Protease) катализирует
активационное расщепление C4 и C2.
◊ Сериновой
протеазой классического пути служит
C1s, одна из субъединиц комплекса C1qr2s2.
Она активируется, когда по крайней мере
2 субъединицы C1q связываются с комплексом
антиген-антитело. Таким образом,
классический путь активации комплемента
связывает врождённый и адаптивный
иммунитет.
• Рецепторы
компонентов комплемента. Известно
5 типов рецепторов для компонентов
комплемента (CR — Complement
Receptor) на различных
клетках организма.
— CR1
экспрессирован на макрофагах, нейтрофилах
и эритроцитах. Он связывает C3b и C4b и при
наличии других стимулов к фагоцитозу
(связывания комплексов антиген-антитело
через FcyR или при воздействии ИФНу —
продукта активированных T-лимфоцитов)
оказывает пермиссивное действие на
фагоциты. CR1 эритроцитов через C4b и C3b
связывает растворимые иммунные комплексы
и доставляет их к макрофагам селезёнки
и печени, обеспечивая тем самым клиренс
крови от иммунных комплексов. При
нарушении этого механизма иммунные
комплексы выпадают в осадок — прежде
всего в базальных мембранах сосудов
клубочков почек (CR1 есть и на подоцитах
клубочков почек), приводя к развитию
гломерулонефрита.
— CR2
B-лимфоцитов связывает продукты деградации
C3 — C3d и iC3b. Это в 10 000-100 000 раз увеличивает
восприимчивость B-лимфоцита к своему
антигену. Эту же мембранную молекулу —
CR2 — использует в качестве своего рецептора
вирус Эпштейна-Барр — возбудитель
инфекционного мононуклеоза.
— CR3
и CR4 также связывают iC3b, который, как и
активная форма C3b, служит опсонином. В
случае если CR3 уже связался с растворимыми
полисахаридами типа бета-глюканов,
связывания iC3b с CR3 самого по себе
достаточно для стимуляции фагоцитоза.
— C5aR
состоит из семи доменов, пенетрирующих
мембрану клетки. Такая структура
характерна для рецепторов, связанных
с G-белками (белки, способные связывать
гуаниновые нуклеотиды, в том числе ГТФ).
• Защита
собственных клеток. Собственные
клетки организма защищены от деструктивных
воздействий активного комплемента
благодаря так называемым регуляторным
белкам системы комплемента.
— C1-ингибитор (C1inh)
разрушает связь C1q с C1r2s2, тем самым
ограничивая время, в течение которого
C1s катализирует активационное расщепление
C4 и C2. Кроме того, C1inh ограничивает
спонтанную активацию C1 в плазме крови.
При генетическом дефекте dinh развивается
наследственный ангионевротический
отёк. Его патогенез состоит в хронически
повышенной спонтанной активации системы
комплемента и избыточном накоплении
анафилактинов (C3a и С5а), вызывающих
отёки. Заболевание лечат заместительной
терапией препаратом dinh.
— C4-связывающий
белок —
C4BP (C4-Binding
Protein) связывает
C4b, предотвращая взаимодействие C4b и
С2а.
— DAF (Decay-Accelerating
Factor — фактор,
ускоряющий деградацию, CD55) ингибирует
конвертазы классического и альтернативного
путей активации комплемента, блокируя
формирование мембраноатакующего
комплекса.
— Фактор
H (растворимый)
вытесняет фактор В из комплекса с C3b.
— Фактор
I (сывороточная
протеаза) расщепляет C3b на C3dg и iC3b, а C4b
— на C4c и C4d.
— Мембранный
кофакторный белок MCP (Membrane
Cofactor Protein, CD46)
связывает C3b и C4b, делая их доступными
для фактора I.
— Протектин (CD59).
Связывается с C5b678 и предотвращает
последующее связывание и полимеризацию
С9, блокируя тем самым образование
мембраноатакующего комплекса. При
наследственном дефекте протектина или
DAF развивается пароксизмальная ночная
гемоглобинурия. У таких больных
эпизодически возникают приступы
внутрисосудистого лизиса собственных
эритроцитов активированным комплементом
и происходит экскреция гемоглобина
почками.
Соседние файлы в предмете Иммунология
- #
- #
Источник
Рецепторы врожденного иммунитета содержатся на так называемых профессиональных аитигенпредставляющих клетках, к которым относятся дендритные клетки, макрофаги и В-лимфоциты. При этом экспрессия таких рецепторов не является клональной. Это означает, что все рецепторные молекулы одного типа имеют идентичные свойства. Каждый клон иммунокомпетентных клеток несет антигенраспознающий рецептор уникальной структуры. Как только шаблонраспознающие рецепторы идентифицируют патогенсвязанный молекулярный шаблон, сразу же запускаются эффекторные механизмы, что объясняет высокую кинетику механизмов врожденной резистентности. Высокая скорость реагирования обусловлена совмещением распознающей клеткой функций клетки-эффектора (т.е, той клетки, которая непосредственно повреждает патоген). Например, макрофаг распознает патогенсвязанный молекулярный шаблон, благодаря чему активируется и мгновенно производит фагоцитоз распознанного патогена.
Функционально рецепторы шаблонного распознавания разделены на три класса: секреторные, клеточные и сигнальные.
Опсонины
Секреторные шаблонраспознающие рецепторы функционируют в качестве опсонинов, связываясь с микробными шаблонами и помечая их для последующего распознавания системой комплемента или фагоцитами. Следует отметить, что опсонинами называют своеобразные биологические «метки», которые, фиксируясь на различных объектах, облегчают их распознавание факторами врожденной резистентности. Наиболее известный секреторный рецептор шаблонного распознавания — маннозосвязывающий лектин (лектин — это белок, способный связывать углеводы), который синтезируется в печени и циркулирует в плазме крови в поиске патогенов. Этот белок относится к кальцийзависимому семейству лектинов и функционирует как компонент так называемой острофазовой реакции.
Рецепторы фагоцитов
Клеточные шаблонраспознающие рецепторы находятся на поверхности фагоцитов. Если такие рецепторы распознают патогенсвязанный молекулярный шаблон на микробной клетке, то они инициируют захват фагоцитом носителя такой шаблонной молекулы с формированием специфической эндоцитарной вакуоли — фагосомы. В последующем фагосома сливается с лизосомой с образованием фаголизосомы, где и происходит деструкция патогена. В результате расщепления захваченного объекта пептиды патогена представляются в составе молекулы главного комплекса гистосовместимости (HLA) II класса на поверхности макрофага (либо другой антигенпредставляющей клетки) для распознавания специфическими рецепторами иммунокомпетентных клеток.
Маннозосвязывающий лектин макрофага является его клеточным шаблонраспознающим рецептором. Этот белок распознает углеводы с высоким содержанием манноз, что характерно для поверхностных структур микроорганизмов, и обеспечивает их фагоцитоз макрофагами. Другой клеточный шаблонраспознающий рецептор макрофагов — фагоцитарный рецептор к липополисахаридам (рЛПС) — связывается со стенками бактериальных клеток, обильно содержащих липополисахаридные субстанции. В частности, этот рецептор используется селезеночными и печеночными макрофагами для удаления микробных клеток из кровотока.
Toll-like-рецепторы (TLR)
Сигнальные шаблонраспознающие рецепторы при взаимодействии с шаблонами активируют внутриклеточные молекулярные каскады, стимулирующие экспрессию многих генов иммунного ответа, кодирующих структуру провоспалительных субстанций. К этой группе относятся Toll-like-рецепторы (TLR). Расшифрован сигнальным путь, запускающийся такими рецепторами при распознавании микробных липополисахаридов (рис. 1). Сегодня известно 14 разновидностей TLR антигенпрезентирующих клеток, способных распознавать шаблонные структуры микроорганизмов (бактерий, вирусов, грибков), простейших, растений и даже собственного организма (табл. 1).
Цитоплазматический каскад, включаемый активированным TLR, может разворачиваться как по MyD88-зависимому (см. рис. 1), так и по MyD88-независимому пути. MyD88 является белком, адаптирующим различные TLR к идентичному цитоплазматическому молекулярному каскаду, в связи с чем получил название белка-адаптера. В первом случае (TLR1, TLR2, TLR4, TLR5, TLR6, TLR7, TLR9) конечным результатом реализации каскада является высвобождение мощного провоспалительного посредника — нуклеарного фактора кВ, который обеспечивает синтез до иммунных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-12), стресс-белков, костимулируютцих молекул (CD80, CD86, CD40), хемокинов (в частности, ИЛ-8), антиапоптотических белков. При реализации MyD88-зависимого пути (TLR3 и TLR4) конечным результатом является синтез α / β -ИФН и костимулирующих молекул.
Таким образом, уже на уровне системы врожденной резистентности имеет место дифференциальный подход к типу ответа при разных формах патогенов. Так, при внеклеточных патогенах (бактерии) реализуется MyD88-зависимый путь активации клетки, а при внутриклеточной инфекции (вирусы) — MyD88- независимый.
Рецептор | Молекулярный шаблон | Носитель шаблона |
TLR1 | Триацил, липопептиды, растворимые факторы | Бактерии, в частности микобактерии и Neisseria meningitidis |
TLR2 | Липопротеины — липопептиды | Разнообразные патогены |
Пептидогликаны, липотейхоевые кислоты | Гр+бактерии | |
Липоарабиноманнан, фенолрастворимый модулин | Микобактерии, Staphylococcus epidermidis | |
Гликоинозитолфосфолипиды Порины | Trypanosoma cruzi Neisseria | |
Атипичные липополисахариды Зимозан | Leptospira interrogans, Porphyromonas gingivalis Грибки | |
Белки теплового шока 70 кД | Макроорганизм | |
TLR3 | Двухспиральная РНК | Вирусы |
TLR4 | Липополисахариды Таксол | Гр-бактерии Растения |
Fusion-белок Envelope-протеин Белок теплового шока 60 кД | Респираторно-синцитиальный вирус Вирус опухоли молочной железы Chlamydia pneumonia | |
Белок теплового шока 70 кД Фибронектин тип III Гиалуроновая кислота | Макроорганизм Материал с сайта https://wiki-med.com | |
Гепаран сульфат Фибриноген | Макроорганизм | |
TLR5 | Флагеллин | Бактерии |
TLR6 | Диациллипопептиды Липотейхоевые кислоты Зимозан | Микоплазмы Гр+бактерии Грибки |
TLR7 | Односпиральная РНК | Вирусы |
TLR8 | Односпиральная РНК | Вирусы |
TLR9 | CpG (цитозин — гуанозин фосфат), содержащие ДНК | Бактерии и вирусы |
TLR10 | Не установлены | Не установлены |
TLR11 | Не установлены | Уро патогенные бактерии |
 На этой странице материал по темам:
На этой странице материал по темам:
иммунология рецепторы фагоцитов
рецепторы в иммунитете это
рецепторы к рамр
система врожденного иммунитета физиология toll рецепторы
презентация tlr-рецепторы
Источник

ТОП 10:
Распознающие рецепторы врожденного иммунитета
Активация врожденного иммунитета начинается с распознавания антигенных структур с помощью многочисленных рецепторов.
Таблица Распознавание в системе врожденного иммунитета
| Мембранные рецепторы (передают сигнал внутрь клетки) | Toll – подобные (TRL1-10) C -лектиновые Рецепторы-мусорщики (Skavender-рецепторы) Интегриновые |
| Внутриклеточные (цитозольные) | NOD RID DAI |
| Секретируемые | Пентаксины Коллектины Компоненты системы комплемента Фиколины |
Особую группу рецепторов врожденного иммунитета составляют паттерн-распознающие рецепторы (patern recognition recepror – PRR). К ним относятся Toll , NOD , RID – рецепторы. Эти рецепторы распознают общие для многих типов микроорганизмов структуры – липополисахариды, пептидогликаны, флагеллин.
Toll – рецепторы имеют на своей поверхности различные клетки иммунной системы – моноциты, макрофаги, дендритные клетки, нейтрофилы, лимфоциты, а также другие клетки организма – фибробласты, эпителиальные, эндотелиальные клетки. В настоящее время у человека идентифицировано 10 Toll – подобных рецепторов.
Таблица. Toll -подобные рецепторы (TLR) человека и их лиганды
| TLR | Лиганды | Патогены |
| TLR1 | Липопептиды | Грамотрицательные бакетрии, микобактерии |
| TLR2 | Пептидогликан, липотейхоевые кислоты | Грамположительные бактерии, грибы |
| TLR3 | Двухцепочные РНК | Вирусы |
| TLR4 | Липополисахарид | Грамотрицательные бактерии |
| TLR5 | Флагеллин | Бактерии |
| TLR6 | Диациллипопептиды, липотейхоевые кислоты | Микобактерии, грамположительные бактерии, грибы |
| TLR7 | Одноцепочечные РНК | Вирусы |
Таблица. Toll -подобные рецепторы, расположенные на клетках иммунной системы
| Клетки иммунной системы | Toll — рецепторы |
| Нейтрофилы | TLR1,2,4,5,6,7,8,9,10 |
| Моноциты/макрофаги | TLR1,2,4,5,6,7,8 |
| Дендритные клетки | TLR1,2,4,5,6,8,10 |
| В-лимфоциты | TLR1,3,6,7,9,10 |
| Т-лимфоциты (Th1/Th2) | TLR2,3,5,9 |
| Т-лимфоциты (регуляторные) | TLR2,5,8 |
Экспрессия Toll – рецепторов обеспечивает важную связь между врожденным и адаптивным иммунитетом, поскольку их активация приводит к превращению фагоцитов в эффективные антигенпрезентирующие клетки. Экспрессия большинства Toll – рецепторов увеличивается при действии провоспалительных цитокинов.
NOD – рецепторы распознают вещества, которые образуются при повреждении клеток организма (АТФ, кристаллы мочевой кислоты) и вызывают развитие воспалительного процесса. NOD – рецепторы имеются на макрофагах, дендритных клетках, эпителии слизистых оболочек.
Особую группу представляют рецепторы, повышающие эффективность фагоцитоза. К ним относятся рецепторы к С3-компоненту комплемента и Fc -фрагменту иммуноглобулинов. Антиген в комплексе с антителом захватывается клетками врожденного иммунитета через Fc-рецепторы, которые взаимодействуют с Fc-фрагментом иммуноглобулинов. Фагоцитоз опсонизированного объекта (покрытого антителом) в сотни раз более эффективен, чем фагоцитоз свободного объекта.
Гуморальные факторы врожденного иммунитета
Гуморальные факторы врожденного иммунитета – это белки, присутствующие в сыворотке крови, секретах слизистых оболочек, которые синтезируются клетками иммунной системы и могут оказывать бактерицидное, опсонизирующее и т.д. действие на организмы.
Система комплемента
Комплемент – система сывороточных белов крови, каскадная активация которых приводит к лизису бактерий, собственных клеток, инфицированных внутриклеточными паразитами, разрушению иммунных комплексов.
Состоит более, чем из 20 инертных белков сыворотки, 9 из которых являются основными и обозначаются как С1, С2 и т.д. — С9. Формирование комплемента в единое целое или его активация происходит при внедрении в организм чужеродных антигенов.
Комплемент может активироваться двумя путями: классическим и альтернативным.
Противомикробные пептиды
Противомикробные пептиды – катионные белка, способные поражать вирусы, грибы, простейшие. Синтезируются нейтрофилами и эпителиальными клетками при взаимодействии их Toll – рецепторов с антигеном. Осуществляют мгновенный иммунитет. Часто их называют эндогенными антибиотиками. Различают 2 основных вида – дефенсины и кателицидины.
Механизм действия: противомикробные пептиды разрушают наружные мембраны микроорганизмов. Мембраны бактериальных клеток заряжены отрицательно, а пептиды положительно. Разность зарядов обеспечивает их взаимодействие. Катионные белки встраиваются в мембрану микробной клетки, образуя поры. Бактериальная клетка теряет ионы калия, аминокислоты. Внутрь клетки поступает вода, обеспечивая ее гибель.
Белки острой фазы продуцируются моноцитами, макрофагами, фибробластами. Синтез белков острой фазы существенно повышается в ответ на инфекцию.
С-реактивный белок ( CRB ) связывается с поверхностью бактерий, активирует систему комплемента. При бактериальной инфекции увеличивается в 100 раз.
Маннозосвязывающий лектин активирует систему комплемента по лектиновому пути.
Сывороточный амилоид А выступает в роли хемоаттрактанта.
Фибриноген выступает как опсонин
Лизоцим – фермент, содержащийся в отделяемом слизистых оболочек глаз, ротовой полости, носоглотки, грудном молоке. Вырабатывается моноцитами крови и тканевыми макрофагами. Разрушает пептидогликаны клеточных стенок бактерий.
Фагоцитоз
Фагоцитоз – это активное распознавание и поглощение микроорганизмов фагоцитирующими клетками с их последующей инактивацией и перевариванием. Фагоцитоз – самый древний вид защиты, унаследованный нами в ходе эволюции. Выраженной фагоцитарной активностью обладают нейтрофилы, моноциты и макрофаги.
Нейтрофилы происходят от стволовой клетки костного мозга. Это короткоживущие неделящиеся клетки с сегментированным ядром и набором гранул, содержащих большое количество бактерицидных веществ. Их время жизни составляет 2-3 суток. Нейтрофилы являются основными клетками, осуществляющими уничтожение внеклеточных микроорганизмов.
Макрофаги образуются из стволовой клетки красного костного мозга, на территории которого дифференцируются до стадии моноцита. Моноциты попадают в ток крови и расселяются по тканям, превращаясь в тканевые макрофаги, где функционируют в течение недель или месяцев. Для них характерно изобилие гранул, близких по составу к содержимому гранул нейтрофилов.
Их функциями является поглощение и уничтожение внедрившихся микроорганизмов (в основном внутриклеточных), а также поврежденных, дегенерированных, вирусинфицированных и опухолевых клеток и образующихся иммунных комплексов. Это клетки — «мусорщики».
Нейтрофилы осуществляют основную защиту от пиогенных (внеклеточных) бактерий, макрофаги – от внутриклеточных паразитов (вирусы, грибы, простейшие).
Нейтрофилы – это основные участники острого воспаления, макрофаги – хронического, они способны стимулировать образование гранулем.
Функции фагоцитов:
n Фагоцитарная – захват и внутриклеточное переваривание микроорганизмов.
n Антигенпрезентирующая – презентация антигена Т-лимфоцитам в комплексе с молекулами главного комплекса гистосовместимости (HLA). Этой функцией обладают антигенпрезентирующие макрофаги.
n Секреторно-регуляторная – синтез и секреция некоторых белков системы комплемента, отдельных цитокинов, лизоцима, белков системы свертывания крови.
n Цитотоксическое действие фагоцитов.
Связывание патогена с фагоцитом может быть прямым и опосредованным. Прямое распознавание происходит с участием Toll-рецепторов. При опосредованном распознается опсонизированный объект, покрытый антителами или C3b – компонентом комплемента.
Хемотаксис
Для того, чтобы процесс фагоцитоза произошел, необходимо сближение фагоцитирующих клеток с антигеном, который вызвал повреждение. Для этого нейтрофилы должны покинуть кровеносное русло, поскольку очаги внедрения антигена чаще имеют тканевую локализацию. Это возможно благодаря хемотаксису. Хемотаксис – движение фагоцитов по концентрационному градиенту химических веществ – хемоаттрактантов. В роли хемоаттрактантов для нейтрофилов выступают продукты жизнедеятельности бактерий, белки системы комплемента, цитокины и.т.д.
Основными хемоаттрактантами для макрофагов являются гамма-интерферон, хемотаксический макрофагальный фактор.
Адгезия – прилипание
Начинается с адгезии (прилипания) микробной частицы к поверхности фагоцита. Процесс поглощения идет эффективнее, если микробные клетки опсонизированы, то есть покрыты белками системы комплемента и специфическими антителами класса IgG. Особенно важно это для бактерий, имеющих капсулу (пневмококк, менингококк, кишечная палочка, гемофильная палочка и т.д.)
Эндоцитоз (поглощение)
Участок мембраны фагоцита в месте контакта с объектом уплотняется, вытягивается и надвигается на объект подобно механизму застежки «молния» до тех пор пока объект не будет полностью поглощен в фагосому.
Дегрануляция
Цитоплазматические гранулы фагоцитирующих клеток сливаются с фагосомой и образуется фаголизосома, в которой происходит киллинг и разрушение захваченной микробной частицы с помощью антимикробных факторов. Антимикробные системы делятся на те, которые требуют кислород – кислородзависимые и те, которые не требуют кислород – кислороднезависимые.
Кислородзависимые факторы (активные формы кислорода) образуются в ходе респираторного взрыва, представляющего собой каскад окислительных реакций.
Включают:
n супероксидный анион (О2-)
n перекись водорода (Н2О2)
n синглетный кислород (О2)
n гидроксильный радикал (ОН˙)
n оксид азота (NO)
Активные формы кислорода являются очень мощными окислителями, вызывают повреждение липидов, белков, ДНК мироорганизмов, оказывают летальное действие на биологические системы.
К кислороднезависимой группе бактерицидных факторов относятся лизоцим, некоторые протеолитические ферменты, лактоферрин, катионные белки, дефенсины.
Лактоферрин – связывает железо, предотвращает рост и размножение бактерий.
Катионные белки – вызывают повреждение клеточных мембран, лизируют бактериальные клетки.
Дефенсины – встраиваются в липидный слой клеток, нарушают ее проницаемость, обладают летальным действием на широкий спектр бактерий, грибов, вирусов.
Экзоцитоз – удаление продуктов разрушения
Распознающие рецепторы врожденного иммунитета
Активация врожденного иммунитета начинается с распознавания антигенных структур с помощью многочисленных рецепторов.
Таблица Распознавание в системе врожденного иммунитета
| Мембранные рецепторы (передают сигнал внутрь клетки) | Toll – подобные (TRL1-10) C -лектиновые Рецепторы-мусорщики (Skavender-рецепторы) Интегриновые |
| Внутриклеточные (цитозольные) | NOD RID DAI |
| Секретируемые | Пентаксины Коллектины Компоненты системы комплемента Фиколины |
Особую группу рецепторов врожденного иммунитета составляют паттерн-распознающие рецепторы (patern recognition recepror – PRR). К ним относятся Toll , NOD , RID – рецепторы. Эти рецепторы распознают общие для многих типов микроорганизмов структуры – липополисахариды, пептидогликаны, флагеллин.
Toll – рецепторы имеют на своей поверхности различные клетки иммунной системы – моноциты, макрофаги, дендритные клетки, нейтрофилы, лимфоциты, а также другие клетки организма – фибробласты, эпителиальные, эндотелиальные клетки. В настоящее время у человека идентифицировано 10 Toll – подобных рецепторов.
Таблица. Toll -подобные рецепторы (TLR) человека и их лиганды
| TLR | Лиганды | Патогены |
| TLR1 | Липопептиды | Грамотрицательные бакетрии, микобактерии |
| TLR2 | Пептидогликан, липотейхоевые кислоты | Грамположительные бактерии, грибы |
| TLR3 | Двухцепочные РНК | Вирусы |
| TLR4 | Липополисахарид | Грамотрицательные бактерии |
| TLR5 | Флагеллин | Бактерии |
| TLR6 | Диациллипопептиды, липотейхоевые кислоты | Микобактерии, грамположительные бактерии, грибы |
| TLR7 | Одноцепочечные РНК | Вирусы |
Таблица. Toll -подобные рецепторы, расположенные на клетках иммунной системы
| Клетки иммунной системы | Toll — рецепторы |
| Нейтрофилы | TLR1,2,4,5,6,7,8,9,10 |
| Моноциты/макрофаги | TLR1,2,4,5,6,7,8 |
| Дендритные клетки | TLR1,2,4,5,6,8,10 |
| В-лимфоциты | TLR1,3,6,7,9,10 |
| Т-лимфоциты (Th1/Th2) | TLR2,3,5,9 |
| Т-лимфоциты (регуляторные) | TLR2,5,8 |
Экспрессия Toll – рецепторов обеспечивает важную связь между врожденным и адаптивным иммунитетом, поскольку их активация приводит к превращению фагоцитов в эффективные антигенпрезентирующие клетки. Экспрессия большинства Toll – рецепторов увеличивается при действии провоспалительных цитокинов.
NOD – рецепторы распознают вещества, которые образуются при повреждении клеток организма (АТФ, кристаллы мочевой кислоты) и вызывают развитие воспалительного процесса. NOD – рецепторы имеются на макрофагах, дендритных клетках, эпителии слизистых оболочек.
Особую группу представляют рецепторы, повышающие эффективность фагоцитоза. К ним относятся рецепторы к С3-компоненту комплемента и Fc -фрагменту иммуноглобулинов. Антиген в комплексе с антителом захватывается клетками врожденного иммунитета через Fc-рецепторы, которые взаимодействуют с Fc-фрагментом иммуноглобулинов. Фагоцитоз опсонизированного объекта (покрытого антителом) в сотни раз более эффективен, чем фагоцитоз свободного объекта.
Источник
