Симптом глаза тигра в мрт причина
Нейродегенерация с отложением железа в мозге или Болезнь Галлервордена — Шпатца — очень редкое нейродегенеративное заболевание, сопровождающееся отложением железа в базальных ганглиях (в бледном шаре и в чёрной субстанции). Это аутосомно-рециссивно наследуемое заболевание было впервые описано в 1922 году Юлиусом Галлеворденом и Гуго Шпатцем. Частота заболевания в среднем 1-3 человека на 1 миллион.
Патогенез[править | править код]
У большинства пациентов, особенно при ранней манифестации заболевания, определяются мутации в кодируемом фермент пантотенкиназу (PANK2) гене, в хромосоме 20p13. Этот фермент играет решающую роль в биосинтезе кофермента-А. Дефект фермента ведет к накоплению цистеина, который в присутствии железа (что означает — в особенности в области чёрного вещества и базальных ганглиев) ведет к повышению свободных радикалов и способствует оксидатному повреждению мозга. Процесс в целом приводит к отложению железа и нейромеланина.
Протекание заболевания[править | править код]
Обычное начало заболевания в детском возрасте, иногда с выраженной симптоматикой уже на первом году жизни. Редко возможна манифестация во взрослом возрасте. Сначала возникают экстрапирамидные моторные нарушения, в особенности нарушения ходьбы с тенденцией к падениям или дистонией ног, реже — психические нарушения. В дальнейшем — нарушения движений (дистонии, хореоатетоз, тремор) с ригидностью затылочной мускулатуры, гиперрефлексией и нарушениями психики (как правило, расстройство интеллекта в виде прогрессирующей деменции). Также обнаруживаются дизартрия и дисфагия. Можно обнаружить пигментацию сетчатки или атрофию зрительного нерва[2]. У взрослых преобладает синдром паркинсонизма-плюс — с деменцией, гиперрефлексией и проминентной дистонией.
Течение заболевания прогрессивно, неврологическое состояние пациентов ухудшается постепенно.
Смерть наступает обычно в возрасте до 30 лет, в состоянии полного психического распада личности.
Дополнительная диагностика[править | править код]
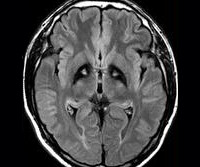
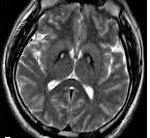
Необходимо биохимическое исключение болезни Вильсона-Коновалова, факультативно — исключение нейроакантоцитоза, прежде всего с помощью МРТ. В МРТ в Т2- взвешенных изображениях являются типичными — обусловленные отложением железа — гипоинтенсивные очаги в бледном шаре, с центральным очагом гиперинтенсивности — так называемые «глаза тигра». Этот симптом обнаруживается у всех больных с PANK2-мутациями. В генетическом обследовании могут обнаруживаться мутации в PANK2-гене. Тем не менее, уверенно можно говорить о диагнозе только после патологоанатомического исследования.
Лечение[править | править код]
Каузальная (этиологическая) терапия неизвестна. Были попытки лечения энзимного дефекта. Хелаторы («ловушки») железа, такие как Дефероксамин, не оказывают эффекта, тем не менее, с 2007 года проводятся попытки проводить лечение хелатором железа Феррипрокс (Деферипрон®). В экспериментах на животных глубокая стимуляция мозга приводила к усилению дистоний и гиперкинезов. Гипокинезия может лечиться Леводопой, гиперкинезы — антихолинэргиками. Тем не менее, эффект Леводопы у пациентов с мутацией гена PANK2 очень сомнителен.
Для мышечной релаксации и купирования болевого синдрома часто назначается Баклофен или бензодиазепины.
Название заболевания[править | править код]
Из-за связей Юлиуса Галлервордена с программой эвтаназии в фашистской Германии было предложено называть заболевание «нейродегенерация с отложением железа в мозге 1» (англ. neurodegeneration with brain iron accumulation 1). В мире распространено сокращённое название заболевания как «NBIA1».
Примечания[править | править код]
Литература[править | править код]
- Hochspringen ↑ Zhou u.a.: A novel pantothenate kinase gene (PANK2) is defective in Hallervorden-Spatz syndrome. in: Nature genetics (Nat Genet.). New York 28.2001,4 (Aug), 345—349. PMID 11479594 ISSN 1061-4036
- Hochspringen ↑ PKAN-Artikel bei genereviews von Gregory/Hayflick, revidierte Version Jan. 2008
- Hochspringen ↑ M. Shevell: Hallervorden and history. in: The New England journal of medicine (N Engl J Med.). Waltham Mass 2.2003,1 (Jan),348,3-4. PMID 12510036 ISSN 0028-4793
Источник
Болезнь Галлервордена-Шпатца — нейродегенеративная наследственная патология, обусловленная отложением железа в базальных ганглиях головного мозга. Проявляется синдромом паркинсонизма, нарушениями интеллектуальной сферы и психики, гиперкинезами, зрительными расстройствами. Основное диагностическое значение имеет обнаружение рисунка «глаз тигра» в зоне бледного шара при проведении МРТ церебральных структур. Лечение симптоматическое: агонисты дофамина, вальпроаты, антиконвульсанты, нейролептики, антидепрессанты. Прогноз неблагоприятный.
Общие сведения
Болезнь Галлервордена-Шпатца описана в 1922 г. немецкими морфологами, в честь которых и получила свое название. К наиболее типичным клиническим маркерам данной патологии относят гиперкинезы, синдром паркинсонизма, интеллектуальное снижение, атрофию зрительных нервов, пигментную ретинопатию. Болезнь Галлервордена-Шпатца встречается крайне редко. В зависимости от времени ее манифестации различают детскую, ювенильную (подростковую) и взрослую формы. Ранее заболевание диагностировалось лишь посмертно по данным аутопсии. После внедрения в практическую неврологию МРТ стала возможна прижизненная постановка диагноза. Прорыв в изучении этиологии был сделан в 2001 г., когда было установлено, что в основе заболевания лежит генетический дефект, обуславливающий нарушения в синтезе фермента пантотенаткиназы. После этого болезнь Галлервордена-Шпатца была официально переименована в пантотенаткиназа-ассоциированную нейродегенерацию.

Болезнь Галлервордена-Шпатца
Причины болезни Галлервордена-Шпатца
Болезнь Галлервордена-Шпатца является генетической патологией, носящей как семейный, так и спорадический характер, передающейся по наследству аутосомно-рецессивным путем. Генетическим субстратом выступают аберрации в гене пантотенаткиназы (локус 20р12.3–р13 20-й хромосомы). Всего известно более 50 мутаций. Результатом генетического дефекта является уменьшение продукции пантотенаткиназы, что ведет к аккумуляции в базальных структурах цистеина. Последний образует устойчивые химические соединения с ионами железа, которые неблагоприятно воздействуют на белки и запускают процесс перекисного окисления, приводящий к апоптозу нейронов. На месте некротизированных нейронов происходит разрастание глиальной ткани.
Описанный патологический процесс затрагивает преимущественно бледный шар и черное вещество (субстанцию nigra), где морфологически обнаруживаются внеклеточные отложения железа, имеющие коричневую пигментацию. Кроме этого, имеют место сфероидные периаксональные образования, расположенные в белом церебральном веществе, коре мозга, спинном мозге и периферических нервных стволах.
Симптомы болезни Галлервордена-Шпатца
Классическим вариантом болезни Галлервордена-Шпатца считается ранняя детская форма с клинической манифестацией в период от 4 до 10 лет (обычно после 5-летнего возраста). В 90% случаев первым признаком заболевания выступает торсионная дистония, затрагивающая мышцы ног. Ведущей жалобой является затруднение ходьбы. Затем, как правило, происходит генерализация процесса с его распространением на мышцы глотки, лица, туловища. Наряду с генерализованными вариантами могут отмечаться мультифокальный или сегментарный тип дистонии. Наиболее часто наблюдается писчий спазм, блефароспазм, лицевой параспазм, спастическая кривошея. У трети пациентов отмечаются признаки паркинсонизма: мышечная ригидность и гипокинезия. В ряде случаев имеют место эпилептические приступы.
Болезнь Галлервордена-Шпатца характеризуется когнитивными расстройствами в виде снижения внимательности и памяти с постепенным развитием олигофрении; психическими изменениями с преобладанием агрессивности и асоциального поведения. Отмечается дизартрия. У большинства больных имеются нарушения остроты зрения. В 68% случаев они обусловлены атрофией зрительных нервов, в 29% случаев — пигментной ретинопатией. Для детской формы болезни Галлервордена-Шпатца типично быстрое прогрессирование с полной потерей в течение 10-15 лет способности к передвижению.
Подростковый вариант болезни Галлервордена-Шпатца проявляется в возрасте от 10 до 18 лет и характеризуется более замедленным течением. Дебютирует проявлениями фокальной торсионной дистонии, наиболее часто в мышцах конечностей или ортомандибулярной области. Сопровождается психическими, интеллектуальными и поведенческими расстройствами.
Взрослая форма болезни Галлервордена-Шпатца дебютирует после 18-летнего возраста. У большинства больных протекает в виде синдрома паркинсонизма. Характерно обеднение активных движений (гипокинезия), генерализованная ригидность мышц (симптом «зубчатого колеса»), постуральный тремор и неустойчивость (атаксия). Оценка последней возможна при помощи пробы Тавенарда — попыток вывести пациента из состояния равновесия в положении стоя, путем подталкивания его за плечи вперед и в стороны. Главной особенностью является сочетание паркинсонизма с различными гиперкинезами (миоклониями, фокальной торсионной дистонией, атетозом, гемибализмом). Степень нарушения когнитивных функций может варьировать от полной сохранности до прогрессирующей деменции. Возможны эмоциональная лабильность, депрессия, агрессивность, эпиприступы.
Диагностика болезни Галлервордена-Шпатца
Благодаря полиморфизму симптоматики, постановка диагноза болезни Галлервордена-Шпатца представляет трудную задачу для неврологов. Основными критериями заболевания считаются дебют в возрасте до 30 лет, экстрапирамидные расстройства, неуклонное прогрессирование симптомов, наличие типичной МРТ-картины. К дополнительным признакам отнесены наличие пирамидных знаков, прогрессирующее интеллектуальное снижение, эпиприступы, атрофия зрительных нервов, пигментная атрофия сетчатки, аутосомное наследование по рецессивному типу.
В диагностике опираются на данные неврологического статуса и электроэнцефалографии. При нарушении зрения проводят консультацию офтальмолога, визиометрию, офтальмоскопию. Определение типа наследования осуществляет генетик путем составления генеалогического древа. Возможна ДНК-диагностика (поиск мутаций в гене пантотенаткиназы). При проведении ПЭТ головного мозга удается выявить сниженный метаболизм в зоне паллидума. Основанием для исключения болезни Галлервордена-Шпатца является наличие симптомов другой патологии, в рамки которой может укладываться имеющаяся клиническая картина: болезни Вильсона, хореи Гентингтона, нейроакантоцитоза, болезни Мачадо-Джозефа.
Основополагающим методом диагностики болезни Галлервордена-Шпатца выступает МРТ. Во всех типичных вариантах патологии в режиме Т2 на МРТ головного мозга определяется расположенная в области бледного шара гиперинтенсивная зона овальной формы, окруженная еще большей гипоинтенсивной зоной. Подобная МРТ-картина является патогномоничной и получила название «глаз тигра». Гипоинтенсивная зона представляет собой «глаз», а гиперинтенсивная — его «зрачок». Время появления этого признака на томограммах пока дискутируется. По мнению одних авторов «глаз тигра» может появляться еще до клинической манифестации болезни, по мнению других — через несколько лет от дебюта клинических симптомов.
Лечение и прогноз болезни Галлервордена-Шпатца
В настоящее время болезнь Галлервордена-Шпатца не имеет эффективных методов лечения. Попытки терапии препятствующими накоплению железа хелатными соединениями (дефероксамином) и антиоксидантами не имели успеха. В связи с этим применяется симптоматическое лечение. Синдром паркинсонизма служит показанием к назначению дофаминовых агонистов (пирибедила, прамипексола) или производных амантадина. Однако при данном заболевании он, как правило, резистентен к проводимому лечению.
При гиперкинезах применяют вальпроаты, бензодиазепины (диазепам, клоназепам). При спастике рекомендованы миорелаксанты (баклофен, толперизона гидрохлорид), при эпиприступах — топирамат или вальпроаты, при когнитивных расстройствах — ипидакрин и холина альфосцерат, при психических отклонениях — нейролептики (рисперидон, кветиапин, клоназепам), антидепрессанты 3-го поколения (венлафаксин, циталопрам, дапоксетин).
Симптоматическая терапия болезни Галлервордена-Шпатца позволяет уменьшить проявленность клинических симптомов, продлить способность пациентов к самообслуживанию. Вместе с тем продолжается разработка новых способов лечения. Исследуется эффективность применения пантотеновой кислоты. Получены данные о положительном влиянии на течение заболевания магнитной стимуляции бледного шара.
Прогноз зависит от формы заболевания. Наиболее неблагоприятное течение имеет ранняя форма, при которой полная инвалидизация наступает в промежутке от 10 до 15 лет с момента дебюта симптомов. Более благоприятен взрослый вариант, особенно в случаях, когда деменция слабо выражена. Его средняя продолжительность составляет более 20 лет.
Источник
Сегодня мы поговорим о двух редких нейродегенеративных заболеваниях – болезни Пика и болезни Галлервордена-Шпатца. Оба недуга названы в честь своих первооткрывателей, каждый из которых прожил сложную, но насыщенную жизнь.
Болезнь Пика – редкое хроническое прогрессирующее заболевание центральной нервной системы. Названа в честь Арнольда Пика (Arnold Pick), профессора психиатрии Карлова университета в Праге. Как и многие медицинские исследователи того времени, в самом начале своего пути он изучал широкий спектр дисциплин: клиническую неврологию, психиатрию и невропатологию, что в настоящее время довольно трудно представить. Современники говорили о нем, как об умном, скромном и принципиальном человеке, который внес существенный вклад в области психиатрии и неврологии: более 350 публикаций на немецком и английском языках тому подтверждение.
Во время своей работы в Карловом университете он столкнулся со множеством проблем, связанными с академическим преподаванием на немецком и чешском языках под контролем Австро-Венгерской империи. Зачастую ученому не хватало элементарных рабочих средств, он сталкивался с враждебностью и обидами, что мешало ему выполнять свой долг. Несмотря на это, его способностями к общению с пациентами с психозами и афазией восхищались, а вклад в медицину впоследствии оказался легендарным.
Случаи больных с различными формами лобно-височной деменции и ее симптомами стали впервые описываться в конце XIX – начале XX века. В 1892 году Арнольд Пик изучал клинические симптомы пациента по имени Август Х., который страдал от тяжелой афазии – потери речи и слабоумия. Позже считалось, что именно Пик первым зарегистрировал случай первичной прогрессирующей афазии.
В следующей работе немецкий доктор изучал случай пациентки по имени Анна Х., чьи симптомы включали в себя отклонения в поведении и потерю когнитивных функций, что также соотносилось с лобной деменцией. Третье исследование описывало проблему пациентки по имени Анна Д. – 75-летней женщины с ослаблением речевых навыков и потерей концептуальных знаний: Анна периодически забывала, как пользоваться привычными предметами домашнего обихода.
Все три случая легли в основу гипотезы Пика, что деменция является результатом локализованных ухудшений в конкретных областях мозга, а не общим нарушением функций головного мозга. Впоследствии Алоис Альцгеймер, в честь которого немецкий психиатр Эмиль Крепелин (Emill Kraepelin) позже назовет одну из разновидностей сенильной деменции, выделил клубки белка, поселившиеся внутри нервных клеток в поврежденных участках мозга – тельца Пика.
Клетка Пика
Тельца Пика и клетки Пика содержат в себе аномальную форму тау-белка – органического вещества, присутствующего во всех нервных клетках, но по каким-либо причинам вырабатывающегося в ненормальных количествах или изменившего форму. Во время многочисленных исследований ученым удалось установить причину аномального количества этого белка в нервных клетках: все дело в мутациях, затронувших хромосому под номером 17. Но до сих пор науке неизвестно, почему меняется форма тау-белков.
Болезнь Пика можно было бы легко перепутать с болезнью Альцгеймера, если бы не тот факт, что первая затрагивает только определенные участки мозга, потому ее часто называют лобно-височной деменцией. Лобной доле головного мозга подконтрольны такие важные аспекты жизнедеятельности, как эмоции, речевое общение, поведение, торможение, а также некоторые формы движения. Очевидно, что любое изменение в клетках этой части мозга может привести к необратимым последствиям.
Болезнь Пика – редкое заболевание, которое вызывает прогрессирующее и необратимое слабоумие. Человек с таким диагнозом испытывает трудности с контролем речи, поведением, мышлением, суждением и памятью. Как и у пациентов с другими типами деменции, могут возникнуть и резкие изменения личности. Чаще всего это расстройство диагностируют у людей в возрасте между 40 и 60, но иногда обнаруживается и у 20-летних.
Универсального теста, определяющего лобно-височную деменцию, нет. Врачи могут провести ряд косвенных исследований: изучить историю болезни, провести тесты на устную и письменную речь, назначить детальное неврологическое обследование, а также рассмотреть ткани мозга при помощи МРТ и компьютерной томографии.
Как лечится болезнь Пика? Не существует известных методов лечения, которые эффективно замедляют прогрессирование лобно-височной деменции, но некоторые препараты могут облегчить симптомы. Например, врач может выписать антидепрессанты или антипсихотические препараты для торможения эмоциональных и поведенческих изменений.
Прогноз для людей с лобно-височной деменцией неутешителен. По данным Калифорнийского университета, расстройство прогрессирует в течение 8-10 лет. При этом от проявления первых симптомов до диагностирования заболевания может пройти несколько лет. В результате промежуток времени между установлением диагноза и смертью составляет около 5 лет.
Болезнь Пика встречается только в трех случаях на миллион, однако унесла достаточно жизней известных людей. С этим расстройством в разное время боролись Роберт Флойд, известный своим вкладом в алгоритм Флойда-Воршалла, Дэвид Румельхарт – американский ученый, известный своими исследованиями научения и памяти в семантических нейронных сетях, Тед Дарлинг – выдающийся хоккеист, игравший за «Баффало Сейбрз», бенгальский поэт, писатель, музыкант и революционер Кази Назрул Ислам, бас-гитарист, композитор и художник, известный по своей работе с группой Van der Graaf Generator Ник Поттер и другие.
Дэвид Румельхарт
Нейродегенерация с отложением железа в мозге первого типа или болезнь Галлервордена-Шпатца
Юлиус Галлерворден (слева) и Уго Шпатц (справа)
Юлиус Галлерворден (Julius Hallervorden), чье имя связано с этим заболеванием, внес важный вклад в неврологию. Несмотря на это, его деятельность во времена Второй мировой войны поднимает серьезные вопросы о моральных обязательствах медицинской науки. Не существовало закона, обязывающего к участию в «Программе умерщвления Т-4» и проведению «усыпления», однако некоторые немецкие врачи шли на это практически добровольно. В их числе оказался и Юлиус Галлерворден.
Некоторые считают, что фамилию этого немецкого невропатолога нужно убрать из названия болезни. Ученые предлагали переименовать недуг в «болезнь Марфы-Алмы», в честь двух сестер, чьи ткани головного мозга впервые исследовались Юлиусом Галлерворденом и Уго Шпатцем (Hugo Spatz). В 1996 году Тодд Тейлор (Todd Taylor) предположил, что это расстройство можно описать как нейродегенеративное с накоплением железа в мозге (NBIA1), чтобы избежать нежелательного эпонима «Галлерворден-Шпатц». Сегодня во всем мире распространен именно вариант Тейлора.
Нейродегенерацию с отложением железа в мозге впервые описали двое немецких невропатологов – Юлиус Галлерворден и Уго Шпатц в 1922 году. На открытие нового неродегенеративного заболевания их натолкнул случай одного семейства, в котором сразу у пяти сестер обнаружились признаки деменции и дизартрии – затруднения в произношении слов. После смерти сестер при вскрытиях врачи обнаружили коричневые пятна в различных областях головного мозга. В особенно больших количествах их обнаружили в бледном шаре и черной субстанции – составных частях базальных ганглий. Этими загадочными пятнами оказались отложения железа.
Дальнейшие исследования и описания произвел Мейер в 1958 году, который диагностировал 30 отдельных случаев NBIA1. Последователи Мейера описали пятерых пострадавших членов семьи и выдвинули гипотезу о том, что заболевание впервые возникло в центральной Европе. Таким образом они поддерживали вопрос о клинико-генетическом анализе.
Болезнь Галлервордена-Шпатца является генетическим неврологическим расстройством, которое вызывает проблемы с движением. Обычно развивается в детском возрасте и с течением времени усиливается. У каждого больного симптомы могут различаться, однако выделяют общую группу признаков: искажения в сокращении мышц и трудности координации движения.
Около четверти всех людей, страдающих от нейродегенерации этого типа, переживают нетипичную форму NBIA1, которая развивается после достижения 10-летнего возраста. В этом случае заболевание прогрессирует медленно и постепенно, в отличие от ситуации, когда недуг проявляется в более раннем возрасте. В то же время, взрослые больные в большей степени переживают значительное ухудшением речи, а также серьезные психические и поведенческие расстройства.
Непреднамеренные, прерывистые мышечные сокращения на лице, теле или в конечностях также являются сигналом возникновения нейродегенеративного заболевания. Такие сокращения впоследствии могут изменять привычные для человека позы. К другим симптомам, сопровождающих больных, относят отвердение мышц, проблемы с координацией движения, припадки, дезориентацию, затруднения глотания, слабоумие и некоторые другие.
Заболевание считается редким: на 1 миллион человек приходится до 3 больных. Чаще всего это члены одного семейства. После обнаружения первых симптомов врачи проверяют пациентов с помощью магнитно-резонансной томографии (МРТ). Главным маркером расстройства является наличие на снимке так называемого «глаза тигра» – расположенная в области бледного шара гиперинтенсивная зона овальной формы, окруженная еще большей гипоинтенсивной зоной. Последняя представляет собой, собственно, «глаз», а гиперинтенсивная – его «зрачок». Этот эффект, как правило, возникает из-за избыточного накопления железа.
Причина заболевания кроется в унаследованном дефекте в гене пантотенат-киназы 2 (PANK2). Белок PANK2 в организме человека контролирует выработку кофермента А, который, в свою очередь, помогает конвертировать жиры, некоторые аминокислоты и углеводы в энергию.
В медицинской практике встречаются случаи, когда нейродегенерация с отложением железа в мозге не вызвана мутацией гена PANK2. Ученые предполагают, что в таких случаях причиной болезни являются дефекты в одном или нескольких других генах, которые еще не идентифицированы.
В настоящее время NBIA1 не поддается лечению, и врачи лишь борются с ее симптомами. В зависимости от случая врачи назначают физиотерапию, медикаментозное лечение или оба решения одновременно. Физическая терапия уменьшает и предотвращает мышечную ригидность, спазмы и другие мышечные проблемы. Одним из успешных методов борьбы с симптомами расстройства также является трудотерапия. С ее помощью пациенты развивают навыки для повседневной жизни и сохраняют текущие способности. Больные, обращающиеся к услугам логопеда, могут управлять расстройствами глотания или речевыми нарушениями.
Источник
