Скорлупа головного мозга на мрт
… результаты различных методов лучевой диагностики должны всегда рассматриваться в контексте клинико-неврологического обследования.
Томографические методы диагностики (прежде всего МРТ) очень хорошо выявляют встречающиеся у пациентов пожилого возраста структурные изменения мозга, и в клинической практике бывает, что морфологические проявления «благополучно стареющего мозга» (распространенный в англоязычной литературе термин для возрастных изменений нормального мозга у пожилых пациентов) принимают за признаки хронической ишемии, ангио- или энцефалопатии, деменции. К настоящему времени хорошо известно, что в пожилом возрасте «нормальная» КТ- и МР-картина головного мозга может варьировать в широких пределах. Следует подчеркнуть, что обычно нельзя судить о сохранности когнитивных функций только по данным КТ и МРТ, выполненных по стандартным методикам.
С возрастом происходит общее уменьшение объема вещества головного мозга, что проявляется расширением всех ликворных пространств. Основная локализация возрастных атрофических изменений – белое вещество полушарий головного мозга и полосатое ядро (преимущественно хвостатое ядро и скорлупа), а также мозжечок. Отмечается расширение борозд коры больших полушарий и мозжечка. При КТ в проекции бледного шара часто выявляются симметричные точечные кальцинаты, также может определяться кальцификация сосудов. МРТ и КТ очень часто выявляют симметрично расширенные периваскулярные пространства (так называемые пространства Вирхова–Робина), которые выглядят как небольшие очаги, изоинтенсивные спинно-мозговой жидкости, расположенные соответственно ходу пенетрирующих артерий головного мозга. Они располагаются преимущественно в нижней трети скорлупы, имеют круглую/овальную или криволинейную форму, четкие ровные контуры, не оказывают масс-эффекта. С возрастом увеличиваются их диаметр (иногда более 2 мм) и количество. Их следует дифференцировать с лакунарными инфарктами. При МРТ на Т2-взвешенных изображениях (Т2-ВИ) достаточно часто в белом веществе мозга перивентрикулярно определяются фокальные или сливные гиперинтенсивные участки (чаше всего наблюдается тонкая полоса повышенного сигнала по периферии боковых желудочков). Выраженность и встречаемость перивентрикулярных изменений белого вещества увеличиваются с возрастом, причем их наличие и выраженность не имеют четкой корреляции с состоянием когнитивных функций. Также встречаются мелкие «инфарктоподобные» очаги в белом веществе полушарий и в подкорковых ядрах, гиперинтенсивные на Т2-ВИ. Они имеются у 1/3 пациентов старше 65 лет, не имеющих жалоб, в 70% случаев их размер не превышает 10 мм. Типичная локализация таких очагов – базальные ядра, таламус. Они представляют собой участки глиоза, точную причину их возникновения нередко установить трудно, но установлено, что часть из них может представлять собой клинически «немые» микроинсульты. Может наблюдаться снижение интенсивности сигнала в области подкорковых ядер за счет накопления гемосидерина. МРТ в режиме диффузионно-взвешенных изображений (ДВИ) не выявляет очаговых изменений диффузии (последнее характерно для острой ишемии). При МРТ с контрастным усилением гиперинтенсивные участки в белом веществе не накапливают контрастное вещество; в противном случае следует думать о наличии острого лакунарного инсульта или объемного поражения (мелкий метастаз). Описывается, что при МР-спектроскопии с возрастом наблюдается повышение содержания холина и креатина в веществе головного мозга. Снижается отношение содержания N-ацетиласпартата (NAA) к уровню холина и креатинина в коре, полуовальном центре и височных областях. При радионуклидных исследованиях (однофотонная эмиссионная компьютерная томография – ОФЭКТ, ПЭТ) головного мозга здоровых пожилых людей может наблюдаться умеренное снижение показателей регионального кровотока как в сером, так и в белом веществе, преимущественно в лобных долях.
Однако бывают случаи, когда приходится дифференцировать лучевую картину возрастных изменений мозга у пожилых людей с изменениями, характерными для деменций или сосудистых ангиопатий, что требует тщательного анализа всех данных комплексного клинико-инструментального обследования. Однако, с другой стороны, выявление одного или нескольких мелких очагов в белом веществе головного мозга у пожилого пациента, не имеющего никаких клинических симптомов, не следует немедленно трактовать как проявление ишемии мозга и ангиопатию.
по материалам статьи: «Лучевая диагностика хронической ишемии головного мозга» В.Е. Синицын, ФГУ Лечебно-реабилитационный центр, Москва, 2010
читайте также статью «Физиологическое старение головного мозга по данным магнитно-резонансной томографии» Гордеев Я.Я., Бойко Д.В., Шамова Т.М, Лебейко Т.Я.; УО «Гродненский государственный медицинский университет», Гродно, Беларусь; УЗ «Гродненская областная клиническая больница», Гродно, Беларусь (Журнал Гродненского государственного медицинского университета, №2, 2015) [читать]
читайте также пост: Старение головного мозга (на laesus-de-liro.livejournal.com) [читать]
Источник
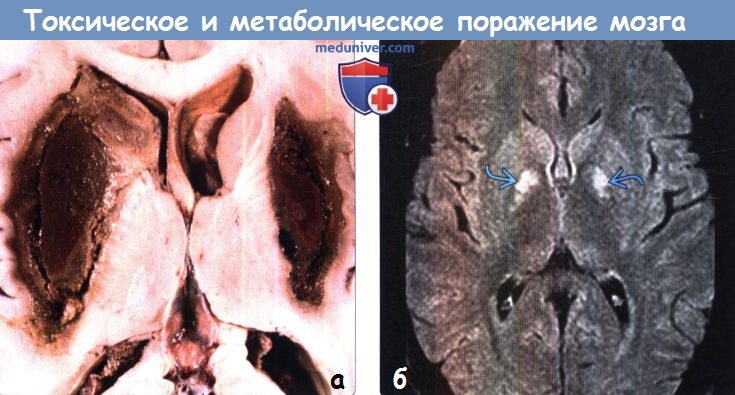
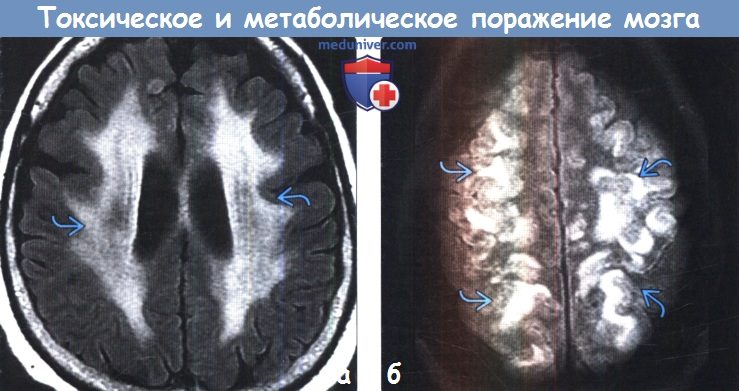
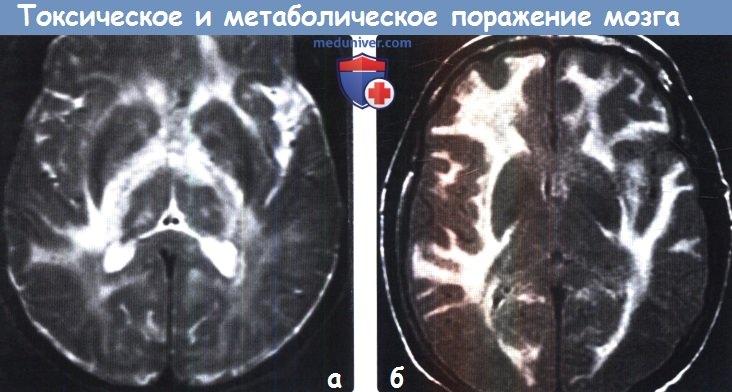
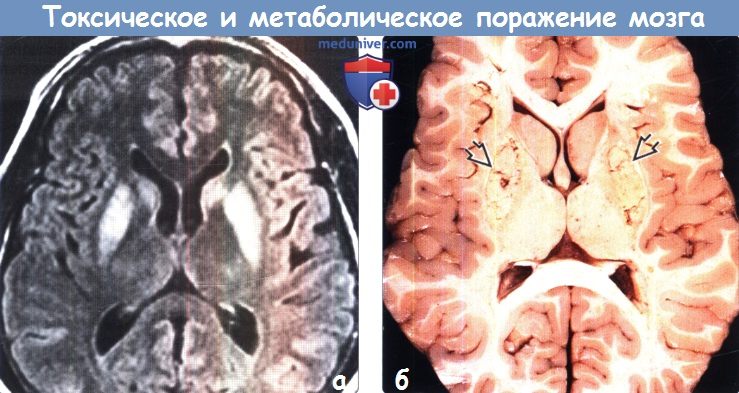
Диагностика токсического и метаболического поражения головного мозгаПриобретенные токсические и метаболические заболевания головного мозга являются результатом воздействия множества различных факторов, включая токсические вещества, алкоголь или наркотические средства, лучевую и химиотерапию, а также метаболических изменений, таких как артериальная гипертензия, печеночная недостаточность, гипогликемия и осмотическая демиелинизация. Большинство токсических и метаболических заболеваний головного мозга характеризуются поражением глубоких ядер (базальные ганглии и таламус) или белого вещества большого головного мозга. Для этих заболеваний, как правило, типична симметричность поражения, что может быть ключевым фактором в постановке диагноза. МРТ позволяет выявить поражения как на ранних, так и поздних стадиях токсических и метаболических заболеваний. ДВИ и FLAIR-ценные последовательности для дифференциальной диагностики различных нозологических форм в этой группе и постановки диагноза. Безусловно, упоминание в анамнезе о приеме/злоупотреблении различными веществами часто имеет ключевое значение в постановке диагноза. а) Анатомия токсического и метаболического поражения головного мозга: 1. Базальные ганглии. К базальным ганглиям (БГ) относятся симметрично расположенные парные ядра серого вещества, залегающие в глубоких отделах белого вещества большого головного мозга, образующие основу экстрапирамидной системы и регулирующие двигательную активность. БГ включают хвостатое ядро, скорлупу и бледный шар (БШ). Хвостатое ядро и скорлупу вместе называют полосатым телом. Скорлупу и БШ вместе называют чечевицеобразным ядром. • Хвостатое ядро представляет собой ядро С-образной формы с крупной головкой, конически суживающимся телом и изогнутым книзу хвостом. Головка ядра формирует дно и латеральную стенку переднего рога бокового желудочка. Тело хвостатого ядра расположено в параллельной боковому желудочку плоскости. Переднее бедро внутренней капсулы отделяет головку хвостатого ядра от скорлупы и бледного шара. • Скорлупа — наиболее удаленная часть БГ, расположенная лате-рально по отношению к БШ и отделенная от него латеральной (наружной) медуллярной пластинкой. • БШ состоит из двух сегментов: латерального (наружного) и медиального (внутреннего), разделенных тонким слоем миелинизиро-ванных аксонов-внутренней медуллярной пластинкой. 2. Таламус. Таламус состоит из парных овоидных комплексов ядер, в которых происходит переключение большинства сенсорных путей. Таламусы залегают на протяжении от отверстия Монро до четверохолмия. Медиальная часть таламуса образует латеральную стенку III желудочка. Заднее бедро внутренней капсулы формирует латеральную границу таламуса. Таламус разделен на несколько групп ядер: передние, медиальные, латеральные ядра, медиальное коленчатое тело (часть слухового анализатора), латеральное коленчатое тело (часть зрительного анализатора) и подушку. Данные группы ядер в свою очередь подразделяются на 10 дополнительных ядер. Подушку можно с легкостью распознать, поскольку она является наиболее задней группой ядер таламуса и нависает над верхними холмиками четверохолмия. Субталамическое ядро имеет малые размеры, линзовидную форму, расположено кверху и латерально по отношению к красному ядру и редко вовлекается в патологический процесс при токсических или метаболических заболеваниях.
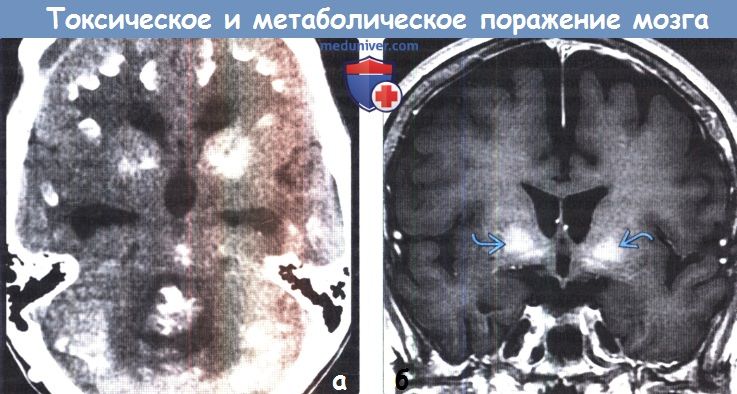
б) Патология токсического и метаболического поражения головного мозга. Механизмы поражения головного мозга различными токсическими и метаболическими агентами имеют сложный и часто комбинированный характер. С учетом высокой метаболической активности и потребности в снабжении кислородом глубокие ядра часто подвержены воздействию токсинов, метаболических нарушений и гипоксически-ишемическому поражению. Достаточно часто (например, при отравлении монооксидом углерода [СО] и цианидами) одним из повреждающих факторов является и гипоксия, что объясняет предрасположенность к токсическому воздействию БШ, имеющего высокую чувствительность к недостаточности оксигенации. Выборочное поражение глубоких ядер также может быть связано с дисфункцией возбуждающих нервных цепей, ингибированием функций митохондрий и селективной потерей допаминэргических нейронов. в) Дифференциальный диагноз. Большинство патологических изменений головного мозга имеют характерную локализацию, что помогает рентгенологу поставить правильный диагноз. Рассмотренные ниже дифференциально-диагностические критерии позволят выделить ключевые особенности частых токсических и метаболических процессов с поражением белого и серого вещества головного мозга. г) Кальцификация базальных ганглиев. Кальцификация базальных ганглиев-конечный результат многих токсических, метаболических, воспалительных и инфекционных поражений. Болезнь Фара представляет собой редкое нейродегенера-тивное заболевание, проявляющееся распространенной двусторонней кальцификацией БГ БШ наиболее часто вовлекается в патологический процесс после скорлупы, хвостатого ядра и таламуса. Также возможно вовлечение мозжечка (в частности, зубчатых ядер) и белого вещества большого мозга. Другие эндокринные заболевания, включая гипотиреоз и гипопаратиреоз, также могут вызывать кальцификацию мозговых структур, в частности БШ, скорлупы, зубчатых ядер, таламусов и субкортикального белого вещества. Лучевая терапия и химиотерапия могут приводить к минерализующей микроангиопатии, часто являющейся причиной кальцификации и атрофии БГ и субкортикального белого вещества. Физиологическая кальцификация структур головного мозга как часть нормальных возрастных изменений чаще затрагивает БШ, чем скорлупу.
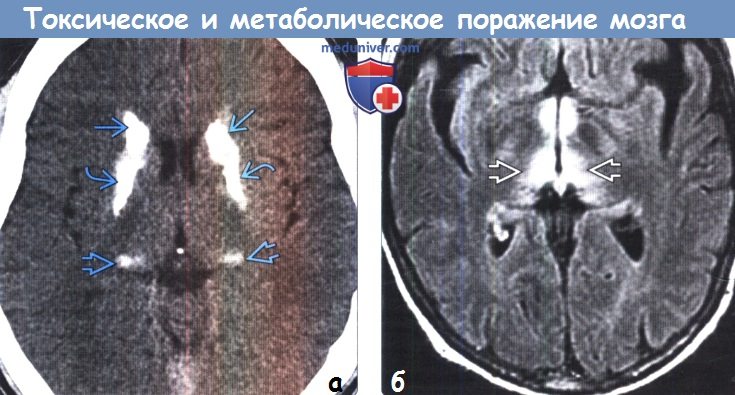
д) Гиперинтенсивный сигнал от базальных ганглиев на Т1-ВИ. Повышение интенсивности сигнала от базальных ганглиев на Т1 -ВИ обычно имеет симметричный характер и связано с их кальцификацией или другой минерализацией. Часто такие изменения сигнала от БШ и черной субстанции можно наблюдать у пациентов с заболеваниями печени или гипералиментацией, связанной с нарушением метаболизма марганца. Ядерная желтуха, связанная с интоксикацией неконъюгированным билирубином у новорожденных, приводит к появлению гиперинтенсивного сигнала на Т1 ВИ от БШ, а также черной субстанции, гиппокампа и зубчатого ядра. Многие эндокринные заболевания, приводящие к кальцификации БШ, также вызывают повышение интенсивности сигнала на Т1 ВИ. К таким заболеваниям относятся гипотиреоз, гипер-, гипопаратиреоз и псевдогипопаратиреоз. Болезнь Фара также приводит к появлению гиперинтенсивного на Т1 ВИ сигнала, особенно, от БШ. е) Гиперинтенсивный сигнал от базальных ганглиев на Т2-ВИ. При токсических и метаболических заболеваниях повышение интенсивности сигнала от БГ на Т2-ВИ также обычно имеет симметричный характер. Достаточно часто ДВИ помогает дифференцировать различные поражения БГ Отравление СО классически проявляется симметричным гиперинтенсивным сигналом на Т2-ВИ от БШ, однако иногда возможно и вовлечение скорлупы, таламуса и белого вещества. В острую стадию на ДВИ может наблюдаться ограничение диффузии. Отравление метанолом обычно приводит к некрозу скорлупы и может иметь геморрагический характер. Злоупотребление наркотическими средствами — еще одна причина изменений со стороны БГ, часто встречающаяся среди молодых взрослых, злоупотребление наркотическими средствами часто проявляется инсультом или васкулитом. Прием героина и МДМА (эктази) часто приводит к ишемии БШ. Синдром осмотической демиелинизации представляет собой острую демиелинизацию, возникающую вследствие быстрого изменения осмолярности плазмы, зачастую из-за попытки быстрой коррекции гипонатриемии. Экстрапонтинный миелинолиз часто приводит к поражению хвостатого ядра, скорлупы, а также белого вещества. Болезнь Вильсона вызывает появление гиперинтенсивного сигнала на Т2-ВИ от скорлупы, БШ, хвостатых ядер и таламусов. Также данное заболевание приводит к появлению симптома «гигантской панды» на Т2-ВИ на уровне среднего мозга вследствие повышения интенсивности сигнала от белого вещества. Развитие острой гипертонической энцефалопатии (СЗОЭ) вызывается артериальной гипертензией и может быть связано с химиотерапией. При СЗОЭ обычно поражается кора и субкортикальное белое вещество в бассейне задней циркуляции. Однако возможно и поражение БГ Помимо токсических и метаболических поражений другими причинами повышения интенсивности сигнала на Т2-ВИ от БГ могут быть гипоксически-ишемическая энцефалопатия, окклюзия глубоких вен и инфекции.
ж) Поражение бледного шара. К заболеваниям, характеризующимся вовлечением в патологический процесс только бледного шара, относятся отравление СО и цианидами, интоксикация героином и МДМА (экстази), ядерная желтуха, нейродегенерация с отложением железа в головном мозге (НОЖМ), пантотенаткиназа-ассоциированная нейродегенерация (ПКАН), гипералиментация, печеночная энцефалопатия и метилмалоновая ацидемия. НОЖМ представляет собой группу прогрессирующих нейродегенеративных заболеваний, характеризующихся экстрапирамидными двигательными нарушениями и отложением железа в головном мозге, что проявляется гипоинтенсивным сигналом на Т2-ВИ от БШ. БГШ, также известная как синдром Галлервордена Шпатца или НОЖМ-1, характеризуется симптомом «глаз тигра» в виде характерных двусторонних симметричных гиперинтенсивных на Т2-ВИ очагов в БШ, окруженных гипоинтенсивными ободками. К другим заболеваниям, часто приводящим к поражению БШ в большей степени по сравнению другими БГ, относятся болезнь Фара, гипотиреоз и Болезнь Вильсона. Как и при других поражениях БГ следует проводить дифференциальную диагностику с гипоксически-ишемической энцефалопатией. з) Двустороннее поражение таламусов. Причиной двустороннего поражения таламуса наиболее часто является артериальная или венозная ишемия или гипоксически-ишемическая энцефалопатия. Однако эти анатомические структуры могут поражаться и при многих токсических и метаболических процессах. Алкогольная энцефалопатия, в частности, энцефалопатия Вернике, обычно вызывает повышение интенсивности сигнала на Т2-ВИ от медиальных отделов таламусов, сосцевидных тел, гипоталамуса и центрального серого вещества. Энцефалопатия Вернике возникает вследствие дефицита витамина В1 и часто связана со злоупотреблением алкоголем. Гиперинтенсивный сигнал на Т1-ВИ от подушек таламусов является частым и патогномоничным признаком болезни Фабри, поэтому рассматривается многими как «симптом гиперинтенсивной подушки таламуса». Болезнь Фабри — редкое полисистемное Х-сцепленное заболевание, проявляющееся нарушениями со стороны почек и сердца и инсультом. Хотя при болезни Фара наиболее часто развивается распространенная двусторонняя кальцификация БГ, нередко поражается и таламус. К другим заболеваниям, приводящим к поражению таламусов, относятся СЗОЭ, васкулит, осмотическая демиелинизация и острый диссеминированный энцефаломиелит. Также таламусы поражаются и при многих энцефалитах, включая энцефалиты, вызываемые вирусами Эпштейна-Барр, Западного Нила и Японский энцефалит. Кроме того, болезнь Клейцфельдта-Якобсона (БКЯ) часто приводит к симметричному поражению базальных ганглиев и таламуса.
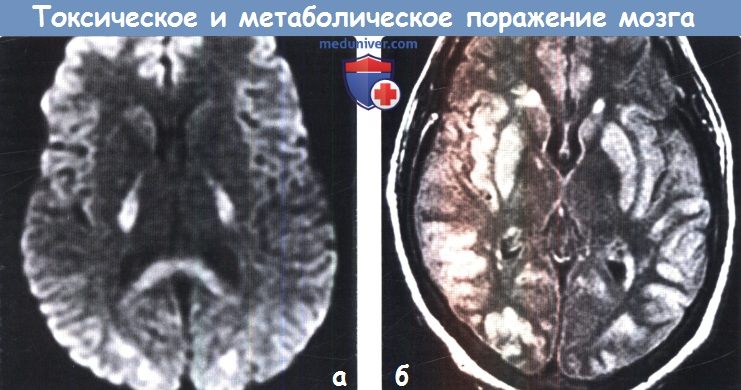
и) Диффузные патологические изменения белого вещества. Токсические и метаболические заболевания часто приводят к развитию лейкоэнцефалопатии в виде сливных зон гиперинтенсивного на Т2-ВИ сигнала. Классическими последствиями лучевой и химиотерапии является развитие лейкоэнцефалопатии с появлением гиперинтенсивных на Т2-ВИ зон в любых отделах белого вещества большого мозга. При этом характерна сохранность субкортикальных U-волокон. Диффузная некротизирующая лейкоэнцефалопатия, часто возникающая при сочетании лучевой и химиотерапии, наряду с лейкоэнцефалопатией характеризуется некрозом белого вещества. Вдыхание паров героина (также известно как синдром «погони за драконом») вызывает токсическую лейкоэнцефалопатию, приводящую к повышению интенсивности сигнала на Т2-ВИ от белого вещества мозжечка и задних бедер внутренних капсул, характеризуется и вовлечением белого вещества задних отделов больших полушарий с относительной сохранностью субкортикального белого вещества. Гипотиреоз вследствие тиреоидита Хашимото может приводить к появлению лейкоэнцефалопатии диффузного сливного характера с типичным поражением белого вещества передних отделов больших полушарий. Кроме того, наблюдается вовлечение в процесс U-волокон с относительной сохранностью задних отделов больших полушарий. Острая печеночная недостаточность также может приводить к развитию диффузного отека с повышением интенсивности сигнала на Т2-ВИ от перивентрикулярного и субкортикального белого вещества. При этом типично поражение коры. СЗОЭ часто приводит к поражению коры и субкортикального белого вещества в бассейне задней циркуляции. Алкогольная энцефалопатия может редко приводить к диффузному повышению интенсивности сигнала на Т2-ВИ от белого вещества вследствие острой демиелинизации.
к) Список литературы:
— Также рекомендуем «Гипогликемия у детей на КТ, МРТ головного мозга» Редактор: Искандер Милевски. Дата публикации: 26.4.2019 |
Источник