Сочетанное действие врожденного и адаптивного иммунитета

Врожденный иммунитет – это эволюционно сформированная и закрепленная защитная система организма, свойственная человеку от рождения и передающаяся по наследству. Хотя, на самом деле, не только люди пользуются «привилегией» обладания врожденным иммунитетом. Этот тип иммунной защиты свойственен всем живым существам, даже самым простейшим.
Биологии установили, что 98 % существ, живущих на земле, вообще не имеют адаптивного иммунитета. Помогает выживать и защищает от врагов и болезней их врожденная иммунная система.
Функции
Основной «обязанностью» врожденного иммунитета является борьба с микроорганизмом или чужеродным веществом, проникнувшим в организм, в первые часы после его проникновения, то есть в те моменты, когда адаптивный иммунитет еще не начал свою работу.
Активность врожденного иммунитета развивается уже через несколько минут после проникновения чужеродного агента и сохраняется на высоком уровне в течение четырех суток после его проникновения. Учеными установлено, что основную массу микроорганизмов и ксенобиотиков, пытающихся проникнуть в организм, уничтожает именно врожденная система иммунитета.

Функции у врожденного иммунитета реализуются посредством:
- Механической защиты на пути проникновения патогенов
- Клеточных защитных факторов (так называемый клеточный иммунитет);
- Гуморальных защитных факторов (гуморальный иммунитет).
Механическим барьером на пути микробов являются неповрежденные кожа и слизистые оболочки, а также кислая реакция желудочного сока.
Кожа и слизистые оболочки выстланы непрерывно обновляющимися эпителиальными клетками, которые являются препятствием на пути проникновения микробов. Кроме того, кожные покровы имеют кислую реакцию среды, что неблагоприятно для размножения бактерий.
Слизистые оболочки также представляют собой препятствие на пути бактерий. И обусловлено это, в первую очередь, наличием специфических клеток – мерцательного эпителия, за счет постоянных колебаний которого осуществляется удаление микроорганизмов и микроскопических частичек пыли.
В желудке уничтожение бактерий обеспечивается за счет антибактериального действия желудочного сока. Способность желудочного сока уничтожать микробы связана с его кислой средой – у здорового человека pH желудочного сока составляет от 1,5 до 2,5.
Клеточные механизмы защиты нашего организма от патогенов реализуются посредством работы нескольких видов клеток — нейтрофильных, базофильных и эозинофильных гранулоцитов, моноцитов и макрофагов. Основным «оружием» клеточного иммунитета является фагоцитоз – способность клеток неспецифической иммунной защиты «пожирать» и «переваривать» патогены.

Механизм работы гуморальной иммунной защиты реализуется посредством специфических веществ, способных уничтожать чужеродные агенты, проникнувшие в организм. К таким веществам относятся:
- Комплекс белков сыворотки крови (так называемый комплемент), обладающий свойством разрушать клеточную стенку бактерий;
- Секреты (выделения) различных желез организма (слюнных, слезных, пищеварительных) – они способны останавливать размножение микробов;
- Лизоцим — фермент, обладающий свойством растворять стенки микроорганизмов.
Взаимодействие врожденного и приобретенного иммунитета
Практически мгновенная активация механизмов иммунной защиты при проникновении в организм патогена вызвана тем, что врожденный иммунитет умеет распознавать патогенные микробы. Это происходит из-за того, что у всех болезнетворных микробов есть определенные молекулы, входящие в состав клеточной стенки, благодаря которым распознавание и происходит.
Эти молекулы называются патоген-ассоциированные молекулярные паттерны (РАМР). Если иммунная система распознает РАМР, то это служить сигналом того, что надо уничтожать вторгшийся чужеродный агент. В этом случае в работу вступают гуморальные и клеточные механизмы иммунной защиты, направленные на уничтожение «вторженца».
В некоторых случаях чужеродным агентам все-таки удается прорваться через «первую линию обороны», то в дело вступает система приобретенного (или адаптивного) иммунитета. Дело в том, что врожденный иммунитет умеет «сигнализировать» приобретенной иммунной системе о том, что «первая линия» защиты прорвана, и необходимо начинать выработку специфических антител. То есть, по сути дела, именно врожденный иммунитет, является пусковым механизмом иммунитета приобретенного. Это явление носит название сочетанное действие врожденного и адаптивного иммунитета.

Рецепторы
Более ста лет назад, задолго до появления «Активии» и «Иммунеле», великим русским ученым Ильей Мечниковым бал изобретен кисломолочный продукт, который не только способствовал хорошему пищеварению и нормализации стула при хронических кишечных расстройствах, но и обладал свойством укреплять иммунитет. В честь своего создателя продукт был назван Мечниковская простокваша.
Однако, к сожалению, сам создатель продукта так и не сумел объяснить благотворное влияние своего изобретения на иммунитет – он считал, что хорошее питание усиливает фагоцитоз, что и приводит к укреплению защитных сил организма.
И только исследования последних десятилетий показали, что содержащиеся в продукте молочнокислые бактерии — болгарская палочка и термофильный стрептококк распознаются врожденной иммунной системой, которая об этом каким-то образом «сигнализирует» иммунной системе приобретенной.
Вопрос о том, как работает «сигнальный механизм», осуществляющий активацию работы приобретенного иммунитета, долгое время волновал умы ученых-иммунологов всего мира. В 1973 году Ральф Штайнман обнаружил особый тип клеток, которые получили название дендритных. Эти клетки имеются во всех тканях, соприкасающихся с окружающей средой.
На поверхностях дендритных клеток имеются специфические рецепторы, роль которых на тот момент была не до конца понятна. Прорыв в решении этой проблемы был сделан в 1996 году, когда Жюль Хоффман, исследуя сопротивляемость инфекциям мушки-дрозофилы, обнаружил, что особи с мутацией в определенном гене при заражении обычно погибают, тогда как с особями, не имеющими мутации, этого не происходит. Этот ген был назван Toll (от немецкого Toll – прекрасно, удивительно), а рецепторы, которые этот ген кодирует – Toll-подобные рецепторы (иммунологи обычно используют буквенное обозначение TLRs).

Первый изученный Toll-подобный рецептор — TLR4, был изучен в 1998 году Брюсом Бютлером. На сегодняшний день известно о существовании у человека 23 разновидностей TLRs, однако наиболее изученными являются 9 из них. TLRs могут быть расположены на цитоплазматической мембране и на внутриклеточных органеллах (лизосомах, эндосомах). К цитоплазматическим рецепторам относят TLR1, TLR2, TLR4, TLR5, TLR6, TLR10, а к рецепторам, локализованным на лизосомах и эндосомах – TLR3, TLR7, TLR8 и TLR9. При этом первый вид Toll-рецепторов распознает поверхностные бактериальные структуры, такие как липополисахариды и липопротеин, а второй — ядерные структуры бактерий и поврежденные молекулы своего собственного организма.
Toll-подобные рецепторы являются рецепторами клеток врожденного иммунитета. Когда рецепторы врожденного иммунитета взаимодействуют с ПАМП, на поверхности дендритных клеток образуются белки-антигены, запускающие реакции приобретенного иммунитета.
В распознавании патогена участвуют не только рецепторы из семейства Toll, но и ряд других, таких, например, как NOD–подобные рецепторы. Учеными было установлено, что NOD–подобные рецепторы участвуют в опознавании микроорганизмы, обладающие способностью выходить из эндосомального пространства в цитоплазму клеток и запускать ответные адаптивные реакции иммунитета.
Вероятно, что список рецепторов, участвующих в иммунном распознавании чужеродных агентов, намного больше, просто не все они еще открыты. Определение этих рецепторов – перспективная задача, стоящая перед современной иммунологией, ведь ее решение поможет не только узнать, к каким последствиям могут привести мутации этих рецепторных структур, но и уточнить механизмы развития иммунных реакций от момента активации сенсорных рецепторов до развития защитных реакций против конкретного микроорганизма.

Все рецепторы, принимающие участие в распознавании патогенна, относятся к группе рецепторов распознавания паттерна. Однако TLRs являются наиболее хорошо из них изученными. В настоящее время установлено, что сигнальная система, опосредованная TLRs, включает в себя не только непосредственно рецепторы, но и белки, осуществляющие передачу сигнала, и активирующиеся при этом молекулы.
В данный момент для ученых-иммунологов всего мира становится очевидно, что существуют дополнительные, еще не открытые составляющие сигнальной активации с участием TLRs.
Нарушения в работе
Так как TLRs играют важнейшую роль в осуществлении механизмов врожденных иммунных реакций и обеспечения взаимодействия между врожденной и приобретенной иммунными системами, нарушения на всех этапах работы сигнальных рецепторов могут привести к возникновению различных расстройств здоровья. Ученые доказали, что наличие Toll-подобных рецепторов
Широкий спектр лигандов TLR и наличие этих рецепторов на разных клетках (эпителиальных, эндотелиальных, кардиомиоцитах, гепатоцитах) способствует вовлечению TLR в патогенез многих заболеваний. Дефекты в системе TLR (изменение способности распознавать лиганды, нарушение экспрессии TLR, передачи сигнала, выработки эффекторных молекул, а также полиморфизм генов TLR) могут приводить к развитию тяжелых инфекционных, аллергических, онкологических, аутоиммунных и других заболеваний [6, 40, 42].
Согласно современным представлениям, причины этих нарушений могут заключаться в:
- мутации генов Toll-подобных рецепторов;
- полиморфизме (вариации) генов, шифрующих TLRs;
- мутациях в системе передачи сигнала с Toll-подобных рецепторов.
Мутации Toll-подобных рецепторов
Учеными установлен факт существования как минимум двух вариантов мутации гена TLR4, при которых у человека возрастает риск развития инфекций, вызванных грамотрицательными микроорганизмами (бактериями, которые не окрашиваются специальным, применяемым в микробиологической диагностике красителем).
Полиморфизм TLRs
Феномен полиморфизма заключается в том, что с одного гена могут копироваться отличающиеся друг от друга копии, часть из которых активностью не обладает. Наличие таких неактивных копий приводит к дефектам в распознавании патогена и, в итоге, к возникновению хронических воспалительных заболеваний.
Мутации в системе передаче сигнала с Toll-подобных рецепторов
Дефекты молекул, осуществляющих передачу сигнала от TLRs, приводят к развитию повышенной чувствительности к инфекциям.

Активаторы
С открытием TLRs научной общественности пришлось пересмотреть свои взгляды на методы лечения инфекционных заболеваний и о месте, которое должна занимать в терапии инфекций особая группа лекарственных препаратов – активаторов врожденного иммунитета.
С момента открытия в первой половине XX века пенициллина препаратами выбора в лечении бактериальных инфекций оставались антибиотики. Но в 2006 г Национальная академия наук США сформулировала инновационную концепцию, в которой освещен новый подход к разработке препаратов для лечения инфекций:
- Сосредоточение внимания на терапии инфекционных болезней посредством модулирования иммунитета;
- Использование иммуномодуляторов в комбинации с антибактериальными препаратами.
Использование иммуномодулирующих препаратов в лечении инфекционных заболеваний позволяет успешно решить еще одну проблему, стоящую перед современными учеными – проблему резистентности патогенных микроорганизмов к антибактериальным препаратам, которая, по данным Минздрава России, на данный момент у 16 % наших соотечественников.
В настоящее время установлен перечень потенциально перспективных веществ – активаторов рецепторов врожденного иммунитета. В первую очередь это агонисты (вещества, увеличивающие активность) TLRs и NOD-рецепторных структур. Одним из таких перспективных веществ является мурамилдипептид.

Мурамилдипептид – это крошечный, но активный фрагмент клеточной стенки микроорганизмов, обладающий свойством активировать иммунитет. Этот фрагмент распознается TLRs как потенциально опасный агент (хотя таков не является), и происходит запуск иммунных реакций, направленных на его уничтожение.
Мурамилдипептид имеет свойство активизировать не только врожденные, но и приобретенные иммунные реакции и увеличивать количество лейкоцитов в крови. Обладает это вещество и противовирусной активностью.
В силу того, что мурамилдипептид обладает высокой пирогенной активностью (способностью повышать температуру) и другими негативными побочными эффектами, использование его в клинической практике не представилось возможным, однако в середине 70 годов XX века отечественными учеными – сотрудниками Института биоорганической химии было синтезировано вещество – аналог мурамилдипептида. Назвали его глюкозаминилмурамилдипептид. В настоящее время существует два препарата на основе глюкозаминилмурамилдипептида, обладающих функцией активатора врожденного иммунитета. Один из них – ромуртид разрешен к применению в Японии, а другой – ликопид – в России
Видео
Источник
Особенности развития иммунного ответа определяются природой и локализацией патогенов. Существует 3 главные стратегии адаптивного иммунитета в отношении внутриклеточных и внеклеточных патогенов (рис. 1.7). Наиболее разнообразные эффекторные механизмы задействованы в защите от внеклеточных патогенов, при которой преобладает гуморальный иммунный ответ. Основные эффекторные молекулы при этом — антитела, секретируемые плазматическими клетками, дифференцирующимися из В-лимфоцитов при участии Th2-клеток.
Антитела способны связываться с антигенами, представленными как на клеточной мембране, так и в свободной растворимой форме. Прямое защитное действие антител в отношении свободных антигенов проявляется в нейтрализации их биологической активности (наиболее характерный пример — нейтрализация токсинов). В отношении антигенов, связанных с мембраной патогена, нейтрализующее действие антител проявляется в изменении биологической активности микроорганизма, например, в подавлении его подвижности или способности к адгезии на клетках хозяина, в предотвращении инфицирования вирусом клетки и т.д.
Более универсальны защитные механизмы, реализуемые антителами с участием других факторов или клеток. Главный из них — опсонизация — покрытие клеток молекулами иммуноглобулинов, облегчающими их распознавание и поглощение фагоцитами, которые имеют на мембране рецепторы для «хвостовой» части антител (Fc-рецепторы). Опсонизация значительно ускоряет фагоцитоз патогенов. Другой механизм защитного действия антител состоит в активации комплемента по классическому пути. Комплекс «антиген—антитело» связывает сывороточный фактор C1q, что вызывает каскадную активацию других компонентов комплемента. Этот процесс имеет
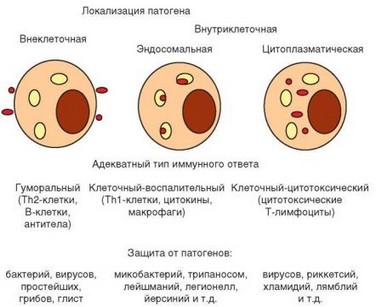
Рис. 1.7. Стратегия иммунной защиты зависит от локализации патогена
2 основных эффекта. Первый и главный из них — опсонизация клеток, но не антителами, а продуктами расщепления С3-компонента — C3b. Фагоциты имеют рецепторы к фрагментам С3 компонента и легко распознают опсони- зированный патоген. Второй результат, опосредующий защитный эффект комплемента, — цитолиз клетки за счет формирования мембраноатакующего комплекса. Кроме того, имеющие Fc-рецепторы естественные киллеры распознают опсонизированную антителами клетку и вызывают ее лизис по контактному механизму. Наконец, антитела облегчают распознавание патогенов макрофагами, имеющими высокоаффинные Fc-рецепторы, что резко усиливает защитные свойства этих клеток.
Защита от другой разновидности внеклеточных патогенов — макропаразитов (гельминтов) также осуществляется по ^2-зависимому механизму. Однако в этом случае наибольшую роль играют эозинофилы, привлекаемые цитокинами, которые секретируют ^2-лимфоциты и тучные клетки. Эозинофилы располагаются по поверхности паразита и выделяют содержащиеся в их эозинофильных гранулах высокоактивные белки, убивающие паразитов.
Антитела не способны проникнуть внутрь клеток и фактически бессильны против патогенов, имеющих внутриклеточную локализацию. Для защиты от внутриклеточных патогенов иммунная система имеет 2 стратегии. Как уже упоминалось, TM-клетки активируют макрофаги. При взаимодействии этих клеток ТЫ-лимфоцит получает дополнительный стимул через TCR, а макрофаг — через действие IFNy и костимулирующую молекулу CD40. Этот
«диалог» приводит к дополнительной активации макрофагов, в частности, к повышению бактерицидной активности этих клеток и формированию нового фактора — оксида азота и его производных (благодаря экспрессии макрофагами индуцибельной NO-синтазы). Это стимулирует разрушенние внутриклеточных патогенов, резистентных к действию факторов врожденного иммунитета до подключения Т-хелперов.
Таким образом, в данном случае истинными эффекторами становятся клетки врожденного иммунитета — макрофаги, завершающие элиминацию патогенов, поглощеных ими путем фагоцитоза. Только стимулирующие сигналы, поставляемые ТЫ-клетками, позволяют реализовать этот способ защиты от внутриклеточных (поглощенных, но не разрушенных) патогенов. В процессе иммунного ответа возникает еще одна разновидность индуцируемых Т-хелперов — Th17 (названы по доминирующему продукту — IL-17). Они привлекают нейтрофилы и реализуют свои эффекты, активируя эти клетки. В то же время их действие часто переходит в область патологии, выражающийся в развитии аутоиммунных процессов.
Другая стратегия борьбы с внутриклеточными патогенами направлена на элиминацию локализующихся в цитозоле патогенов (микоплазмы, лямблии и т.д.) или вирусов, геном которых интегрируется в геном клетки. Если в основе предыдущего механизма лежит усиление активности эффекторных клеток врожденного иммунитета, позволяющее им «излечиться» от патогена, то в данном случае иммунная система выбирает более радикальный путь — убивает инфицированную клетку вместе с патогеном (убитая клетка затем фагоцитируется). Функцию киллеров выполняют цитотоксические СD8+ Т-лимфоциты, отличающиеся от естественных киллеров не столько механизмом цитолиза, сколько специфичностью: прежде чем убить клетку, цитотоксический Т-лимфоцит должен распознать антигенный пептид патогена, выносимый на поверхность клетки-мишени в составе молекул MHC-I. Такой же механизм иммунная система использует при борьбе с опухолевыми клетками и при отторжении чужеродного трансплантата. Он же может участвовать в развитии аутоиммунной патологии (сахарный диабет I типа и др.).
Сопоставляя эффекторные механизмы врожденного (реализуемые на первой линии защиты) и адаптивного иммунитета (формируются в ходе иммунного ответа), следует отметить их сходство; при адаптивном ответе они незначительно модифицируются. Действительно, и во врожденном, и в адаптивном иммунитете используется киллинг патогенов или инфицированных клеток, регулируемый цитокинами или антителами. Таким образом, под влиянием факторов адаптивного иммунитета фагоцитоз интенсифицируется и становится более целенаправленным. Т-киллеры действуют подобно натуральным киллерам, но спектр их мишеней ограничен специфичностью их рецепторов, т.е. Т-киллеры действуют более избирательно. Внеклеточный цитолиз, осуществляемый эозинофилами, при адаптивном ответе проявляется локально благодаря выработке цитокинов, привлекающих эозинофилы к гельминтам. Наконец, реакции комплемента, активируемого через альтернативный и классический пути, приводят к одинаковым результатам, но включаются по антигенспецифическому механизму только во втором случае. Иными словами, адаптивный иммунитет использует

Рис. 1.8. Взаимосвязь врожденного и адаптивного иммунитета. Врожденный иммунитет обеспечивает презентацию антигена и костимуляцию, необходимые для запуска адаптивного иммунитета. В свою очередь, адаптивный иммунитет благодаря выработке антител и цитокинов придает реакциям врожденного иммунитета избирательность действия и повышает их эффективность
эффекторные механизмы врожденного иммунитета, придавая им специфичность и усиливая их путем контактных межклеточных взаимодействий и стимулирующего действия цитокинов (рис. 1.8).
Источник
