Т клеточного звена иммунитета
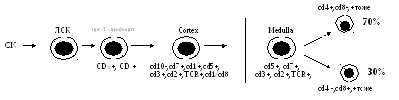
Иммунитет к любому инфекционному заболеванию есть следствие глубоко эшелонированной обороны, состоящей из множество элементов. В норме они действуют координировано, работая на единую цель – отбить «атаку агрессора». Если не вдаваться в детали, то в «иммунной обороне» есть несколько блоков.
Первый блок это, так-называемый, врождённый иммунитет (innate immunity). Особенности врождённого иммунитета – распознавание агрессоров «по-крупному», не вдаваясь в детали, быстрое реагирование и отсутствие «памяти» — это означает, что врождённый иммунитет, встретившись с агрессором, не «запоминает» его и если происходит повторная встреча, реагирует точно таким же образом как и при первой встрече. Наши возможности избирательно влиять в нужном направлении на врождённый иммунитет очень ограничены, если они вообще есть.
Второй блок это, так называемый, адаптивный иммунитет (adaptive immunity). Эта линия обороны реагирует на агрессора медленнее, но зато она значительно лучше различает индивидуальность агрессоров и обладает «злопамятностью» — если агрессор попытается внедриться повторно, то «сдачи» он получит гораздо сильнее, чем при первом вторжении. По-научному, это называется иммунологической памятью . Ключевыми элементами индивидуального образа агрессора являются антигены. Именно антигены, а точнее их микроструктуры, находящиеся на поверхности, так-называемые, эпитопы, являются теми элементами, по которым адаптивная иммунная система отличает «своих» от «чужих». Когда агрессорами являются вирусы, то антигены это белки вирусов. В адаптивной иммунной системе есть две составные части. Первая, традиционно называется гуморальной («жидкостной»), в вторая – клеточной. Это исторически-укоренившиеся названия не совсем точны, поскольку первичными «игроками» и в гуморальном и в клеточном звене адаптивного иммунитета являются клетки, а «жидкостные факторы» играют роль не только в гуморальном, но и в клеточном звене иммунитета. Более точное название для гуморального иммунитета — «антительный или В-клеточный», так как ключевым «бойцом» здесь являются антитела (продукты В-клеток). А клеточный адаптивный иммунитет точнее называть «Т-клеточным», так как эффекторами этого звена являются Т-лимфоциты. В- и Т- клеточные звенья иммунитета работают не изолированно. Они взаимосвязаны. Но феномены, связанные с антительным иммунитетом, значительно проще исследовать и мы знаем о В-клеточном иммунитете значительно больше, чем о Т-клеточном. Большинство существующих вакцин работают, в основном или исключительно, стимулируя В-клеточный иммунитет. Единственный тип вакцин, который включает в иммунную защиту все типы иммунитета, это вакцины, состоящие из ослабленных (аттенуированных) возбудителей. Эти вакцины наиболее полно «имитируют» естественный инфекционный процесс. Но такие вакцины не полностью безопасны. Их пытаются заменить более безопасными «высокотехнологичными» вакцинами. Этот процесс идёт не очень быстро. Но это отдельная большая тема, в которую я сейчас углубляться не буду. Экскурс в иммунологию сделан для того, чтобы читатели-неспециалисты понимали, в самых общих чертах, что иммунная защита от инфекции, в частности, иммунная защита от SARS-CoV-2 не сводится только к антителам. Просто антительные иммунные ответы значительно легче изучать, чем Т-клеточные, а методы определения антител, в отличие от таковых для Т-клеточных иммунных ответов, относительно просты и легко коммерциализируются. Однако, без понимания роли каждого из этих двух звеньев адаптивного иммунитета попытки создание вакцины против SARS-CoV-2/COVID-19 это «блуждание в потемках». А ведь до сих пор не было ни одной научной публикации о Т-клеточном иммунитете при инфекции «новым коронавирусом»! Наконец она появилась.
В MedRxiv опубликован препринт статьи озаглавленной «Присутствие SARS-CoV-2-реактивных клеток у пациентов с COVID-19 и здоровых доноров» (оригинал здесь: https://doi.org/10.1101/2020.04.17.20061440). Не буду вдаваться в методические детали этой работы. Не специалисту с ходу в этом разобраться трудно. Остановлюсь на основных выводах:
1) Т-клетки, реагирующие на главный антиген SARS-CoV-2 (гликопротеин S), есть в крови 83% больных COVID-19. Частота обнаружения таких клеток коррелирует с тяжестью заболевания – у тяжелых больных COVID-19, таких клеток, как правило, было меньше или они отсутствовали (хотя размер выборки очень маленький). Существенной корреляции между антительным и Т-клеточным иммунными ответами у больных COVID-19 не обнаружено.
2) Т-клетки, реагирующие на гликопротеин S вируса SARS-CoV-2, обнаружены у здоровых людей, у которых нет никаких признаков инфицирования этим вирусом, ни в настоящем, ни в прошлом. Причём, реагирующие на вирус Т-клетки у больных COVID-19 и здоровых доноров «нацелены» на разные эпитопы гликопротеина S. Более того, эпитопы, с которыми реагируют Т-клетки от здоровых доноров, находятся в той части гликопротеина S, которая имеет наибольшее сходство с аналогичным белком «сезонных» коронавирусов.
Что это всё значит? Прежде всего, это только первая работа такого рода и количество исследованных случаев не слишком велико (больных исследовано – 18; здоровых доноров — 68). Работа выполнена в весьма авторитетной лаборатории, но независимо от авторитета, научные результаты должны пройти проверку на воспроизводимость. Если всё подтвердиться, то будут основания считать, что Т-клеточный иммунитет является важным, а возможно, и необходимым фактором для выздоровления. Остаётся открытым вопрос, насколько важен Т-клеточный иммунитет для поддержания пост-инфекционного иммунитета, если он конечно развивается (что пока не доказано). Методы, апробированные в данной работе, дают возможность этот вопрос изучить. Далее нужно разобраться, что означает неожиданно частая реактивность Т-клеток здоровых доноров с некоторыми эпитопами гликопротеина S. Действительно ли это связано с перекрёстной реакцией между «новым» и «старыми» сезонными коронавирусами? На уровне антительного ответа такой перекрёстной реактивности нет. Но может она есть на уровне Т-клеточных эпитопов. Если окажется, что это так, то можно будет, по крайней мере частично, объяснить индивидуальные различия в чувствительности к SARS-CoV-2, особенно, в зависимости от возраста. Ведь дети чаще взрослых болеют ОРВИ, вызванными обычными коронавирусами. Может в следствии этого они приобретают частичный иммунитет против SARS-CoV-2?
И в заключение «узелок на память» — при нынешнем состоянии знаний нет и не может быть научно-обоснованного «теста на иммунитет к коронавирусу» или «иммунного паспорта», подтверждающего невосприимчивость к коронавирусу. Всё разговоры об этом, по крайней мере, преждевремены.
Источник
Составляет 5—10% общего количества первичных
иммунодефицитов.
1.Синдром
Ди Джоржи (гипо-, аплазия тимуса).
Специфический дефект. Дисэмбриогенез: нарушение развития
тимуса, щитовидной и паращитовидных желез. Снижение количества и функции
Т-лимфоцитов. Снижение способности продуцировать антитела при нормальном количестве
В-лимфоцитов. Локализация дефекта в хромосоме: 22qII.
Клинические особенности. Синдром Ди Джорджа характеризуется,
прежде всего, глубоким нарушением функции Т-лимфоцитов, что проявляется рецидивирующими
вирусными, паразитарными, некоторыми бактериальными инфекциями и микозами.
Однако уровень сывороточных иммуноглобулинов у таких больных не нарушен.
Характерно также наличие признаков нарушения функции паращитовидных желез –
гипопаратиреоидизм. Снижение уровня ионов кальция сопровождается развитием судорог–одного из самых ранних симптомов заболевания. При внешнем осмотре у ребенка
обнаруживают дисморфию лица – неправильно сформированные и низко посаженные
уши, антимонголоидный разрез глаз. Такие дети могут давать необычные, вплоть до
смертельного исхода, реакции при вакцинации живыми, аттенуированными вакцинами
вируса кори, полиомиелита, при вакцинации БЦЖ.
Зачастую у ребенка имеются и другие пороки развития: атрезия
пищевода, недоразвитие почек и мочеточников, полых вен. Могут наблюдаться
психические отклонения.
При иммуно-лабораторном обследовании выявляют:
- лимфоцитопению;
- снижение количества и пролиферативной активности
Т-лимфоцитов; - снижение кожных реакций гиперчувствительности замедленного
типа.
Уровень Ig в сыворотке крови в пределах нормы, однако, способность
продуцировать антитела на определенные антигены снижена из-за отсутствия
Т-хелперов. Количество В-лимфоцитов в пределах нормы.
Лечение. Используются пересадка тимуса; введение гормонов
тимуса с заместительной целью; симптоматическая терапия. Согласно имеющимся
наблюдениям, если ребенок дожил до пятилетнего возраста, то проявления синдрома
Ди Джорджи постепенно нивелируются.
2.Хронический
слюисто-кожный кандидоз.
Специфический дефект. Селективный дефицит ответа Т-клеток на
Candida- антиген. Гуморальный ответ не нарушен.
Клинические особенности. Характеризуется хроническим поражением
кожи, ногтей, волосистой части головы и слизистых оболочек, вызванным Candida
albicans. В основе заболевания лежит уникальный дефект реагирования Т-звена
иммунитета: на фоне нормального количества Т-лимфоцитов и их нормального
пролиферативного ответа на фитогемагглютинин отмечается резкое снижение
способности Т-лимфоцитов активироваться и продуцировать лимфокины (в частности,
фактор, ингибирующий миграцию макрофагов) в присутствии антигена Candida
albicans. При этом ответ на другие антигены может быть не нарушен. Кожные тесты
гиперчувствительности замедленного типа на антиген Candida также отрицательны.
Вместе с тем, гуморальный ответ на антиген Candida не нарушен. Характерны
аутоиммунные эндокринные заболевания.
В лечении используют симптоматическую противомикозную
терапию. Есть указания на применение трансфер-фактора и пересадки тимуса.
Источник
Т-клеточный
имунитет.
Дифференцировка
и функционирование Т-клеток (лимфоцитов).
Клетки иммунной системы включают в себя
лимфоциты, мон/макрофаги, гранулоциты.
Они различаются морфологически,
биохимически и функционально. ОБщее
их свойство- обеспечение иммунитета.
Все они происходят из ПСК. Зрелые
лимфоциты состоят из 2-х больших популяций:
тимусзависимые (Т-лимфоциты),дифференцирующиеся
в тимусе; тимуснезависимые.
(В-лимфоциты), дифференцирующиеся в
бурсе (у человека, возможно, в костном
мозге, АкЛТ).
Среди клеточных элементов иммунной
системы лидерство, как по количественным,
так и по функциональным параметрам
принадлежит Т-лимфоцитам, количество
которых составляет в периферической
крови от 60 до
80%общей
численности лимфоидных клеток. Зрелые
Т-лимфоциты диаметром около
6,5 мкм, ядро плотное, интенсивно
окрашенное, занимает всю клетку,
эксцентрически располагается почти
отсутствующая цитоплазма. Исследование
в сканирующем микроскопе показало, что
Т-лимфоциты имеют почти гладкую
поверхность, lg-рецепторов
на их поверхности в 100-1 000
раз меньше чем на В-лимфоцитах. В-клетки
больших размеров до 8.5
мкм, ядро менее интенсивно окрашено,
не содержит ядрышка, цитоплазма больших
размеров, базофильна. В-лимфоциты имеют
отростчатую поверхность за счет большой
плотности lg-рецепторов.
Функционально Т-лимфоциты определяют
практически полный спектр клеточных
реакций иммунитета, эффекторную функцию,
включая реакции гиперчувствительности
замедленного типа, реакции
противоопухолевого и трансплантационного
иммунитета, принимают участие в регуляции
функциональной активности кроветворных
стволовых клеток, В-лф. Это клетки,
которые осуществляют рецепцию антигена
и запуск иммунного ответа.
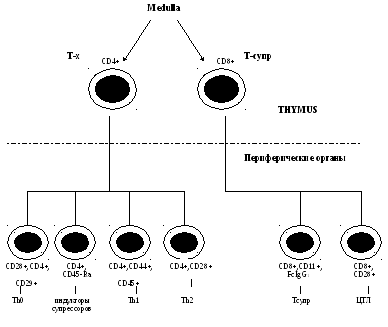
Функции Т-лимфоцитов.
1)эффекторной функции Т-лимфоциты
выполняют
2)иммунорегуляторную функцию.
3) взаимодействие с
макрофагами (АПК) —
распознавание антигена и запуск имунного
ответа.
4) продукция цитокинов,
регулирующих не только межсистемные
взаимодействия, но и многие жизненно
важные процессы в организме (например
Т-лимфоциты через продукцию ИЛ-3
воздействуют на самые ранние процессы
гемопоэза ).
Одной из особенностей Т-лимфоцитов
является их гетерогенность.
Среди Т-клеток выделяют:
регуляторы Тх/Тс;
Т-индукторы (Тинд,Тh1,Тh2);
Т-цитотоксические. Т-эффекторы ГЗТ.
Т-дифференцирующие (Т-амплифайеры) и
др.
Т-индукторы — клетки,
сходные по многим характеристикам
(морфологическим, функциональным)
с Т-хелперами, но активирующие другие
типы клеток, в частности Т-супрессоры.
Т-клетки замедленной
гиперчувствительности
— эти клетки
обеспечивают приток макрофагов в
локальные участки, например, на коже,
слизистых, где развивается клеточная
иммунная реакция по типу ГЧЗТ
(туберкулиновая проба и т.д.).
Т-клеточный рецептор для антигена TCR
В отличие от антигенраспознающих
рецепторов В-лимфоциты (молекулы
мембранных 1д) Т-лимфоциты имеют
специфический рецептор для антигена
-TCR. По строению молекулы
TCR оказались близкими молекулам
Ig и МНС.
В состав рецептора TCR
входит:
антигенрасопзнающий рецептор и молекула
CD3 в комплексе с молекулой
ГКГ 1 и II
класса. Молекула CD3,
связанная с TCR, вероятно,
осуществляет передачу сигнала от
TCR к внутриклеточным эффекторным
системам .
Онтогенез
Т-лимфоцитов.

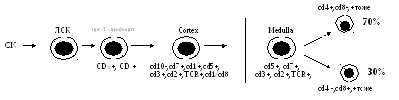
В костном мозге на пре-Т-лимфоцит
появляется самый ранний маркер
Т-лимфоцитов — CD7+(это
рецептор к µ-цепи Fc
фрагмента IgM). Ранние
предшественники мигрируют из костного
мозга через кровоток в тимус под действием
гормонов тимуса, где происходит их
размножение, созревание, образование
зрелых Т-лимфоцитов, оттуда миграция в
кровь, заселение периферических органов
.Только 5-10% пройдет позитивную селекцию,
90-95%- погибнет, а затем только начнется
заселение зон организма.
В тимус пре-Т поступают из сосудов,
расположенных между корковым и мозговым
веществом, где они первоначально
взаимодействуют с дендритными
клетками и макрофагами, а затем после
миграции в субкортикальный слой
-с эпителиальными клетками-«няньками»,
после чего начинается их активная
пролиферация.
Т-лимфоциты не вступившие во взаимодействие
с антигенами называют наивными, а
подвергнувшиеся действию гормонов и
т.д.- армированными.
Периферические
органы иммунной системы
В процессе созревания тимоцитов, их
взаимодействие с эпителиальными
клетками тимуса (клетки-«няньки»)
они учатся распознавать антиген,
экспрессир. антигенраспоэнающий
рецептор — позитивная
селекция {У/о клеток).
«Негативная селекция»-
(95%) — клетки, которые не научились
распознавать антиген, они имеют
рецепторы к аутоантигенам. На
дифференци-ровку (созревание) клеток в
тимусе влияют гуморальные факторы
тимуса и стромы. Гуморальные факторы
тимуса: тимозин, тимопоэтин, тимический
гормональный фактор, тимостимулин,
сывороточный тимический фактор, ИЛ-3.
Стромальные факторы: в медуллярной
зоне тимуса имеются макрофаги,
дендритные клетки тимуса.
Маркеры—
поверхностные структуры (или
внутриклеточные), характеризующие
как отдельные типы лимфоцитов, так и
определенные этапы их развития.
Варианты маркеров:
1) поверхностные антигены,
в т.ч. дифференцировочные, появляющиеся
и исчезающие в зависимости от стадии
развития клетки или сохраняющиес
на всех стадиях клеточного цикла;
2) поверхностные рецепторы
( распознающие структуры), с помощью
которых клетки узнают антиген и
воспринимают другие стимулы, необходимые
для их жизнедеятельности.
Важнейшими маркерами Т-лимфоцитов
служат рецепторы, которые отличаются
по строению, функциональному назначению
и разделены на 3 группы
1)антигенраспознающие рецепторы на Тлф
— (TCP.), на Влф
— рец.Тд
природы; позволяют специфически
распознавать антиген;
2) рецепторы для
иммунологически значимых продуктов
иммунной системы (рец. к Fclg,CI-C9,
лимфокинов цк и др.) —
необходимы для реализации различных
функций иммунной системы;
3) рецепторы для продуктов
неиммунного происхождения (гормонов,
нейропептидов и др.), рецепторы адгезии.
Методы идентификации Т-клеток.
Для выделения Т-лимфоцитов из пула
клеток крови или других тканей используют
различные приемы:
1) РОК
2) МКА
3 ) цитофлюорометрия
4) по рец. к Fc
lg-на Тх-Fc
lgM; -Т на Те-Fc
lgG; -Т
Патология в системе Т-клеточного
иммунитета.
— врожденная недостаточность
Т-лимфоцитов (первичный ИД
— Т-КИН, синдром Ди-Джорджа, синдром
атаксии-телеангиоэктазии и др);
— инфицирование Т-клеток
вирусом ВИЧ, острого лимфолейкоза
взрослых ;
— Т-клеточные
иммунопролиферативные заболевания
(варианты острого лимфолейкоза,
Т-клеточные лимфомы и Др.)-
— врожденные и приобретенные
дефекты Т-клеточного антигенраспоз-нающего
рецепторного комплекса или его отдельных
субъединиц, адгезив-ных молекул,
дефектность механизмов «обучения»
Т-лф в тимусе ( блок
позитивной и/или негативной селекции
тимических лимфоцитов) ;
— нарушение соотношения
регул. Т-лимфоцитов (CD4 и
008), субпопуляций с превышением
функции хелперно-индуцирующих клеток
— аутоиммун-ная и аллергическая
направленность или
супрессорно-ЦТК-иммунодефицит-ная
направленность иммунопатологии;
— приобретенные тимусзависимые
ИДС (удаление тимуса, поражение Т-клеток
физическими, фармакологическими и
другими методами, опухоли, нарушение
питания, инфекции, возрастные изменения
и др.);
— преактивация Т-лимфоцитов
in vivo (факторы
микроорганизмов, ау-тоантитела против
структур Т-клеток, фармакологические
средства и др.) с развитием аутоиммунных
процессов, повышенной продукцией ЦК,
актив, мф — усиление
воспалительных, деструктивных процессов).
3
Источник
Синдром Ди Джорджи (гипо-, аплазия тимуса).Заболевание развивается вследствие дисэмбриогенеза: нарушения развития тимуса, щитовидной и паращитовидных желез. Обнаруживается лимфоцитопения, снижение количества и функции Т-лимфоцитов. Число В-лимфоцитов
в пределах нормы, однако, способность продуцировать антитела на определенные антигены снижена из-за отсутствия Т-хелперов.
Синдром Ди Джорджи проявляется рецидивирующими вирусными, паразитарными, некоторыми бактериальными инфекциями и микозами. Обычно уровень сывороточных иммуноглобулинов у больных не нарушен. Характерно также нарушение функции паращитовидных желез — снижение уровня ионов кальция сопровождается развитием судорог — одного из ранних симптомов заболевания. При внешнем осмотре у ребенка обнаруживают дисморфию лица: неправильно сформированные и низко посаженные уши, антимонголоидный разрез глаз. Зачастую имеются
и другие пороки развития: атрезия пищевода, недоразвитие почек и мочеточников, полых вен. Могут наблюдаться психические отклонения.
Хронический генерализованный кандидоз кожи и слизистых оболочек. Характеризуется хроническим поражением кожи, ногтей, слизистых оболочек, волосистой части головы, вызванным грибами рода Candida. В основе заболевания лежит уникальный дефект реагирования
Т-звена иммунитета: на фоне нормального количества и нормального пролиферативного ответа Т-лимфоцитов на фитогемагглютинин отмечается резкое снижение их способности активироваться и продуцировать лимфокины в присутствии антигена Candida albicans. При этом ответ на другие антигены может быть не нарушен. Характерны аутоиммунные эндокринные заболевания.
Комбинированные иммунодефициты с нарушением
клеточного и гуморального иммунитета
Для комбинированных ИД, кроме инфекционного синдрома, характерна повышенная частота аутоиммунных заболеваний, в частности, нейтро-, тромбоцитопений, артритов, нефритов и др. Кроме того, больные
с большей частотой подвержены онкологическим заболеваниям, особенно лимфоретикулярного происхождения.
Тяжелая комбинированная иммунная недостаточность (ТКИН) — наиболее серьезное заболевание из группы дефектов, которое проявляется в первые месяцы жизни. ТКИН представляет собой группу генетически разнородных заболеваний, в основе которых лежит нарушение созревания Т-лимфоцитов с полным отсутствием их функции. В зависимости от генетического дефекта заболевание наследуется Х-сцепленно или аутосомно-рецессивно. Критериями диагноза для всех форм ТКИН является гипоплазия лимфоидной ткани, лимфопения, значительное снижение концентраций сывороточных иммуноглобулинов. В зависимости от формы заболевания число В-лимфоцитов варьирует от нулевых до нормальных значений,
однако во всех случаях их функция резко нарушена.
К типичным проявлениям относится задержка физического развития, хроническая диарея, тяжелая молочница и грибковые поражения кожи, прогрессирующее поражение респираторного тракта в виде пневмоциcтных пневмоний. Обычно больные умирают на первом году жизни от осложнений вирусных, бактериальных, протозойных инфекций или сепсиса.
Атаксия–телеангиэктазия (синдром Луи-Бар).Заболевание наследуется аутосомно-рецессивно и проявляется нарушением функции Т-
и В-лимфоцитов. Снижен уровень IgA, IgE и IgG2. Наблюдается гипоплазия тимуса, селезенки, лимфатических узлов, миндалин.
Характерна телеангиэктазия кожных покровов и глаз, прогрессирующая мозжечковая атаксия, рецидивирующие инфекции бронхо-легочной системы вирусной и бактериальной природы, бронхоэктатическая
болезнь, повышенный уровень альфа-фетопротеина. В перспективе —
поражение нервной, эндокринной, сосудистой систем, злокачественные опухоли. У половины больных отмечается отставание в умственном
развитии, заторможенность, адинамия. Некоторые доживают до 20 и даже 40 лет.
Синдром Вискотта–Олдрича.Тип наследования рецессивный, сцепленный с Х-хромосомой. Болеют мальчики, редко доживая до 10 лет.
Обнаруживается умеренная лимфоцитопения, угнетение клеточного иммунитета, нарушение продукции IgM. Уровень IgG обычно в норме, уровень IgА и IgE повышен. Количество В-лимфоцитов, как правило, в норме.
Для синдрома характерна триада: экзема, тромбоцитопения, частые пиогенные инфекции, начинающиеся, как правило, с 6 месяцев жизни. Впоследствии развиваются аутоиммунные заболевания, злокачественные новообразования, геморрагический синдром. С возрастом возможна стабилизация состояния, но тромбоцитопения сохраняется.
Источник
