Т система клеточного иммунитета
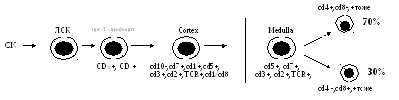
Ниже продублирован мой предыдущий пост на эту важную тему. На днях появились новые, очень интересные данные. Об этом в следующем посте (скорее всего завтра). А пока рекомендую ознакомиться с результатами первого исследования Т-клеточного иммунитета при SARS-CoV-2 инфекции/COVID-19.
Иммунитет к любому инфекционному заболеванию есть следствие глубоко эшелонированной обороны, состоящей из множество элементов. В норме они действуют координировано, работая на единую цель – отбить «атаку агрессора». Если не вдаваться в детали, то в «иммунной обороне» есть несколько блоков.
Первый блок это, так-называемый, врождённый иммунитет (innate immunity). Особенности врождённого иммунитета – распознавание агрессоров «по-крупному», не вдаваясь в детали, быстрое реагирование и отсутствие «памяти» — это означает, что врождённый иммунитет, встретившись с агрессором, не «запоминает» его и если происходит повторная встреча, реагирует точно таким же образом как и при первой встрече. Хотя, нужно отметить, что в последнее время появились данные о существования аналога памяти и у врождённого иммунитета. Для обозначения этого феномена предложен термин «тренированный иммунитет» (trained immunity). Наши возможности избирательно влиять в нужном направлении на врождённый иммунитет пока очень ограничены.
Второй блок это, так называемый, адаптивный иммунитет (adaptive immunity). Эта линия обороны реагирует на агрессора медленнее, но зато она значительно лучше различает индивидуальность агрессоров и обладает «злопамятностью» — если агрессор попытается внедриться повторно, то «сдачи» он получит гораздо сильнее, чем при первом вторжении. По-научному, это называется иммунологической памятью . Ключевыми элементами индивидуального образа агрессора являются антигены. Именно антигены, а точнее их микроструктуры, находящиеся на поверхности, так-называемые, эпитопы, являются теми элементами, по которым адаптивная иммунная система отличает «своих» от «чужих». Когда агрессорами являются вирусы, то антигены это белки вирусов. В адаптивной иммунной системе есть две составные части. Первая, традиционно называется гуморальной («жидкостной»), в вторая – клеточной. Это исторически-укоренившиеся названия не совсем точны, поскольку первичными «игроками» и в гуморальном и в клеточном звене адаптивного иммунитета являются клетки, а «жидкостные факторы» играют роль не только в гуморальном, но и в клеточном звене иммунитета. Более точное название для гуморального иммунитета — «антительный или В-клеточный», так как ключевым «бойцом» здесь являются антитела (продукты В-клеток). А клеточный адаптивный иммунитет точнее называть «Т-клеточным», так как эффекторами этого звена являются Т-лимфоциты. В- и Т- клеточные звенья иммунитета работают не изолированно. Они взаимосвязаны. Но феномены, связанные с антительным иммунитетом, значительно проще исследовать и мы знаем о В-клеточном иммунитете значительно больше, чем о Т-клеточном. Большинство существующих вакцин работают, в основном или исключительно, стимулируя В-клеточный иммунитет. Единственный тип вакцин, который включает в иммунную защиту все типы иммунитета, это вакцины, состоящие из живых, но ослабленных (аттенуированных) возбудителей. Эти вакцины наиболее полно «имитируют» естественный инфекционный процесс. Но такие вакцины не полностью безопасны. Их пытаются заменить более безопасными «высокотехнологичными» вакцинами. Этот процесс идёт не очень быстро. Но это отдельная большая тема, в которую я сейчас углубляться не буду. Экскурс в иммунологию сделан для того, чтобы читатели-неспециалисты понимали, в самых общих чертах, что иммунная защита от инфекции, в частности, иммунная защита от SARS-CoV-2 не сводится только к антителам. Просто антительные иммунные ответы значительно легче изучать, чем Т-клеточные, а методы определения антител, в отличие от таковых для Т-клеточных иммунных ответов, относительно просты и легко коммерциализируются. Однако, без понимания роли каждого из этих двух звеньев адаптивного иммунитета попытки создание вакцины против SARS-CoV-2/COVID-19 это «блуждание в потемках». А ведь до сих пор не было ни одной научной публикации о Т-клеточном иммунитете при инфекции «новым коронавирусом»! Наконец она появилась.
В MedRxiv опубликован препринт статьи озаглавленной «Присутствие SARS-CoV-2-реактивных клеток у пациентов с COVID-19 и здоровых доноров» (оригинал здесь: https://doi.org/10.1101/2020.04.17.20061440). Не буду вдаваться в методические детали этой работы. Не специалисту с ходу в этом разобраться трудно. Остановлюсь на основных выводах:
1) Т-клетки, реагирующие на главный антиген SARS-CoV-2 (гликопротеин S), есть в крови 83% больных COVID-19. Частота обнаружения таких клеток коррелирует с тяжестью заболевания – у тяжелых больных COVID-19, таких клеток, как правило, было меньше или они отсутствовали (хотя размер выборки очень маленький). Существенной корреляции между антительным и Т-клеточным иммунными ответами у больных COVID-19 не обнаружено.
2) Т-клетки, реагирующие на гликопротеин S вируса SARS-CoV-2, обнаружены у здоровых людей, у которых нет никаких признаков инфицирования этим вирусом, ни в настоящем, ни в прошлом. Причём, реагирующие на вирус Т-клетки у больных COVID-19 и здоровых доноров «нацелены» на разные эпитопы гликопротеина S. Более того, эпитопы, с которыми реагируют Т-клетки от здоровых доноров, находятся в той части гликопротеина S, которая имеет наибольшее сходство с аналогичным белком «сезонных» коронавирусов.
Что это всё значит? Прежде всего, это только первая работа такого рода и количество исследованных случаев не слишком велико (больных исследовано – 18; здоровых доноров — 68). Работа выполнена в весьма авторитетной лаборатории, но независимо от авторитета, научные результаты должны пройти проверку на воспроизводимость. Если всё подтвердиться, то будут основания считать, что Т-клеточный иммунитет является важным, а возможно, и необходимым фактором для выздоровления. Остаётся открытым вопрос, насколько важен Т-клеточный иммунитет для поддержания пост-инфекционного иммунитета, если он конечно развивается (что пока не доказано). Методы, апробированные в данной работе, дают возможность этот вопрос изучить. Далее нужно разобраться, что означает неожиданно частая реактивность Т-клеток здоровых доноров с некоторыми эпитопами гликопротеина S. Действительно ли это связано с перекрёстной реакцией между «новым» и «старыми» сезонными коронавирусами? На уровне антительного ответа такой перекрёстной реактивности нет. Но может она есть на уровне Т-клеточных эпитопов. Если окажется, что это так, то можно будет, по крайней мере частично, объяснить индивидуальные различия в чувствительности к SARS-CoV-2, особенно, в зависимости от возраста. Ведь дети чаще взрослых болеют ОРВИ, вызванными обычными коронавирусами. Может в следствии этого они приобретают частичный иммунитет против SARS-CoV-2?
Источник
Т-клеточный
имунитет.
Дифференцировка
и функционирование Т-клеток (лимфоцитов).
Клетки иммунной системы включают в себя
лимфоциты, мон/макрофаги, гранулоциты.
Они различаются морфологически,
биохимически и функционально. ОБщее
их свойство- обеспечение иммунитета.
Все они происходят из ПСК. Зрелые
лимфоциты состоят из 2-х больших популяций:
тимусзависимые (Т-лимфоциты),дифференцирующиеся
в тимусе; тимуснезависимые.
(В-лимфоциты), дифференцирующиеся в
бурсе (у человека, возможно, в костном
мозге, АкЛТ).
Среди клеточных элементов иммунной
системы лидерство, как по количественным,
так и по функциональным параметрам
принадлежит Т-лимфоцитам, количество
которых составляет в периферической
крови от 60 до
80%общей
численности лимфоидных клеток. Зрелые
Т-лимфоциты диаметром около
6,5 мкм, ядро плотное, интенсивно
окрашенное, занимает всю клетку,
эксцентрически располагается почти
отсутствующая цитоплазма. Исследование
в сканирующем микроскопе показало, что
Т-лимфоциты имеют почти гладкую
поверхность, lg-рецепторов
на их поверхности в 100-1 000
раз меньше чем на В-лимфоцитах. В-клетки
больших размеров до 8.5
мкм, ядро менее интенсивно окрашено,
не содержит ядрышка, цитоплазма больших
размеров, базофильна. В-лимфоциты имеют
отростчатую поверхность за счет большой
плотности lg-рецепторов.
Функционально Т-лимфоциты определяют
практически полный спектр клеточных
реакций иммунитета, эффекторную функцию,
включая реакции гиперчувствительности
замедленного типа, реакции
противоопухолевого и трансплантационного
иммунитета, принимают участие в регуляции
функциональной активности кроветворных
стволовых клеток, В-лф. Это клетки,
которые осуществляют рецепцию антигена
и запуск иммунного ответа.
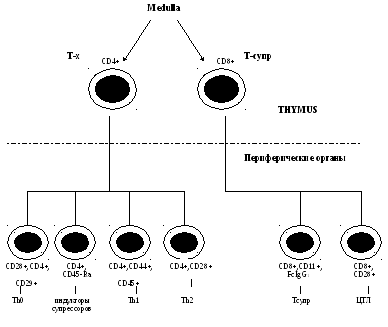
Функции Т-лимфоцитов.
1)эффекторной функции Т-лимфоциты
выполняют
2)иммунорегуляторную функцию.
3) взаимодействие с
макрофагами (АПК) —
распознавание антигена и запуск имунного
ответа.
4) продукция цитокинов,
регулирующих не только межсистемные
взаимодействия, но и многие жизненно
важные процессы в организме (например
Т-лимфоциты через продукцию ИЛ-3
воздействуют на самые ранние процессы
гемопоэза ).
Одной из особенностей Т-лимфоцитов
является их гетерогенность.
Среди Т-клеток выделяют:
регуляторы Тх/Тс;
Т-индукторы (Тинд,Тh1,Тh2);
Т-цитотоксические. Т-эффекторы ГЗТ.
Т-дифференцирующие (Т-амплифайеры) и
др.
Т-индукторы — клетки,
сходные по многим характеристикам
(морфологическим, функциональным)
с Т-хелперами, но активирующие другие
типы клеток, в частности Т-супрессоры.
Т-клетки замедленной
гиперчувствительности
— эти клетки
обеспечивают приток макрофагов в
локальные участки, например, на коже,
слизистых, где развивается клеточная
иммунная реакция по типу ГЧЗТ
(туберкулиновая проба и т.д.).
Т-клеточный рецептор для антигена TCR
В отличие от антигенраспознающих
рецепторов В-лимфоциты (молекулы
мембранных 1д) Т-лимфоциты имеют
специфический рецептор для антигена
-TCR. По строению молекулы
TCR оказались близкими молекулам
Ig и МНС.
В состав рецептора TCR
входит:
антигенрасопзнающий рецептор и молекула
CD3 в комплексе с молекулой
ГКГ 1 и II
класса. Молекула CD3,
связанная с TCR, вероятно,
осуществляет передачу сигнала от
TCR к внутриклеточным эффекторным
системам .
Онтогенез
Т-лимфоцитов.

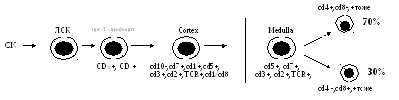
В костном мозге на пре-Т-лимфоцит
появляется самый ранний маркер
Т-лимфоцитов — CD7+(это
рецептор к µ-цепи Fc
фрагмента IgM). Ранние
предшественники мигрируют из костного
мозга через кровоток в тимус под действием
гормонов тимуса, где происходит их
размножение, созревание, образование
зрелых Т-лимфоцитов, оттуда миграция в
кровь, заселение периферических органов
.Только 5-10% пройдет позитивную селекцию,
90-95%- погибнет, а затем только начнется
заселение зон организма.
В тимус пре-Т поступают из сосудов,
расположенных между корковым и мозговым
веществом, где они первоначально
взаимодействуют с дендритными
клетками и макрофагами, а затем после
миграции в субкортикальный слой
-с эпителиальными клетками-«няньками»,
после чего начинается их активная
пролиферация.
Т-лимфоциты не вступившие во взаимодействие
с антигенами называют наивными, а
подвергнувшиеся действию гормонов и
т.д.- армированными.
Периферические
органы иммунной системы
В процессе созревания тимоцитов, их
взаимодействие с эпителиальными
клетками тимуса (клетки-«няньки»)
они учатся распознавать антиген,
экспрессир. антигенраспоэнающий
рецептор — позитивная
селекция {У/о клеток).
«Негативная селекция»-
(95%) — клетки, которые не научились
распознавать антиген, они имеют
рецепторы к аутоантигенам. На
дифференци-ровку (созревание) клеток в
тимусе влияют гуморальные факторы
тимуса и стромы. Гуморальные факторы
тимуса: тимозин, тимопоэтин, тимический
гормональный фактор, тимостимулин,
сывороточный тимический фактор, ИЛ-3.
Стромальные факторы: в медуллярной
зоне тимуса имеются макрофаги,
дендритные клетки тимуса.
Маркеры—
поверхностные структуры (или
внутриклеточные), характеризующие
как отдельные типы лимфоцитов, так и
определенные этапы их развития.
Варианты маркеров:
1) поверхностные антигены,
в т.ч. дифференцировочные, появляющиеся
и исчезающие в зависимости от стадии
развития клетки или сохраняющиес
на всех стадиях клеточного цикла;
2) поверхностные рецепторы
( распознающие структуры), с помощью
которых клетки узнают антиген и
воспринимают другие стимулы, необходимые
для их жизнедеятельности.
Важнейшими маркерами Т-лимфоцитов
служат рецепторы, которые отличаются
по строению, функциональному назначению
и разделены на 3 группы
1)антигенраспознающие рецепторы на Тлф
— (TCP.), на Влф
— рец.Тд
природы; позволяют специфически
распознавать антиген;
2) рецепторы для
иммунологически значимых продуктов
иммунной системы (рец. к Fclg,CI-C9,
лимфокинов цк и др.) —
необходимы для реализации различных
функций иммунной системы;
3) рецепторы для продуктов
неиммунного происхождения (гормонов,
нейропептидов и др.), рецепторы адгезии.
Методы идентификации Т-клеток.
Для выделения Т-лимфоцитов из пула
клеток крови или других тканей используют
различные приемы:
1) РОК
2) МКА
3 ) цитофлюорометрия
4) по рец. к Fc
lg-на Тх-Fc
lgM; -Т на Те-Fc
lgG; -Т
Патология в системе Т-клеточного
иммунитета.
— врожденная недостаточность
Т-лимфоцитов (первичный ИД
— Т-КИН, синдром Ди-Джорджа, синдром
атаксии-телеангиоэктазии и др);
— инфицирование Т-клеток
вирусом ВИЧ, острого лимфолейкоза
взрослых ;
— Т-клеточные
иммунопролиферативные заболевания
(варианты острого лимфолейкоза,
Т-клеточные лимфомы и Др.)-
— врожденные и приобретенные
дефекты Т-клеточного антигенраспоз-нающего
рецепторного комплекса или его отдельных
субъединиц, адгезив-ных молекул,
дефектность механизмов «обучения»
Т-лф в тимусе ( блок
позитивной и/или негативной селекции
тимических лимфоцитов) ;
— нарушение соотношения
регул. Т-лимфоцитов (CD4 и
008), субпопуляций с превышением
функции хелперно-индуцирующих клеток
— аутоиммун-ная и аллергическая
направленность или
супрессорно-ЦТК-иммунодефицит-ная
направленность иммунопатологии;
— приобретенные тимусзависимые
ИДС (удаление тимуса, поражение Т-клеток
физическими, фармакологическими и
другими методами, опухоли, нарушение
питания, инфекции, возрастные изменения
и др.);
— преактивация Т-лимфоцитов
in vivo (факторы
микроорганизмов, ау-тоантитела против
структур Т-клеток, фармакологические
средства и др.) с развитием аутоиммунных
процессов, повышенной продукцией ЦК,
актив, мф — усиление
воспалительных, деструктивных процессов).
3
Источник
Т-клетки памяти — популяция Т-лимфоцитов, хранящих информацию о ранее действовавших антигенах и формирующих вторичный иммунный ответ, осуществляющийся в более короткие сроки, чем первичный иммунный ответ, так как минует основные стадии этого процесса.
Суб-популяции[править | править код]
Внутри всей категории Т-клеток памяти выделяются минимум три субпопуляции, различающиеся экспрессией хемокиновых рецепторов CCR7 и L-селектина (CD62L).[1]
- Центральные клетки памяти TCM экспрессируют L-селектин и CCR7, также секретируют IL-2, но не секретируют IFNγ или IL-4.
- Эффекторные клетки памяти TEM не экспрессируют L-селектин и CCR7, а секретируют цитокины, такие как IFNγ и IL-4.
В последнее время выделены новые субпопуляции на основе CD27 и CD28 экспрессии в дополнение к CCR7 и CD62L.[2]
Функция[править | править код]
Антиген-специфическая память T-клеток может быть обнаружена в обеих популяциях TCM и TEM. Хотя большая доля представлений основана на исследованиях цитотоксических T-лимфоциты (CD8-положительных), сходные популяции, как представляется, существуют как для Т-хелперов (CD4-положительных) так и для цитотоксических T-лимфоцитов.
- Центральные клетки памяти (TCM). Считается что имея некоторые общие характеристики с клетками памяти, TCM проявляют потенциал самообновления благодаря высоким уровням фосфорилирования важного фактора транскрипции известного как STAT5.[3] TCM клетки мыши демонстрируют обеспечиваемую ими надежную защиту от вирусов,[4] бактерий,[4] и раковых клеток[5] в некоторых других моделях сравниваются с TEM клетками.
- два тесно связанных эффекторных подтипов клеток памяти, которые сильно экспрессируют гены для молекул, необходимых для цитотоксических функций СD8+ клеток:
- эффекторные клетки памяти (TEM)
- эффекторные клетки памяти RA (TEMRA)
- Антиген-опытные CD8+ Т-клетки с возможностями к самообновлению были описаны у мышей.[6][7] Эта популяция, названная стволовыми клетками памяти (TSCM), может быть идентифицирована по CD44(низким)CD62L(высоким)CD122(высоким)sca-1(+) уровням экспрессии и способна к производству TCM и TEM субпопуляций сохраняя при этом свою. В доклинических исследованиях трансплантированные TSCM показывают превосходящее значение для иммунитета в сравнении с другими субпопуляциями клеток памяти.[7] Остается предметом исследования существует ли такая популяция клеток в организме человека.
Исследование, опубликованное в Science, показало, что T-лимфоциты селезёнки могут синтезировать ацетилхолин в ответ на стимуляцию блуждающего нерва. (Science Sept 15, 2011. DOI : 10.1126/science.1209985)
Этот механизм может играть роль в регуляции воспаления посредством ФНО макрофагов.
Примечания[править | править код]
- ↑ Sallusto F., Langenkamp A., Geginat J., Lanzavecchia A. Functional subsets of memory T cells identified by CCR7 expression (англ.) // Curr. Top. Microbiol. Immunol. : journal. — 2000. — Vol. Current Topics in Microbiology and Immunology. — P. 167—171. — ISBN 978-3-540-67569-3. — doi:10.1007/978-3-642-57276-0_21. — PMID 11036772.
- ↑ Okada R., Kondo T., Matsuki F., Takata H., Takiguchi M. Phenotypic classification of human CD4+ T cell subsets and their differentiation (англ.) // Int. Immunol. (англ.)русск. : journal. — 2008. — September (vol. 20, no. 9). — P. 1189—1199. — doi:10.1093/intimm/dxn075. — PMID 18635582.
- ↑ Willinger T., Freeman T., Hasegawa H., McMichael A. J., Callan M. F. Molecular signatures distinguish human central memory from effector memory CD8 T cell subsets (англ.) // Journal of Immunology (англ.)русск. : journal. — 2005. — November (vol. 175, no. 9). — P. 5895—5903. — PMID 16237082.
- ↑ 1 2 Wherry EJ; Teichgräber V; Becker TC; Masopust, David; Kaech, Susan M.; Antia, Rustom; Von Andrian, Ulrich H.; Ahmed, Rafi. Lineage relationship and protective immunity of memory CD8 T cell subsets (англ.) // Nature Immunology : journal. — 2003. — March (vol. 4, no. 3). — P. 225—234. — doi:10.1038/ni889. — PMID 12563257.
- ↑ Klebanoff CA; Gattinoni L; Torabi-Parizi P; Kerstann, K; Cardones, AR; Finkelstein, SE; Palmer, DC; Antony, PA; Hwang, S. T. Central memory self/tumor-reactive CD8+ T cells confer superior antitumor immunity compared with effector memory T cells (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2005. — July (vol. 102, no. 27). — P. 9571—9576. — doi:10.1073/pnas.0503726102. — PMID 15980149.
- ↑ Zhang Y., Joe G., Hexner E., Zhu J., Emerson S. G. Host-reactive CD8+ memory stem cells in graft-versus-host disease (англ.) // Nature Medicine : journal. — 2005. — December (vol. 11, no. 12). — P. 1299—1305. — doi:10.1038/nm1326. — PMID 16288282.
- ↑ 1 2 Gattinoni L; Zhong XS; Palmer DC; Ji, Yun; Hinrichs, Christian S; Yu, Zhiya; Wrzesinski, Claudia; Boni, Andrea; Cassard, Lydie. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells (англ.) // Nature Medicine : journal. — 2009. — July (vol. 15, no. 7). — P. 808—813. — doi:10.1038/nm.1982. — PMID 19525962.
См. также[править | править код]
- Иммунная система
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 марта 2020;
проверки требует 1 правка.
Принципиальная схема механизма иммунной памяти у В-лимфоцитов
(B-клетки, от bursa fabricii птиц, где впервые были обнаружены) — функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального иммунитета. При контакте с антигеном или стимуляции со стороны T-клеток некоторые B-лимфоциты трансформируются в плазматические клетки, способные к продукции антител. Другие активированные B-лимфоциты превращаются в B-клетки памяти. Помимо продукции антител, В-клетки выполняют множество других функций: выступают в качестве антигенпрезентирующих клеток, продуцируют цитокины и экзосомы[1].
У эмбрионов человека и других млекопитающих B-лимфоциты образуются в печени и костном мозге из стволовых клеток, а у взрослых млекопитающих — только в костном мозге. Дифференцировка В-лимфоцитов проходит в несколько этапов, каждый из которых характеризуется присутствием определённых белковых маркеров и степенью генетической перестройки генов иммуноглобулинов.
Аномальная активность В-лимфоцитов может быть причиной аутоиммунных и аллергических заболеваний[1].
Дифференцировка В-лимфоцитов[править | править код]
B-лимфоциты происходят от плюрипотентных гемопоэтических стволовых клеток, дающих также начало всем клеткам крови. Стволовые клетки находятся в определённом микроокружении, которое обеспечивает их выживание, самообновление или, при необходимости, дифференцировку. Микроокружение определяет, по какому пути пойдёт развитие стволовой клетки (эритроидному, миелоидному или лимфоидному)[1].
Дифференцировка В-лимфоцитов условно делится на две стадии — антигеннезависимую (в которую происходит перестройка генов иммуноглобулинов и их экспрессия) и антигензависимую (при которой происходит активация, пролиферация и дифференцировка в плазматические клетки). Выделяют следующие промежуточные формы созревающих В-лимфоцитов:
- Ранние предшественники В-клеток — не синтезируют тяжёлых и лёгких цепей иммуноглобулинов, содержат зародышевые гены IgH и IgL, но содержат антигенный маркер, общий со зрелыми пре-В-клетками.
- Ранние про-В-клетки — D-J-перестройки в генах IgН.
- Поздние про-В-клетки — V-DJ-перестройки в генах IgН.
- Большие пре-В-клетки — гены IgН VDJ-перестроены; в цитоплазме есть тяжёлые цепи класса μ, экспрессируется пре-В-клеточный рецептор.
- Малые пре-В-клетки — V-J-перестройки в генах IgL; в цитоплазме есть тяжёлые цепи класса μ.
- Малые незрелые В-клетки — гены IgL VJ-перестроены; синтезируют тяжёлые и лёгкие цепи; на мембране экспрессируются иммуноглобулины (B-клеточный рецептор).
- Зрелые В-клетки — начало синтеза IgD.
В-клетки поступают из костного мозга во вторичные лимфоидные органы (селезёнку и лимфатические узлы), где происходит их дальнейшее созревание, презентация антигена, пролиферация и дифференцировка в плазматические клетки и В-клетки памяти.
В-клетки[править | править код]
Экспрессия всеми В-клетками мембранных иммуноглобулинов позволяет осуществляться клональному отбору под действием антигена. При созревании, стимулировании антигеном и пролиферации существенно меняется набор маркеров В-клеток. По мере созревания В-клетки переключаются от синтеза IgM и IgD на синтез IgG, IgA, IgE (при этом у клеток сохраняется способность синтезировать также IgM и IgD — вплоть до трёх классов одновременно). При переключении синтеза изотипов антигенная специфичность антител сохраняется.
Различают следующие типы зрелых В-лимфоцитов:
- Собственно В-клетки (ещё называемые «наивными» В-лимфоцитами) — неактивированные В-лимфоциты, не контактировавшие с антигеном. Не содержат тельца Голла, в цитоплазме рассеяны монорибосомы. Полиспецифичны и имеют слабое сродство к многим антигенам.
- В-клетки памяти — активированные В-лимфоциты, вновь перешедшие в стадию малых лимфоцитов в результате кооперации с Т-клетками. Являются долгоживущим клоном В-клеток, обеспечивают быстрый иммунный ответ и выработку большого количества иммуноглобулинов при повторном введении того же антигена. Названы клетками памяти, так как позволяют иммунной системе «помнить» антиген на протяжении многих лет после прекращения его действия. В-клетки памяти обеспечивают долговременный иммунитет.
- Плазматические клетки являются последним этапом дифференцировки активированных антигеном В-клеток. В отличие от остальных В-клеток, несут мало мембранных антител и способны секретировать растворимые антитела. Являются большими клетками с эксцентрично расположенным ядром и развитым синтетическим аппаратом — шероховатый эндоплазматический ретикулум занимает почти всю цитоплазму, также развит и аппарат Гольджи. Живут недолго (2—3 дня) и быстро элиминируются при отсутствии антигена, вызвавшего иммунный ответ.
Маркеры В-клеток[править | править код]
Характерной особенностью В-клеток является наличие поверхностных мембраносвязанных антител, относящихся к классам IgM и IgD. В комплексе с другими поверхностными молекулами иммуноглобулины формируют антигенраспознающий рецептивный комплекс — B-клеточный рецептор, ответственный за узнавание антигена. Также на поверхности В-лимфоцитов расположены антигены МНС класса II, важные для взаимодействия с Т-клетками, также на некоторых клонах В-лимфоцитов присутствует маркер CD5, общий с Т-клетками. Рецепторы компонентов системы комплемента C3b (Cr1, CD35) и C3d (Cr2, CD21) играют определённую роль в активации В-клеток. Следует отметить, что маркеры CD19, CD20 и CD22 используются для идентификации В-лимфоцитов. Также на поверхности В-лимфоцитов обнаружены Fc-рецепторы.
Активация В-клеток[править | править код]
Антигенпрезентирующие клетки (макрофаги, клетки Купфера, фолликулярные дендритные клетки, интердигитальные дендритные клетки и т. д.) вскоре после процессирования патогена выносят эпитопы на поверхность клетки при помощи белков МНС II, делая их доступными для Т-клеток. Т-хелпер при помощи Т-клеточного рецептора распознаёт комплекс эпитоп—МНС II. Активированный Т-хелпер выделяет цитокины, усиливающие антигенпрезентирующую функцию, а также цитокины, активирующие В-лимфоцит — индукторы активации и пролиферации. В-лимфоциты присоединяются при помощи мембраносвязанных антител, выступающих в роли рецепторов, к «своему» антигену и в зависимости от получаемых от Т-хелпера сигналов пролиферируют и дифференцируются в плазматическую клетку, синтезирующую антитела, либо перерождаются в В-клетки памяти. При этом от качества и количества антигена будет зависеть исход взаимодействия в данной трёхклеточной системе. Описанный механизм справедлив для полипептидных антигенов, относительно неустойчивых к фагоцитарному процессингу — т. н. тимусзависимых антигенов. Для тимуснезависимых антигенов (обладающих высокой полимерностью с часто повторяющимися эпитопами, относительно устойчивых к фагоцитарному перевариванию и обладающих свойствами митогена) участия Т-хелпера не требуется — активация и пролиферация В-лимфоцитов происходит за счёт собственной митогенной активности антигена.
Роль В-лимфоцитов в презентации антигена[править | править код]
В-клетки способны интернализовать свои мембранные иммуноглобулины вместе со связанным с ними антигеном и затем презентировать фрагменты антигена в комплексе с молекулами МНС класса II. При низкой концентрации антигена и при вторичном иммунном ответе В-клетки могут выполнять функцию основных антигенпрезентирующих клеток.
Клетки В-1 и В-2[править | править код]
Выделяют две субпопуляции В-клеток: В-1 и B-2. Субпопуляцию В-2 составляют обычные В-лимфоциты, к которым относится всё сказанное выше. В-1 — это относительно небольшая группа В-клеток, обнаруживаемая у человека и мышей. Они могут составлять около 5 % от общей популяции B-клеток. Такие клетки появляются в течение эмбрионального периода. На своей поверхности они экспрессируют IgM и небольшое количество (или вовсе не экспрессируют) IgD. Маркером этих клеток является CD5. Однако он не является обязательным компонентом клеточной поверхности. В эмбриональном периоде В1-клетки появляются из стволовых клеток костного мозга. В течение жизни пул B-1-лимфоцитов поддерживается за счёт активности специализированных клеток–предшественников и не пополняется за счёт клеток, происходящих из костного мозга. Клетка–предшественница отселяется из кроветворной ткани на свою анатомическую нишу — в брюшную и плевральную полости — ещё в эмбриональном периоде. Итак, место обитания B-1-лимфоцитов — прибарьерные полости.
B-1-лимфоциты значительно отличаются от B-2-лимфоцитов по антигенной специфичности продуцируемых антител. Антитела, синтезированные B-1-лимфоцитами, не имеют значительного разнообразия вариабельных участков молекул иммуноглобулинов, но, напротив, ограничены в репертуаре распознаваемых антигенов, и эти антигены — наиболее распространённые соединения клеточных стенок бактерий. Все B-1-лимфоциты — как бы один не слишком специализированный, но определённо ориентированный (антибактериальный) клон. Антитела, продуцируемые B-1-лимфоцитами, почти исключительно IgM, переключение классов иммуноглобулинов в B-1-лимфоцитах не «предусмотрено». Таким образом, B-1-лимфоциты — «отряд» противобактериальных «пограничников» в прибарьерных полостях, предназначенных для быстрой реакции на «просачивающиеся» через барьеры инфекционные микроорганизмы из числа широко распространённых. В сыворотке крови здорового человека преобладающая часть иммуноглобулинов — продукт синтеза как раз B-1-лимфоцитов, т.е. это относительно полиспецифичные иммуноглобулины антибактериального назначения.
Примечания[править | править код]
- ↑ 1 2 3 Samitas K., Lötvall J., Bossios A. B cells: from early development to regulating allergic diseases // Arch Immunol Ther Exp (Warsz).. — 2010. — Т. 58, вып. 3. — С. 209—225. — doi:10.1007/s00005-010-0073-2. — PMID 20458549.
Литература[править | править код]
- А. Ройт, Дж. Брюсстофф, Д. Мейл. Иммунология — М.: Мир, 2000 — ISBN 5-03-003362-9
- Иммунология (в 3 т.) / Под. ред. У. Пола. — М.: Мир, 1988
См. также[править | править код]
- Иммунная система
- Гуморальный иммунитет
Источник
