Т звено иммунитета иммунология

Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
При попадании в организм человека «клетки-агрессора», иммунная система распознаёт чужеродные и собственные измененные макромолекулы (антигены) и удаляет их из организма. Также при первичном контакте с новыми антигенами происходит их запоминание, что способствует их более быстрому удалению, в случае вторичного попадания в организм.
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов. Это клетки иммунной системы, являющиеся
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
- В-клетки (распознающие «агрессора» и вырабатывающие к нему антитела);
- Т-клетки (выполняющие функцию регулятора клеточного иммунитета);
- NК- клетки (разрушающие отмеченные антителами чужеродные структуры).
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
Справочно. Важной особенностью T-клеток является их способность реагировать только на презентированные антигены. На одном T-лимфоците находится только один рецептор к одному конкретному антигену. Это обеспечивает отсутствие реакции T-клеток на собственные аутоантигены организма.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
Около половины Т-лимфоцитов имеют антиген CD4, то есть являются Т-хелперами. Это помощники, стимулирующие процесс секреции антител В-лимфоцитами, стимулируют работу моноцитов, тучных клеток и предшественников Т-киллеров к «включению» в иммунную реакцию.
Справочно. Функция хелперов осуществляется за счёт синтеза цитокинов (информационных молекул, регулирующих взаимодействие между клетками).
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Важно. Нарушение работы клеток-помощников, а именно недостаточность их функции, наблюдается у больных с приобретённым иммунодефицитом. Т-хелперы являются основной мишенью ВИЧ. В результате их гибели нарушается иммунная реакция организма на стимуляцию антигенов, что приводит к развитию тяжёлых инфекций, росту онкологических новообразований и летальному исходу.
Т-киллеры
Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
После лизирования клетки «агрессора» Т-киллеры остаются жизнеспособными и продолжают циркулировать в крови, разрушая чужеродные антигены.
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Справочно. Помимо обеспечения реакций нормального иммунного ответа, Т-эффекторы могут участвовать в реакциях антителозависимой клеточной цитотоксичности, способствуя развитию гиперчувствительности второго типа (цитотоксической).
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Важно. Препараты с цитотоксическим действием используют в химиотерапии онкологических заболеваний.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Т-супрессоры и клетки памяти
Супрессоры подавляют функцию хелперов и В-лимфоцитарного звена. Однако современная классификация не выносит супрессоры в отдельную субпопуляцию. Поскольку доказано, что решающую роль в угнетении иммунной реакции играют апоптоз и специфические цитокины.
Помимо основных T-лимфоцитов, в организме человека существуют потомки клеток, контактировавших с антигеном и имеющих к нему рецепторы. Это клетки обеспечивающие иммунологическую память. Они способны в течение от десяти до 15 лет сохранять память об антигене, передавая её другим клеткам.
Справочно. Благодаря клеткам памяти обеспечивается быстрый иммунный ответ при повторном попадании «агрессора» в организм.
Нулевые лимфоциты
К ним относят лимфоциты, не имеющие T и B маркеров. Они составляют до 10% от всей популяции лимфоцитов. К ним относят NК-клетки (естественные киллеры) и K-клетки (киллерные).
Справочно. Основным отличием NK-клеток от T-киллеров является способность уничтожать не сенсибиллизированные клетки-мишени.
K-клетки отвечают за антителозависимую клеточную цитотоксичность. Они отражают взаимодействия гуморального и клеточного звеньев иммунитета, а также выступают в качестве «наводчиков» эффекторных (выполняющих функцию – в данном случае уничтожение) клеток на мишень.
NК- клетки обеспечивают контроль за качеством клеток и участвуют в формировании противовирусного иммунитета, обеспечиваютзащиту от роста опухолей и размножения мутировавших (дефектных) клеток.
Диагностика клеточного иммунитета
Диагностика T- и B-лимфоцитарного звена позволяет оценить состояние клеточного иммунитета. Базовое исследование с определением процентного содержания Т-, В- и нулевых клеток проводится с целью выявления первичных или вторичных иммунодефицитов, а также при контроле иммуностимулирующего лечения.
Исследование основных популяций при помощи маркеров CD3, 8, 19, 16+5б, а также соотношение между хелперами и киллерами, позволяет комплексно оценить иммунный статус. Для исследования используют венозную кровь.
Диагностика проводится при выявлении и контроле течения:
- аутоиммунных заболеваний (увеличено содержание CD3, CD4 хелперов);
- лимфолейкозов (повышено количество Т-лимфоцитов CD3);
- злокачественных новообразований (увеличено количество NK);
- ВИЧ (CD3, CD8);
- хронических инфекций, аллергических реакций, бронхиальной астмы и т.д.
Справочно. В зависимости от результатов анализа пациенту может быть рекомендована консультация иммунолога, гематолога, аллерголога, онколога или инфекциониста. С дальнейшим лечением у профильного специалиста по основному заболеванию.
Источник

Т-звено иммунитета. Клеточный иммунный ответ

Т-звено иммунитета: общая характеристика n Центральный орган – тимус n Клетки – Т-лимфоциты (Т-клетки) n Т-цитотоксические=Т-киллеры (уничтожают клетки организма, зараженные вирусами, бактериями, т. е. внутриклеточными патогенами) n Т-хелперы (вырабатывают цитокины, регулирующие формирование различных вариантов иммунного ответа) n Т-клетки распознают не свободный антиген, а антигенный пептид (эпитоп), встроенный в HLA-молекулы и презентированный АПК

Роль тимуса Убедительно показана при изучении заболевания, получившего название «синдром Ди. Джорджи (Di. George)», при котором генетически детерминированное недоразвитие этого органа приводит к отсутствию одной из популяций лимфоцитов — Т-лимфоцитов. У детей с таким врожденным иммунодефицитом проявлялась повышенная чувствительность к вирусным, грибковым и некоторым бактериальным инфекциям
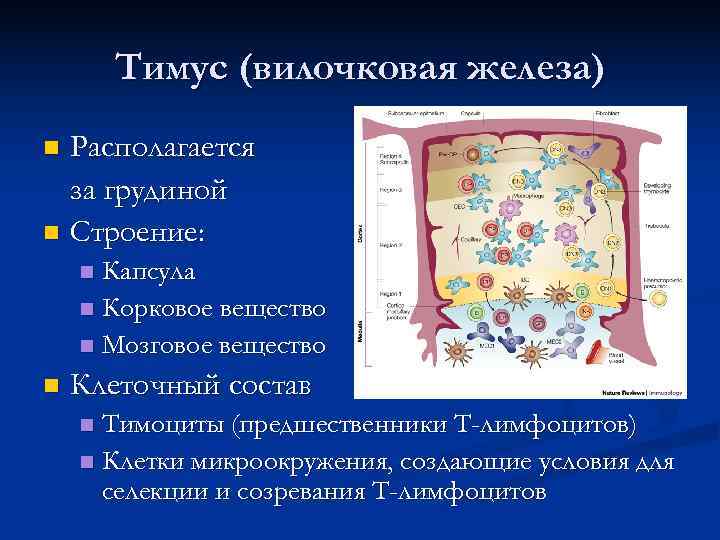
Тимус (вилочковая железа) n Располагается за грудиной n Строение: n Капсула n Корковое вещество n Мозговое вещество n Клеточный состав n Тимоциты (предшественники Т-лимфоцитов) n Клетки микроокружения, создающие условия для селекции и созревания Т-лимфоцитов

Микроокружение в тимусе n Клеточное n Эпителиальные клетки n Секреторные (продуцируют IL-7 и др. цитокины, а также пептиды и гормоны тимуса) n Ретикулярные (поддерживающие) n Клетки-няньки n Дендритные клетки n Макрофаги участвуют в селекции тимоцитов n Молекулярное n Тимопоэтин n Тимулин Гормоны тимуса (действуют не только в тимусе, но и на периферии) n Тимозины

Ключевым структурным и функциональным элементом иммунной системы является лимфоцит. Морфологически – это округлые клетки диаметром 7 -9 микрон с плотным ядром и узким ободком цитоплазмы. Наиболее характерной чертой этой популяции является способность распознавать собственные и чужеродные антигены. Лимфоцит – носитель рецептора для антигена, в случае контакта с которым происходит активация, пролиферация и дифференцировка в эффекторные или регуляторные участники иммунных процессов

Т-клетки n Разновидность лимфоцитов, основные этапы развития которых проходят в тимусе, что и определило их название (тимусзависимые, или Т-лимфоциты). Для них характерно участие в реализации иммунного ответа в качестве исполнительных и регуляторных клеток

Основное назначение тимуса – формирование зрелых Т-клеток. Включает: Появление антигенраспознающих рецепторов Дифференцировку Т-клеток на субпопуляции Отбор клонов Т-клеток, способных распознавать чужие АГ-пептиды в комплексе со своими HLA
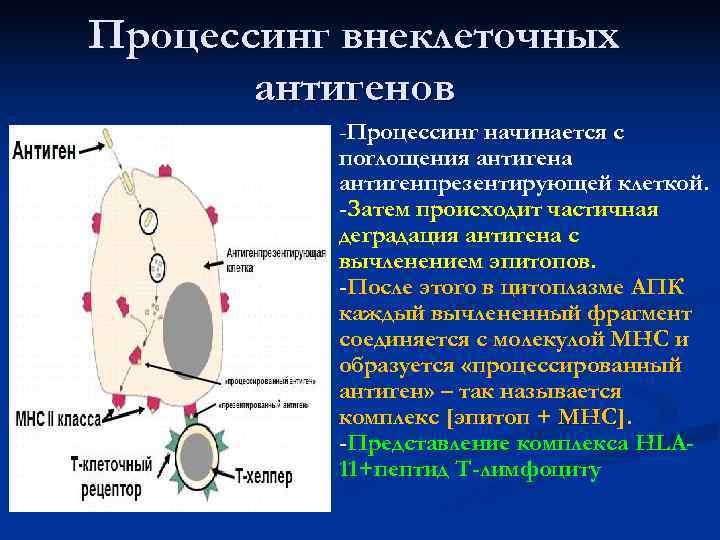
Процессинг внеклеточных антигенов -Процессинг начинается с поглощения антигена антигенпрезентирующей клеткой. -Затем происходит частичная деградация антигена с вычленением эпитопов. -После этого в цитоплазме АПК каждый вычлененный фрагмент соединяется с молекулой МНС и образуется «процессированный антиген» – так называется комплекс [эпитоп + МНС]. МНС -Представление комплекса HLA- 11+пептид Т-лимфоциту
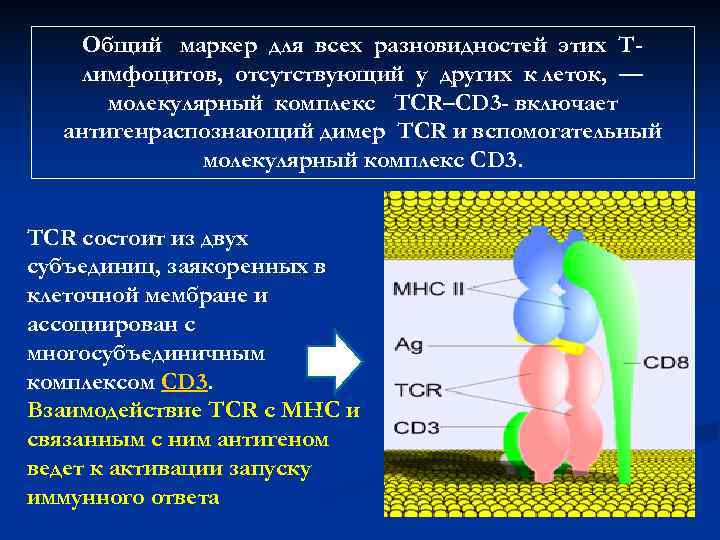
Общий маркер для всех разновидностей этих Т- лимфоцитов, отсутствующий у других к леток, — молекулярный комплекс TCR–CD 3 — включает антигенраспознающий димер TCR и вспомогательный молекулярный комплекс CD 3. TCR состоит из двух субъединиц, заякоренных в клеточной мембране и ассоциирован с многосубъединичным комплексом CD 3. Взаимодействие TCR с MHC и связанным с ним антигеном ведет к активации запуску иммунного ответа

В тимусе T-лимфоциты дифференцируются, приобретая Т- клеточные рецепторы и поверхностные маркеры опосредующие их взаимодействие с антигенпредставляющими клетками Т-лимфоциты несут на своей поверхности маркеры – антигены, которые объединены в кластеры дифференцировки (CD) Рецептор CD 3 CD 4 (у Т-хелперов) CD 8 (у Т-цитотоксических) CD 28 CD 40 L CD 25
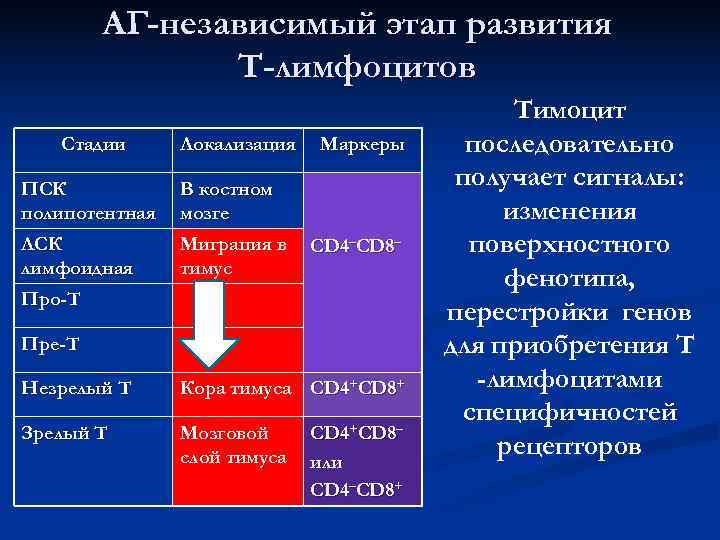
АГ-независимый этап развития Т-лимфоцитов Тимоцит Стадии Локализация Маркеры последовательно ПСК В костном получает сигналы: полипотентная мозге изменения ЛСК Миграция в CD 4–CD 8– поверхностного лимфоидная тимус фенотипа, Про-Т перестройки генов Пре-Т для приобретения Т Незрелый Т Кора тимуса CD 4+CD 8+ -лимфоцитами специфичностей Зрелый Т Мозговой CD 4+CD 8– слой тимуса или рецепторов CD 4–CD 8+
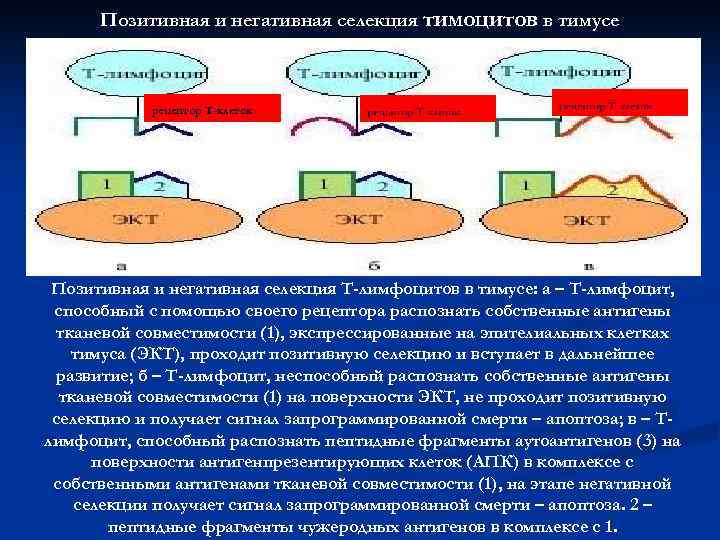
Позитивная и негативная селекция тимоцитов в тимусе рецептор Т-клеток Позитивная и негативная селекция Т-лимфоцитов в тимусе: а – Т-лимфоцит, способный с помощью своего рецептора распознать собственные антигены тканевой совместимости (1), экспрессированные на эпителиальных клетках тимуса (ЭКТ), проходит позитивную селекцию и вступает в дальнейшее развитие; б – Т-лимфоцит, неспособный распознать собственные антигены тканевой совместимости (1) на поверхности ЭКТ, не проходит позитивную селекцию и получает сигнал запрограммированной смерти – апоптоза; в – Т- лимфоцит, способный распознать пептидные фрагменты аутоантигенов (3) на поверхности антигенпрезентирующих клеток (АПК) в комплексе с собственными антигенами тканевой совместимости (1), на этапе негативной селекции получает сигнал запрограммированной смерти – апоптоза. 2 – пептидные фрагменты чужеродных антигенов в комплексе с 1.

Позитивная и негативная селекция n Позитивная селекция – сохранение тимоцитов, распознающих собственные молекулы МНС n Негативная селекция – уничтожение тимоцитов, распознающих собственные антигенные пептиды в комплексе с МНС- молекулами (чтобы предотвратить возможность аутоиммунных реакций) n В результате выживают и превращаются в зрелые Т-клетки только 2 -5% тимоцитов
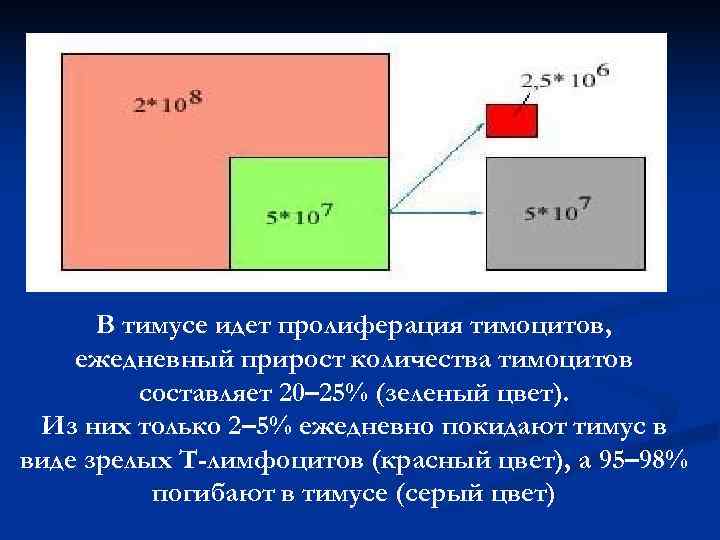
В тимусе идет пролиферация тимоцитов, ежедневный прирост количества тимоцитов составляет 20– 25% (зеленый цвет). Из них только 2– 5% ежедневно покидают тимус в виде зрелых Т-лимфоцитов (красный цвет), а 95– 98% погибают в тимусе (серый цвет)
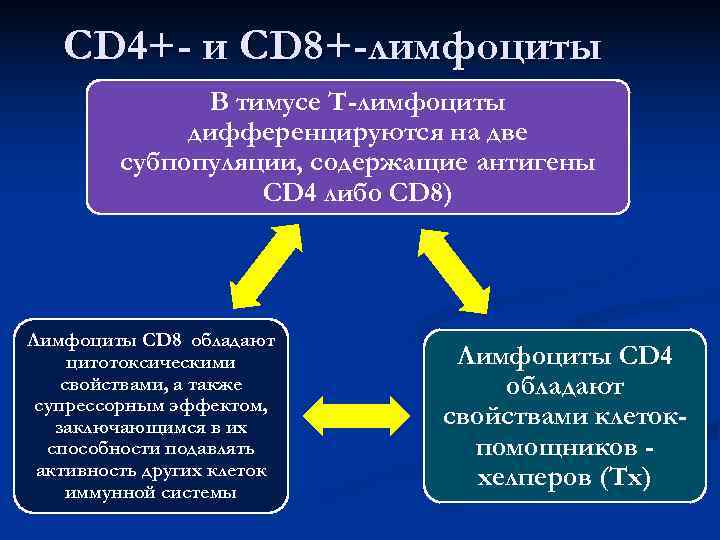
CD 4+- и СD 8+-лимфоциты В тимусе Т-лимфоциты дифференцируются на две субпопуляции, содержащие антигены CD 4 либо СD 8) Лимфоциты CD 8 обладают цитотоксическими Лимфоциты CD 4 свойствами, а также обладают супрессорным эффектом, заключающимся в их свойствами клеток- способности подавлять помощников — активность других клеток хелперов (Тх) иммунной системы

n Вышедшие из тимуса зрелые Т-клетки называют наивными, так как они еще не встречались с антигеном n После встречи с антигеном начинается АГ-зависимый этап развития Т-лимфоцитов
АГ-зависимый этап развития Т-лимфоцитов лимфоузлы Проходит в периферических органах иммунной системы МАЛТ селезенка

АГ-зависимый этап развития Т-лимфоцитов CD 8 лимфоциты дифференцируются в армированные Т-цитотоксические клетки CD 4 лимфоциты – T-хелперы-0 – (Th 0) дифференцируются в Th 1, либо Th 2 АПК презентирует АГ наивным Т- лимфоцитам, в результате чего:

Выделяют несколько подтипов Т -хелперов: Т-хелперы 0 (Th 0) — «наивные» , недифференцированные Т- хелперы Т-хелперы 2 (Th 2) — Т-хелперы 1 (Th 1) — активируют В-лимфоциты, преимущественно способствуя развитию способствуют развитию гуморального иммунного клеточного иммунного ответа; продуцируют ответа, активируя Т- интерлейкины 4, 5 и 13; киллеры; основной выделяемый цитокин — интерферон-гамма

Th 1 n Для их развития требуeтся IL-12, выделяемый дендритными клетками n Th 1 вырабатывают IFNγ, IL-2 и др. цитокины, стимулирующие макрофаги и Т-цитотоксические клетки n Значение Th 1: n стимуляция защиты от внутриклеточных патогенов: n Микобактерий – возбудителей туберкулеза, проказы n Вирусов

Th 2 n Для их развития требуется IL-4 n Th 2 вырабатывают: n IL-4 – стимулирует В-лимфоциты и выработку иммуноглобулинов (в 1 очередь Ig. E) n IL-5 – привлекает и активирует эозинофилы n Значение Th 2: n Поддержка гуморального иммунного ответа n Стимуляция защиты от гельминтов

Клеточный иммунный ответ: фаза индукции (запуска) n Поступление АГ n Захват антигенпрезентирующей (дендритной) клеткой АГ, его процессинг и перенос в регионарный лимфоузел n Презентация АГ: формирование иммунологического контакта между АПК и Т-лимфоцитом, передача сигнала внутрь клеток

Взаимодействия рецепторов в синапсе n Т-лимфоцит с помощью TCR распознает АГ пептид, встроенный в HLA-молекулу АПК. Сигнал через CD 3 передается внутрь Т-лимфоцита n Дополнительные: n Т-хелпер с помощью CD 4 соединяется с HLA-II n Т-цитотоксический с помощью CD 8 – c HLA-I n Костимулирующие: n CD 40 АПК взаимодействует с CD 40 L Т-клетки n CD 80 АПК соединяется с CD 28 Т-клетки (без этого взаимодействия разовьется анергия, т. е. неотвечаемость на антиген)
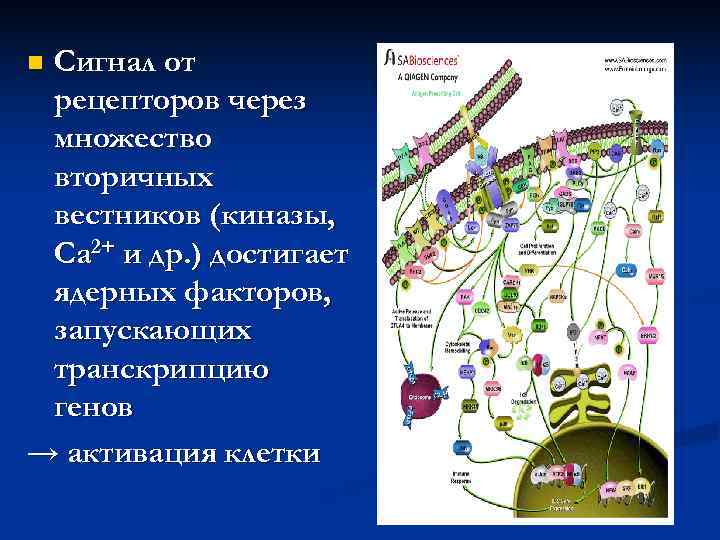
n. Сигнал от рецепторов через множество вторичных вестников (киназы, Ca 2+ и др. ) достигает ядерных факторов, запускающих транскрипцию генов → активация клетки

Фаза индукции (продолжение) n Активация Т-лимфоцита (выработка им IL-2 – главного фактора роста Т-клеток, и экспрессия его рецептора → аутокринная стимуляция) n Клональная экспансия (размножение клона Т- лимфоцитов, распознавших антиген) n Дифференцировка: n Наивных CD 8 лимфоцитов – в армированные Т- цитотоксические n Наивных CD 4 лимфоцитов (Th 0) – в Th 1 n Миграция Т-клеток из лимфоузла в кожу, слизистые оболочки
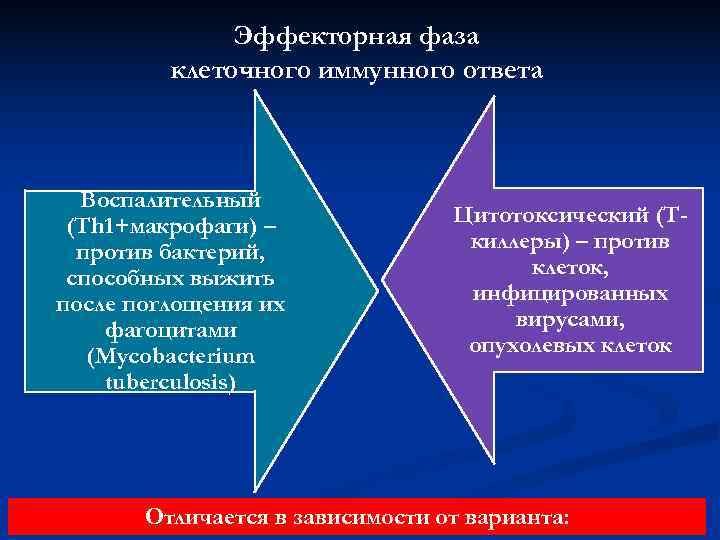
Эффекторная фаза клеточного иммунного ответа Воспалительный (Th 1+макрофаги) – Цитотоксический (Т- против бактерий, киллеры) – против способных выжить клеток, после поглощения их инфицированных фагоцитами вирусами, (Mycobacterium опухолевых клеток tuberculosis) Отличается в зависимости от варианта:

Воспалительный вариант клеточного ИО: эффекторная фаза n Макрофаги презентируют АГ Т-хелперам-1, сформировавшимся в фазу индукции n Распознав АГ, Th 1 выделяют IFNγ и другие цитокины, стимулирующие макрофаги n Макрофаги активируются и разрушают поглощенные бактерии, которые они без помощи Th 1 не могли уничтожить (так, IFNγ стимулирует образование NO, убивающего устойчивые к перевариванию микобактерии) n Активируясь, МФ выделяют провоспалительные цитокины (IL-1β, IL-6, TNFα), а также АФК, NO, ферменты, повреждающие не только патогены, но и нормальные клетки

Цитотоксический вариант клеточного ИО: эффекторная фаза n Сформировавшийся в фазу индукции армированный Т-цитотоксический лимфоцит уничтожает мишени без дополнительной активации n Мишень – клетка, инфицированная вирусом n Вирусные антигены расщепляются на протеасомах до пептидов, которые соединяются с HLA-I и выводятся на поверхность (так клетка сигнализирует о своей инфицированности) n Т-киллер с помощью ТCR распознает встроенный в HLA-I антигенный пептид, а с помощью CD 8 – саму молекулу HLA-I
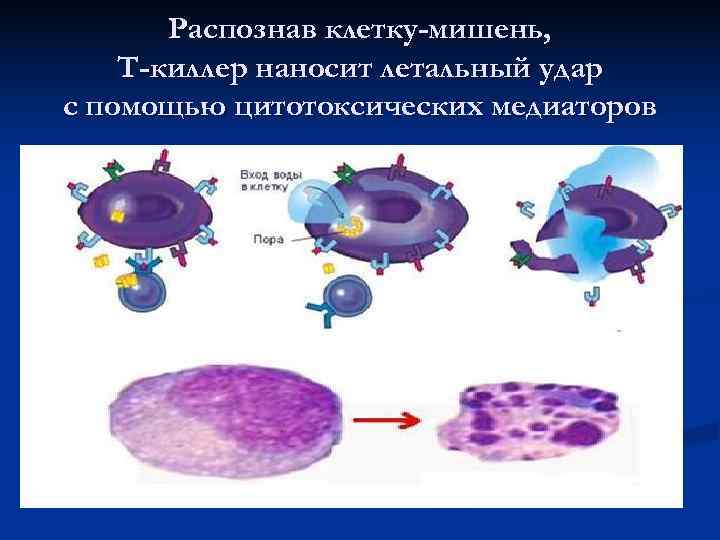
Распознав клетку-мишень, Т-киллер наносит летальный удар с помощью цитотоксических медиаторов

Механизмы Т-киллинга n Перфорин – полимеризуясь, формирует каналы в мембране клетки-мишени, в клетку входят ионы Na+, за ними – вода, клетка набухает и лопается. n Гранзимы – входят через отверстие, подготовленное перфорином и активируют внутриклеточные посредники апоптоза – каспазы, запускающие программированную гибель n TNFβ, Fas. L – соединяются с рецепторами на поверхности клетки-мишени, сигнал передается на каспазы → апоптоз

NK-клетки n Большие гранулярные лимфоциты n Маркеры: CD 16, CD 56 n Относятся к врожденному иммунитету (не нуждаются в презентации АГ, уничтожают мишени при первом же контакте) n Мишени: собственные клетки, на которых имеются молекулы клеточного стресса и отсутствуют HLA (зараженные вирусами и опухолевые клетки) n Киллинг: n Перфорин, гранзим
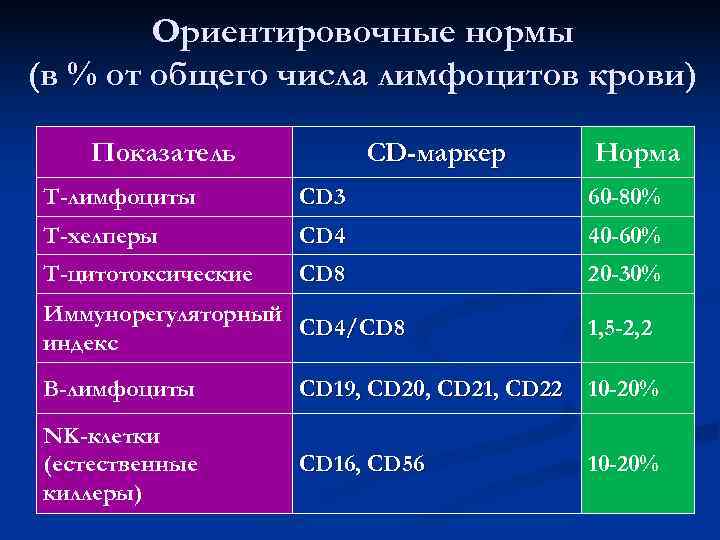
Ориентировочные нормы (в % от общего числа лимфоцитов крови) Показатель СD-маркер Норма Т-лимфоциты CD 3 60 -80% Т-хелперы CD 4 40 -60% Т-цитотоксические CD 8 20 -30% Иммунорегуляторный CD 4/CD 8 1, 5 -2, 2 индекс В-лимфоциты СD 19, CD 20, CD 21, CD 22 10 -20% NK-клетки (естественные CD 16, CD 56 10 -20% киллеры)
Источник
