Теория иммунитета нобелевская премия
Илья Ильич Мечников вошел в историю как создатель науки о старении — геронтологии. Кроме того, именно он понял, что такое иммунитет, и открыл явление фагоцитоза.
Илья Мечников родился 15 мая 1845 года в деревне Панасовка в Харьковской области. Его семья происходила из молдавских бояр, и они были довольно образованными для своего времени людьми. Например, его дед был вхож в литературные круги столицы и водил знакомство с Пушкиным и Крыловым. Старший брат будущего ученого водил дружбу со Львом Толстым — кстати, именно его последние дни писатель описал в повести «Смерть Ивана Ильича».
А вот отец Ильи был заядлым игроком в карты и после свадьбы быстро промотал почти все состояние жены. После этого родственники супруги заставили его уйти в отставку и поселиться в отдаленном имении. Там и появился на свет будущий ученый.
По традициям того времени у всех детей Мечниковых были домашние учителя. Один из них, студент-медик, преподававший старшим ребятам биологию, привил Илье интерес к природе и естественным наукам.
В 1856 году Илья Мечников поступает в харьковскую гимназию, но биологию не бросает. Он ходит на лекции по анатомии и физиологии в Харьковском университете, выписывает научные книги и уговаривает родителей купить ему микроскоп. В 1862 году он оканчивает гимназию с золотой медалью и, окрыленный, уезжает в Германию — поступать в Вюрцбургский университет.
И тут начинаются проблемы. Илья оказывается один в чужом городе, без знания языка. Квартирная хозяйка, у которой он планировал снимать жилье, отказывается сдать ему комнату. А ведь учеба еще даже не началась — до начала занятий оставалось почти 2 месяца… Илья, обескураженный неудачами, решает вернуться в Харьков, и поступает на естественное отделение физико-математического факультета Харьковского университета.
Но назвать полным провалом всю эту эпопею нельзя. Мечников привез с собой из Германии книгу, которая навсегда определила его убеждения — «Происхождение видов путем естественного отбора» Чарльза Дарвина.
Четырехлетний университетский курс Илья Мечников проходит за два года. За это время он определился со сферой своих научных исследований. Согласно теории Дарвина птицы и млекопитающие эволюционировали из самых простых животных — червей и других беспозвоночных. Вот их-то Мечников и решил исследовать. Тем более что позвоночные животные в то время были изучены куда лучше.
С 1864 по 1867 год Мечников работает за границей. Открывает новую группу червей-гастротрих на острове Гельголанд в Северном море, исследует чередование поколений беспозвоночных в Гисенском университете, исследует морских беспозвоночных в Неаполе. Там он знакомится с молодым русским зоологом Александром Ковалевским. И вместе они публикуют работу, которая подтверждает теорию Дарвина — они показали, что эмбрионы многоклеточных животных на разных стадиях развития очень похожи между собой. Сейчас картинки, иллюстрирующие этот принцип, есть во всех учебниках биологии.
Мечникову в то время всего 22 года, но он уже защитил диссертацию и получил докторскую степень в Санкт-Петербургском университете. Из-за постоянного сидения над микроскопом и работы с бумагами у него сильно портится зрение. Поэтому Илья Ильич вынужден делать перерывы в исследованиях и в 1870 году становится ординарным профессором кафедры зоологии в Новороссийском университете в Одессе.
Как отмечали современники, Илья Ильич был мрачным и пессимистичным по натуре. Оказавшись в незнакомом городе, он остро переживал свое одиночество и впал в депрессию. Во время болезни за ним ухаживала родственница известного химика Бекетова — Людмила Федорович. И ученый влюбляется в нее. Но вскоре она сама тяжело заболела чахоткой. Людмила была настолько слаба, что в церковь для венчания ее вносили в кресле… От болезни она так и не оправилась.
После смерти жены ученый был так подавлен, что попытался покончить с собой и выпил морфий. Но судьба сыграла шутку: доза оказалась слишком высока, яд вызвал рвоту и не успел попасть в кровь. Оправившись, Мечников выбросил все запасы морфия и никогда больше не прибегал к нему.
Но уже в 1875 году он женится на своей студентке Ольге Белокопытовой. На тот момент ей было всего 15 лет, и на свадьбу она надела первое в своей жизни длинное платье… А на следующее утро девочка поднялась пораньше, чтобы лучше приготовить урок по зоологии и тем самым доставить приятное супругу… Детей у них не было, и после смерти родителей жены Мечниковы стали опекунами ее братьев и сестер.
Но после 1881 года все меняется. Убийство Александра II влечет за собой реакционную волну. В университетах начинают ужесточать дисциплину. В ответ на это возникает все больше радикально настроенных студенческих группировок. Мечников выступает против закручивания гаек в области просвещения и в 1882 году уходит в отставку. И переезжает в Мессину. Именно там ученый делает открытие, которое перевернуло всю его жизнь.
«Мне пришло в голову, — писал потом Мечников, — что подобные клетки должны служить в организме для противодействия вредным деятелям. Я сказал себе, что если мое предположение справедливо, то заноза, вставленная в тело личинки морской звезды, не имеющей ни сосудистой, ни нервной системы, должна в короткое время окружиться налезшими на нее подвижными клетками, подобно тому, как это наблюдается у человека, занозившего себе палец. В крошечном садике при нашем доме я сорвал несколько розовых шипов и тотчас же вставил их под кожу великолепных, прозрачных, как вода, личинок морской звезды. Я, разумеется, всю ночь волновался в ожидании результата и на другой день, рано утром, с радостью констатировал удачу опыта. Этот последний и составил основу теории фагоцитов, разработке которой были посвящены последующие 25 лет моей жизни».
Эту гипотезу Илья Ильич подтвердил очень простым способом. Он воткнул в тело личинки шип розы и наблюдал, как вокруг занозы скопились амебоциты. Они либо пытались поглотить инородное тело, либо создавали защитный слой вокруг него. Мечников назвал эти клетки фагоцитами (от греческого слова «есть»), а само явление — фагоцитозом.
Ученый приезжает в Одессу и открывает свою частную лабораторию. Однажды он получает выгодный заказ от местного помещика — сделать прививку овцам от сибирской язвы. Мечников в то время находился в своем имении и передал дело ученикам. Но те допустили несколько серьезных ошибок, и в результате от болезни погибло 80 процентов из четырехтысячной отары… Ученики еле-еле спаслись от расправы разгневанных пастухов, а помещик подал в суд. Скандал был таким громким, что Министерство внутренних дел запретило прививки от сибирской язвы по всей России! И даже то, что в Париже опыты по вакцинации закончились триумфом, никого не убеждало. В конце концов, то Париж, а то Одесса — две большие разницы…
Вдобавок к этому в имении Мечникова случился бунт, 12 человек отправились на каторгу на Сахалин… Все эти беды нервировали ученого и мешали работать. И в 1888 году он эмигрировал в Париж. Как оказалось, навсегда…
Там он знакомится с Луи Пастером, который предлагает ему кафедру в своем институте.
В Пастеровском институте Мечников нашел тихую гавань, которую так долго искал. Там никто не мешал ему заниматься исследованиями, и он проработал на своей кафедре 28 лет. Илья Ильич получил широкое признание в научной среде благодаря циклу работ, посвященных эпидемиологии холеры, чумы, брюшного тифа и туберкулеза.
Этими исследованиями Мечников занимается и по личным причинам: от брюшного тифа умирает его вторая жена. Илья Ильич снова пытается покончить с собой и вкалывает себе вакцину, содержащую возбудителей тифа. Но после тяжелой болезни он выздоравливает. А по иронии судьбы, вместе со здоровьем улучшаются и зрение, и даже характер — теперь Мечников уже не так мрачно смотрит на мир…
Эти исследования позволяют ему развить свою теорию фагоцитоза, и Мечников выдвигает фагоцитарную теорию иммунитета.
Суть теории вот в чем: Илья Ильич предположил, что фагоциты захватывают и изолируют вредные тела, вызывающие заболевание. Это позволяет организму их изучить и выработать стратегию борьбы с ними. Организм вырабатывает соответствующие антитела и при повторном заражении уже знает, как бороться ними. Так, например, работают прививки от гриппа и других заболеваний.
За эту теорию в 1908 году Мечникову присудили Нобелевскую премию. Но сам он к тому моменту уже увлекся механизмами старения организма.
В 1903 году Илья Ильич опубликовал книгу, посвященную умению «жить правильно». Ученый считал, что люди стареют и умирают слишком рано. По его мнению, это происходит из-за микробов кишечной флоры, которые отравляют организм токсинами. Бороться с этим Мечников предлагал с помощью диеты: употреблять побольше кисломолочных продуктов, например, йогуртов, и поменьше мяса. Современные компании до сих пор производят «мечниковскую простоквашу» по его рецепту.
Не меньший вред, с точки зрения ученого, наносят и «противоречия человеческой природы». А преодолеть их возможно только с помощью науки и культуры.
Начало Первой мировой войны Илья Ильич очень сильно переживал — он-то понимал сколько бед и несчастий она принесет людям. Мечников перенес несколько инфарктов и в 1916 году скончался. Согласно завещанию урна с его прахом хранится в библиотеке Пастеровского института.
Великие ученые: Илья Мечников.Русский и французский биолог. Лауреат Нобелевской премии в области физиологии и медицины
Источник
• Древняя история до 20 века • 20-й век • Первые шаги. Резус-фактор •
• Цитокины, интерлейкины •Законы трансплантации • Превратности судьбы •
• Иммунология в России • Нобелевские лауреаты •
Нобелевские лауреаты за работы по иммунологии.
В заключение исторического очерка приведем список лауреатов Нобелевской премии по биологии и медицине за работы по иммунологии. Напомним, что Нобелевская премия учреждена с 1901 г. и за исключением нескольких первых премий, как правило, ее не присуждают раньше чем через 15—20 лет после первой публикации авторов. Эти 15—20 лет отводят для проверки и перепроверки заявляемого открытия.
Эмиль Беринг (Emil A. von Behring, I854—1917, Германия) — Нобелевская премия 1901 г. за открытие антитоксинов, впоследствии антител, и серотерапию дифтерии. Это первая в истории Нобелевская премия,
Роберт Кох (Robert Koch, 1843—1910, Германия) — Нобелевская премия 1905 г. за исследования по туберкулезу.
Илья Ильич Мечников (1845—1916, Россия) — Нобелевская премия 1908 г. за открытие защитной роли фагоцитоза и клеточную теорию иммунитета.
Пауль Эрлих (Paul Ehrlich, 1854—1915, Германия) — Нобелевская премия 1908 г. (совместно с И.И.Мечниковым) за гуморальную теорию иммунитета.
Шарль Рише (Charles Richet, 1850—1935, Франция) — Нобелевская премия 1913 г. за работы по анафилаксии и открытие того, что иммунный ответ может не только защитить, но и повредить организм.
Жюль Борде (Jules Bordet, 1870—1961, Бельгия) — Нобелевская премия 1919 г. за экспериментальные работы по комплементзависимому бактериолизу, специфическому гемолизу, за разработку метода фиксации комплемента для диагностики инфекционных болезней.
Карл Ландштейнер (Karl Landsteiner, 1868—1943, Австрия) — . Нобелевская премия 1930 г. за открытие групп крови и фундаментальную книгу «The Specificity of Serologic Reactions». Сам К.Ландштейнер считал, что не открытие групп крови — его главное дело жизни, а исследования реакции антигена с антителом.
Макс Тэйлер (Max Theiler, 1899-1972, ЮАР, Англия, США) — Нобелевская премия 1951 г. за создание вакцины против желтой лихорадки.
Дэниэль Бовэ (Daniel Bovet, 1907, Швейцария) — Нобелевская премия 1957 г. за открытие роли гистамина в патогенезе аллергических реакций и разработку антигистаминных фармакологических препаратов для лечения аллергических болезней. Кроме того, он разработал курареподобные релаксанты, транквилизаторы и ряд анестетиков.
Фрэнк Вернет (F.Macfarlane Buraet, 1899—1985, Австралия) и Питер Медавар (Peter В. Medawar, 1915—1987, Великобритания) — Нобелевская премия 1960 г. за исследования по искусственной индукции иммунологической толерантности.
Родни Портер (Rodney R. Porter, 1917—1985, Великобритания) и Джеральд Эдельман (Gerald M. Edelman, 1929, США) — Нобелевская премия 1972 г. за установление химической структуры молекул антител.
Розалин Ялоу (Rosalyn Yalow, 1921) — Нобелевская премия 1977 г. за разработку конкурентного радиоиммунологического анализа, позволившего определять нано- и пикограммовые количества пептидных гормонов.
Бару Бенацерраф (Baruj Benacerraf, 1920, США), Жан Доссе (Jean Dausset, 1916, Франция) и Джордж Д. Снелл (Gearge D. Snell, 1903, США) — Нобелевская премия 1980 г. за открытие генов и структур поверхности клеток главного комплекса гистосовместимости.
Нилье Йерне (Niels К. Jerne, 1911—1994, Великобритания) — Нобелевская премия 1984 г. за разработку теории идиотипических сетей. Кроме того, Н.Йерне разработал метод количественного подсчета антителообразующих клеток. Именно Н.Йерне является первым, кому принадлежит самая фундаментальная и по сей день основная идея иммунологии — идея клональности лимфоцитов, следовательно, клональности любого иммунного ответа.
Георг Кёлер (Georges F. Kohler, 1946—1995, Германия) и Цезарь Мильштейн (Cesar Milstein, 1927, Великобритания) — Нобелевская премия 1984 г. за разработку революционного биотехнологического метода — получения гибридом и моноклональных антител.
Сузуму Тонегава (Susumu Tonegawa, 1939, Япония) — Нобелевская премия 1987 г. за работы по молекулярной биологии генов иммуноглобулинов и раскрытие механизмов, обеспечивающих разнообразие антигенсвязывающих участков молекул антител — рекомбинацию ДНК в соматических клетках (лимфоцитах).
Питер Дохерти (Peter Doherty, 1940, США) и Рольф Цинкернагель (Rolf Zinkernagel, 1944, Швейцария) — Нобелевская премия 1996 г. за открытие двойного распознаванияв иммунологии — природной функции молекул главного комплекса гистосовместимости.
Стенли Прусинер (Stenly Prusiner, США) — Нобелевская премия 1997 г. за открытие прионов — возбудителей инфекций нового типа, не похожих на известные ранее медицине. К прионным инфекциям относят возбудителей губчатого энцефалита — бешенства коров, заразного и для человека, в том числе по пищевым путям, всколыхнувшего Европу в 1996—1997 гг. Его первые публикации на эту тему были сделаны в 1982 г.
Лилацд Хартуэлл (L. Hartwall, 1939, США), Тимоти Хант (Т. Hunt, 1943, Великобритания), Пол Нерс (P. Nerth, 1949, Великобритания) — Нобелевская премия 2001 г. за исследования генов и их продуктов, контролирующих пролиферацию клеток. Хартуэлл ввел понятие CDC — cell division cycle, оценил количество генов, обеспечивающих деление клетки как не менее 100 и идентифицировал стартовый ген (start), инициирующий переход клетки из фазы gj в фазу S. Нерс нашел гены, кодирующие ферменты киназы, обеспечивающие переход клетки в фазу митоза — М. Хант нашел в клетке белки — циклины, приводящие в активное состояние киназы Нерса (CDK — cyclin dependent kinase), каждой киназе — свой циклин. Эти открытия существенным образом способствовали пониманию того, что этиология и патогенез злокачественных опухолей есть проблемы повреждения системы генов CDC.
По прогнозу одного из наиболее уважаемых современных теоретиков иммунологии Чарльза Джанвея (С. A. Janeway), который является также исследователем и преподавателем (он ведущий автор отличного учебника «Immunobiology: immune system in health and disease», переиздаваемого ежегодно с 1994 г.), ближайшей Нобелевской премии по иммунологии, заслуживают авторы исследований по молекулярным механизмам эволюционного происхождения процессов перестройки ДНК генов рецепторов лимфоцитов для антигенов. Две независимые группы исследователей получили фактические данные молекулярной биологии, наводящие на мысль, что инициаторные гены перестройки ДНК RAG-1 и RAG-2 — это транспозоны, т.е. ретро-вирусы по происхождению(отсутствие нитронов, характерные последовательности нуклеотидов и т.д.). Инфекция этих древних вирусов в гаметы каких-то древних челюстных рыб привнесла полезные для выживания свойства, которые закрепились отбором и превратились со временем в такое биологическое свойство всех вышестоящих многоклеточных, как лимфоцитарный иммунитет.
• Древняя история до 20 века • 20-й век • Первые шаги. Резус-фактор •
• Цитокины, интерлейкины • Законы трансплантации • Превратности судьбы •
• Иммунология в России • Нобелевские лауреаты •
Об иммунитете
Источник: Р.М. Хаитов «Иммунология» 2002г.
Источник
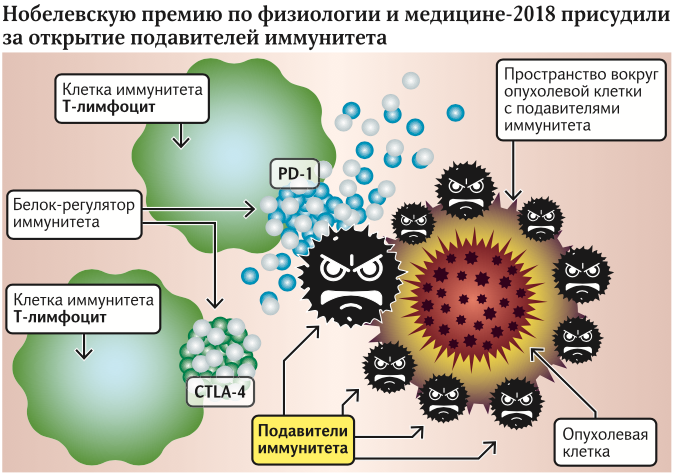
Вчера были названы лауреаты Нобелевской премии по физиологии и медицине. Ими стали иммунологи Джеймс Эллисон из США и Тасуку Хондзё из Японии. Почетным призом были отмечены работы ученых, касающиеся открытия механизма локального подавления иммунитета вокруг злокачественных опухолей. Пионерская работа Эллисона касалась открытия белка CTLA-4, а Хондзё параллельно открыл белок PD-1.
Открытия Джеймса Эллисона и Тасуку Хондзё касаются фундаментального вопроса, которым задавались врачи на всем протяжении изучения онкологических заболеваний. Понятно, что основным защитником организма в борьбе со злокачественными клетками является иммунитет. Каждый день в нашем организме возникают зачатки опасных опухолей, но иммунная система оперативно справляется с ними, поэтому мы и не догадываемся об их существовании. Диагноз «рак» ставят в случае, когда неожиданно одна из опухолей находит пути «взломать» защиту организма.
Длительное время у онкобольных пытались найти нарушение иммунитета — ведь понятно, что если опухоль растет, то иммунитет с ней не справляется. Однако все попытки найти системные нарушения иммунитета оказались неудачными.
Джеймс Эллисон и Тасуку Хондзё установили потрясающий факт: опухоль в стадии роста способна сама выделять иммуносупрессоры, то есть ограничители иммунитета. Поэтому на уровне организма эффекты падения защиты увидеть нельзя, а рядом с опухолью — можно.
По словам руководителя отдела биологии опухолевого роста НИИ онкологии им. Н.Н. Петрова, заведующего кафедрой медицинской генетики Санкт-Петербургского педиатрического университета, профессора кафедры онкологии Северо-Западного медицинского университета им. И.И. Мечникова Евгения Имянитова, это действительно один из самых значительных прорывов онкологии в понимании механизмов вовлечения иммунитета.

— Как мы знаем, онкологию лечат при помощи хирургического вмешательства, облучения и химиотерапии. Открытие нобелевских лауреатов привело к появлению четвертого столпа в борьбе с раком — работы с иммунитетом. Благодаря этому открытию были разработаны лекарства, которые снижают активность иммуносупрессоров и приводят к уменьшению опухоли, — отмечает эксперт.
Исследования белков СTLA-4 и PD-1 велись почти 30 лет. В настоящий момент получены лекарства, которые подавляют локальную защиту опухоли, вынуждая иммунитет работать в обычном режиме. Как считает руководитель лаборатории геномной инженерии МФТИ Павел Волчков, это говорит о том, что в будущем с раком будет бороться иммунитет человека, а не химиотерапия, которая убивает и «своих» и «чужих».
В настоящий момент, по словам научного сотрудника лаборатории молекулярной иммунологии и вирусологии НИЦ «Курчатовский институт» Сергея Крынского, разрабатываются и внедряются различные подходы к стимулирующей иммунотерапии у онкологических больных, основанные на природоподобных технологиях направленной активации иммунных клеток больного.
— В их числе, например, метод противоопухолевой вакцинации, основанный на введении в организм фрагментов белков опухоли для стимуляции иммунного ответа на нее. Другой современный метод — это использование собственных лимфоцитов пациента, обработанных в лабораторных условиях биологически активными веществами, лимфокинами, и затем возвращенных в организм для эффективной атаки на опухоль (метод лимфокин-активированных киллеров, или ЛАК-терапия). Эффективное применение этих методов было бы невозможным без открытий Джеймса Эллисона и Тасуку Хондзё.
Академик РАН, заведующий лабораторией молекулярных механизмов иммунитета Института молекулярной биологии им. В.А. Энгельгардта РАН и заведующий кафедрой иммунологии биологического факультета МГУ им. М.В. Ломоносова Сергей Недоспасов считает нынешнее присуждение одним из самых справедливых в недавней истории этой премии.
— Я лично хорошо знаю и Джеймса Эллисона, и Тасуку Хондзё. Почти 30 лет назад они открыли важные молекулы, которые участвуют в сигнальных каскадах иммунной системы. Потом они установили, что речь идет о молекулярных тормозах для Т-лимфоцитов. А потом оказалось, что именно эти молекулы могут стать мишенью для лекарств при борьбе с опухолями. Однако не стоит думать, что эти очень важные и наукоемкие лекарства станут панацеей. Это просто еще один важный инструмент для онкологов. И нужно понимать, что он работает не на всех видах рака, не на всех пациентах и имеет побочные действия, — подчеркнул Сергей Недоспасов.
Побочные эффекты связаны с тем, что лекарства отключают механизм, блокирующий аутоиммунные заболевания. Но так как они развиваются долго и только в редких случаях приводят к смерти, этот риск считается приемлемым для онкологического пациента. Поэтому российские производители также приступили к созданию лекарств на основе антител к PD-1 и CTLA-4.
Компания Biocad с 2013 года разрабатывает препараты против меланомы, один из которых уже близок к выходу на рынок.
— Решение работать с этими белками было принято еще в 2013 году, когда появились самые первые результаты клинических исследований при использовании антител к PD-1, показавшие прорывные результаты на меланоме, — рассказал вице-президент компании по исследованиям и разработкам Роман Иванов. — Сейчас мы понимаем, что самый лучший терапевтический эффект можно достигнуть при совмещении этих двух антител. Препарат от меланомы на основе антител к PD-1 будет подан в ближайшее время на регистрацию в Минздрав. В первой половине 2019 года препарат появится на российском рынке. Потом мы планируем провести испытания этого же препарата при раке легкого и раке шейки матки. А вот препарат, в котором два антитела будут применяться вместе, поступит на рынок через два-три года.
Понятно, что созданные на основе антител лекарства будут иметь высокую стоимость. Поэтому, прежде чем их применять, нужно убедиться в эффективности их воздействия на конкретного пациента. Для этого в Курчатовском институте разработан метод OncoBox, позволяющий подобрать онкологическому больному наиболее эффективное лечение на основе генного анализа раковой опухоли.
Технология OncoBox уже проходит клинические испытания. Ученые рассчитывают, что через два года начнется ее использование в больницах. OncoBox позволяет исследовать индивидуальную реакцию пациента на прием лекарств — в частности, какой препарат можно использовать для эффективного лечения поздней стадии рака. Анализ предполагает взятие образца опухоли и исследование более 2 тыс. его генов. После этого тест OncoBox сымитирует воздействие 140 целевых препаратов на раковую опухоль, а специалисты оценят эффективность лекарств для конкретного больного.
Источник
