Тромбоциты в клеточном иммунитете

Внутренняя среда организма складывается из 3 тесно взаимосвязанных компонентов: кровь, лимфа и межклеточная жидкость (тканевая,
интерстициальная).
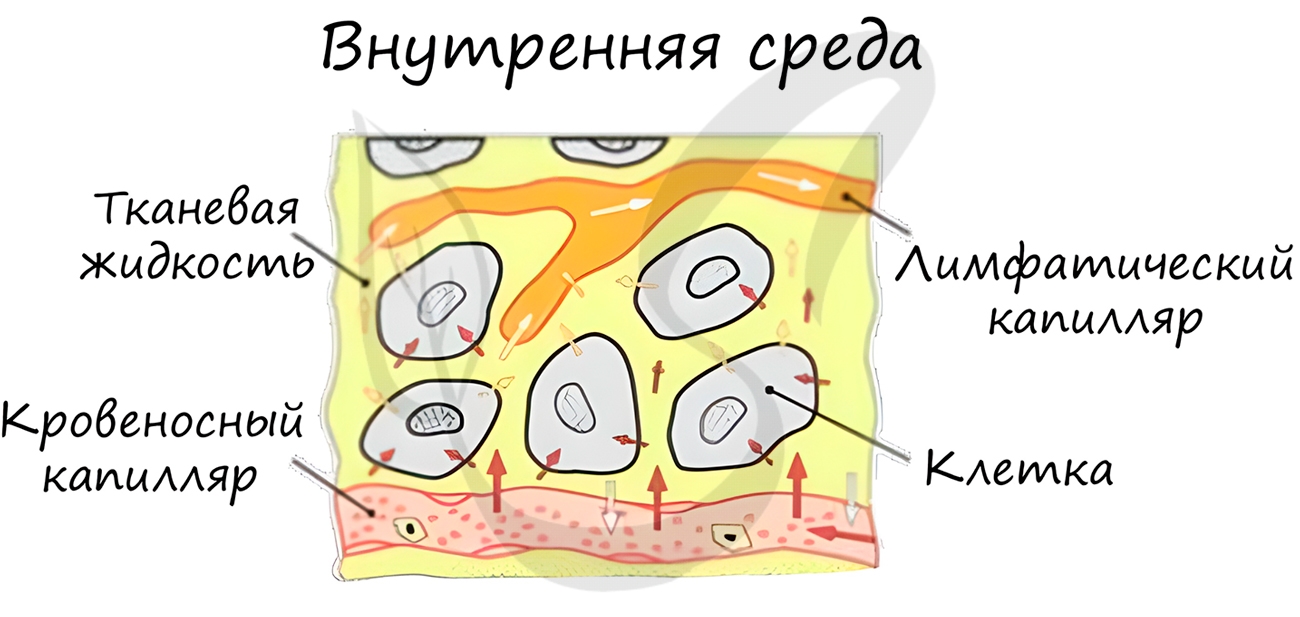
В капиллярах стенка состоит из одного слоя клеток, что делает возможным газообмен и обмен питательными веществами с окружающими капилляр тканями. Через стенку
сосуда газы, питательные вещества и вода из крови устремляются к клеткам. В клетках происходит тканевое дыхание, в межклеточную
жидкость выделяется углекислый газ, который затем поступает в кровь, соединяется с гемоглобином и, достигая альвеол в легких,
удаляется из организма.
У лимфатических сосудов есть особенность, которую вы всегда обнаружите на рисунке: они начинаются слепо, в отличие от кровеносных
сосудов. Лимфу в них образует вода, поступающая из межклеточной жидкости. Лимфа участвует в перераспределении жидкости в организме.
Состав и функции крови
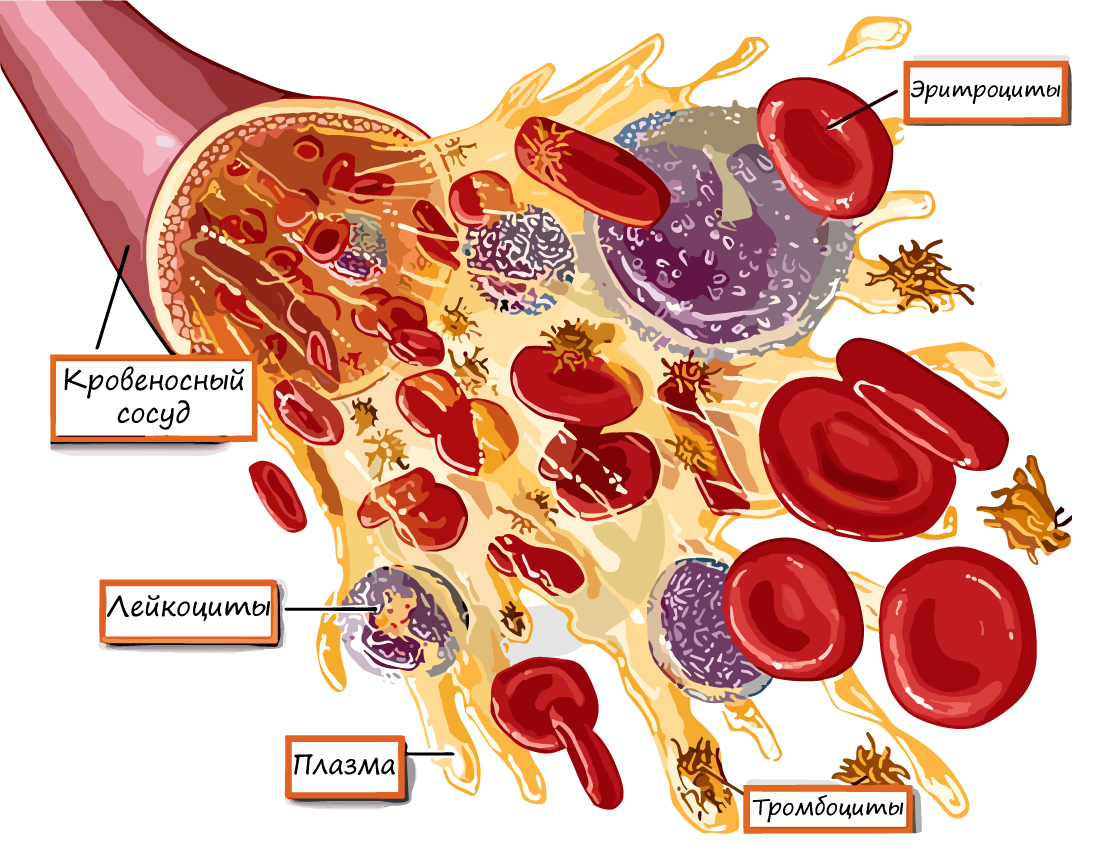
Кровь — важнейшая составляющая внутренней среды организма. Напомню, что эта ткань относится к жидким соединительным
тканям и состоит из плазмы (на 55%) и форменных элементов (оставшиеся 45%). У взрослого человека объем крови составляет 4-6 литра.
Давайте систематизируем и углубим наши знания о крови. Кровь состоит из:
- Плазмы на 55%
- Трофическую (питательную) — белки плазмы являются источником аминокислот
- Буферную — поддерживают кислотно-щелочное состояние (pH крови = 7,35-7,4)
- Транспортную — белки глобулины транспортируют питательные вещества — жиры, а также гормоны, витамины
- Защитную — в крови циркулируют антитела, белки крови (в частности фибриноген) обеспечивают гемостаз
(свертывание крови) - Форменных элементов
- Эритроциты — от греч. ἐρυθρός — красный и κύτος — вместилище, клетка
- C кислородом — оксигемоглобин
- C углекислым газом — карбгемоглобин
- C угарным газом — карбоксигемоглобин
- Лейкоциты — от др.-греч. λευκός — белый и κύτος — вместилище, тело
- Осуществлении фагоцитоза
- Обезвреживании ядов, токсинов
- Участие в клеточном и гуморальном иммунитете
- Тромбоциты — от греч. θρόμβος — сгусток и κύτος — клетка
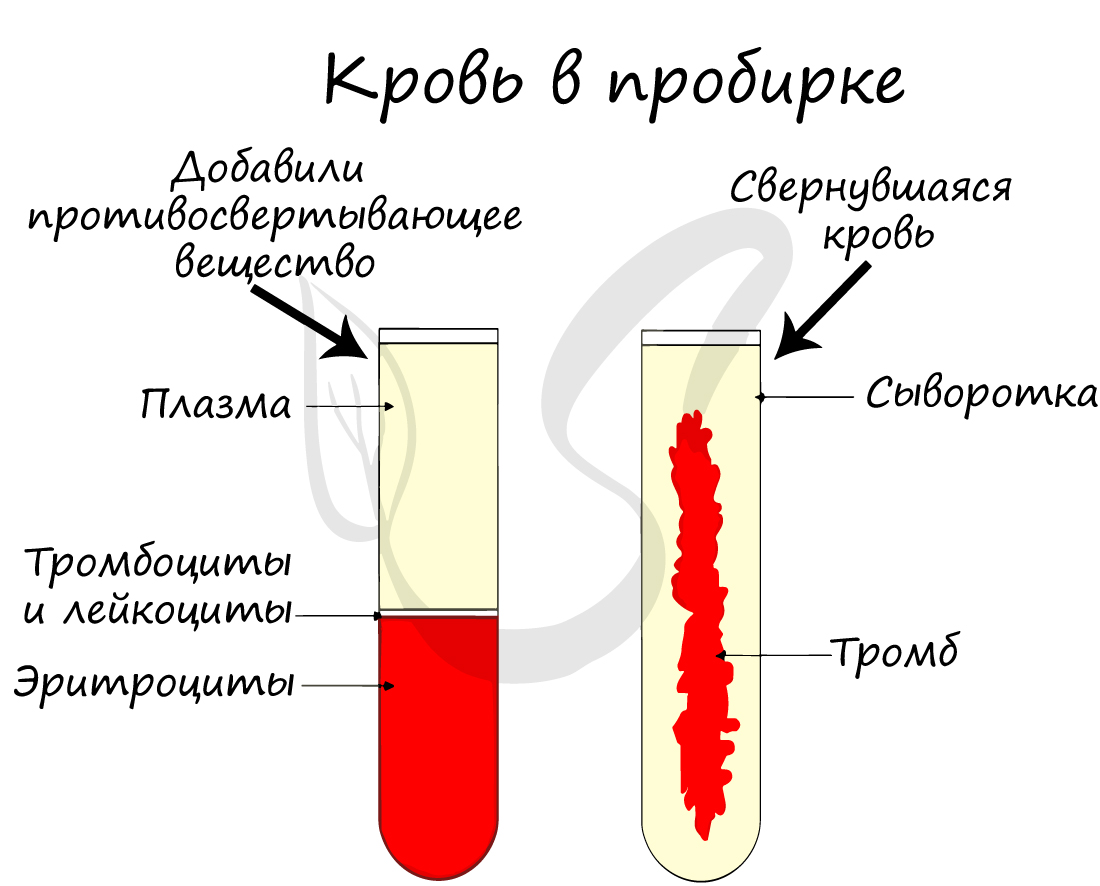
В состав плазмы входят различные белки: альбумины, глобулины, фибриноген, ионы Ca2+, K+,
Mg2+, Na+, Cl-, HPO4-, HCO3-.
Плазма выполняет ряд важных функций:
Отметьте, что плазма крови без фибриногена называется сывороткой (она не свертывается, в отличие от плазмы).
Концентрация соли NaCl (хлорида натрия) в крови примерно постоянна и составляет 0,9%.
К ним относятся:
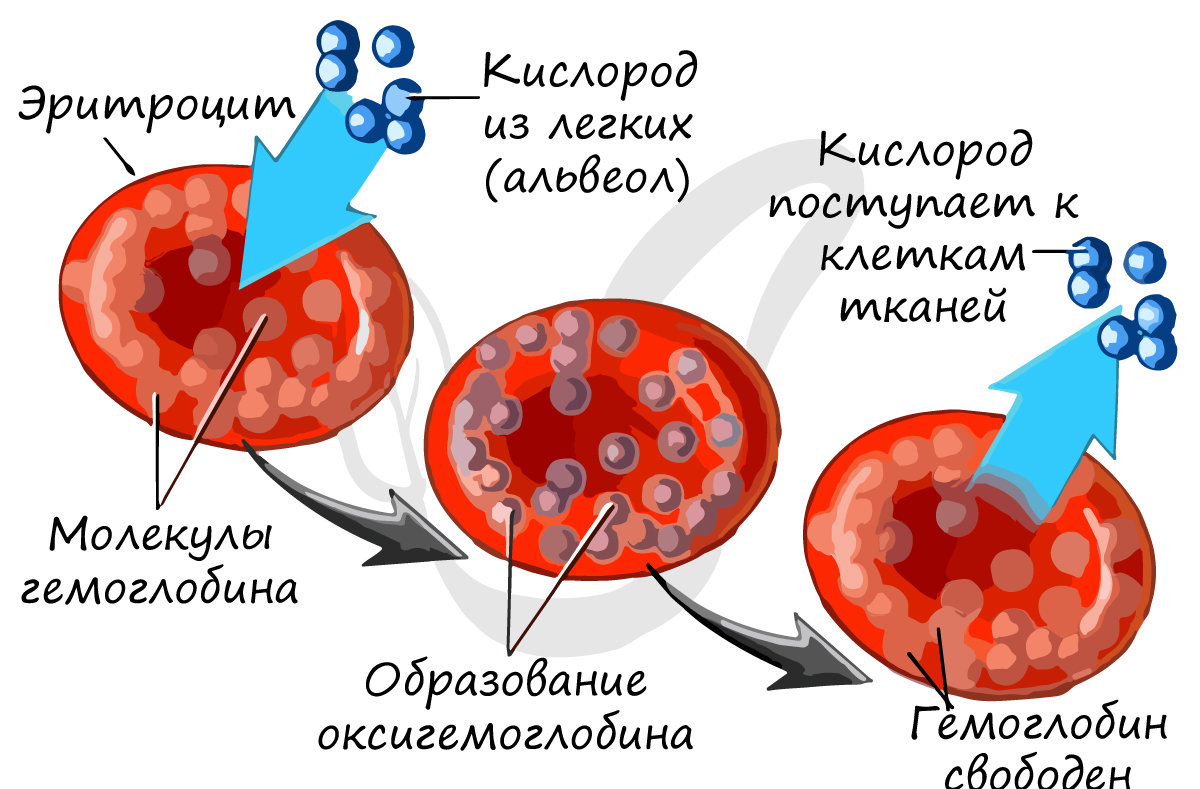
Эритроциты — красные кровяные тельца, основная их
функция — дыхательная — перенос газов: кислорода от альвеол легких к тканям и углекислого газа от тканей к альвеолам.
В 1 мм3 крови находится около 4-5 млн.
Основной белок эритроцита — гемоглобин, состоящий из железосодержащего гема (Fe) и белка глобина.
Эритроциты имеют характерную двояковогнутую форму, лишены ядра (в отличие от эритроцитов других животных, например,
эритроциты лягушки содержат ядро). Их маленький диаметр и способность складываться помогает им проникать через самые
мельчайшие сосуды нашего тела — капилляры, диаметр которых меньше, чем диаметр эритроцита!
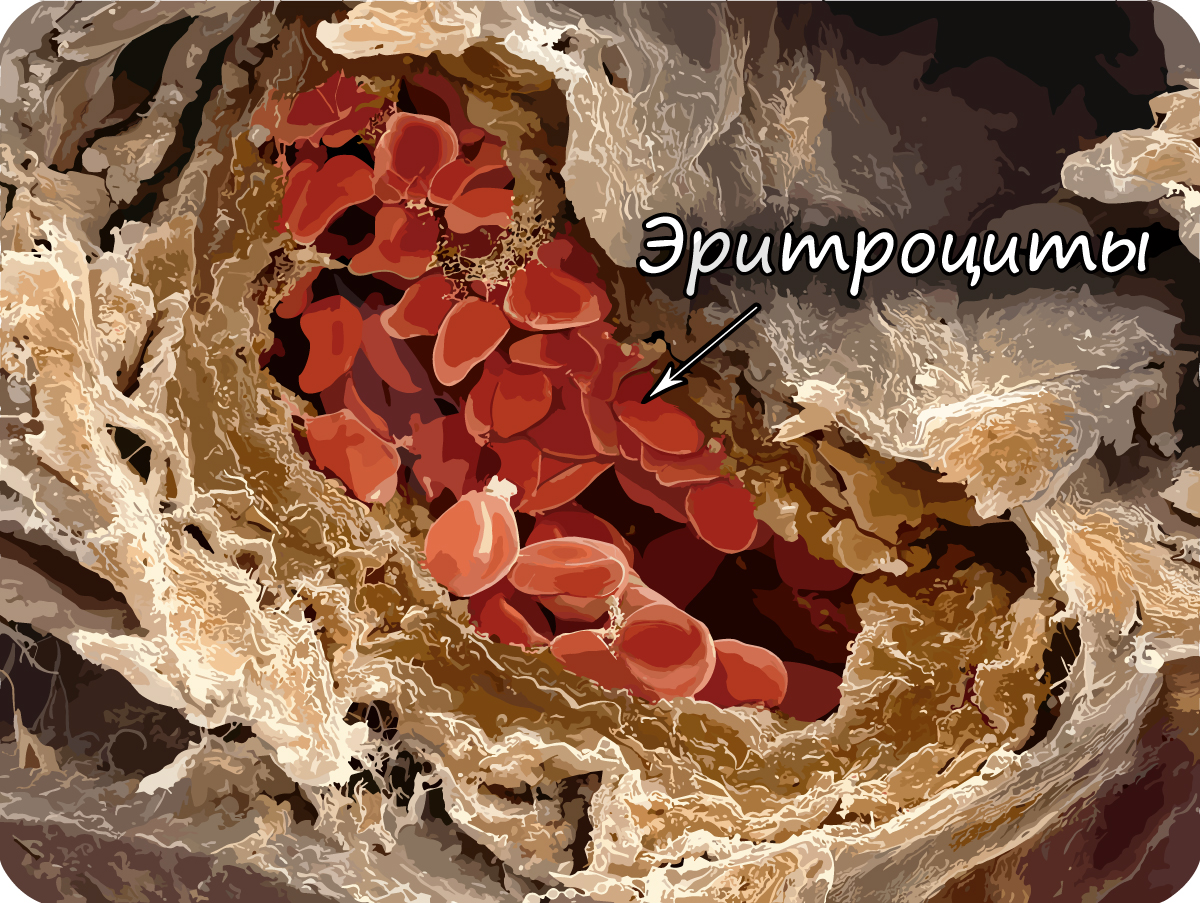
Эритроциты дифференцируются в красном костном мозге (в губчатом веществе костей), срок их жизни составляет 120 дней. К окончанию жизненного цикла их форма становится шарообразной. Такие старые шарообразные эритроциты
задерживаются в печени и селезенке, которая называется кладбищем эритроцитов. Здесь они разрушаются, а их остатки
фагоцитируются.
Из статьи о легких вы уже знаете, что гемоглобин образует соединения:
Сродство гемоглобина к угарному газу в 300 раз выше, чем к кислороду, поэтому карбоксигемоглобин
очень устойчив.
Вообразите: при содержании во вдыхаемом воздухе 0,1% угарного газа 80% от общего количества гемоглобина
связываются с угарным газом, а не кислородом! Угарный газ образуется при пожарах в замкнутом пространстве,
отравиться им и потерять сознание можно очень быстро. Если немедленно не вынести человека на свежий воздух,
то летальный исход становится неизбежным.

Запомните, что у людей, живущих в горной местности, количество эритроцитов в крови несколько выше, чем у
обитателей равнины. Это связано с тем, что концентрация кислорода в горах ниже средней, вследствие чего
компенсаторно увеличивается содержание эритроцитов в крови, чтобы переносить больше кислорода.

Лейкоциты — белые кровяные тельца, имеющие ядро и не содержащие гемоглобин. Дифференцируются в красном костном мозге,
лимфатических узлах. С кровью переносятся к тканям организма, где проходит основная часть их жизненного цикла: они выполняют защитную функцию, которая заключается в:
Число лейкоцитов в 1 мм3 крови 4-9 тысяч. Лейкоциты разнообразны по форме и строению, среди них встречаются
нейтрофилы, лимфоциты, моноциты. Их деятельность направлена на защиту организма: они обеспечивают иммунитет.
Если лейкоциты
увеличены в анализе крови, то врач может заподозрить инфекционный процесс: во время него лейкоциты возрастают, чтобы
уничтожить бактерии и вирусы, попавшие в организм.
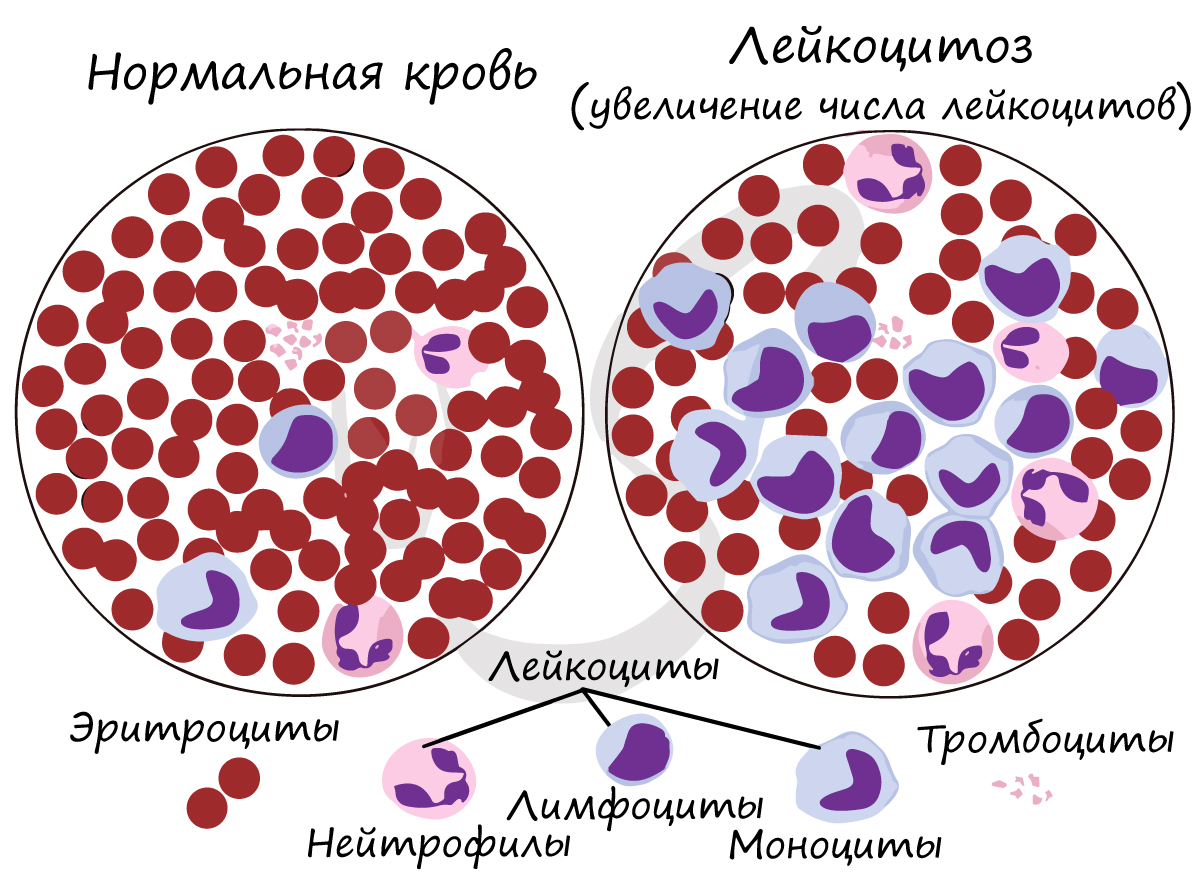
Около 25-40% от всех лейкоцитов составляют лимфоциты, в популяции которых можно обнаружить T- и B-лимфоциты. Они
выполняют важнейшие функции, благодаря которым формируется иммунитет.
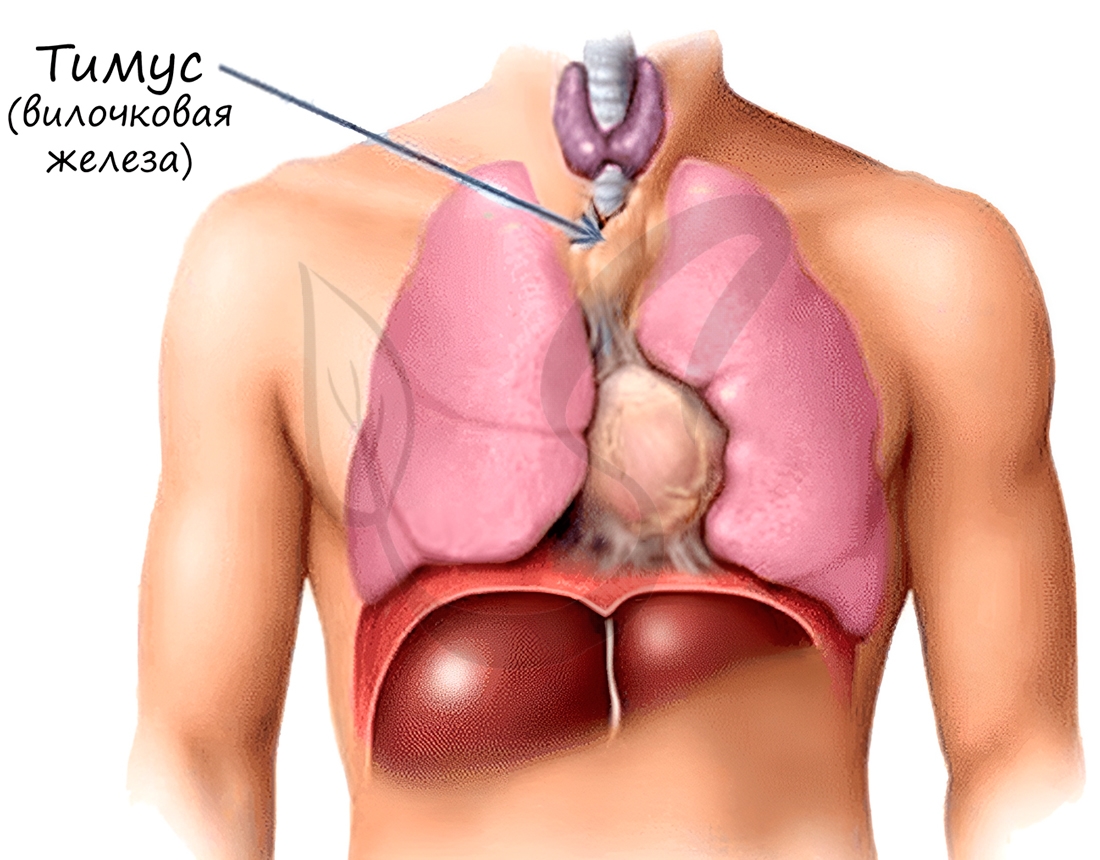
T-лимфоциты созревают в специальном органе — тимусе (вилочковой железе). Они обеспечивают клеточный иммунитет, выявляют
и уничтожают мутантные (раковые) клетки, миллионы которых ежедневно образуются даже у здорового человека. Уничтожают в организме подобные клетки T-лимфоциты путем фагоцитоза.
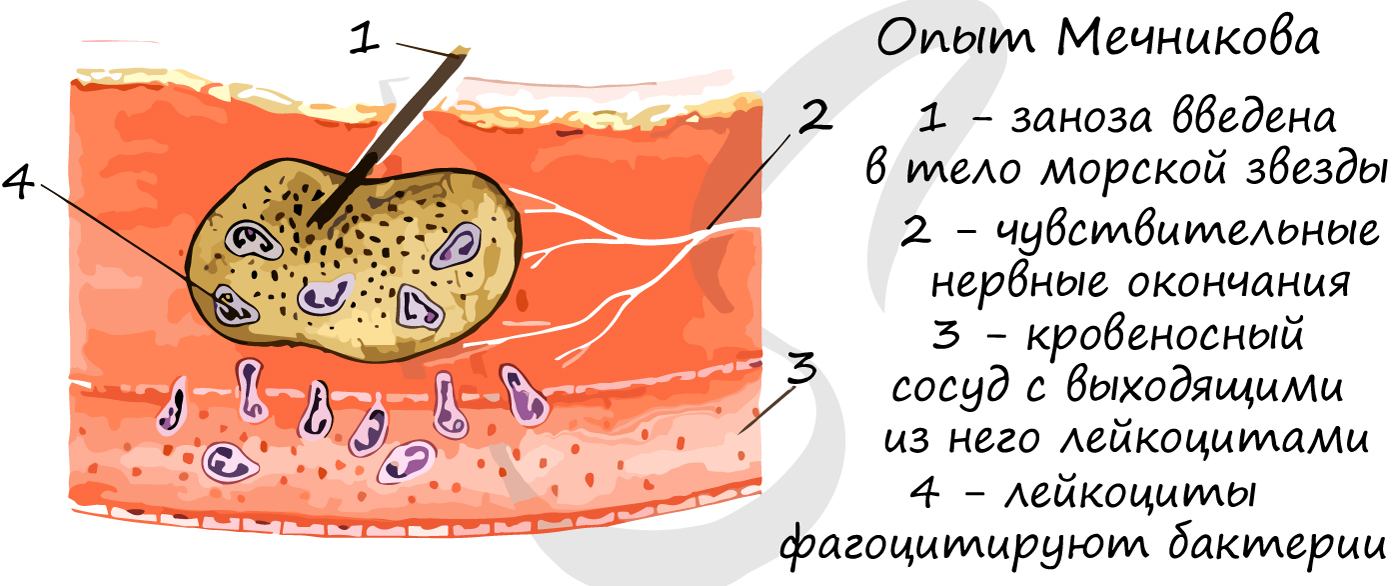
Фагоцитоз — процесс, при котором клетки захватывают и переваривают твердые частицы (другие клетки). Создатель фагоцитарной
теории иммунитета И.И. Мечников провел опыт, который наглядно демонстрирует, что лейкоциты способны выходить из кровеносного
русла в ткани (при воспалении), фагоцитировать попавшие в рану чужеродные белки, бактерии.
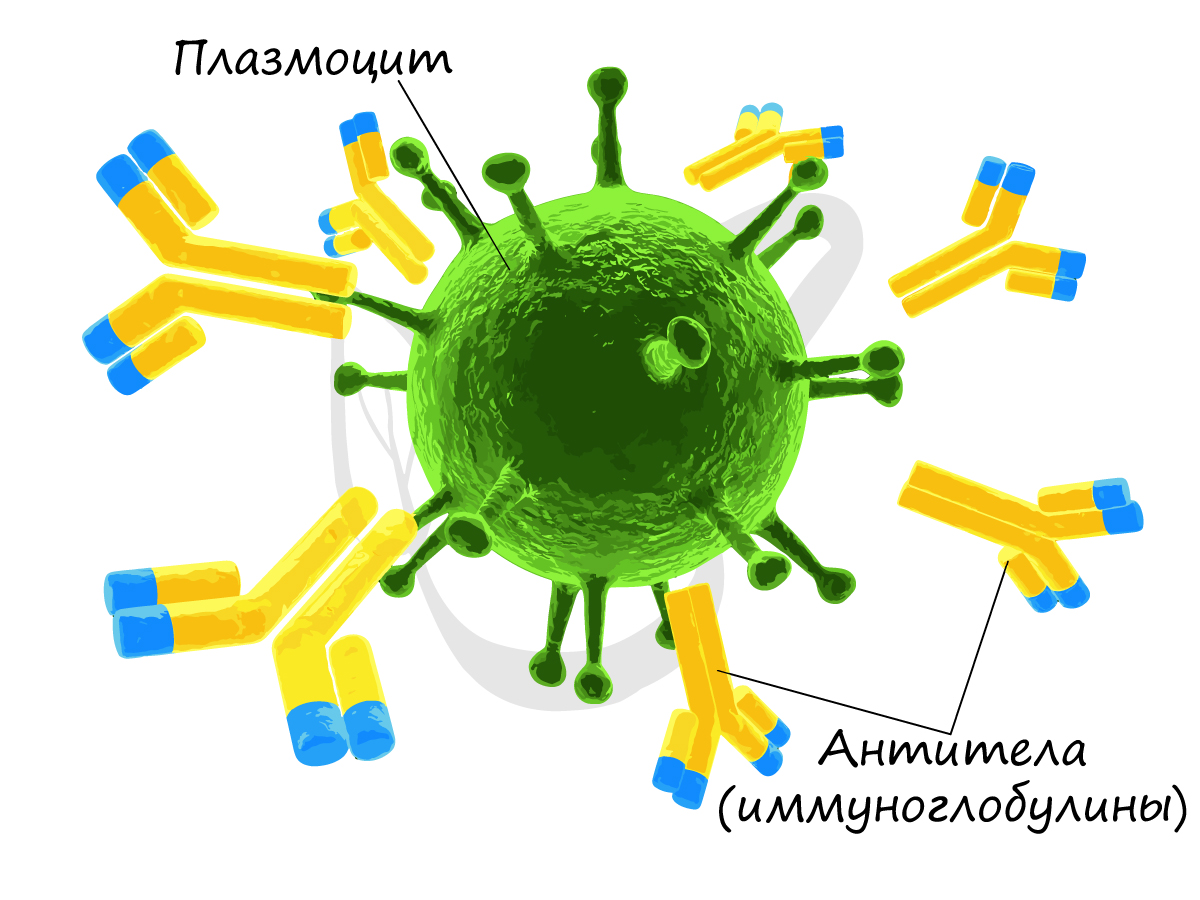
Гуморальный (греч. humor — жидкость) иммунитет обеспечивается B-лимфоцитами. После контакта с антигеном (чужеродное вещество в организме) B-лимфоцит
превращается в плазмоцит — клетку, которая вырабатывает антитела. Антитела (иммуноглобулины) — белковые молекулы, препятствующие размножению микроорганизмов и нейтрализующие выделяемые ими токсины.
Часть плазмоцитов может оставаться в организме после устранения антигена многие годы, эта часть обеспечивает иммунную память, благодаря которой
в случае повторного попадания того же антигена — человек не заболеет, либо легко и быстро перенесет болезнь.
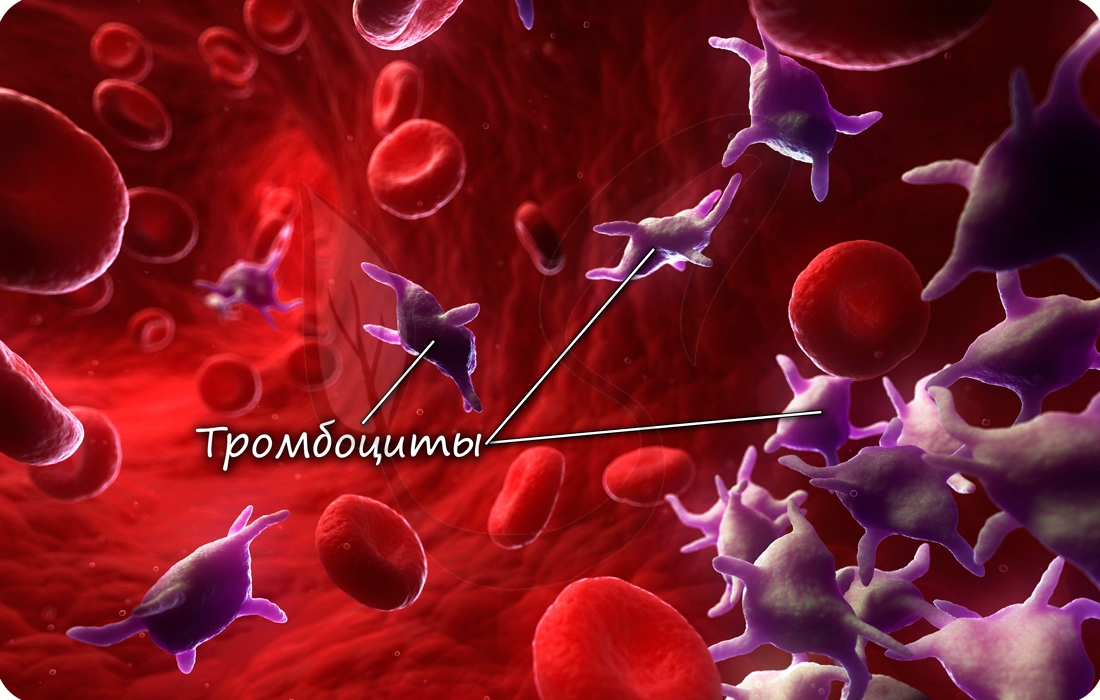
Устаревшее название тромбоцитов — кровяные пластинки. Тромбоциты — клеточные элементы крови, представляющие собой круглые безъядерные
образования. В 1 мм3 насчитывается 250-400 тысяч клеток.
Дифференцируются (образуются) тромбоциты в красном костном мозге. На их поверхности имеются рецепторы,
которые активируются при повреждении кровеносного русла. Они играют важную роль в процессе
гемостаза — свертывания крови, предотвращают кровопотерю.
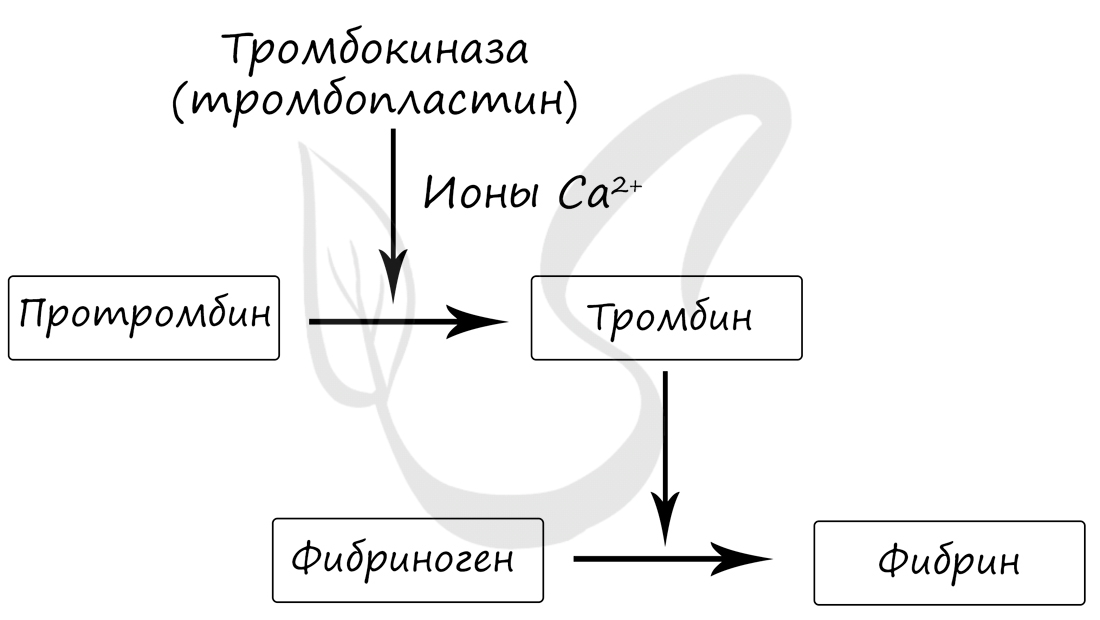
Процесс гемостаза требует нашего особого внимания. Гемостаз (от греч. haima — кровь + stasis — стояние) —
процесс свертывания крови, являющийся важнейшим защитным механизмом от кровопотери. Активируется при
повреждении кровеносных сосудов.
Гемостаз зависит от множества факторов, среди которых важное место отводится ионам Ca2+. Гемостаз происходит
следующим образом: при повреждении сосуда из тромбоцитов высвобождаются тромбопластины, которые способствуют переходу протромбина в тромбин. В свою очередь, тромбин способствует переходу растворимого белка крови, фибриногена, в нерастворимый фибрин.
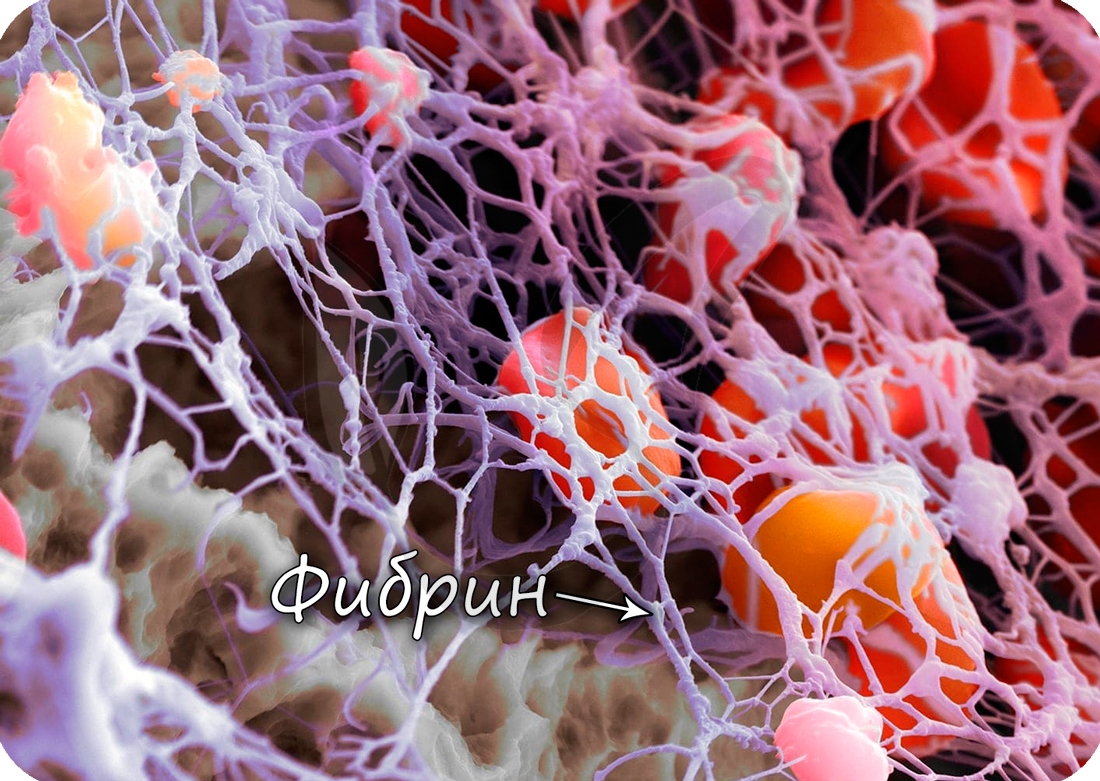
Истинный тромб образуется при переходе растворимого белка крови, фибриногена, в нерастворимый фибрин, нити которого
создают «сетку», где застревают эритроциты. В результате останавливается кровотечение из сосуда.
Группы крови и трансфузия (переливание)
Не могу утаить, что существует более 30 различных систем групп крови. Наиболее широко используемая (в том числе и в
медицине при переливании крови) — система AB0. Она основана на том факте, что на мембране эритроцитов располагаются различные
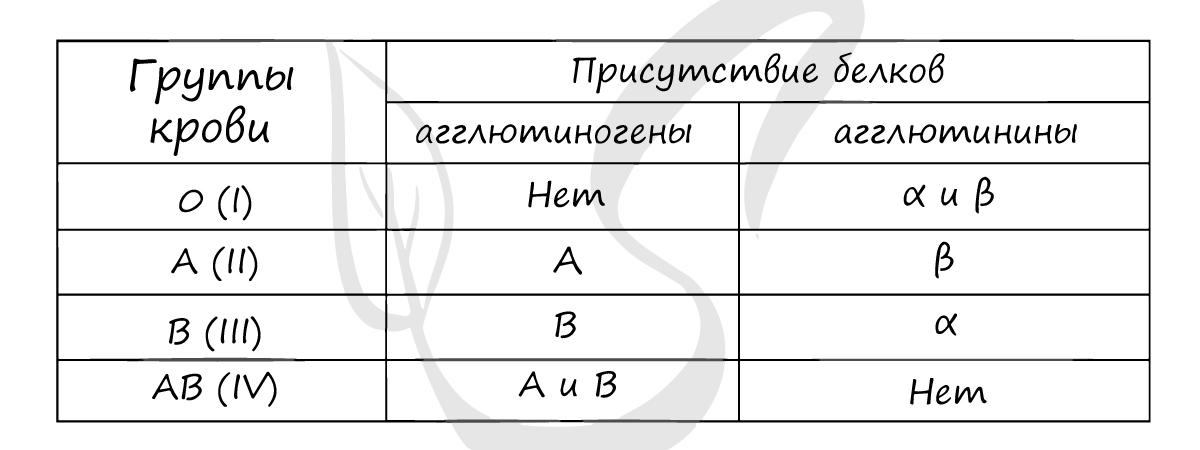
антигены, определенные генетически. На основании сходства этих антигенов людей делят на 4 группы.
Наибольшее значение в системе AB0 имеют агглютиногены A и B, расположенные на поверхности эритроцитов, и агглютинины α и β.
Если встречаются два одинаковых компонента, к примеру: агглютиноген A и агглютинины α, то начинается реакция агглютинации —
эритроциты начинают склеиваться.
Агглютинацию ни в коем случае нельзя допустить, она может сильно ухудшить состояние пациента
вплоть до летального исхода. При переливании крови строго соблюдается следующее правило: переливается только кровь,
относящаяся к одной и той же группе. Это наилучший вариант, однако, и здесь бывают неудачные переливания, заканчивающиеся
гибелью пациента, ведь ранее я уточнил, что система AB0 является лишь одной из 30 систем групп крови, а учесть их все
не представляется возможным.
Ниже вы найдете схему, где группы крови (по системе AB0) проверяют на совместимость. Реципиентом называют того, кому переливают кровь,
а донором — от кого переливают. Если вы видите сгустки эритроцитов, то это значит, что произошла агглютинация, и переливание крови от донора к реципиенту ни к чему хорошему не приведет.
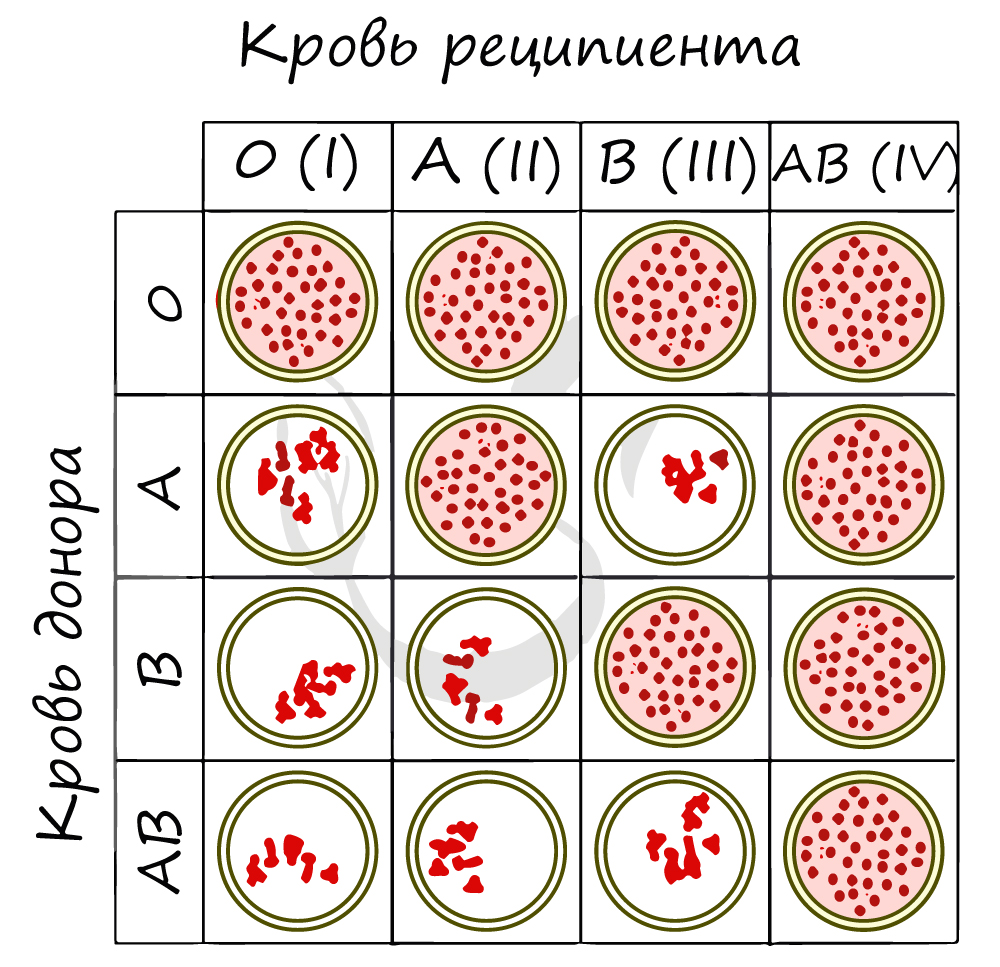
Предлагаю еще раз расставить все точки над i, ответив на вопрос — «Почему агглютинация произошла при смешении
II (A) и I (O) групп крови?» Ответить можно, вспомнив, что II(A) содержит агглютиноген A и агглютинин β;
I (O) группа содержит агглютинины α и β.
Из-за того, что вместе оказываются агглютинин α и агглютиноген A между эритроцитами начинается агглютинация — они
склеиваются.
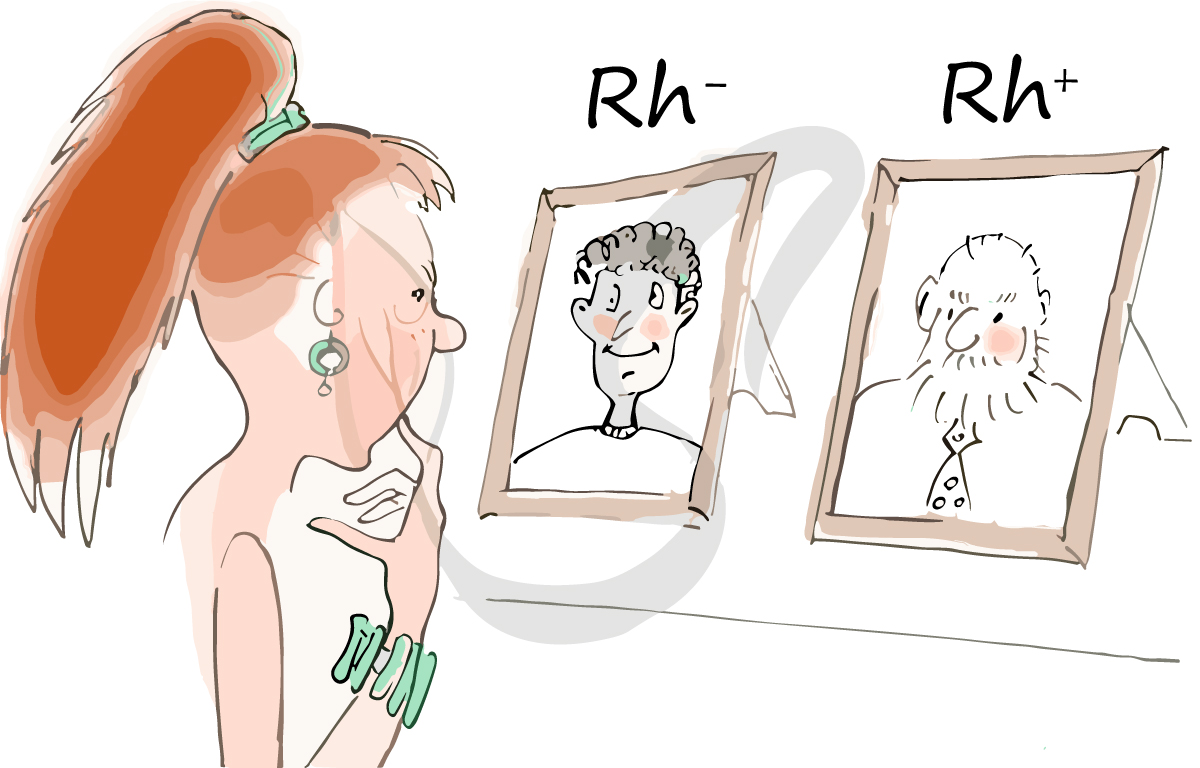
Резус-фактор (Rh-фактор) и резус-конфликт
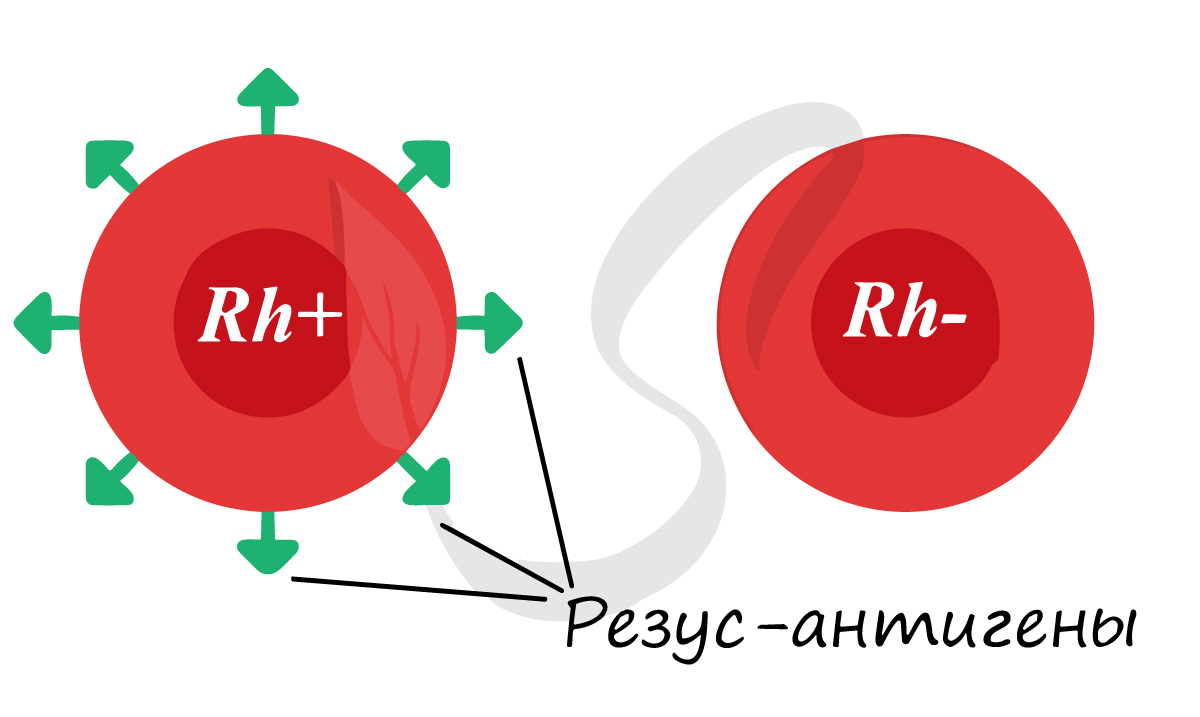
Помимо агглютиногенов системы AB0 на поверхности эритроцитов могут присутствовать резус-антигены. «Могут» — потому что
у большинства людей они есть (85%), а у некоторых резус-антигены отсутствуют (15%). Если данные белки имеются, то
говорят, что у человека положительный резус-фактор, если белки отсутствуют — отрицательный резус-фактор.
Особую важность приобретает резус-фактор у матери и плода. Если женщина резус-отрицательна, а плод
резус-положителен, то при повторной беременности существует риск резус-конфликта: антитела матери начнут атаковать
эритроциты плода, которые разрушатся и плод погибент от гипоксии (нехватки кислорода).
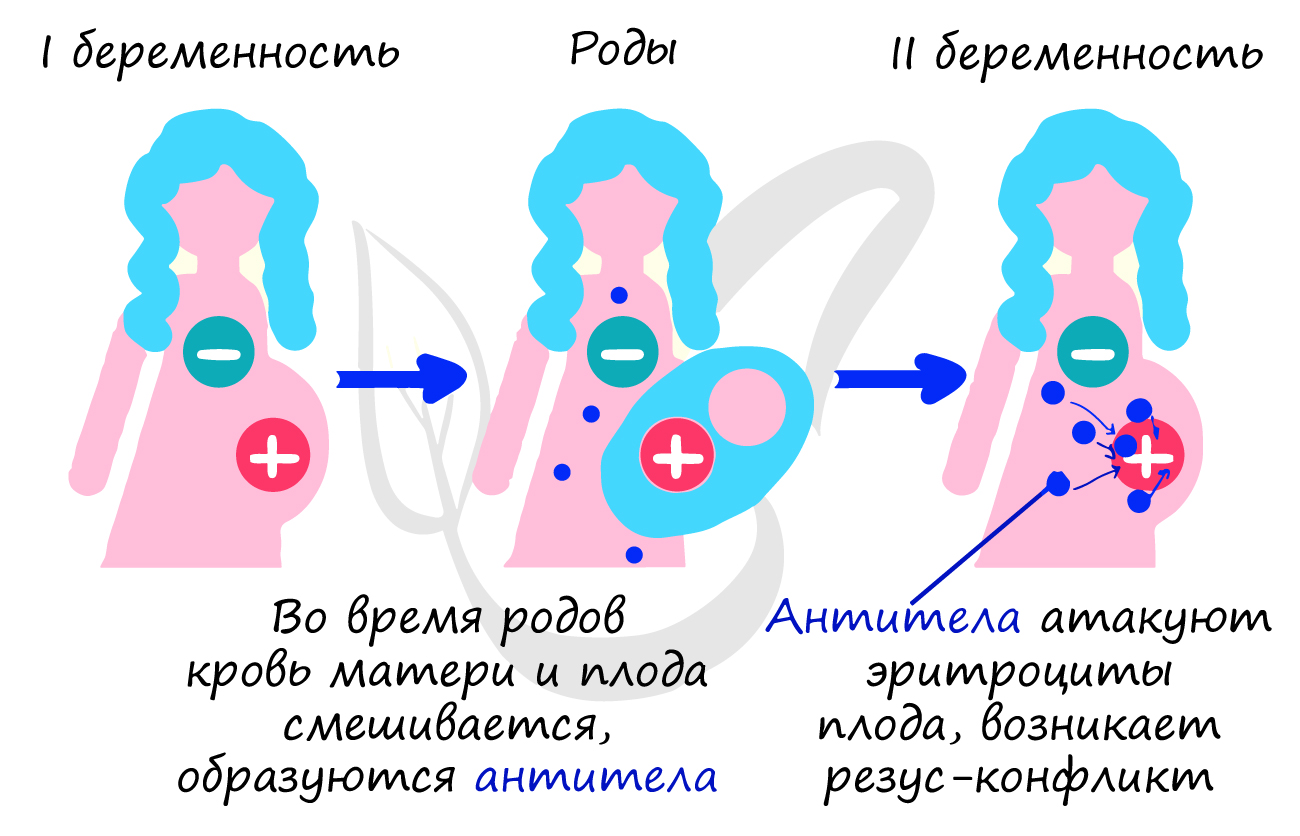
Заметьте — при первой беременности нет угрозы резус-конфликта. Если женщина резус-положительна, то никакого резус-конфликта
не может быть априори, независимо от того резус-положительный или резус-отрицательный плод.
Опасность резус-конфликта вовсе не значит, что вы должны выбирать свою половинку руководствуясь наличием или отсутствием
резус-антигенов)) Они не должны вам препятствовать!) Доложу вам, что на сегодняшней день арсенал лекарственных препаратов
помогает устранить резус-конфликт и успешно рожать женщине во 2, 3, и т.д. раз. Главное, чтобы беременность протекала под наблюдением врача с самого раннего срока.
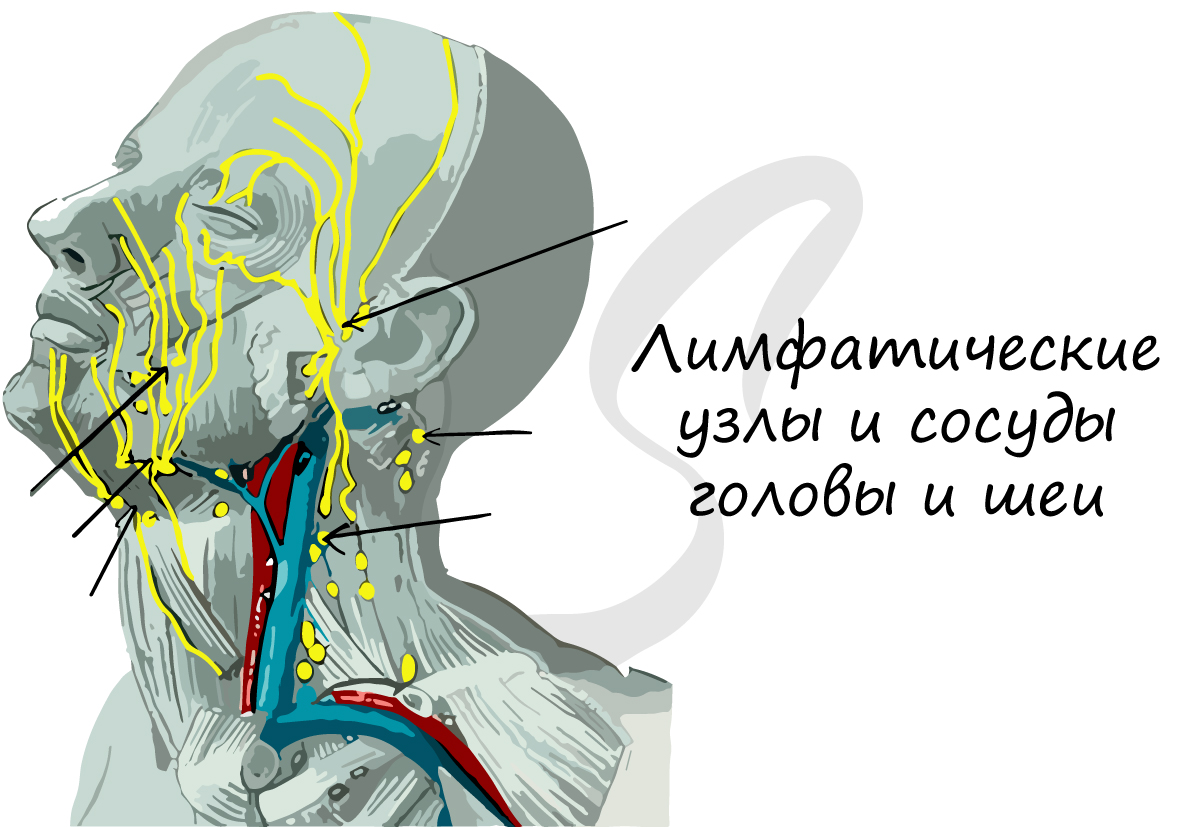
Лимфа, лимфатическая система
Лимфа, как и кровь, образует внутреннюю среду организма. В самом начале статьи была схема, на которой видно, как кровь,
тканевая жидкость и лимфа соотносятся друг с другом. В норме избыток жидкости выводится из тканей по лимфатическим сосудам.
Состав лимфы близок к плазме крови: в лимфе можно обнаружить антитела, фибриноген и ферменты. Лимфатические сосуды
впадают в лимфатические узлы, которые М.Р. Сапин, выдающийся анатом, называл «сторожевые посты». Здесь появляются
лимфоциты — важнейшее звено иммунитета, и происходит фагоцитоз бактерий.
Подытоживая полученные знания, давайте соберем вместе функции лимфатической системы:
- Защитная — в лимфатических узлах образуются лимфоциты, происходит фагоцитоз бактерий
- Транспортная — в лимфатические сосуды кишечника всасываются жиры
- Возврат белка в кровь из тканевой жидкости
- Перераспределение жидкости в организме
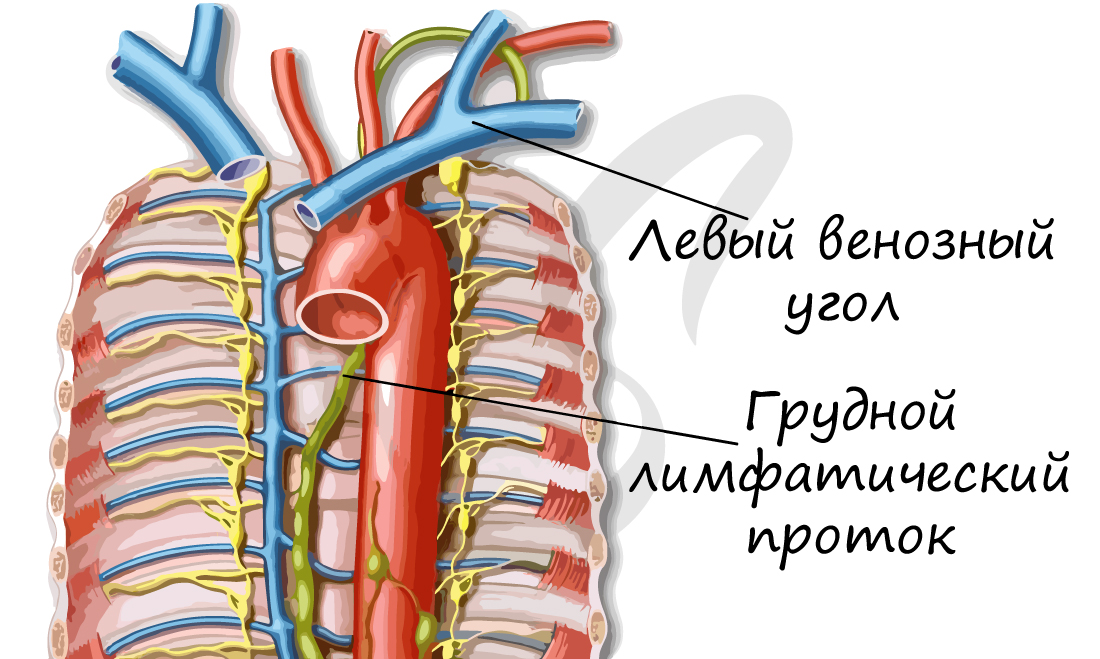
Куда же течет вся лимфа с жирами, лимфоцитами и белками? В конечном итоге лимфатическая система соединяется с кровеносной,
впадая в нее в области левого и правого венозных углов. Таким образом, лимфатическая и кровеносная системы теснейшим образом
связаны друг с другом.
Виды иммунитета
Мы уже отчасти касались темы иммунитета в нашей статье и отмечали особый вклад И.И. Мечникова в создании фагоцитарной теории
иммунитета.
Иммунитет — способ защиты организма и поддержания гомеостаза внутренней среды, предупреждающий размножение
в организме инфекционных агентов. Выделяют естественный и искусственный иммунитет.
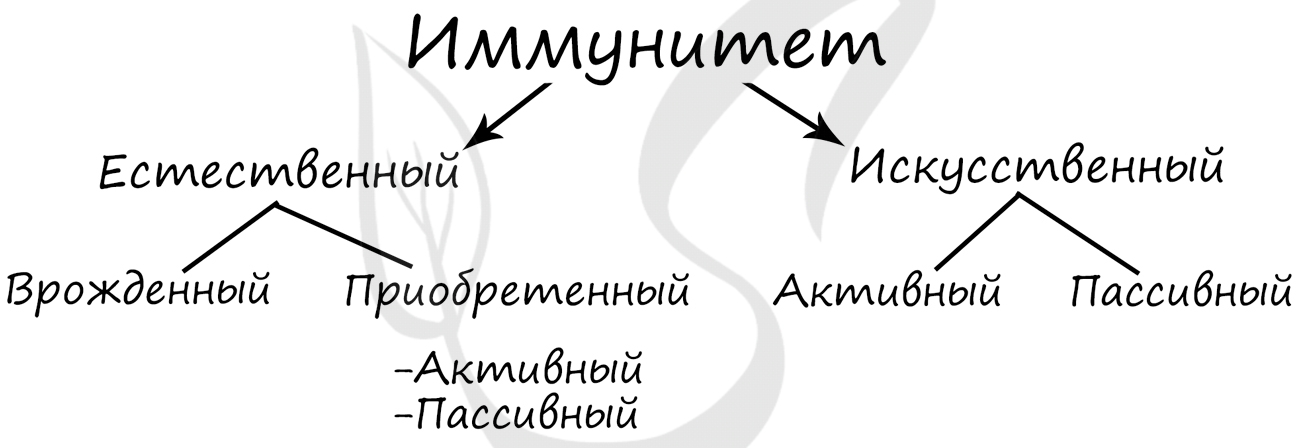
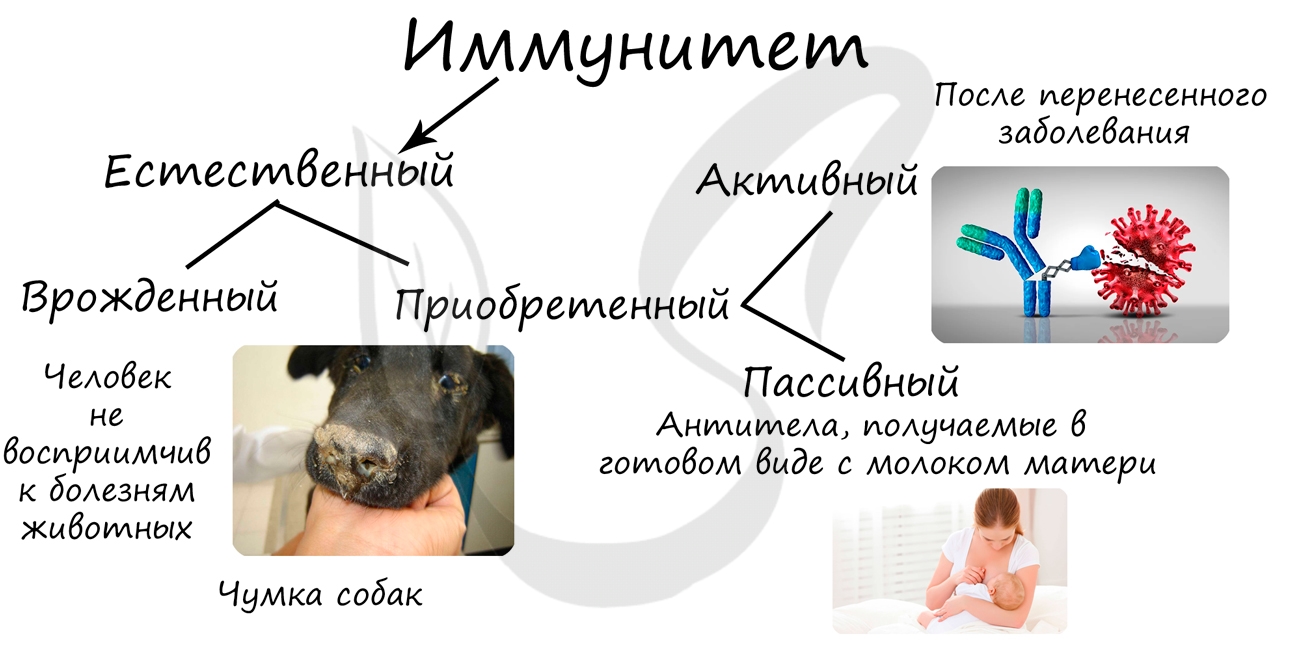
Естественный иммунитет включает в себя врожденный (видовой) и приобретенный (индивидуальный).
Врожденный иммунитет заключается в невосприимчивости человека к болезням животных: человек не может заболеть многими
болезнями собак, и, наоборот, собаки невосприимчивы ко многим заболеваниям человека.
Приобретенный (индивидуальный) иммунитет бывает активный и пассивный.
- Активный
- Пассивный
Вырабатывается человеком в ответ на внедрение инфекционного агента через 10-12 дней (образование антител)
Состоит в переходе материнских антител в кровь плода, также антитела поступают вместе
с грудным молоком. Пассивным этот вид иммунитета называется потому, что сам организм антитела не вырабатывает, а использует уже готовые.
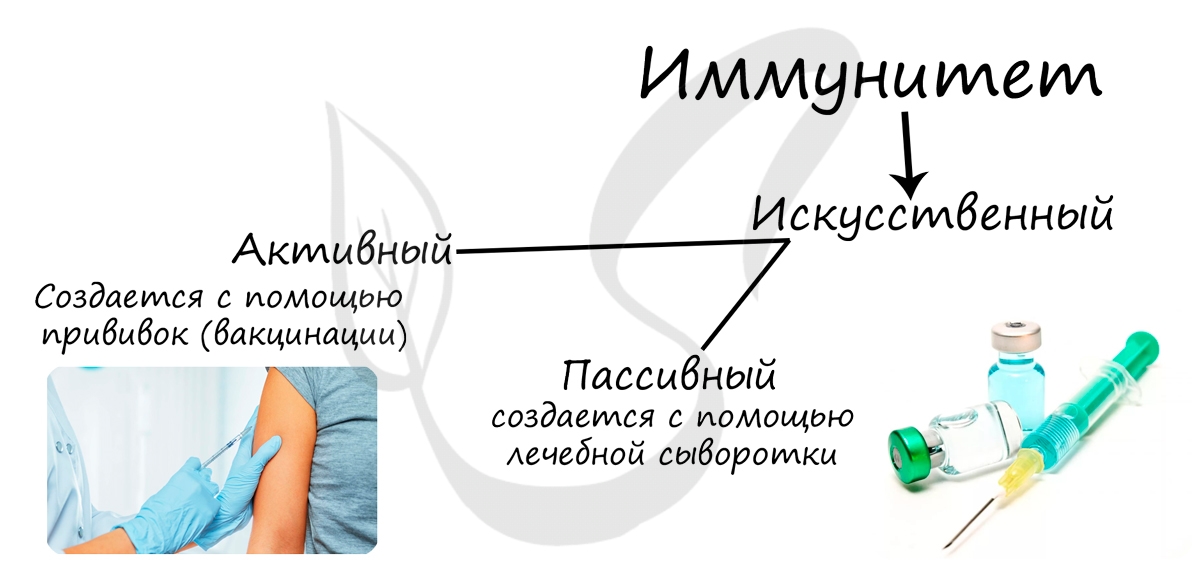
Искусственный иммунитет делится на активный и пассивный.
Активный искусственный создается с помощью прививок — вакцинации. При вакцинации в организм здорового человека вводят разрушенные или ослабленные инфекционные агенты (вакцину), с которыми лейкоциты легко справляются, в результате чего вырабатываются антитела. Это напоминает тренировку перед матчем: когда настоящий вирус/бактерия попадут
в организм, лейкоцитам будет все о них известно, и они быстро выработают антитела, за счет чего заболевание пройдет либо в легкой,
либо в бессимптомной форме.
Пассивный искусственный иммунитет подразумевает применение лечебной сыворотки, которая содержит готовые антитела к возбудителю
заболевания. Часто сыворотки применяются в экстренных случаях, когда заболевание протекает тяжело и медлить нельзя. Существует
противоботулиническая сыворотка (применятся при тяжелейшем заболевании — ботулизме), антирабическая сыворотка (против вируса
бешенства).
Лечебные сыворотки получают из крови животных, зараженных определенным вирусом или бактерией. Получение сыворотки заключается
в выделении из крови готовых антител к данному возбудителю. Применяются сыворотки не только в лечебных, но и в профилактических
целях.
Позвольте добавить краткую и важную историческую сводку. Первая прививка была сделана Эдвардом Дженнером в 1796 году. Он заметил, что
доярки, переболевшие коровьей оспой, невосприимчивы к натуральной. Получив согласие родителей ребенка, Дженнер заразил ребенка (!) коровьей оспой, тот перенес ее и через две недели был невосприимчив к натуральной оспе. Так Эдвард Дженнер начал эпоху вакцинации.

Луи Пастер также внес огромнейший вклад, создав и сделав первую прививку от бешенства в 1885 году. Мать привезла к нему в Париж сына,
которого покусала бешеная собака. Было очевидно, что без вмешательства мальчик умрет. Пастер взял на себя огромную ответственность (к слову,
не имея врачебной лицензии) и 14 дней вводил мальчику изобретенную вакцину. Мальчик вылечился, симптомы бешенства не развились. Примечательно,
что всю взрослую жизнь спасенный юноша посвятил Пастеру, работая сторожем в Пастеровском музее.

Заболевания
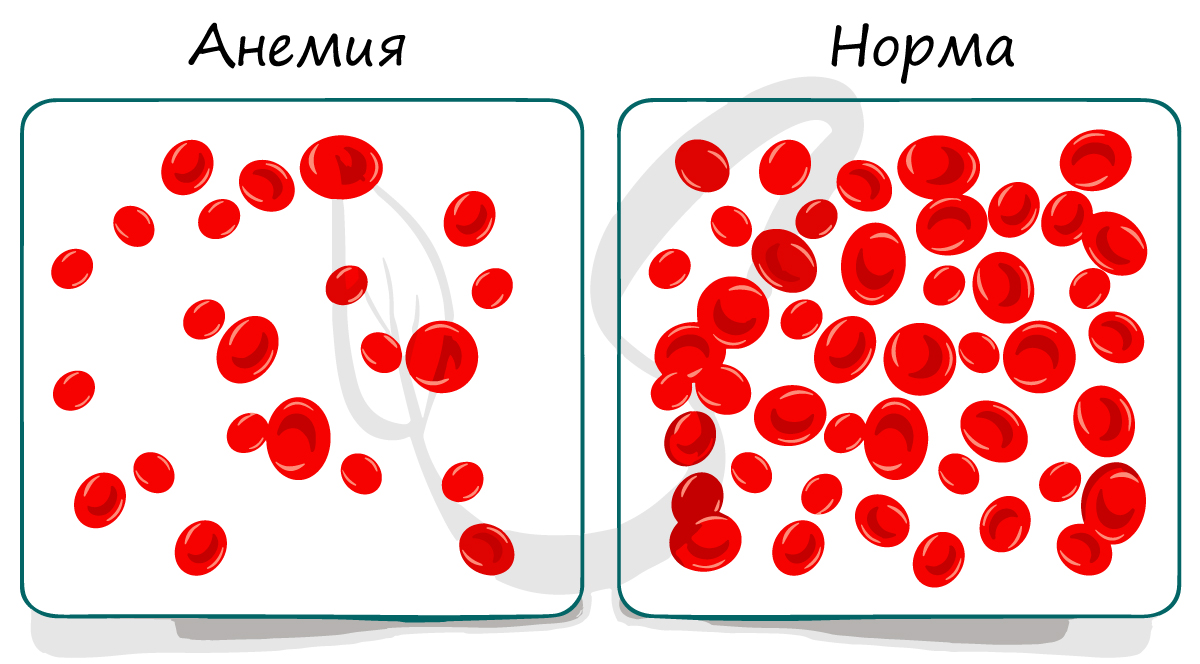
Анемия (от др.-греч. ἀν- — приставка со значением отрицания и αἷμα «кровь»), или малокровие — снижение концентрации гемоглобина в крови,
очень часто с одновременным уменьшением количества эритроцитов. Вам уже известна основная функция эритроцитов, и вы легко сможете догадаться,
что при анемии кислорода к тканям поступает меньше должного уровня — отсюда и развиваются симптомы анемии.
Пациенты могут жаловаться на непривычную одышку (учащение дыхания) при незначительных физических нагрузках, общую слабость, быструю утомляемость,
головную боль, сердцебиение, шум в ушах. При анализе крови анемию выявить легко, гораздо сложнее выявить причину, из-за которой анемия возникла.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
1. Серебряная Н.Б., Шанин С.Н., Фомичева Е.Е., Якуцени П.П. Тромбоциты как активаторы и регуляторы воспалительных и иммунных реакций. Часть 1. Основные характеристики тромбоцитов как воспа-лительных клеток// Медицинская иммунология, 2018. Т. 20, № 6. С. 785-796. [Serebryanaya N.B., Shanin S.N., Fomicheva E.E., Yakutseni P.P. Blood platelets as activators and regulators of inflammatory and immune reactions. Part 1. Basic characteristics of platelets as inflammatory cells. Meditsinskaya immunologiya = Medical Immunology (Russia), 2018, Vol. 20, no. 6, pp. 785-796.(In Russ.)] doi: 10.15789/1563-0625-2018-6-785-796.
2. Andonegui G., Kerfoot S.M., McNagny K., Ebbert K.V.J., Patel K.D., Kubes P. Platelets express functional Toll-like receptor-4. Blood, 2005, Vol. 106, pp. 2417-2423.
3. Andrews R.K., Arthur J.F., Gardiner E. Neutrophil extracellular traps (NETs) and the role of platelets in infection. Thromb. Haemost., 2014, Vol. 112, no. 4, pp. 659-665.
4. Anitua E., Andia I., Ardanza B., Nurden P., Nurden A.T. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb. Haemost., 2004, Vol. 91, pp. 4-15.
5. Arisato T., Hashiguchi T., Sarker K.P., Arimura K., Asano M., Matsuo K., Osame M., Maruyama I. Highly accumulated platelet vascular endothelial growth factor in coagulant thrombotic region.J. Thromb. Haemost., 2003, no. 1, pp. 2589-2593.
6. Blair P., Flaumenhaft R. Platelet α-granules: Basic biology and clinical correlates. Blood Rev., 2009, Vol. 23, no. 4, pp. 177-189.
7. Boehlen F., Clemetson K.J. Platelet chemokines and their receptors: what is their relevance to platelet storage and transfusion practice?Transfus. Med., 2001, no. 11, pp. 403-417.
8. Brandt E., Petersen F., Ludwig A., Ehlert J.E., Bock L., Flad H.D. The beta-thromboglobulins and platelet factor 4: blood platelet-derived CXC chemokines with divergent roles in early neutrophil regulation. J. Leukoc. Biol., 2000, Vol. 67, pp. 471-478.
9. Brill A., Elinav H., Varon D. Differential role of platelet granular mediators in angiogenesis. Cardiovasc. Res., 2004, Vol. 63, pp. 226-235.
10. Chapman L.M., Aggrey A.A., Field D.J., Srivastava K., Ture S., Yui K., Topham D.J., Baldwin W.M. 3rd , Morrell C.N. Platelets present antigen in the context of MHC class I. J. Immunol., 2012, Vol. 189, no. 2, pp. 916-923.
11. Clark S.R., Ma A.C., Tavener S.A., Mcdonald B., Goodarzi Z., Kelly M.M., Patel K.D., Chakrabarti S., Mcavoy E., Sinclair G.D., Keys E.M., Allen-Vercoe E., Devinney R., Doig C.J., Green F.H.Y., Kubes P. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nat. Med., 2007, Vol. 13, pp. 463-469.
12. Cognasse F., Hamzeh H., Chavarin P., Acquart S., Genin C., Garraud O. Evidence of Toll-like receptor molecules on human platelets. Immunol. Cell. Biol., 2005, Vol. 83, pp. 196-198.
13. Cognasse F., Hamzeh-Cognasse H., Lafarge S., Chavarin P., Cogné M., Richard Y., Garraud O. Human platelets can activate peripheral blood B cells and increase production of immunoglobulins. Exp. Hematol., 2007, Vol. 35, pp. 1376-1387.
14. Colotta F., Sciacca F.L., Sironi M., Luini W., Rabiet M.J., Mantovani A. Expression of monocyte chemotactic protein-1 by monocytes and endothelial cells exposed to thrombin. Am. J. Pathol., 1994, Vol. 144, no. 5, pp. 975-985.
15. Corken A., Russell S., Dent J., Post S.R., Ware J. Platelet glycoprotein Ib-IX as a regulator of systemic inflammation. Arterioscler. Thromb. Vasc. Biol., 2014, Vol. 34, pp. 996-1001.
16. Danese S., de la Motte C., Reyes B.M., Sans M., Levine A.D., Fiocchi C. Cutting edge: T cells trigger CD40-dependent platelet activation and granular RANTES release: a novel pathway for immune response amplification. J. Immunol., 2004, Vol. 172, pp. 2011-2015.
17. del Conde I., Crúz M.A., Zhang H., López J.A., Afshar-Kharghan V. Platelet activation leads to activation and propagation of the complement system.J. Exp. Med., 2005, Vol. 201, no. 6, pp. 871-879.
18. Delaney M.K., Kim K., Estevez B., Xu Z., Stojanovic-Terpo A., Shen B., Ushio-Fukai M., Cho J., Du X. Differential roles of the NADPH-oxidase 1 and 2 in platelet activation and thrombosis. Arterioscler. Thromb. Vasc. Biol., 2016, Vol. 36, no. 5, pp. 846-854.
19. Diacovo T.G., Catalina M.D., Siegelman M.H., von Andrian U.H. Circulating activated platelets reconstitute lymphocyte homing and immunity in L-selectin-deficient mice. J. Exp. Med., 1998, Vol. 187, no. 2, pp. 197-204.
20. Diacovo T.G., de Fougerolles A.R., Bainton D.F., Springer T.A. A functional integrin ligand on the surface of platelets: intercellular adhesion molecule-2.J. Clin. Invest., 1994, Vol. 94, pp. 1243-1251.
21. Dixon D.A., Tolley N.D., Bemis-Standoli K., Martinez M.L., Weyrich A.S., Morrow J.D., Prescott S.M., Zimmerman G.A. Expression of COX-2 in platelet-monocyte interactions occurs via combinatorial regulation involving adhesion and cytokine signaling.J. Clin. Invest., 2006, Vol. 116, pp. 2727-2738.
22. Duffau P., Seneschal J., Nicco C., Richez C., Lazaro E., Douchet I., Bordes C., Viallard J.-F., Goulvestre C., Pellegrin J.-L., Weil B., Moreau J.-F., Batteux F., Blanco P. Platelet CD154 potentiates interferon-alpha secretion by plasmacytoid dendritic cells in systemic lupus erythematosus.Sci. Transl. Med., 2010, Vol. 1, no. 2 (47), 47ra63. doi: 10.1126/scitranslmed.3001001.
23. Ekdahl K.N., Nilsson B. Phosphorylation of complement component C3 and C3 fragments by a human platelet protein kinase. Inhibition of factor I-mediated cleavage of C3b. J. Immunol., 1995, Vol. 154, no. 12, pp. 6502-6510.
24. Elzey B.D., Ratliff T.L., Sowa J.M., Crist S.A. Platelet CD40L at the interface of adaptive immunity. Thromb. Res., 2011, Vol. 127, no. 3, pp. 180-183.
25. Elzey B.D., Sprague D.L., Ratliff T.L. The emerging role of platelets in adaptive immunity. Cell Immunol., 2005, Vol. 238, pp. 1-9.
26. Evangelista V., Manarini S., Dell’Elba G., Martelli N., Napoleone E., Di S.A., Lorenzet P.S. Clopidogrel inhibits platelet-leukocyte adhesion and platelet-dependent leukocyte activation. Thromb. Haemost., 2005, Vol. 94, no. 3, pp. 568-577.
27. Fleischer J., Grage-Griebenow E., Kasper B., Heine H., Ernst M., Brandt E., Flad H.-D., Petersen F. Platelet factor 4 inhibits proliferation and cytokine release of activated human T cells. J. Immunol., 2002, Vol. 169, pp. 770-777.
28. Foy T.M., Aruffo A., Bajorath J., Buhlmann J.E., Noelle R.J. Immune regulation by CD40 and its ligand GP39. Annu. Rev. Immunol., 1996, Vol. 14, pp. 591-617.
29. Gear A.R.L., Camerini D. Platelet chemokines and chemokine receptors: linking hemostasis, inflammation, and host defense. Microcirculation, 2003, no. 10, pp. 335-350.
30. Gerdes N., Zhu L., Ersoy M., Hermansson A., Hjemdahl P., Hu H., Hansson G.K., Li N. Platelets regulate CD4+ T-cell differentiation viamultiple chemokines in humans. Thromb. Haemost., 2011, Vol. 106, pp. 353-362.
31. Gudbrandsdottir S., Hasselbalch H.C., Nielsen C.H. Activated platelets enhance IL-10 secretion and reduce TNF-αsecretion by monocytes. J. Immunol., 2013, Vol. 191, no. 8, pp. 4059-4067.
32. Hagihara M., Higuchi A., Tamura N., Ueda Y., Hirabayashi K., Ikeda Y., Kato S., Sakamoto S., Hotta T., Handa S., Goto S. Platelets, after exposure to a high shear stress, induce IL-10-producing, mature dendritic cells in vitro. J. Immunol., 2004, Vol. 172, no. 9, pp. 5297-5303.
33. Halvorsen B., Smedbakken L.M., Michelsen A.E., Skjelland M., Bjerkeli V., Sagen E.L., Taskén K., Bendz B., Gullestad L., Holm S., Biessen E.A., Aukrust P. Activated platelets promote increased monocyte expression of CXCR5 through prostaglandin E2-related mechanisms and enhance the anti-inflammatory effects of CXCL13. Atherosclerosis, 2014, Vol. 234, no. 2, pp. 352-359.
34. Hamzeh-Cognasse H., Cognasse F., Palle S., Chavarin P., Olivier T., Delézay O., Pozzetto B., Garraud O. Direct contact of platelets and their released products exert different effects on human dendritic cell maturation. BMC Immunol., 2008, Vol. 9, no. 1, pp. 54-60.
35. Hartwig H., Drechsler M., Lievens D., Kramp B., von Hundelshausen P., Lutgens E., Weber C., Döring Y., Soehnlein O. Platelet-derived PF4 reduces neutrophil apoptosis following arterial occlusion. Thromb. Haemost., 2014, Vol. 111, no. 3, pp. 562-564.
36. Hasegawa S., Pawankar R., Suzuki K., Nakahata T., Furukawa S., Okumura K., Ra C. Functional expression of the high affinity receptor for IgE (FcepsilonRI) in human platelets and its’ intracellular expression in human megakaryocytes. Blood, 1999, Vol. 93, pp. 2543-2551.
37. Hawrylowicz C.M., Howells G.L., Feldmann M. Platelet-derived interleukin 1 induces human endothelial adhesion molecule expression and cytokine production.J. Exp. Med., 1991, Vol. 174, pp. 785-790.
38. Henn V., Slupsky J.R., Gräfe M., Anagnostopoulos I., Förster R., Müller-Berghaus G., Kroczek R.A. CD40 ligand on activated platelets triggers an inflammatory reaction of endothelial cells. Nature, 1998, Vol. 391, pp. 591-594.
39. Herter J.M., Rossaint J., Zarbock A. Platelets in inflammation and immunity. J. Thromb. Haemost., 2014, Vol. 12, no. 11, pp. 1764-1775.
40. von Hundelshausen P., Weber K.S., Huo Y., Proudfoot A.E., Nelson P.J., Ley K., Weber C. RANTES deposition by platelets triggers monocyte arrest on inflamed and atherosclerotic endothelium. Circulation, 2001, Vol. 103, pp. 1772-1777.
41. Iannacone M., Sitia G., Isogawa M., Marchese P., Castro M.G., Lowenstein P.R., Chisari F.V., Ruggeri Z.M., Guidotti L.G. Platelets mediate cytotoxic T lymphocyte-induced liver damage. Nat. Med., 2005, no. 11, pp. 1167-1170.
42. Joseph M., Auriault C., Capron A., Vorng H., Viens P. A new function for platelets: IgE-dependent killing of schistosomes. Nature, 1983, Vol. 303, pp. 810-812.
43. Kameyoshi Y., Schröder J.M., Christophers E., Yamamoto S. Identification of the cytokine RANTES released from platelets as an eosinophil chemotactic factor. Int. Arch. Allergy Immunol., 1994, Vol. 104, no. 1, pp. 49-51.
44. Kaneider N.C., Kaser A., Tilg H., Ricevuti G., Wiedermann C.J. CD40 ligand-dependent maturation of human monocyte-derived dendritic cells by activated platelets. Int. J. Immunopathol. Pharmacol., 2003, Vol. 16, pp. 225-231.
45. Katsounas A., Schlaak J.F., Lempicki R.A. CCL5: a double-edged sword in host defense against the hepatitis C virus. Int. Rev. Immunol., 2011, Vol. 30, no. 5-6, pp. 366-378.
46. Kerrigan A.M., Navarro-Nuñez L., Pyz E., Finney B.A., Willment J.A., Watson S.P., Brown G.D. Podoplaninexpressing inflammatory macrophages activate murine platelets via CLEC-2. J. Thromb. Haemost., 2012, no. 10, pp. 484-486.
47. Kim K., Li J., Tseng A., Andrews R.K., Cho J. NOX2 is critical for heterotypic neutrophil-platelet interactions during vascular inflammation. Blood, 2015, Vol. 126, no. 16, pp. 1952-1964.
48. Kissel K., Berber S., Nockher A., Santoso S., Bein G., Hackstein H. Human platelets target dendritic cell differentiation and production of proinflammatory cytokines.Transfusion, 2006, Vol. 46, pp. 818-827.
49. Koupenova M., Vitseva O., MacKay C.R., Beaulieu L.M., Benjamin E.J., Mick E., Kurt-Jones E.A., Ravid K., Freedman J.E. Platelet-TLR7 mediates host survival and platelet count during viral infection in the absence of platelet-dependent thrombosis. Blood, 2014, Vol. 124, pp. 791-802.
50. Kraemer B.F., Campbell R.A., Schwertz H., Cody M.J., Franks Z., Tolley N.D., Kahr W.H., Lindemann S., Seizer P., Yost C.C., Zimmerman G.A., Weyrich A.S. Novel anti-bacterial activities of β-defensin 1 in human platelets: suppression of pathogen growth and signaling of neutrophil extracellular trap formation. PLoS Pathog., 2011, Vol. 7, no. 11, e1002355. doi:10.1371/journal.ppat.1002355.
51. Krotz F., Sohn H.Y., Pohl U. Reactive oxygen species: players in the platelet game. Arterioscler. Thromb. Vasc. Biol., 2004, Vol. 24, no. 11, pp. 1988-1996.
52. Langer H.F., Daub K., Braun G., Schönberger T., May A.E., Schaller M., Stein G.M., Stellos K., Bueltmann A., Siegel-Axel D., Wendel H.P., Aebert H., Roecken M., Seizer P., Santoso S., Wesselborg S., Brossart P., Gawaz M. Platelets recruit human dendritic cells viaMac-1/JAM-C interaction and modulate dendritic cell function in vitro. Arterioscler. Thromb. Vasc. Biol., 2007, Vol. 27, no. 6, pp. 1463-1470.
53. Larsen E., Celi A., Gilbert G.E., Furie B.C., Erban J.K., Bonfanti R., Wagner D.D., Furie B. PADGEM protein: a receptor that mediates the interaction of activated platelets with neutrophils and monocytes.Cell, 1989, Vol. 59, pp. 305-312.
54. León-Ponte M., Ahern G.P., O’Connell P.J. Serotonin provides an accessory signal to enhance T-cell activation by signaling through the 5-HT7 receptor. Blood, 2007, Vol. 109, no. 8, pp. 3139-3146.
55. Li G., Kim Y.J., Mantel C., Broxmeyer H.E. P-selectin enhances generation of CD14 + CD16+ dendritic-like cells and inhibits macrophage maturation from human peripheral blood monocytes.J. Immunol., 2003, Vol. 171, pp. 669-677.
56. Li N. Platelet-lymphocyte cross-talk.J. Leukoc. Biol., 2008, Vol. 83, pp. 1069-1078.
57. Li Zh., Yang F., Dunn S., A. Gross K., Smyth S.S. Platelets as immune mediators: Their role in host defense responses and sepsis.Thromb. Res., 2011, Vol. 127, no. 3, pp. 184-188.
58. Liu C.Y., Battaglia M., Lee S.H., Sun Q-H., Aster R.H., Visentin G.P. Platelet factor 4 differentially modulates CD4+ CD25+ (Regulatory) versus CD4 + CD25-(Nonregulatory) T cells. J. Immunol., 2005, Vol. 174, pp. 2680-2686.
59. Loppnow H., Bil R., Hirt S., Schonbeck U., Herzberg M., Werdan K., Rietschel E.T., Brandt E., Flad H.D. Platelet-derived interleukin-1 induces cytokine production, but not proliferation of human vascular smooth muscle cells. Blood, 1998, Vol. 91, pp. 134-141.
60. Matsuda H., Ushio H., Geba G.P., Askenase P.W. Human platelets can initiate Tcell-dependent contact sensitivity through local serotonin release mediated by IgE antibodies.J. Immunol., 1997, Vol. 158, pp. 2891-2897.
61. Maugeri N., Rovere-Querini P., Evangelista V., Covino C., Capobianco A., Bertilaccio M.T., Piccoli A., Totani L., Cianflone D., Maseri A., Manfredi A.A. Neutrophils phagocytose activated platelets in vivo: a phosphatidylserine, P-selectin, and (beta)2 integrin-dependent cell clearance program. Blood, 2009, Vol. 113, no. 21, pp. 5254-5265.
62. Mei J., Liu Y., Dai N., Favara M., Greene T., Jeyaseelan S., Poncz M., Lee J.S., Worthen G.S. CXCL5 regulates chemokine scavenging and pulmonary host defense to bacterial infection. Immunity, 2010, Vol. 33, pp. 106-117.
63. Michetti N., Weyrich A.S., Zimmerman G.A. Platelet-leukocyte interactions in inflammation and thrombosis. US Hematology, 2009, no. 2, pp. 24-27.
64. Nakanishi T., Inaba M., Inagaki-Katashiba N., Tanaka A., Vien P.T.X., Kibata K., Ito T., Nomura S. Plateletderived RANK ligand enhances CCL17 secretion from dendritic cells mediated by thymic stromal lymphopoietin. Platelets, 2014, Vol. 25, pp. 425-431.
65. Nomura S., Fujita S., Nakanishi T., Yokoi T., Shimamoto K., Miyamoto R., Ito T. Platelet-derived microparticles cause CD154-dependent activation of dendritic cells. Platelets, 2012, Vol. 23, no. 1, pp. 81-82.
66. Nurden A.T., Nurden P., Sanchez M., Andia I., Anitua E. Platelets and wound healing. Front. Biosci., 2008, Vol. 13, pp. 3532-3548.
67. O’Brien M. The reciprocal relationship between inflammation and coagulation. Top Companion Anim. Med., 2012, Vol. 27, no. 2, pp. 46-52.
68. Page C., Pitchford S. Neutrophil and platelet complexes and their relevance to neutrophil recruitment and activation. Int. Immunopharmacol., 2013, Vol. 17, no. 4, pp. 1176-1184.
69. Passacquale G., Vamadevan P., Pereira L., Hamid C., Corrigall V., Ferro A. Monocyte-platelet interaction induces a pro-inflammatory phenotype in circulating monocytes. PLoS ONE, 2011, Vol. 6, no. 10, e25595. doi: 10.1371/journal.pone.0025595.
70. Peerschke E.I., Yin W., Ghebrehiwet B. Сomplement activation on platelets: implications for vascular inflammation and thrombosis. Mol. Immunol., 2010, Vol. 47, no. 13, pp. 2170-2175.
71. Peerschke E.I., Yin W., Grigg S.E., Ghebrehiwet B. Blood platelets activate the classical pathway of human complement. J. Thromb. Haemost., 2006, Vol. 4, no. 9, pp. 2035-2042.
72. Petrucci G., de Cristofaro R., Rutella S., Ranelletti F.O., Pocaterra D., Lancellotti S., Habib A., Patrono C., Rocca B. Prostaglandin E2 differentially modulates human platelet function through the prostanoid EP2 and EP3 receptors. J. Pharmacol. Exp. Ther., 2011, Vol. 336, pp. 391-402.
73. Pintucci G., Froum S., Pinnell J., Mignatti P., Rafii S., Green D. Trophic effects of platelets on cultured endothelial cells are mediated by platelet-associated fibroblast growth factor-2 (FGF-2) and vascular endothelial growth factor (VEGF).Thromb. Haemost., 2002, Vol. 88, pp. 834-842.
74. Qian K., Xie F., Gibson A.W., Edberg J.C., Kimberly R.P., Wu J. Functional expression of IgA receptor FcalphaRI on human platelets. J. Leukoc. Biol., 2008, Vol. 84, pp. 1492-1500.
75. Rahman M., Roller J., Zhang S., Syk I., Menger M.D., Jeppsson B., Thorlacius H. Metalloproteinases regulate CD40L shedding from platelets and pulmonary recruitment of neutrophils in abdominal sepsis. Inflamm. Res., 2012, Vol. 61, pp. 571-579.
76. Ramadan A. Ali, Leah M. Wuescher, Randall G. Worth. Platelets: essential components of the immune system. Curr. Trends Immunol., 2015, Vol. 16, pp. 65-78.
77. Rosenfeld S.I., Looney R.J., Leddy J.P., Phipps D.C., Abraham G.N., Anderson C.L. Human platelet Fc receptor for immunoglobulin G. Identification as a 40,000-molecular-weight membrane protein shared by monocytes. J. Clin. Invest., 1985, Vol. 76, no. 6, pp. 2317-2122.
78. Rossaint J., Herter J.M., van Aken H., Napirei M., Döring Y., Weber C. Soehnlein O., Zarbock A. Synchronized integrin engagement and chemokine activation is crucial in neutrophil extracellular trap-mediated sterile inflammation. Blood, 2014, Vol. 123, no. 16, pp. 2573-2584.
79. Rossaint J., Kühne K., Skupski J., van Aken H., Looney M.R., Hidalgo A., Zarbock A. Directed transport of neutrophil-derived extracellular vesicles enables platelet-mediated innate immune response. Nat. Commun., 2016, no. 7, 13464. doi: 10.1038/ncomms13464.
80. Rouhiainen A., Imai S., Rauvala H., Parkkinen J. Occurrence of amphoterin (HMG1) as an endogenous protein of human platelets that is exported to the cell surface upon platelet activation. Thromb. Haemost., 2000, Vol. 84, no. 6, pp. 1087-1094.
81. Rozman P., Bolta Z. Use of platelet growth factors in treating wounds and soft-tissue injuries.Acta Dermatovenerol. Alp. Panonica Adriat., 2007, Vol. 16, pp. 155-165.
82. Scheuerer B., Ernst M., Dürrbaum-Landmann I., Fleischer J., Grage-Griebenow E., Brandt E., Flad H.D., Petersen F. The CXC-chemokine platelet factor 4 promotes monocyte survival and induces monocyte differentiation into macrophages.Blood, 2000, Vol. 95, pp. 1158-1166.
83. Scull C.M., Hays W.D., Fischer T.H. Macrophage pro-inflammatory cytokine secretion is enhanced following interaction with autologous platelets. J. Inflamm. (Lond.), 2010, no. 7, pp. 53-58.
84. Shiraki R., Inoue N., Kawasaki S., Takei A., Kadotani M., Ohnishi U., Ejiri J., Kobayashi S., Hirata K., Kawashima S., Yokoyama M. Expression of Toll-like receptors on human platelets. Thromb. Res., 2004, Vol. 113, pp. 375-385.
85. Simon D.I., Chen Z., Xu H., Li C.Q., Dong J.F., McIntire L.V., Ballantyne C.M., Zhang L., Furman M.I., Berndt M.C., López J.A. Platelet glycoprotein ibalpha is a counterreceptor for the leukocyte integrin Mac-1 (CD11b/ CD18). J. Exp. Med., 2000, Vol. 192, pp. 193-204.
86. Spycher M.O., Nydegger U.E. Participation of the blood platelet in immune reactions due to plateletcomplement interaction.Infusionsther. Transfusionsmed., 1995, Vol. 22, no. 1, pp. 36-43.
87. Steinhubl. S.R., Badimon J.J., Bhatt D.L., Herbert J.M., Luscher T.F. Clinical evidence for anti-inflammatory effects of anti-platelet therapy Steinhubl in patients with atherothrombotic disease. Vasc. Med., 2007, Vol. 12, no. 2, pp. 113-122.
88. Stephen J., Emerson B., Fox K.A., Dransfield I. The uncoupling of monocyte-platelet interactions from the induction of proinflammatory signaling in monocytes. J. Immunol., 2013, Vol. 191, no. 11, pp. 5677-5683.
89. Tilley S.L., Coffman T.M., Koller B.H. Mixed messages: modulation of inflammation and immune responses by prostaglandins and thromboxanes. J. Clin. Invest., 2001, Vol. 108, pp. 15-23.
90. Vieira-de-Abreu A., Campbell R.A., Weyrich A.S., Zimmerman G.A. Platelets: versatile effector cells in hemostasis, inflammation, and the immune continuum. Semin. Immunopathol., 2012, Vol. 3, no. 1, pp. 5-30.
91. Violi F., Pignatelli P. Platelet NOX a novel target for anti-thrombotic treatment. Thromb. Haemost., 2014, Vol. 111, no. 5, pp. 817-823.
92. Waehre T., Damas J.K., Pedersen T.M., Gullestad L., Yndestad A., Andreassen A.K., Froland S.S., Semb A.G., Hansteen V., Gjertsen E., Ueland T., Brosstad F., Solum N.O., Aukrust P. Clopidogrel increases expression of chemokines in peripheral blood mononuclear cells in patients with coronary artery disease: results of a doubleblind placebo-controlled study.J. Thromb. Haemost., 2006, Vol. 4, no. 10, pp. 2140-2147.
93. Weltermann A., Wolzt M., Petersmann K. Czerni C., Graselli U., Lechner K., Kyrle P.A. Large amounts of vascular endothelial growth factor at the site of hemostatic plug formation in vivo. Arterioscler. Thromb. Vasc. Biol., 1999, Vol. 19, pp. 1757-1760.
94. Xiang B., Zhang G., Guo L., Li X-A., Morris A.J., Daugherty A., Whiteheart S.W., Smyth S.S., Li Z. Platele
