Удостоен нобелевской премии за труды по иммунитету
10 декабря 1908 г.
…состоялась церемония присуждения Нобелевской премии за исследование иммунитета русскому биологу И. И. Мечникову.
Русский учёный Илья Ильич Мечников за свою долгую научную жизнь успел сделать вклад в зоологию, бактериологию, геронтологию (науку о старении человека). Вместе со своим коллегой А. Ковалевским Мечников заложил основы эволюционной эмбриологии — науки о сходствах и различиях зародышей различных живых существ и их связи с общей эволюцией.
Но главным научным достижением Мечникова стали его работы по изучению иммунитета — способности организма сопротивляться заболеваниям.
А началось всё с того, что Мечников обнаружил странные подвижные клетки у личинки морской звезды.
Из воспоминаний Мечникова:
Мне пришло в голову, что подобные клетки должны служить в организме для противодействия вредным деятелям… Я сказал себе, что если моё предположение справедливо, то заноза, вставленная в тело личинки морской звезды, не имеющей ни сосудистой, ни нервной системы, должна в короткое время окружиться налезшими на неё подвижными клетками, подобно тому, как это наблюдается у человека, занозившего себе палец… Я сорвал несколько розовых шипов и тотчас же вставил их под кожу великолепных, прозрачных, как вода, личинок морской звезды. Я… на другой день, рано утром, с радостью констатировал удачу опыта.
Мечников предположил, что подобные клетки есть не только у примитивных морских животных, но и у животных более развитых, и у человека.
Проведённые наблюдения подтвердили: повсюду особые клетки, названные им фагоцитами (от греческого «фагос» — пожирать и «цитос» — клетка), захватывали и уничтожали посторонние включения и микроорганизмы. Учёный пришёл к выводу, что любое воспаление — это защитная реакция организма на вторжение инородных тел. Если фагоциты успевают «пожирать» чужеродные микроорганизмы, наступает выздоровление.
Когда в 1883 году на съезде естествоиспытателей и врачей Мечников рассказал об открытой им фагоцитáрной теории иммунитета, он был подвергнут резкой критике сторонников так называемой гуморальной теории. Теория эта гласила, что с возбудителями различных болезней и выделяемыми ими ядами борются особые вещества, содержащиеся в крови животных и человека. Впоследствии подтвердилось, что специальные клетки (В-лимфоциты), распознавая попадающие в организм вирусы и бактерии, действительно вырабатывают к каждому из них своё определённое противоядие — «антитела».
Борьба между двумя теориями длилась больше двадцати лет. Стремясь подтвердить свои умозаключения экспериментами, учёные создавали сыворотки и вакцины от чумы, холеры, дифтерии и других болезней.
И вот, практика позволила обнаружить истину: фагоцитарный иммунитет, открытый Мечниковым, и гуморальный иммунитет, дополняя друг друга, действуют в организме согласованно. При этом гуморальный иммунитет борется в основном с бактериями и отравой, а фагоцитарный — с вирусами, грибками и опухолями.
10 декабря 1908 года состоялось полное и окончательное примирение двух школ: Нобелевскую премию за «труды по иммунитету» разделили создатель фагоцитарной теории иммунитета Мечников и создатель гуморальной теории немец Пауль Эрлих.
Источник
Иммунная система позволяет нам существовать в мире, полном патогенных микроорганизмов — вирусов, бактерий, грибов. Нобелевская премия по физиологии и медицине 2011 года вручена за открытия в области активации врожденного иммунитета (половину премии разделили Брюс Бётлер и Жюль Хоффман) и за изучение роли дендритных клеток в приобретенном иммунитете (вторая половина премии присуждена Ральфу Стайнману, к сожалению, скончавшемуся 30 сентября). Эти достижения не только дали понимание того, как слаженная работа врожденного и адаптивного иммунитета защищает организм, но и открыли новые перспективы в лечении инфекций, рака и воспалительных заболеваний.
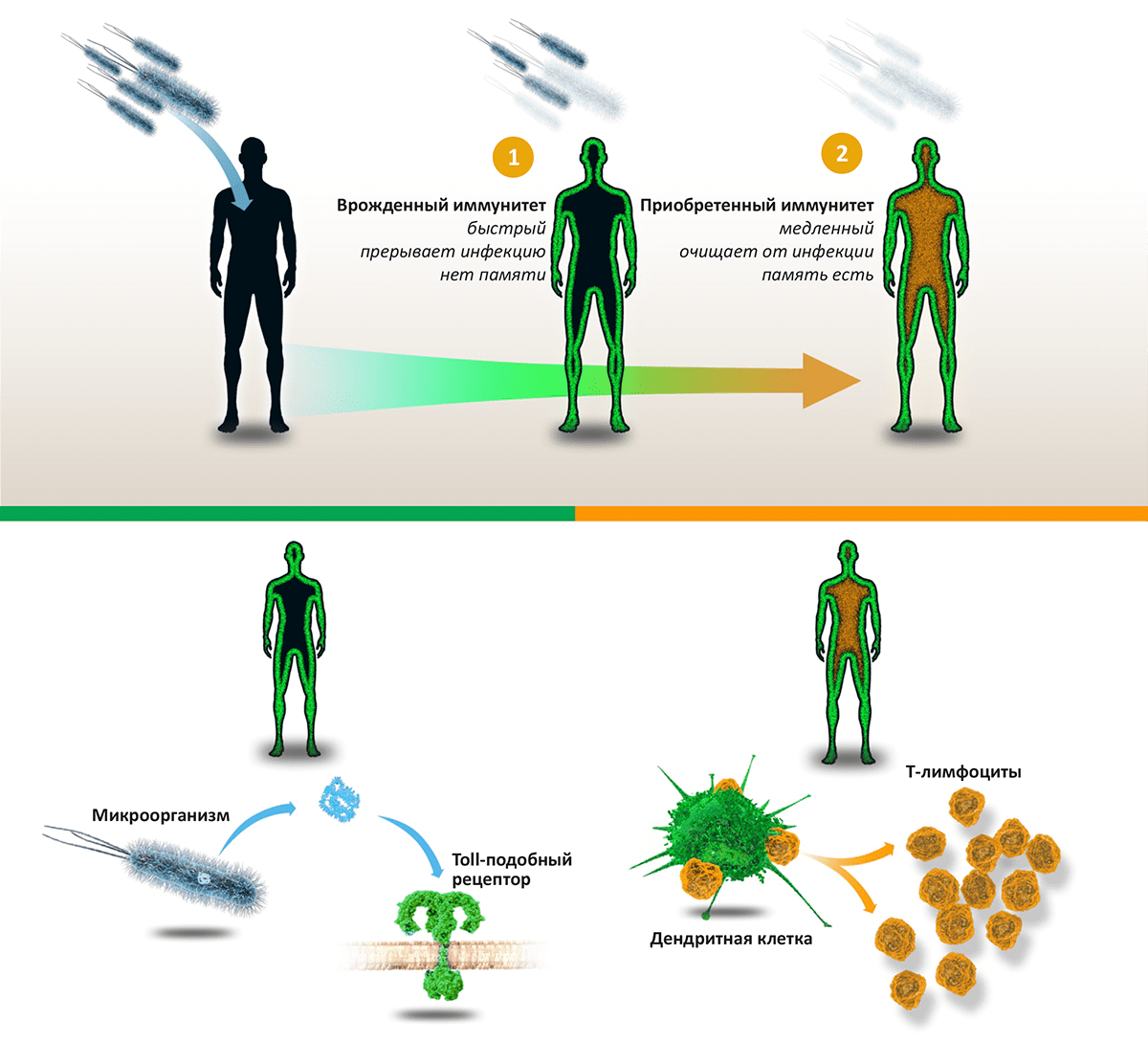
Две линии иммунной обороны
Мы обитаем в мире, буквально кишащем патогенными микроорганизмами (бактериями, грибами, вирусами и паразитами), однако наши организмы оснащены совершенной системой защиты, позволяющей (в норме) не замечать опасного соседства. «Первая линия» иммунной обороны — врожденный иммунитет — уничтожает вторгшиеся в организм патогены на основе технологии «свой—чужой», распознавая черты, всегда присутствующие у «захватчиков», но отсутствующие в собственном организме. Если же инфекции удается прорваться, вступает в работу «вторая линия» — приобретенный, или адаптивный, иммунитет. Основанный на согласованной работе B- и T-лимфоцитов, он действует посредством специфических к конкретной инфекции антител и клеток-«убийц», уничтожающих зараженные клетки и саму инфекцию. В отличие от врожденного иммунитета, способность к распознаванию патогенов которого закодирована генетически, приобретенный иммунитет обучается распознавать новые «образы» врага и сохраняет память о нем, мгновенно «вспоминая», встретившись вновь.
Однако, обеспечивая необходимую защиту, иммунные механизмы скрывают и опасность: если «активационный барьер» слишком низок, иммунитет может активироваться собственными молекулами, что приводит к развитию аутоиммунных и воспалительных заболеваний.
Организация иммунной системы изучалась в течение XX века постепенно; в частности, нобелевскими премиями отмечены изучение строения антител и определение механизма распознавания Т-клетками инородных веществ. Однако только с работами Бётлера, Хоффмана и Стайнмана стали понятны механизмы, активирующие врожденный иммунитет и связывающие его с иммунитетом приобретенным.
Открытие сенсоров врожденного иммунитета
Пионерское открытие Жюля Хоффмана было сделано в 1996 году, когда он с коллегами исследовал, как дрозофила сопротивляется инфекциям [1]. Они работали на линиях мух, мутантных по нескольким генам, включая ген Toll, участвующий в эмбриональном развитии (за открытие роли этого гена также вручена Нобелевская премия в 1995 году). Хоффман с коллегами открыли, что мухи с мутантным геном Toll погибали при заражении бактериями или грибами, в то время как «дикий тип» чувствовал себя вполне сносно. В результате их работ был сделан вывод, что продукт этого гена — Toll-рецептор — «чувствует» патогенные микроорганизмы и запускает механизмы врожденного иммунитета.
Брюс Бётлер с коллегами, со своей стороны, искали рецепторы, которые могли бы активироваться элементом клеточной стенки бактерий липополисахаридом (ЛПС), который при попадании в кровь вызывает септический шок (чрезмерная активация иммунной системы, грозящая смертью). В 1998 году они обнаружили, что мыши, не реагирующие на введение ЛПС, имели мутации в гене, гомологичном Toll у дрозофил. Продукт этого гена — Toll-подобный рецептор — и оказался искомым сенсором липополисахарида [2]. Связывание ЛПС (обозначающее присутствие бактерий) активирует иммунитет и запускает воспаление, а чрезмерная концентрация ЛПС приводит к септическому шоку. Это открытие показало, что и членистоногие, и млекопитающие используют схожие стратегии противостояния бактериальным инвазиям.
Открытия Хоффмана и Бётлера фактически положили начало новой «горячей» области биологии: впоследствии было открыто более 10 Toll-подобных рецепторов, каждый распознающий свой «образ», характерный для разных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней.

Рисунок 1. Схема работы иммунитета. Проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует «две линии» иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Врожденный иммунитет: компоненты микроорганизмов, такие как липополисахарид, связываются с Toll-подобными рецепторами, находящимися на поверхности многих клеток организма. Это запускает врожденный иммунитет, активирующий воспалительную реакцию и уничтожающий «захватчиков». Приобретенный иммунитет: Дендритные клетки активируют T-лимфоциты, лежащие в основе каскада иммунных реакций, приводящих к синтезу антител и уничтожению патогенов и зараженных клеток.
Новый игрок в команде адаптивного иммунитета
Еще в 1973 году Ральф Стайнман открыл новый тип клеток иммунитета с длинными отростками, названный им дендритными клетками. Его предположение было — что эти клетки активируют T-лимфоциты, играющие ключевую роль в приобретенном иммунитете и иммунной памяти. Это предположение блестяще подтвердилось в клеточных экспериментах, где добавление дендритных клеток к популяции Т-лимфоцитов способствовало формированию иммунитета [3–5].
Дальнейшие работы Стайнмана и других исследователей были направлены на то, чтобы понять, как приобретенный иммунитет определяет, — надо ли реагировать на то или иное вещество, или можно этого не делать. Обнаружилось, что дендритные клетки воспринимают сигналы от системы врожденного иммунитета, и это управляет их способностью активировать T-клетки. Это позволяет нашему иммунитету прицельно бороться с патогенными микроорганизмами, «не обращая внимания» на молекулы нашего собственного тела.
Фундаментальные науки — медицине
Достижения нобелевских лауреатов 2011 года пролили свет на подробности работы систем врожденного и приобретенного иммунитета. Это знание легло в основу создания новых стратегий лечения многих болезней, — например, новых вакцин против инфекций и попыток «натравить» собственную иммунную систему на раковые опухоли. В дополнение к этому, стало понятно, почему организм иногда начинает атаковать свои собственные ткани, что приводит к воспалительным и аутоиммунным заболеваниям.
Горькая ирония
Как известно, Нобелевская премия не вручается посмертно. Однако этот год стал исключением: 30 сентября после продолжительной борьбы с раковой опухолью скончался Ральф Стайнман, — буквально за несколько дней до объявления лауреатов премии. Нобелевский комитет не знал об этом, и обнародовал свое решение 3 октября. Несмотря на этот печальный казус, решение менять не будут. Работы Стайнмана легли в основу терапии дендритными клетками — перспективного способа лечения воспалительных и онкологических заболеваний. К сожалению, самому ему оказалось суждено стать жертвой такого заболевания [6], [7].
И снова мимо!..
Сегодня интернет пестрит сообщениями, что опять — в который уже раз! — Нобелевский комитет обошел своим решением российских ученых. Речь идет о российском эмигранте Руслане Меджитове [8], который, вместе со своим (ныне уже покойным) учителем Чарльзом Дженуэем показал, что и у людей существуют Toll-подобные рецепторы [9]. Если бы Дженуэй был жив, то, скорее всего, именно он был бы третьим лауреатом премии (вместо Стайнмана), а сама премия была бы конкретно за врожденный иммунитет.
По материалам пресс-релиза Нобелевского комитета [10].
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- A. Poltorak. (1998). Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene. Science. 282, 2085-2088;
- R. M. Steinman. (1973). IDENTIFICATION OF A NOVEL CELL TYPE IN PERIPHERAL LYMPHOID ORGANS OF MICE: I. MORPHOLOGY, QUANTITATION, TISSUE DISTRIBUTION. Journal of Experimental Medicine. 137, 1142-1162;
- R. M. Steinman, M. D. Witmer. (1978). Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice.. Proceedings of the National Academy of Sciences. 75, 5132-5136;
- G. Schuler. (1985). Murine epidermal Langerhans cells mature into potent immunostimulatory dendritic cells in vitro. Journal of Experimental Medicine. 161, 526-546;
- Нобелевскую премию присудили только что умершему от рака ученому. Но другого выбирать уже не будут. (2011). NewsRu;
- Воронин Е. (2011). Ральф Стайнман. shvarz.livejournal.com;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- The Nobel Prize in Physiology or Medicine 2011. (2011). The Nobel Prize.
Источник
• Древняя история до 20 века • 20-й век • Первые шаги. Резус-фактор •
• Цитокины, интерлейкины •Законы трансплантации • Превратности судьбы •
• Иммунология в России • Нобелевские лауреаты •
Нобелевские лауреаты за работы по иммунологии.
В заключение исторического очерка приведем список лауреатов Нобелевской премии по биологии и медицине за работы по иммунологии. Напомним, что Нобелевская премия учреждена с 1901 г. и за исключением нескольких первых премий, как правило, ее не присуждают раньше чем через 15—20 лет после первой публикации авторов. Эти 15—20 лет отводят для проверки и перепроверки заявляемого открытия.
Эмиль Беринг (Emil A. von Behring, I854—1917, Германия) — Нобелевская премия 1901 г. за открытие антитоксинов, впоследствии антител, и серотерапию дифтерии. Это первая в истории Нобелевская премия,
Роберт Кох (Robert Koch, 1843—1910, Германия) — Нобелевская премия 1905 г. за исследования по туберкулезу.
Илья Ильич Мечников (1845—1916, Россия) — Нобелевская премия 1908 г. за открытие защитной роли фагоцитоза и клеточную теорию иммунитета.
Пауль Эрлих (Paul Ehrlich, 1854—1915, Германия) — Нобелевская премия 1908 г. (совместно с И.И.Мечниковым) за гуморальную теорию иммунитета.
Шарль Рише (Charles Richet, 1850—1935, Франция) — Нобелевская премия 1913 г. за работы по анафилаксии и открытие того, что иммунный ответ может не только защитить, но и повредить организм.
Жюль Борде (Jules Bordet, 1870—1961, Бельгия) — Нобелевская премия 1919 г. за экспериментальные работы по комплементзависимому бактериолизу, специфическому гемолизу, за разработку метода фиксации комплемента для диагностики инфекционных болезней.
Карл Ландштейнер (Karl Landsteiner, 1868—1943, Австрия) — . Нобелевская премия 1930 г. за открытие групп крови и фундаментальную книгу «The Specificity of Serologic Reactions». Сам К.Ландштейнер считал, что не открытие групп крови — его главное дело жизни, а исследования реакции антигена с антителом.
Макс Тэйлер (Max Theiler, 1899-1972, ЮАР, Англия, США) — Нобелевская премия 1951 г. за создание вакцины против желтой лихорадки.
Дэниэль Бовэ (Daniel Bovet, 1907, Швейцария) — Нобелевская премия 1957 г. за открытие роли гистамина в патогенезе аллергических реакций и разработку антигистаминных фармакологических препаратов для лечения аллергических болезней. Кроме того, он разработал курареподобные релаксанты, транквилизаторы и ряд анестетиков.
Фрэнк Вернет (F.Macfarlane Buraet, 1899—1985, Австралия) и Питер Медавар (Peter В. Medawar, 1915—1987, Великобритания) — Нобелевская премия 1960 г. за исследования по искусственной индукции иммунологической толерантности.
Родни Портер (Rodney R. Porter, 1917—1985, Великобритания) и Джеральд Эдельман (Gerald M. Edelman, 1929, США) — Нобелевская премия 1972 г. за установление химической структуры молекул антител.
Розалин Ялоу (Rosalyn Yalow, 1921) — Нобелевская премия 1977 г. за разработку конкурентного радиоиммунологического анализа, позволившего определять нано- и пикограммовые количества пептидных гормонов.
Бару Бенацерраф (Baruj Benacerraf, 1920, США), Жан Доссе (Jean Dausset, 1916, Франция) и Джордж Д. Снелл (Gearge D. Snell, 1903, США) — Нобелевская премия 1980 г. за открытие генов и структур поверхности клеток главного комплекса гистосовместимости.
Нилье Йерне (Niels К. Jerne, 1911—1994, Великобритания) — Нобелевская премия 1984 г. за разработку теории идиотипических сетей. Кроме того, Н.Йерне разработал метод количественного подсчета антителообразующих клеток. Именно Н.Йерне является первым, кому принадлежит самая фундаментальная и по сей день основная идея иммунологии — идея клональности лимфоцитов, следовательно, клональности любого иммунного ответа.
Георг Кёлер (Georges F. Kohler, 1946—1995, Германия) и Цезарь Мильштейн (Cesar Milstein, 1927, Великобритания) — Нобелевская премия 1984 г. за разработку революционного биотехнологического метода — получения гибридом и моноклональных антител.
Сузуму Тонегава (Susumu Tonegawa, 1939, Япония) — Нобелевская премия 1987 г. за работы по молекулярной биологии генов иммуноглобулинов и раскрытие механизмов, обеспечивающих разнообразие антигенсвязывающих участков молекул антител — рекомбинацию ДНК в соматических клетках (лимфоцитах).
Питер Дохерти (Peter Doherty, 1940, США) и Рольф Цинкернагель (Rolf Zinkernagel, 1944, Швейцария) — Нобелевская премия 1996 г. за открытие двойного распознаванияв иммунологии — природной функции молекул главного комплекса гистосовместимости.
Стенли Прусинер (Stenly Prusiner, США) — Нобелевская премия 1997 г. за открытие прионов — возбудителей инфекций нового типа, не похожих на известные ранее медицине. К прионным инфекциям относят возбудителей губчатого энцефалита — бешенства коров, заразного и для человека, в том числе по пищевым путям, всколыхнувшего Европу в 1996—1997 гг. Его первые публикации на эту тему были сделаны в 1982 г.
Лилацд Хартуэлл (L. Hartwall, 1939, США), Тимоти Хант (Т. Hunt, 1943, Великобритания), Пол Нерс (P. Nerth, 1949, Великобритания) — Нобелевская премия 2001 г. за исследования генов и их продуктов, контролирующих пролиферацию клеток. Хартуэлл ввел понятие CDC — cell division cycle, оценил количество генов, обеспечивающих деление клетки как не менее 100 и идентифицировал стартовый ген (start), инициирующий переход клетки из фазы gj в фазу S. Нерс нашел гены, кодирующие ферменты киназы, обеспечивающие переход клетки в фазу митоза — М. Хант нашел в клетке белки — циклины, приводящие в активное состояние киназы Нерса (CDK — cyclin dependent kinase), каждой киназе — свой циклин. Эти открытия существенным образом способствовали пониманию того, что этиология и патогенез злокачественных опухолей есть проблемы повреждения системы генов CDC.
По прогнозу одного из наиболее уважаемых современных теоретиков иммунологии Чарльза Джанвея (С. A. Janeway), который является также исследователем и преподавателем (он ведущий автор отличного учебника «Immunobiology: immune system in health and disease», переиздаваемого ежегодно с 1994 г.), ближайшей Нобелевской премии по иммунологии, заслуживают авторы исследований по молекулярным механизмам эволюционного происхождения процессов перестройки ДНК генов рецепторов лимфоцитов для антигенов. Две независимые группы исследователей получили фактические данные молекулярной биологии, наводящие на мысль, что инициаторные гены перестройки ДНК RAG-1 и RAG-2 — это транспозоны, т.е. ретро-вирусы по происхождению(отсутствие нитронов, характерные последовательности нуклеотидов и т.д.). Инфекция этих древних вирусов в гаметы каких-то древних челюстных рыб привнесла полезные для выживания свойства, которые закрепились отбором и превратились со временем в такое биологическое свойство всех вышестоящих многоклеточных, как лимфоцитарный иммунитет.
• Древняя история до 20 века • 20-й век • Первые шаги. Резус-фактор •
• Цитокины, интерлейкины • Законы трансплантации • Превратности судьбы •
• Иммунология в России • Нобелевские лауреаты •
Об иммунитете
Источник: Р.М. Хаитов «Иммунология» 2002г.
Источник
