Адаптивный иммунитет иммунология лекция

Глава 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Иммунитет — особое биологическое свойство многоклеточных организмов, направленное на защиту от генетически чужеродных факторов: микроорганизмов (бактерий, вирусов, простейших, грибов), инородных молекул и др. Иммунитет также обеспечивает невосприимчивость организма к инфекции при повторной встрече с патогеном. В медицинском смысле этот термин употребляли ещё до нашей эры в значениях: неприкосновенный, чистый, не затронутый заболеванием, невредимый, находящийся под хорошей защитой, устойчивый к заразной болезни.
Совокупность органных, тканевых, клеточных и молекулярных компонентов, функцией которых является осуществление иммунной защиты, называется иммунной системой. Иммунология — наука о строении и функциях иммунной системы как в норме, так и при различных патологических состояниях, в том числе и при нарушениях самой иммунной системы — иммунопатологиях.
Иммунную защиту обеспечивают два механизма: врождённый и адаптивный.
Врождённый иммунитет является присущей каждому организму с рождения, генетически закреплённой способностью противостоять инфекции. Это передовая линия обороны организма против патогенов, пытающихся проникнуть или уже проникших в покровные ткани или внутреннюю среду. Врождённый иммунитет срабатывает мгновенно или в течение первых нескольких часов после контакта с патогеном (возбудители, выделяемые ими токсины и другие чужеродные молекулы). Он включает четыре основных уровня защиты: анатомический, физиологический, фагоцитарный и воспалительный — покровные ткани, фагоциты, микробоцидные гуморальные вещества (протеазы, сильные окислители и свободные радикалы, продуцируемые фагоцитами, эндогенные противомикробные пептиды и др.), сосудистые реакции. Первичные рецепторы врождённого иммунитета — это молекулы многоклеточных, позволяющие «считывать» эволюционную память — информацию о том, чем отличаются микроорганизмы от собственных клеток.
Эти рецепторы способны распознавать консервативные молекулярные структуры — РАМР (Pathogen-Associated Molecular Patterns), характерные для групп сходных микроорганизмов. В настоящее время постоянно открывают новые патогенраспознающие рецепторы врождённого иммунитета. К ним относят мембраносвязанные паттернраспознающие рецепторы (Pattern Recognition Receptors, PRR), а также растворимые рецепторы — ряд белков сыворотки крови: C-реактивный белок (СРБ), маннозосвязывающий лектин (MBL — Mannose-Binding Lectin), компоненты комплемента.
Собственные возможности клеток врождённого иммунитета санировать организм от проникшего патогена часто недостаточны. Множество патогенов приспособилось выживать в присутствии факторов врождённой резистентности к инфекциям. Именно поэтому в процессе эволюции, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный иммунитет — специфический. Материальные носители адаптивного иммунитета — лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток — способность распознавать почти неограниченное (1018) разнообразие молекулярных объектов — антигенов. Лимфоциты характеризуются экспрессией Т-клеточных (TCR) или В-клеточных (BCR) рецепторов, распознающих только одну антигенную детерминанту либо небольшое число структурно очень близких детерминант, и поэтому, в отличие от PRR, обладающих высокой специфичностью (рис. 1-1).
Адаптивный (приобретённый) иммунитет формируется в течение жизни индивидуума. Активно приобретённый иммунитет — состояние невосприимчивости к инфекции после перенесённого инфекционного заболевания или после вакцинации (сам организм вырабатывает соответствующие антитела). Пассивно приобретённый иммунитет — состояние невосприимчивости к инфекции в результате поступления в организм уже готовых антител от матери или в результате инъекции (сам организм эти антитела не вырабатывает).
ИММУННЫЙ ОТВЕТ
Врождённая и адаптивная системы защиты организма включают клеточный и гуморальный компоненты и активно взаимодействуют друг с другом в процессе иммунного ответа. Иммунный ответ — многоэтапный процесс, заключающийся в распознавании и деструкции патогена и повреждённых им тканей. В его основе лежит уникальное свойство иммун-

Рис. 1-1. Сравнение врождённого и адаптивного иммунитета
ной системы отличать «свое» («sef») от «чужого» («nonself») и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно — иммунные реакции. Распознавание множества чужеродных антигенов происходит благодаря наличию в организме огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов главного комплекса гистосовместимости (MHC) классов I и II. Нейтрализацию «чужого» осуществляют цирку-
лирующие в жидкостях организма антитела (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет).
Таким образом, основными характеристиками адаптивного иммунного ответа являются умение различать собственные антигены от чужеродных, специфичность и иммунная память.
• Различение «своего» и «чужого» выражается в дифференциации компонентов собственных тканей организма и чужеродных молекул. Специфическую неотвечаемость организма на собственные антигены обозначают как иммунную толерантность. Если же организм воспринимает собственные компоненты как чужеродные, развивается аутоиммунный ответ.
• Специфичность иммунного ответа проявляется в том, что иммунитет, сформировавшийся в результате контакта с определённым антигеном, будет обеспечивать защиту только против этого антигена.
• Иммунная память формируется в результате адаптивного иммунного ответа против конкретного возбудителя и сохраняется, как правило, в течение всей последующей жизни организма, защищая его от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к «запоминанию» антигенных детерминант патогена за счёт образования клеток иммунной памяти. Наличие иммунной памяти обусловливает развитие ускоренного и усиленного ответа (вторичный иммунный ответ) при повторном контакте с антигеном. Формирование иммунной памяти является основной целью вакцинации, т.е. процесса естественного или искусственного формирования иммунной защиты против определённой инфекции.
Схема развития иммунного ответа представлена на рис. 1-2. Содержание отдельных этапов иммунного ответа раскрыто ниже.
• Воспаление: участвуют клетки, поглощающие антигены (фагоциты, антигенпрезентирующие клетки) — в частности, дендритные клетки (ДК), макрофаги, эндотелиальные и другие клетки. Выделяются провоспалительные цитокины и хемокины.
• Переработка антигена (процессинг). После поглощения антигена антигенпрезентирующей клеткой (АПК) происходит его процессинг (расщепление и встраивание в молекулы MHC) и презентация на поверхности клетки. Это необходимо для распознавания антигена Т-лимфоцитами.
• Распознавание антигена происходит в периферических лимфоидных органах. Начало специфического иммунного ответа — про-

Рис. 1-2. Основные этапы иммунного ответа
лиферация и дифференцировка эффекторных и регуляторных лимфоцитов.
• Деструкция антигена и повреждённых патогеном тканей. При этом одни лимфоциты (помощники — хелперы) «нанимают» для выполнения эффекторных функций другие лимфоциты (эффекторные) и/или воспалительные лейкоциты (нейтрофилы, моноциты, базофилы, эозинофилы), тучные клетки, а также гуморальные литические системы типа комплемента.
• Выведение продуктов распада происходит с участием известных систем выделения.
КЛЕТКИ ИММУННОЙ СИСТЕМЫ
Клетки иммунной системы условно подразделяют на клетки врождённого и адаптивного иммунитета (рис. 1-3). Главным их различием является специфичность распознавания: низкая у первых и высокая у вторых. Существует и третья группа клеток — промежуточная, несущая черты обеих групп. Наличие этой группы показывает единство происхождения и способов защиты организма от чужеродных веществ антигенной природы.

Рис. 1-3. Клетки иммунной системы
В выполнении эффекторных иммунных функций очень важную роль играют АПК, T- и B-лимфоциты и NK-клетки (от англ. Natural Killer — естественный киллер, натуральный киллер).
• Антигенпрезентирующие клетки (АПК). К АПК относят макрофаги, дендритные клетки (включая клетки Лангерганса эпидермиса, М-клетки лимфатических фолликулов пищеварительного тракта и других слизистых оболочек, дендритные эпителиальные клетки тимуса), а также B-лимфоциты. АПК захватывают антиген, обрабатывают его (процессируют) и презентируют антигенные фрагменты на своей поверхности T-лимфоцитам (рис. 1-4).
• T-лимфоциты обусловливают клеточный иммунный ответ, а также помогают отвечать на антиген B-лимфоцитам при гуморальном иммунном ответе. Каждый T-лимфоцит несет на своей поверхности рецептор T-лимфоцитов (TCR — T-Cell Receptor) (см. рис. 5-1, в и рис. 6-1) строго одной специфичности, т.е. взаимодействующий с одним антигеном. T-клетки по экспрессии маркёрных антигенов CD (Cluster Differentiation) подразделяют на CD4+ и CD8+.
— CD4+ Т-лимфоциты (хелперы). Среди T-клеток, экспрессирующих мембранные маркёры CD4, выделяют Т-лимфоциты с эффекторными функциями (Th1, Th2, Th17) и Т-регуляторные клетки (естественные — Treg и индуцированные — Th3, или Tr1).

Рис. 1-4. Взаимодействие клеток в ходе гуморального иммунного ответа. Рецептор T-хелпера (TCR) распознаёт антигенную детерминанту (эпитоп), экспрессированную на поверхности антигенпрезентирующей клетки вместе с молекулой главного комплекса гистосовместимости класса II (MHC-II). Во взаимодействии участвует маркёрная молекула T-хелпера — CD4. В результате подобного взаимодействия антигенпрезентирующая клетка секретирует интерлейкин-1 (ИЛ-1), стимулирующий в T-хелпере синтез и секрецию цитокинов, включая ИЛ-2, а также синтез и перенос на плазматическую мембрану T-хелпера рецепторов для ИЛ-2 (ИЛ-2 также стимулирует пролиферацию T-хелперов). Отбор B-лимфоцитов происходит при взаимодействии антигена с вариабельными участками антител (иммуноглобулинов) на поверхности этих клеток (правая часть рисунка). Эпитоп этого антигена в комплексе с молекулой MHC-II распознаёт рецептор T-хелпера, после чего T-лимфоцит секретирует цитокины, стимулирующие пролиферацию B-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие антитела к данному антигену. Также показаны некоторые мембранные белки (CD40/CD40L и CD28/B7), участвующие в проведении костимуляторных сигналов, необходимых для полноценной активации взаимодействующих клеток (они описаны подробнее в главе 7)
◊ T-хелперы при взаимодействии с АПК специфически распознают антигены и начинают вырабатывать определённый набор цитокинов соответственно типу инфекционного агента: Th2 при взаимодействии с B-клетками индуцируют гуморальный иммунный ответ (см. рис. 1-4), а Th1 — при взаимодействии с макрофагами и цитотоксическими Т-лимфоцитами (ЦТЛ) — клеточный иммунный ответ. Th17 продуцируют ИЛ17 — мощный индуктор тканевого воспаления, привлекающий и активирующий гранулоциты и макрофаги.
◊ Регуляторные T-клетки (Т-регуляторы) контролируют интенсивность иммунного ответа, подавляя активность других субпопуляций Т-лимфоцитов.
— CD8+ Т-лимфоциты. Субпопуляция T-клеток, экспрессирующих мембранные молекулы CD8. Эти клетки выступают в роли ЦТЛ. Они лизируют клетки-мишени, несущие чужеродные или видоизменённые собственные антигены — аутоантигены: например, клетки опухоли, трансплантата, инфицированные вирусом клетки, несущие поверхностные вирусные антигены. Эффекторные функции ЦТЛ реализуются через индукцию образования в клетках-мишенях пор (под действием особых белков — перфоринов) и секрецию в поры специализированных сериновых протеаз — гранзимов. Вызванное этим нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки (рис. 1-5). Под влиянием гранзимов индуцируются процессы запрограммированной гибели клетки — апоптоза.
• Т-клетки памяти — долгоживущие рециркулирующие малые лимфоциты, формируемые при первичном иммунном ответе. Они «запоминают» особенности детерминант антигенов и при повторном распознавании того же антигена развивают быстрый и усиленный ответ. Т-клетки памяти отличаются от наивных и эффекторных Т-лимфоцитов высоким уровнем экспрессии мембранных маркёров активации, меньшей потребностью в провоспалительных медиаторах и корецепторных сигналах для развития вторичного иммунного ответа.
• B-лимфоциты отвечают за гуморальный иммунный ответ. На мембране B-лимфоцитов присутствует рецептор для антигена — мономер IgM. Продолжительность жизни большинства B-лимфоцитов (если они не активируются антигеном!) не превышает 10 сут.

Рис. 1-5. Уничтожение клетки-мишени цитотоксическим T-лимфоцитом (Т-киллером). При сближении цитотоксического T-лимфоцита с клеткоймишенью после специфичного взаимодействия мембранных молекул клетокпартнёров T-лимфоцит убивает клетку-мишень
— Эффекторные B-лимфоциты. Активированные B-лимфоциты размножаются и дифференцируются в плазматические клетки (см. рис. 5-9), вырабатывающие антитела (иммуноглобулины, специфичные к конкретному антигену). При этом плазматические клетки теряют экспрессию специфических рецепторов для антигена.
— B-лимфоциты иммунной памяти — долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об антигене, с которым когда-то контактировали, за счёт продолжающейся экспрессии рецептора для антигена. Клетки памяти активируются
при повторном распознавании того же антигена. В этом случае B-лимфоциты памяти, при обязательном участии T-хелперов и ряда других факторов, превращаются в плазматические клетки, обеспечивая быстрый синтез большого количества специфичных антител, взаимодействующих с чужеродным антигеном, и развитие эффективного иммунного ответа. • NK-клетки (от англ. Natural Killer — естественный киллер) — лимфоциты, лишённые характерных для T- и B-клеток поверхностных CD-маркёров, а также антигенраспознающих рецепторов — TCR (T Cell Receptor) или BCR (B Cell Receptor). Эти клетки играют важную роль в механизмах врождённого иммунитета (см. главу 3), уничтожают трансформированные, инфицированные вирусами и чужеродные клетки.
Источник
Адаптивный иммунитет Лекция № 5 Лечебный факультет 3 курс Доцент Чудилова Г. А
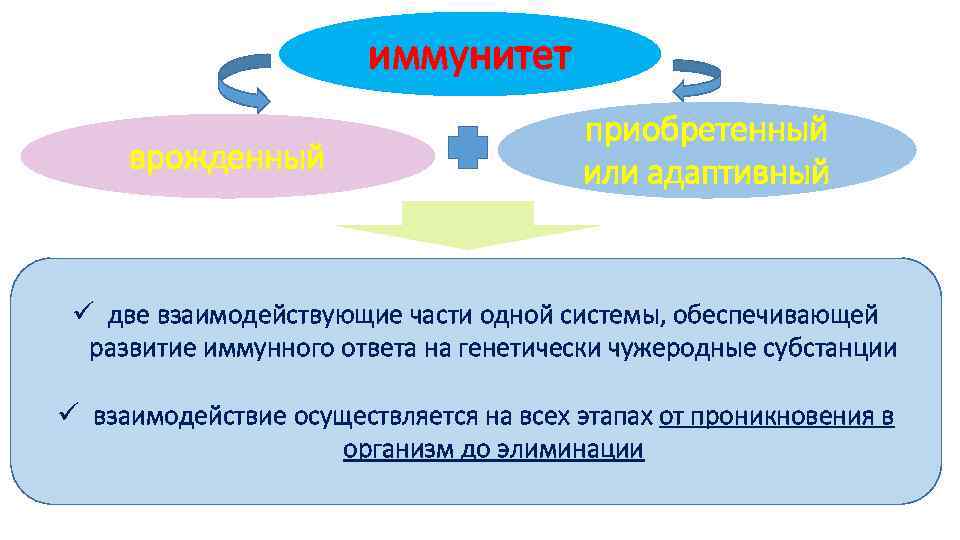
иммунитет врожденный приобретенный или адаптивный ü две взаимодействующие части одной системы, обеспечивающей развитие иммунного ответа на генетически чужеродные субстанции ü взаимодействие осуществляется на всех этапах от проникновения в организм до элиминации

vадаптивный иммунитет неотделим от врожденного vсистема врожденного иммунитета формирует сигналы определяющие форму адаптивного иммунного ответа. vосновной сигнал исходит от фагоцитов и АПК, которые в ответ на распознавание РАМР с помощью TLR одновременно представляют АГ и секретируют цитокины: ИНФ α и β; ФНОα; ИЛ-1β; ИЛ-6; ИЛ-12. v аутоантигены не распознаются рецепторами врожденного иммунитета и не активируют В-л и Т-л.

Адаптивный иммунитет включается, когда неэффективны врожденные механизмы, которыми может завершиться иммунный ответ Используя эффекторные механизмы врожденного иммунитета, адаптивный придает им высокую избирательность и значительно повышает эффективность Главное преимущество адаптивного иммунитетаформирование иммунологической памяти, резко повышающей эффективность иммунной защиты при повторном поступлении патогена и фактически предотвращающей при этом повторное развитие заболевания
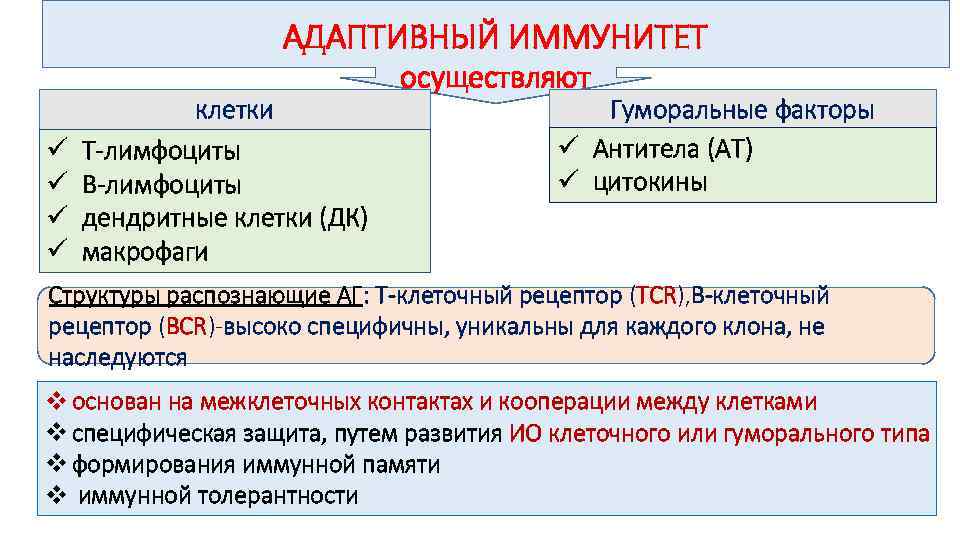
АДАПТИВНЫЙ ИММУНИТЕТ ü ü клетки Т-лимфоциты В-лимфоциты дендритные клетки (ДК) макрофаги осуществляют Гуморальные факторы ü Антитела (АТ) ü цитокины Структуры распознающие АГ: Т-клеточный рецептор (TCR), В-клеточный рецептор (BCR)-высоко специфичны, уникальны для каждого клона, не наследуются v основан на межклеточных контактах и кооперации между клетками v специфическая защита, путем развития ИО клеточного или гуморального типа v формирования иммунной памяти v иммунной толерантности
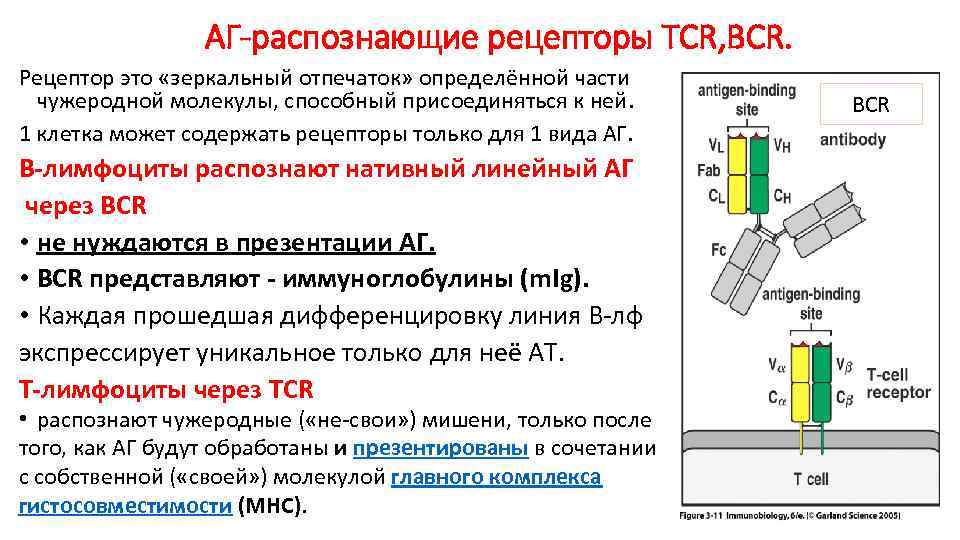
АГ-распознающие рецепторы ТСR, ВСR. Рецептор это «зеркальный отпечаток» определённой части чужеродной молекулы, способный присоединяться к ней. 1 клетка может содержать рецепторы только для 1 вида АГ. B-лимфоциты распознают нативный линейный АГ через BCR • не нуждаются в презентации АГ. • BCR представляют — иммуноглобулины (m. Ig). • Каждая прошедшая дифференцировку линия B-лф экспрессирует уникальное только для неё АТ. T-лимфоциты через ТСR • распознают чужеродные ( «не-свои» ) мишени, только после того, как АГ будут обработаны и презентированы в сочетании с собственной ( «своей» ) молекулой главного комплекса гистосовместимости (MHC). ВСR
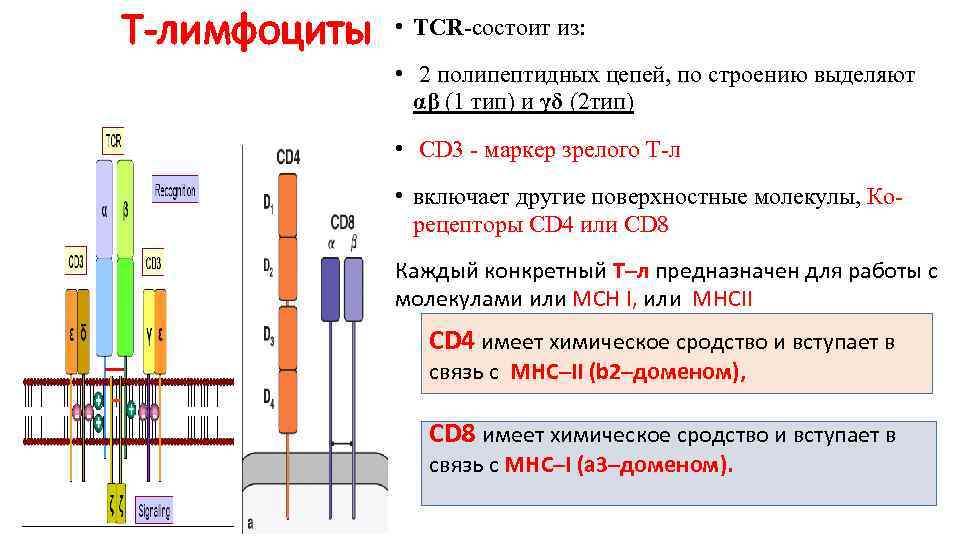
Т-лимфоциты • TCR-состоит из: • 2 полипептидных цепей, по строению выделяют αβ (1 тип) и γδ (2 тип) • CD 3 — маркер зрелого Т-л • включает другие поверхностные молекулы, Корецепторы CD 4 или CD 8 Каждый конкретный T–л предназначен для работы с молекулами или МСН I, или MHCII CD 4 имеет химическое сродство и вступает в связь с MHC–II (b 2–доменом), CD 8 имеет химическое сродство и вступает в связь с MHC–I (a 3–доменом).

В-лимфоциты ВСR(m. Ig+Ig α/β) (СD 19(+), СD 21(+), СD 5(+/-), МНС-II Функция • заключается в выработке антител — действие которых направлено прежде всего против внеклеточно расположенных возбудителей • Продуцируют ИЛ-12, который активирует NK-клетки. выделяют популяции В 2(CD 5 -)—зрелые В-лимфоциты виде Ig. М+, Ig. D+, Ig. G+ виде Ig. М+, Ig. D+, Ig. А+ виде Ig. М+, Ig. D+, Рецепторы C 3 b компонента (Cr 1, CD 35) и C 3 d (Cr 2, CD 21) имеют роль в активации В-лф В 1(CD 5+) –В 1 а и В 1 в врожденная субпопуляция В-лф

Функции: Т-лимфоциты ТСR(αβ ; yδ)- СD 3+ ; МНС-I • регуляторы воспаления, иммунных реакций и гемопоэза • эффекторы клеточного иммунитета (опосредуют клеточные цитотоксические реакции) • участвуют в процессах регенерации различных тканей По функциональным характеристикам выделяют популяции: • СD 3(+)CD 4(+)-Тh(хелперы) • СD 3(+)CD 8(+)-ТЦТ (CTL) (цитотоксические лимфоциты) • СD 3(+)CD 4(+) СD 25(+)Foxp 3(+)-Тreg – самостоятельная субпопуляция естественных реуляторных клетки выполняющие супрессорные фунуции • NKТ –клетки ТСR- СD 3 (+), СD 56(+) • Клетки памяти- СD 45 RO (+), СD 44(+)
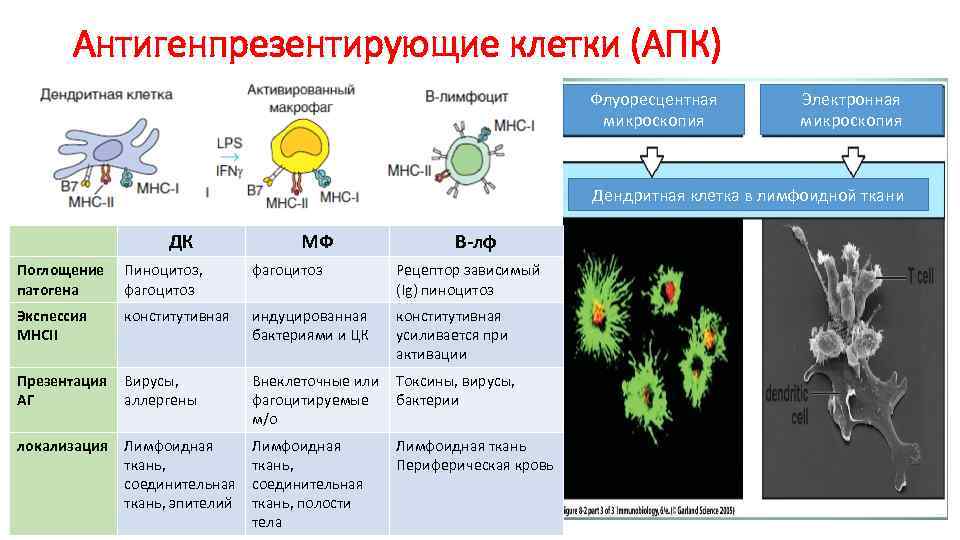
Антигенпрезентирующие клетки (АПК) Флуоресцентная микроскопия Электронная микроскопия Дендритная клетка в лимфоидной ткани ДК МФ В-лф Поглощение патогена Пиноцитоз, фагоцитоз Рецептор зависимый (Ig) пиноцитоз Экспессия МНСII конститутивная индуцированная бактериями и ЦК конститутивная усиливается при активации Презентация АГ Вирусы, аллергены Внеклеточные или Токсины, вирусы, фагоцитируемые бактерии м/о локализация Лимфоидная ткань, соединительная ткань, эпителий Лимфоидная ткань, соединительная ткань, полости тела Лимфоидная ткань Периферическая кровь
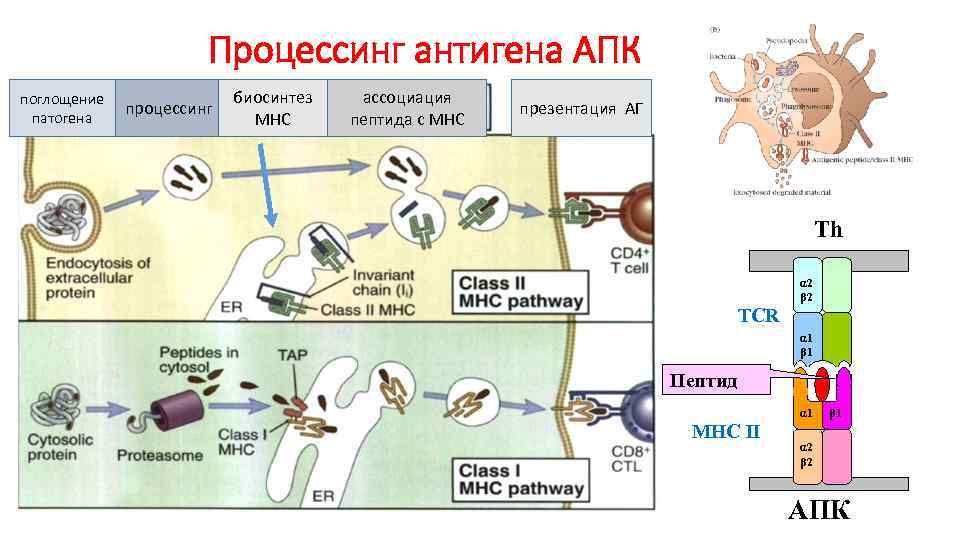
Процессинг антигена АПК поглощение патогена процессинг биосинтез МНС ассоциация пептида с МНС презентация АГ Тh α 2 β 2 TCR α 1 β 1 Пептид α 1 MHC II β 1 α 2 β 2 AПК
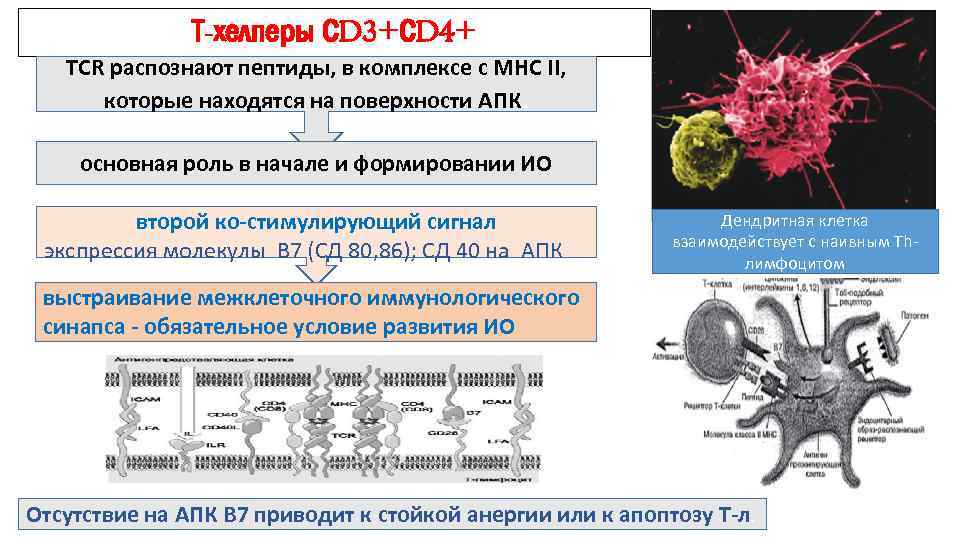
Т-хелперы СD 3+СD 4+ ТСR распознают пептиды, в комплексе с MHC II, которые находятся на поверхности АПК. основная роль в начале и формировании ИО второй ко-стимулирующий сигнал экспрессия молекулы В 7 (СД 80, 86); СД 40 на АПК Дендритная клетка взаимодействует с наивным Тhлимфоцитом выстраивание межклеточного иммунологического синапса — обязательное условие развития ИО Отсутствие на АПК В 7 приводит к стойкой анергии или к апоптозу Т-л.
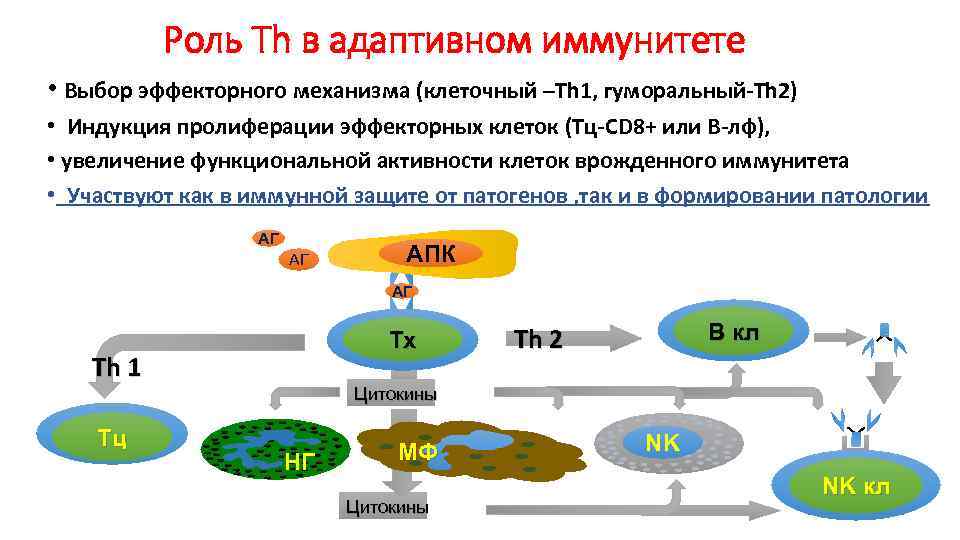
Роль Th в адаптивном иммунитете • Выбор эффекторного механизма (клеточный –Тh 1, гуморальный-Th 2) • Индукция пролиферации эффекторных клеток (Тц-СD 8+ или В-лф), • увеличение функциональной активности клеток врожденного иммунитета • Участвуют как в иммунной защите от патогенов , так и в формировании патологии AГ АГ AПК AГ Tх Th 1 Tц B кл Th 2 Цитокины НГ МФ Цитокины NK NK кл
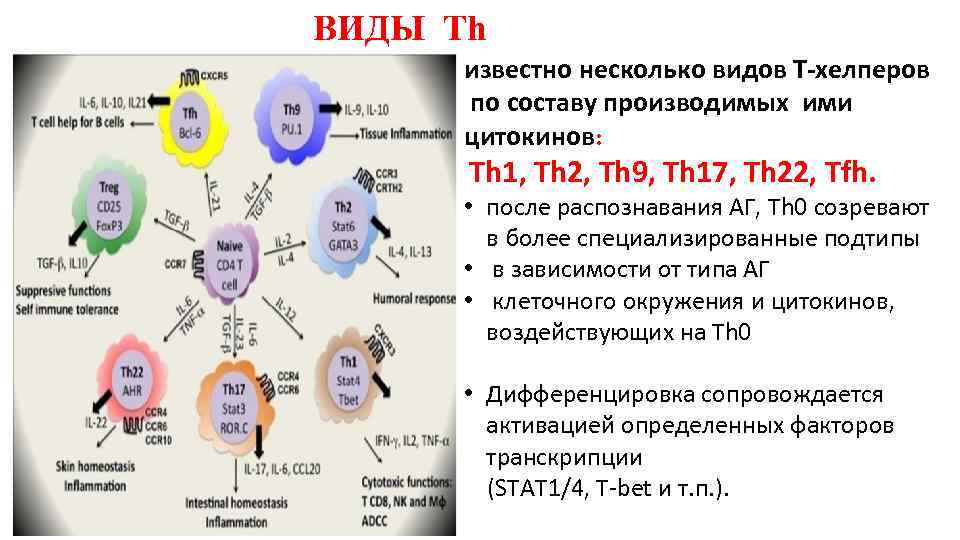
ВИДЫ Тh известно несколько видов Т-хелперов по составу производимых ими цитокинов: Th 1, Th 2, Th 9, Th 17, Th 22, Tfh. • после распознавания АГ, Тh 0 созревают в более специализированные подтипы • в зависимости от типа АГ • клеточного окружения и цитокинов, воздействующих на Тh 0 • Дифференцировка сопровождается активацией определенных факторов транскрипции (STAT 1/4, T-bet и т. п. ).
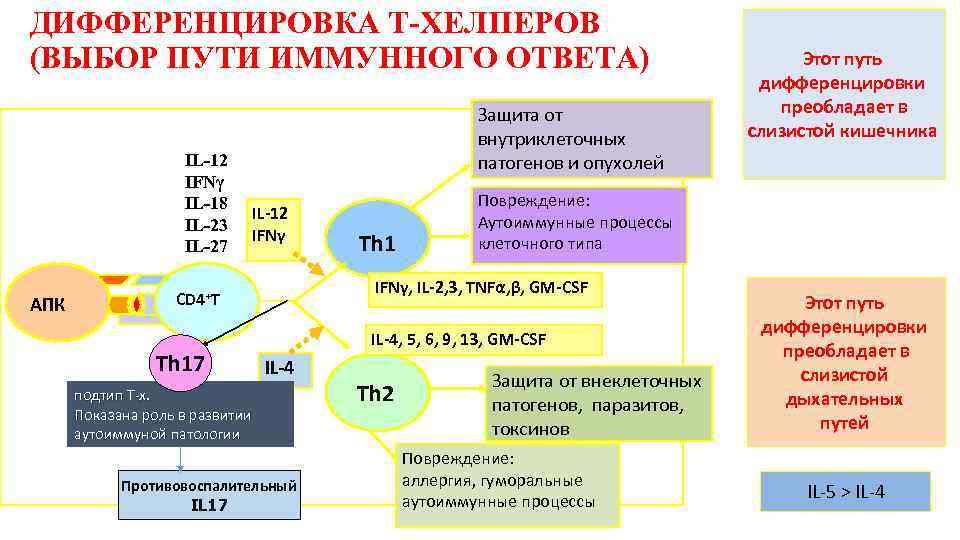
ДИФФЕРЕНЦИРОВКА Т-ХЕЛПЕРОВ (ВЫБОР ПУТИ ИММУННОГО ОТВЕТА) IL-12 IFNγ IL-18 IL-23 IL-27 AПК Защита от внутриклеточных патогенов и опухолей IL-12 IFNγ Повреждение: Аутоиммунные процессы клеточного типа IFNγ, IL-2, 3, TNFα, β, GM-CSF CD 4+T IL-4, 5, 6, 9, 13, GM-CSF Th 17 Th 1 IL-4 подтип Т-х. Показана роль в развитии аутоиммуной патологии Противовоспалительный IL 17 Th 2 Этот путь дифференцировки преобладает в слизистой кишечника Защита от внеклеточных патогенов, паразитов, токсинов Повреждение: аллергия, гуморальные аутоиммунные процессы Этот путь дифференцировки преобладает в слизистой дыхательных путей IL-5 > IL-4

Запуск начальных этапов адаптивного иммунного ответа зависит от структуры и дозы самого АГ, от путей его проникновения. Развитию клеточного Тh 1 Развитию гуморального Тh 2 ответа способствуют: vвысокие или очень низкие v средние дозы АГ v паразиты, аллергены vвнутриклеточные патогены v пероральное или v проникновение АГ через интраназальное кожные барьеры проникновение АГ vиндукторы цитокины: ИЛ-12, v индукторы цитокины: ИЛ-4 ИФНᵧ, ИЛ-18, ИЛ-23, ИЛ-27 v презентация AГ: В-л v представление АГ: МФ и ДК
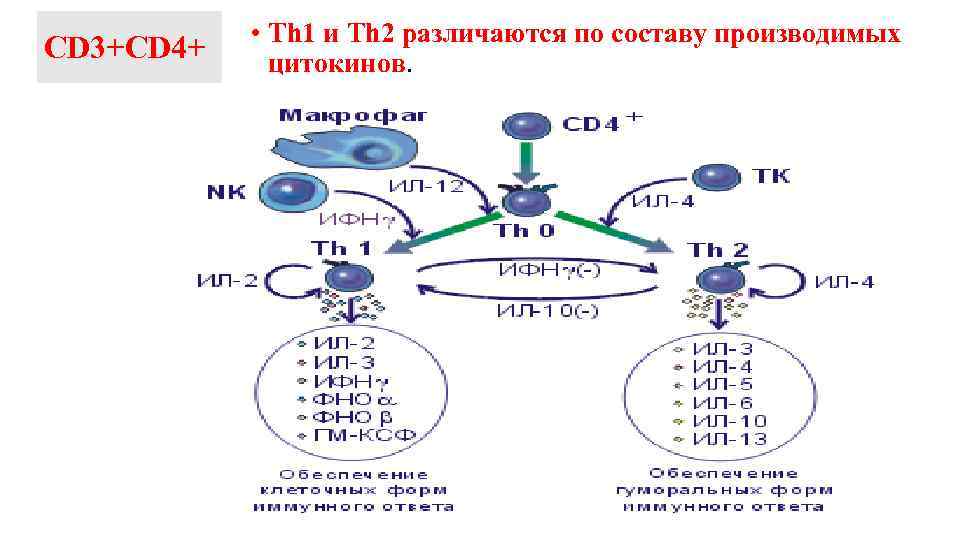
СD 3+СD 4+ • Th 1 и Th 2 различаются по составу производимых цитокинов.
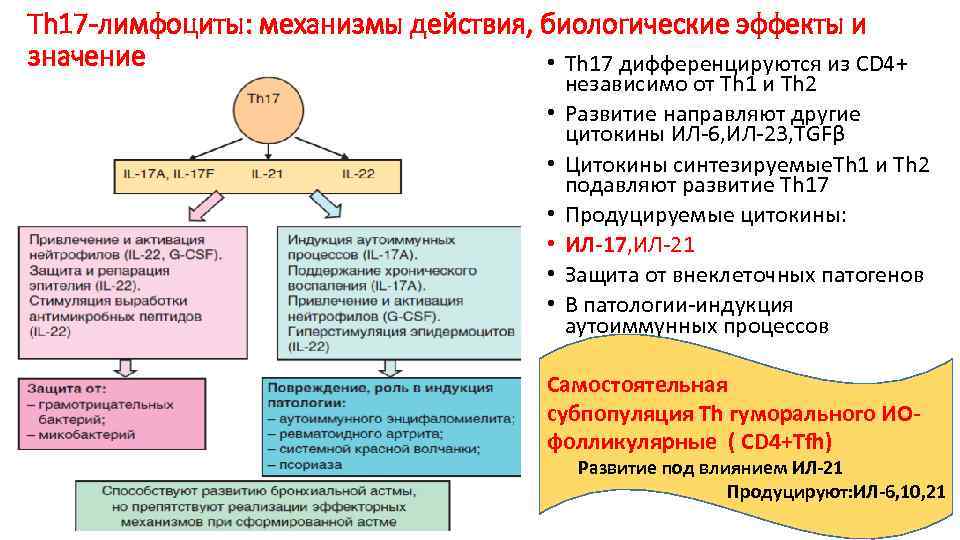
Th 17 -лимфоциты: механизмы действия, биологические эффекты и значение • Th 17 дифференцируются из СD 4+ • • • независимо от Th 1 и Th 2 Развитие направляют другие цитокины ИЛ-6, ИЛ-23, TGFβ Цитокины синтезируемые. Th 1 и Th 2 подавляют развитие Th 17 Продуцируемые цитокины: ИЛ-17, ИЛ-21 Защита от внеклеточных патогенов В патологии-индукция аутоиммунных процессов Самостоятельная субпопуляция Тh гуморального ИОфолликулярные ( СD 4+Тfh) Развитие под влиянием ИЛ-21 Продуцируют: ИЛ-6, 10, 21
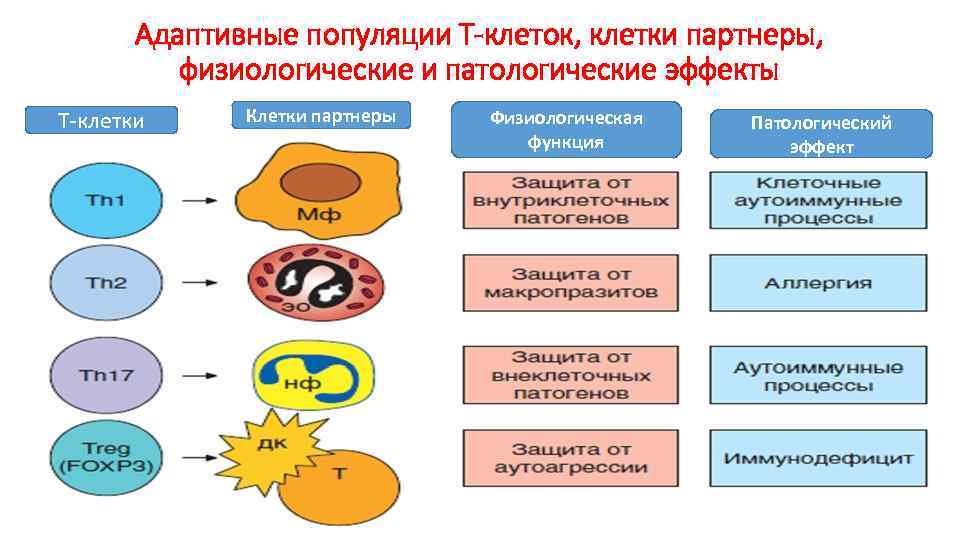
Адаптивные популяции Т-клеток, клетки партнеры, физиологические и патологические эффекты Т-клетки Клетки партнеры Физиологическая функция Патологический эффект
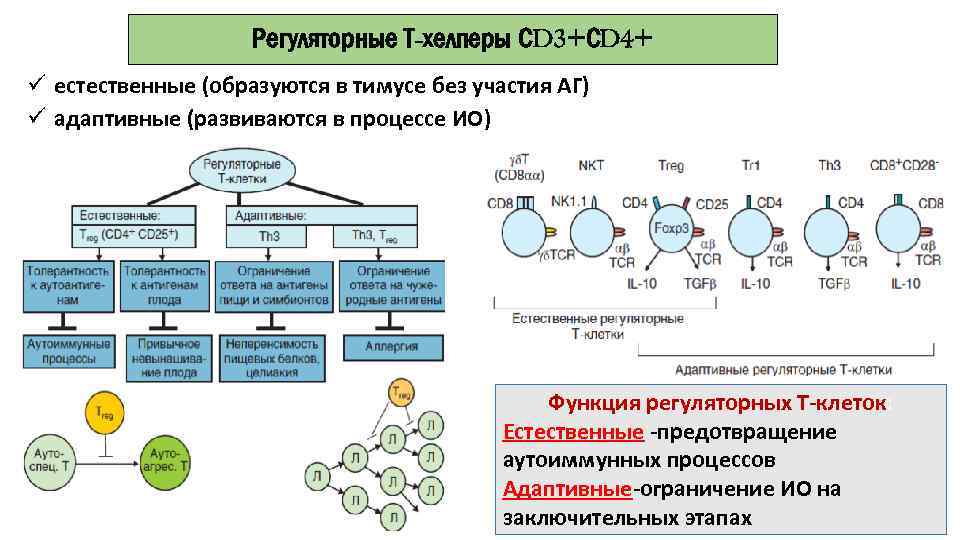
Регуляторные Т-хелперы СD 3+СD 4+ ü естественные (образуются в тимусе без участия АГ) ü адаптивные (развиваются в процессе ИО) Функция регуляторных Т-клеток: Естественные -предотвращение аутоиммунных процессов Адаптивные-ограничение ИО на заключительных этапах
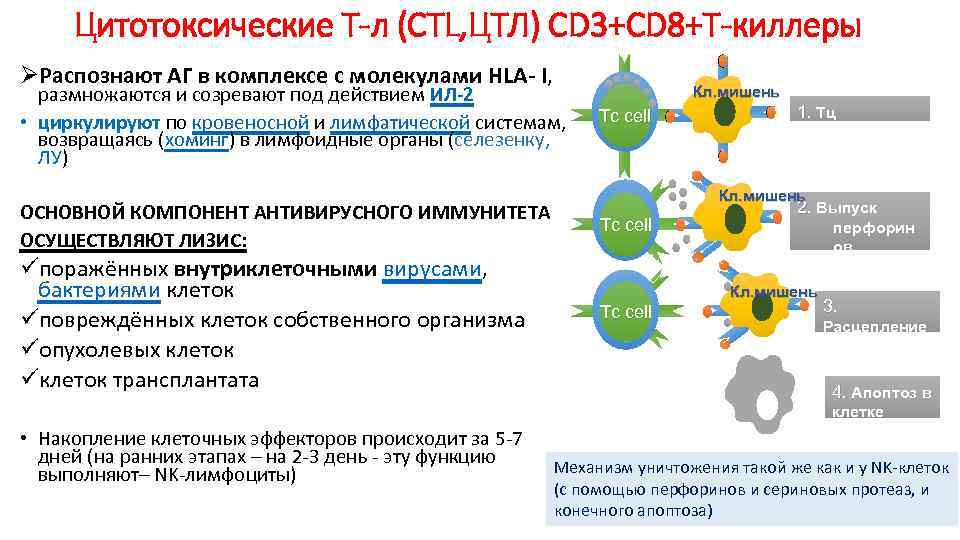
Цитотоксические Т-л (CTL, ЦТЛ) СD 3+CD 8+Т-киллеры ØРаспознают АГ в комплексе с молекулами HLA- I, размножаются и созревают под действием ИЛ-2 • циркулируют по кровеносной и лимфатической системам, возвращаясь (хоминг) в лимфоидные органы (селезенку, ЛУ) ОСНОВНОЙ КОМПОНЕНТ АНТИВИРУСНОГО ИММУНИТЕТА ОСУЩЕСТВЛЯЮТ ЛИЗИС: üпоражённых внутриклеточными вирусами, бактериями клеток üповреждённых клеток собственного организма üопухолевых клеток üклеток трансплантата • Накопление клеточных эффекторов происходит за 5 -7 дней (на ранних этапах – на 2 -3 день — эту функцию выполняют– NK-лимфоциты) Кл. мишень Tc cell 1. Tц. распознает Аг Кл. мишень Tc cell 2. Выпуск перфорин ов и гранзимов Кл. мишень Tc cell 3. Расцепление клеток 4. Апоптоз в. клетке мишени Механизм уничтожения такой же как и у NK-клеток (с помощью перфоринов и сериновых протеаз, и конечного апоптоза)

Лимфоциты выполняют различные функции: • обеспечение эффективного клеточного иммунитета (в том числе отторжение трансплантата, уничтожение опухолевых клеток); • формирование гуморального ответа (синтез АТ( Ig разных классов )к АГ; • регуляция иммунного ответа и координация работы всей иммунной системы в целом (посредством цитокинов); • обеспечение иммунологической памяти (способности к ускоренному и усиленному ИО при повторной встрече с чужеродным АГ).

ИММУННЫЙ ОТВЕТ
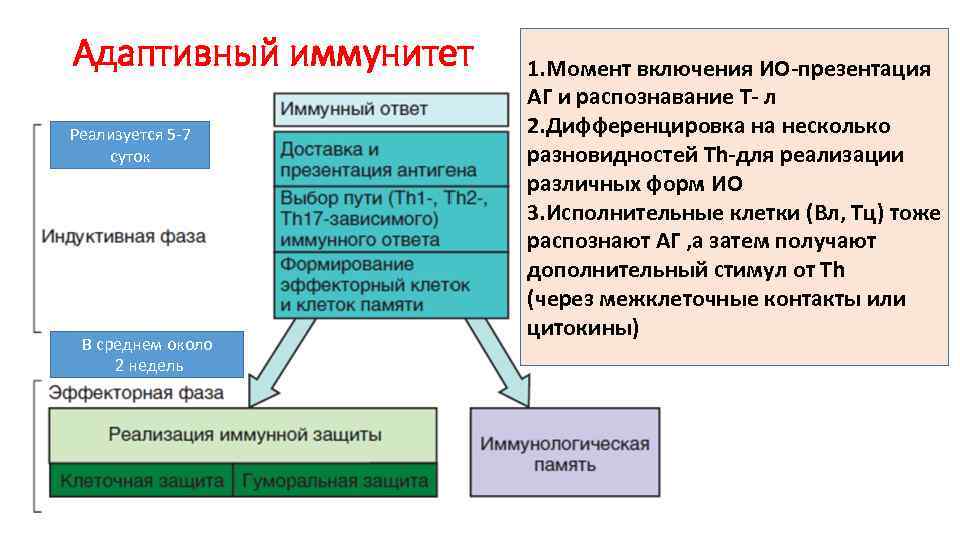
Адаптивный иммунитет Реализуется 5 -7 суток В среднем около 2 недель 1. Момент включения ИО-презентация АГ и распознавание Т- л 2. Дифференцировка на несколько разновидностей Th-для реализации различных форм ИО 3. Исполнительные клетки (Вл, Тц) тоже распознают АГ , а затем получают дополнительный стимул от Тh (через межклеточные контакты или цитокины)
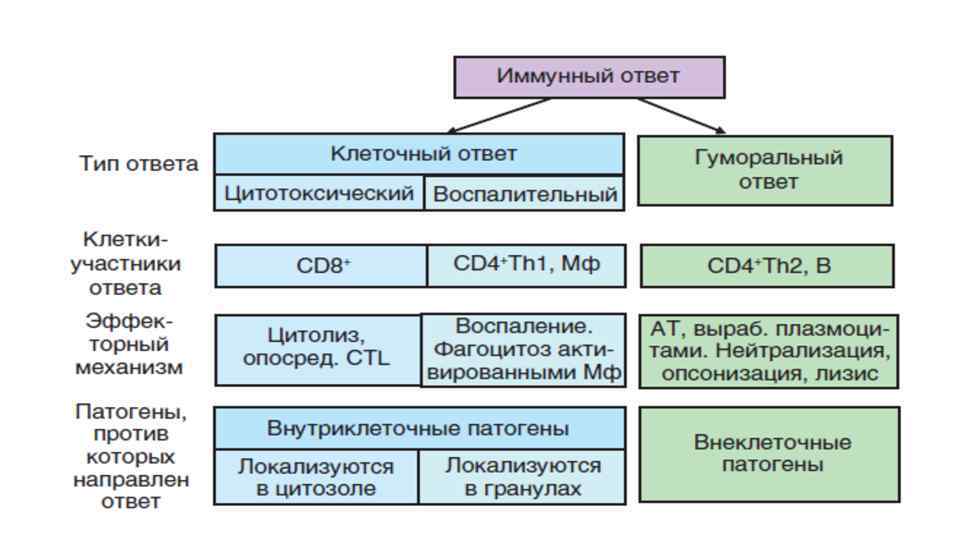

Клеточный иммунный ответ • Осуществляется Т-лимфоцитами • Направлен на защиту от внутриклеточных патогенов • Зависит от доминирующего направления ИО • В зависимости от локализации патогена ( в цитозоле или гранулах) «клетки мишени» различают 2 варианта ответа: 1. Цитотоксический клеточный ответ 2. Воспалительный клеточный ответ
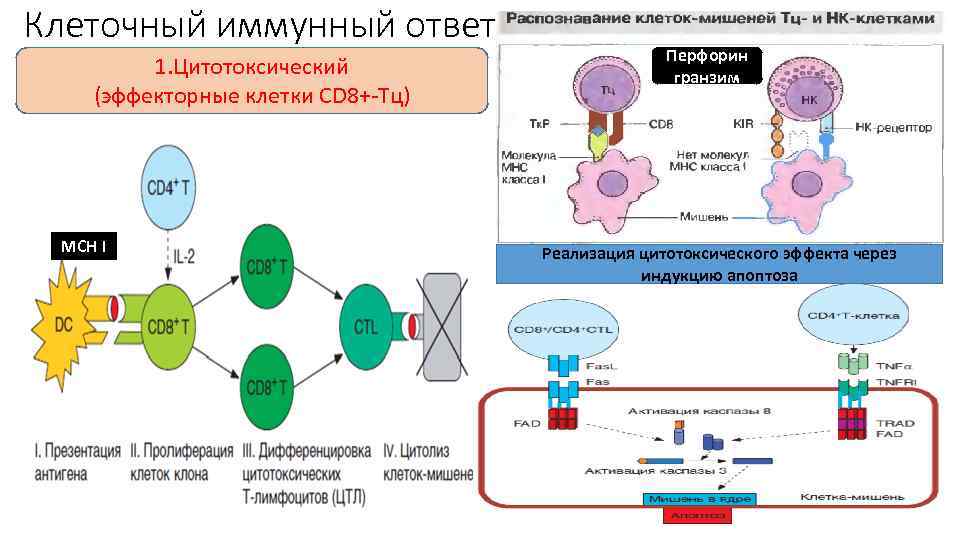
Клеточный иммунный ответ 1. Цитотоксический (эффекторные клетки СD 8+-Тц) МСН I Перфорин гранзим Реализация цитотоксического эффекта через индукцию апоптоза
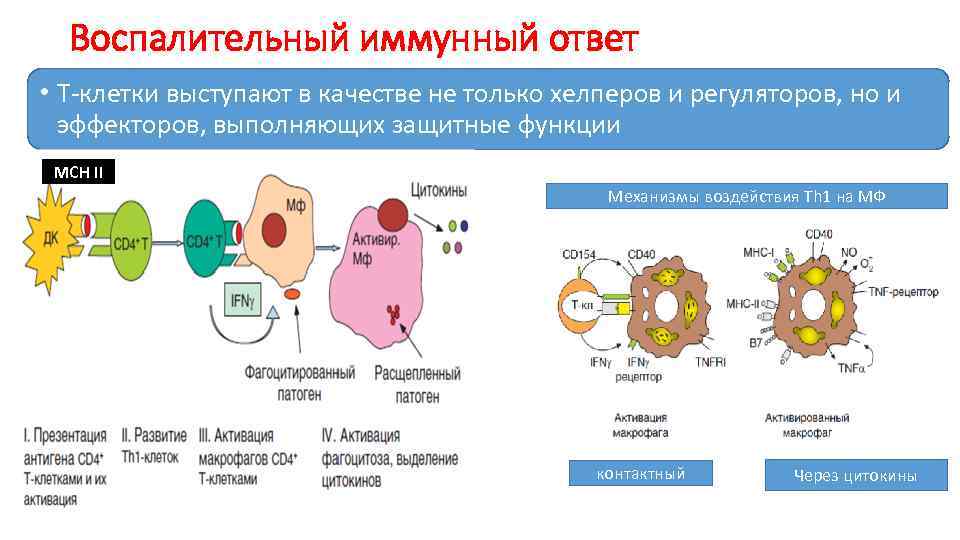
Воспалительный иммунный ответ • Т-клетки выступают в качестве не только хелперов и регуляторов, но и эффекторов, выполняющих защитные функции МСН II Механизмы воздействия Th 1 на МФ контактный Через цитокины
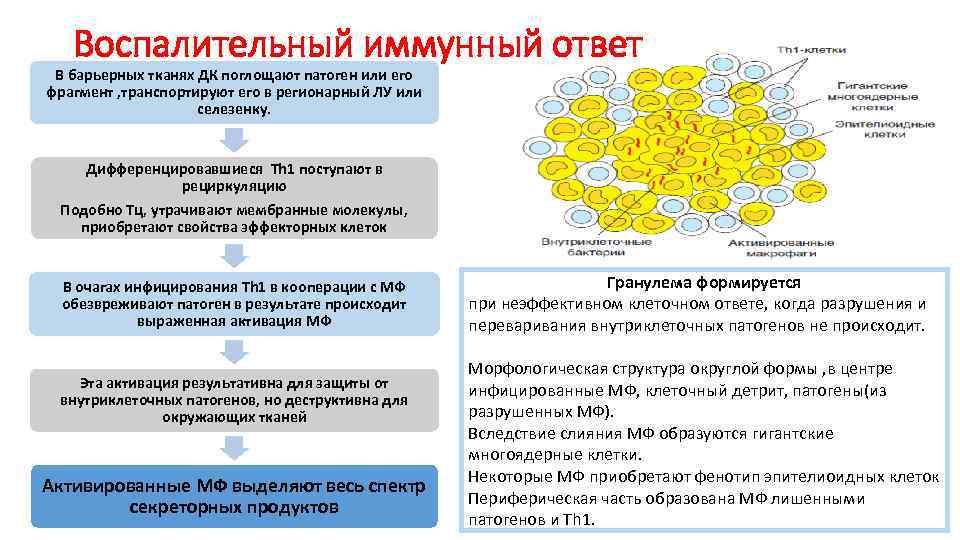
Воспалительный иммунный ответ В барьерных тканях ДК поглощают патоген или его фрагмент , транспортируют его в регионарный ЛУ или селезенку. . Дифференцировавшиеся Th 1 поступают в рециркуляцию Подобно Тц, утрачивают мембранные молекулы, приобретают свойства эффекторных клеток В очагах инфицирования Th 1 в кооперации с МФ обезвреживают патоген в результате происходит выраженная активация МФ Эта активация результативна для защиты от внутриклеточных патогенов, но деструктивна для окружающих тканей Активированные МФ выделяют весь спектр секреторных продуктов Гранулема формируется при неэффективном клеточном ответе, когда разрушения и переваривания внутриклеточных патогенов не происходит. Морфологическая структура округлой формы , в центре инфицированные МФ, клеточный детрит, патогены(из разрушенных МФ). Вследствие слияния МФ образуются гигантские многоядерные клетки. Некоторые МФ приобретают фенотип эпителиоидных клеток Периферическая часть образована МФ лишенными патогенов и Тh 1.
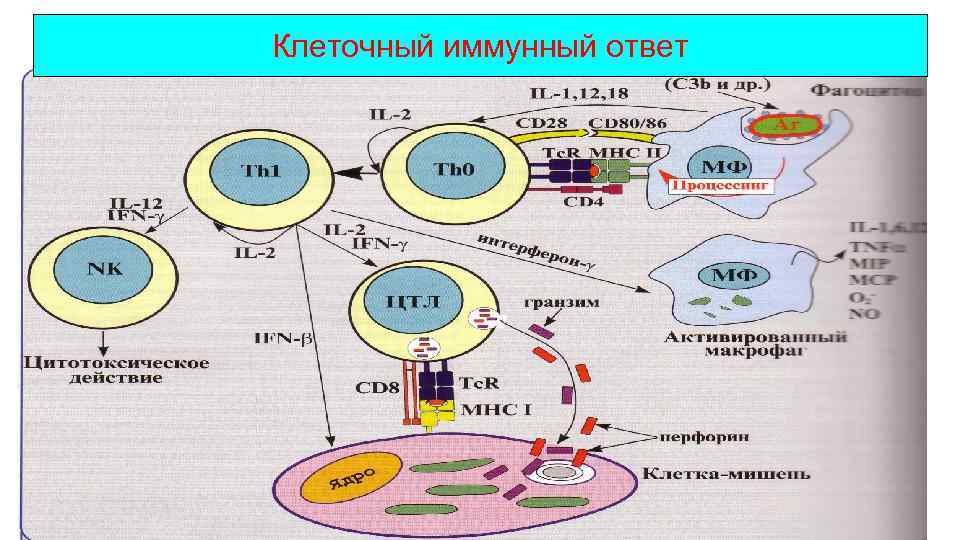
Клеточный иммунный ответ
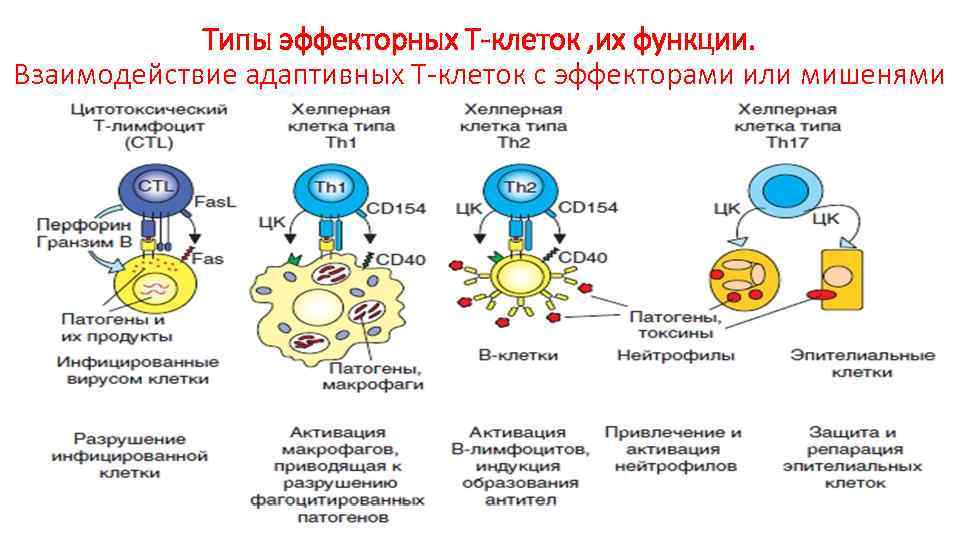
Типы эффекторных Т-клеток , их функции. Взаимодействие адаптивных Т-клеток с эффекторами или мишенями

Клеточный иммунный ответ играет важную роль в следующих реакциях: 1. Аллергические реакции замедленного типа (ГЗТ), аллергический контактный дерматит. 2. Защита против внутриклеточных паразитов. 3. Противовирусный и противогрибковый иммунитет. 4. Отторжение трансплантата. 5. Противоопухолевый иммунитет.
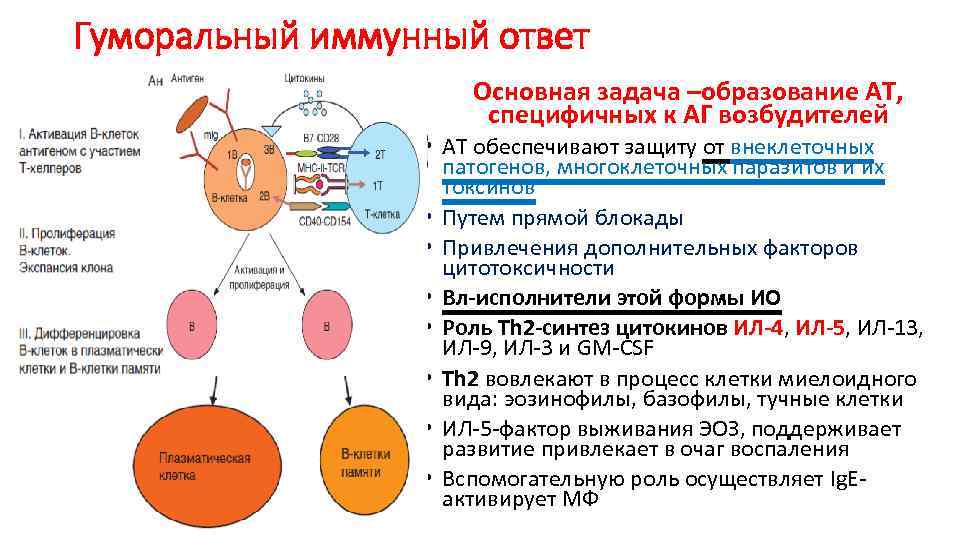
Гуморальный иммунный ответ Основная задача –образование АТ, специфичных к АГ возбудителей • АТ обеспечивают защиту от внеклеточных патогенов, многоклеточных паразитов и их токсинов • Путем прямой блокады • Привлечения дополнительных факторов цитотоксичности • Вл-исполнители этой формы ИО • Роль Тh 2 -синтез цитокинов ИЛ-4, ИЛ-5, ИЛ-13, ИЛ-9, ИЛ-3 и GM-CSF • Тh 2 вовлекают в процесс клетки миелоидного вида: эозинофилы
