Активация клеток врожденного иммунитета происходит при участии рецепторов


А. Иммунитет, Обеспечивающий Защиту Организма Только В Ранний Постнатальный Период.
Б. Составляющую Часть Полноценного Иммунного Ответа На Протяжении Жизни.
В. Основу Для Развития Специфического Иммунного Ответа.
Особенности Врождённого Иммунитета:
А. Наследуется.
Б. Реализуется Только Миелоидными Клетками.
В. Осуществляется Клетками Миелоидного И Лимфоидного Ряда.
Г. Формирует Клетки Иммунологической Памяти.
Д. Функционирует Независимо От Наличия Антигена.
В Эмиграции Лейкоцитов Из Сосудистого Русла Не Участвуют:
А. Интегрины.
Б. Антигенраспознающие Рецепторы.
В. Хемокиновые Рецепторы.
Г. Селектины Направление Миграции Лимфоцитов В Ткани (Хоминг) Не Зависит От:
А. Специфичности Антигенраспознающих Рецепторов.
Б. Хемокиновых Рецепторов.
В. Молекул Адгезии.
В Реализации Реакций Врождённого Иммунитета Участвуют:
А. Т-Лимфоциты.
Б. В-Лимфоциты.
В. Nk-Лимфоциты.
Г. Моноциты/Макрофаги.
Д. Нейтрофилы.
Функции Естественных Клеток-Киллеров (Nk-Лимфоцитов):
А. Обеспечение Т-Зависимой Цитотоксичности.
Б. Обеспечение «Спонтанной» Цитотоксичности Против Клеток, Несущих Чужеродную Генетическую Информацию.
В. Обеспечение Антителозависимого Опосредованного Клетками Лимфолизиса.
Лимфопоэз Nk-Лимфоцитов Происходит:
А. В Костном Мозге.

Б. В Пейеровых Бляшках Кишечника.
В. В Тимусе.
Г. В Лимфатических Узлах.
Д. В Селезёнке.
Разрушение Клеток-Мишеней При Помощи Перфорин-Гранзимовых Механизмов Осуществляют:
А. Т-Лимфоциты.
Б. В-Лимфоциты.
В. Nk-Лимфоциты.
Г. Моноциты/Макрофаги.
Д. Эозинофилы.
В Реализации Цитолитической Активности Т- И Nk-Клеток Не Участвуют Молекулы:
А. Cd28.
Б. Перфорин.
В. Компоненты Комплемента.
Г. Ил-2.
Д. Гранзимы.
Активация Клеток Врождённого Иммунитета Происходит При Участии Рецепторов:
А. Toll-Подобных (Tlr).
Б. Иммуноглобулиновых (Bcr).
В. Tcr.
Tоll-Подобные Рецепторы (Tlr) Распознают:
А. Чужеродные Антигены.
Б. Цитокины.
В. Группы Молекул, Свойственные Патогенам.
Г. Иммунные Комплексы.
В Активации Клеток Врождённого Иммунитета Не Участвуют:
А. Рецепторы Для Маннозы.
Б. Скэвенджер-Рецепторы (Рецепторы-«Мусорщики», Scavenger-Рецепторы).
В. Toll-Подобные Рецепторы (Tlr).
Г. Антигенраспознающие Рецепторы.

Фагоцитарная Активность Несвойственна:
А. Лимфоцитам.
Б. Макрофагам.
В. Нейтрофилам.
Г. Эозинофилам.
Профессиональные Фагоцитирующие Клетки:
А. Т-Лимфоциты.
Б. В-Лимфоциты.
В. Nk-Лимфоциты.
Г. Моноциты/Макрофаги.
Д. Нейтрофилы.
Е. Эозинофилы.
Ж. Дендритные Клетки.
Профессиональные Антигенпрезентирующие Клетки:
А. Т-Лимфоциты.
Б. В-Лимфоциты.
В. Nk-Лимфоциты.
Г. Моноциты/Макрофаги.
Д. Нейтрофилы.
Е. Эозинофилы.
Ж. Дендритные Клетки.
Лимфопоэз Дендритных Клеток Происходит:
А. В Костном Мозге.
Б. В Пейеровых Бляшках Кишечника.
В. В Тимусе.
Г. В Лимфатических Узлах.
Д. В Селезёнке.
Для Процессов Эндоцитоза Характерны:
А. Развитие Пиноцитоза.
Б. Развитие Фагоцитоза.

В. Дегрануляция Тучных Клеток.
Г. Секреция Перфорин-Гранзимовых Молекул.
Процессы Экзоцитоза Включают:
А. Пиноцитоз.
Б. Фагоцитоз.
В. Дегрануляцию Тучных Клеток.
Г. Секрецию Перфорин-Гранзимовых Молекул.
Клетки Системы Мононуклеарных Фагоцитов Включают:
А. Моноциты.
Б. Макрофаги.
В. Нейтрофилы.
Г. Эозинофилы.
Д. Базофилы.
Основные Функции Макрофага:
А. Поглощение И Деструкция Бактерий.
Б. Деструкция Клеток Опухолей.
В. Презентация Иммунодоминантных Пептидов Т-Хелперам.
Г. Секреция Цитокинов, Ферментов И Других Молекул.
Д. Реорганизация Ткани И Заживление Ран.
Е. Синтез/Секреция Иммуноглобулинов.
Гранулоциты, Участвующие В Процессах Воспаления:
А. Моноциты.
Б. Нейтрофилы.
В. Эозинофилы.
Г. Базофилы.
Д. Мегакариоциты.
Бактерицидная Активность Фагоцитов Не Связана С:
А. Активными Формами Кислорода.
Б. Активными Формами Оксида Азота.
В. Компонентами Комплемента.

Г. Дефензинами.
Укажите Неправильное Обозначение Путей Активации Комплемента:
А. Классический.
Б. Альтернативный.
В. Цитокиновый.
Г. Лектиновый.
Система Комплемента:
А. Относится К Интерлейкинам.
Б. Относится К Белкам Сыворотки Крови, Активирующимся Каскадом Реакций Протеолиза.
В. Имеется Только У Человека.
Г. Имеется У Всех Позвоночных.
Участие Системы Комплемента В Иммунологических Реакциях:
А. Участвует В Патогенезе Воспаления.
Б. Участвует В Перфорин-Гранзимовых Механизмах Активности Nk-Клеток.
В. Участвует В Образовании Антител Плазматическими Клетками.
Г. Участвует В Патогенезе Аллергических Реакций Ii Типа (Цитотоксических).
Функции Компонентов Системы Комплемента:
А. Компонент С1 Запускает Активацию По Альтернативному Пути.
Б. С3 Участвует В Патогенезе Аллергических Реакций Немедленного Типа.
В. Компоненты С3а, С4а И С5а — Анафилатоксины.
Г. Компоненты С3а, С4а И С5а — Опсонины.
Д. Компоненты С3b, Ic3b И C4b — Анафилатоксины.
Е. Компоненты С3b, Ic3b И C4b — Опсонины.
Мембраноатакующий Комплекс Включает Компоненты Комплемента:
А. C3bbb.
Б. C3bbb3b.
В. C4b2a.
Г. C4b2a3b.
Д. C5bc6c7c8c9.
Мембраноатакующий Комплекс Формируется Под Влиянием Компонента Комплемента:

А. С3a.
Б. С3b.
В. C4b.
Г. С5a.
Д. C5b.
Механизм Активации Системы Комплемента По Классическому Пути Связан:
А. С Комплексом Антиген–Антитело.
Б. С Интерферонами.
В. С Ил-2.
Г. С Ige.
Механизм Активации Системы Комплемента По Альтернативному Пути Связан:
А. С Участием Комплекса Антиген–Антитело.
Б. С Распознаванием Определённых Сахаров Бактериальной Мембраны.
В. С Действием Продуктов Фагосом Активированных Фагоцитов.
Г. С Действием Цитокинов Естественных Киллеров.
Механизм Активации Системы Комплемента По Лектиновому Пути Связан:
А. С Участием Комплекса Антиген–Антитело.
Б. С Действием Белков Острой Фазы.
В. С Действием Пептидов-Антибиотиков Г. С Распознаванием Маннозосвязывающего Лектина.
Активация Системы Комплемента Не Вызывает:
А. Гибель Клетки.
Б. Усиление Хемотаксиса.
В. Дегрануляцию Тучных Клеток, Базофилов.
Г. Усиление Развития Воспаления.
Д. Усиление Персистенции Инфекции.
В Активации Системы Комплемента По Классическому Пути Принимает Участие:
А. Iga.
Б. Ige.
В. Igg.

Г. Igd.
Причины Дефицита С1-Ингибитора:
А. Снижение Содержания С1-Ингибитора В Плазме.
Б. Снижение Функциональной Активности С1-Ингибитора.
В. Наличие Аутоантител К С1-Ингибитору.
Г. Повышение Содержания С3-Компонента В Плазме.
Адаптивный иммунитет:
А. Наследуется.
Б. Реализуется Миелоидными Клетками.
В. Осуществляется Клетками Миелоидного И Лимфоидного Ряда.
Г. Реализуется Лимфоидными Клетками.
Д. Формирует Клетки Иммунологической Памяти.
Е. Функционирует Независимо От Наличия Антигена.
К Клеткам Первой Линии Защиты Относят Следующие Разновидности Т-Клеток:
А. Αβт-Клетки.
Б. Γδт-Клетки.
В. Регуляторные Т-Клетки.
Г. Т-Клетки Памяти.
В Адаптивном Иммунном Ответе Участвуют:
А. Эритроциты.
Б. Остеоциты.
В. Лимфоциты.
Г. Дендритные Клетки.
Центральные Клетки Адаптивного Иммунитета:
А. Т-Лимфоциты.
Б. В-Лимфоциты.
В. Nk-Лимфоциты.
Г. Моноциты/Макрофаги.
Д. Нейтрофилы.
Регуляторные И Эффекторные Функции Осуществляют Клетки Иммунной Системы:

А. Покоящиеся.
Б. Исключительно Мигрирующие.
В. Исключительно Дифференцирующиеся.
Г. Активированные.
Основные Функции Специфического Иммунного Ответа:
А. Образование Антител.
Б. Накопление Сенсибилизированных Лимфоцитов.
В. Пиноцитоз.
Г. Фагоцитоз.
Вопрос № 56
Наличие На Клетках-Мишенях Сингенных Молекул Главного Комплекса Гистосовместимости Препятствует Реализации Активности:
А. Т-Клеток.
Б. В-Клеток.
В. Макрофагов.
Г. Nk-Клеток.
Вопрос № 57
Иммунодоминантный Пептид — Это:
А. Специфический Сигнал Для Запуска Иммунного Ответа.
Б. Конечный Продукт Спонтанного Распада Антигена.
В. Маркёр Субпопуляций Иммунокомпетентных Клеток.
Вопрос № 58
Клетки Организма, Обеспечивающие Первичное Распознавание Чужеродных Иммунодоминантных Пептидов:
А. Т-Эффекторы.
Б. В-Лимфоциты.
В. Т-Хелперы.
Вопрос № 59
Главный Комплекс Генов Гистосовместимости Hla (Mhc):
А. Отвечает Исключительно За Развитие Реакции Отторжения Трансплантатов.
Б. Определяет Группу Крови.
В. Осуществляет Генетический Контроль Иммунного Ответа И Взаимодействие Иммунокомпетентных Клеток.
Вопрос № 60
Антигены Главного Комплекса Гистосовместимости Класса I Человека Представлены На Поверхности:
А. Только Эритроцитов.
Б. Только Лимфоцитов.
В. Всех Ядросодержащих Клеток.

Вопрос № 61
Чужеродный Иммунодоминантный Пептид Распознаётся В Комплексе С: А. Igm-Антителами.
Б. Антигенами Гистосовместимости. В. Эритроцитарными Антигенами.
Вопрос № 62
Количество Известных Специфичностей Главного Комплекса Гистосовместимости Составляет:
А. Больше 20.
Б. Больше 200.
В. Больше 2000.
Вопрос № 63
Вероятность Совпадения По Всему Набору Антигенов Гистосовместимости Для Двух Случайных Лиц:
А. 1:100.
Б. 1:100 000.
В. 1:1 000 000.
Вопрос № 64
Какой Уровень Идентичности По Антигенам Гистосовместимости Между Супругами Неблагоприятен:
А. Высокая Степень Идентичности.
Б. Частичная Идентичность.
В. Полная Неидентичность.
Вопрос № 65
Клетки, Ответственные За Восстановление Иммунной Системы При Пересадке Костного Мозга:
А. В-Лимфоциты.
Б. Т-Лимфоциты.
В. Кроветворные Стволовые Клетки.
Вопрос № 66
Функции, Не Свойственные Для Кроветворных Стволовых Клеток:
А. Пролиферация.
Б. Дифференцировка.
В. Миграция.
Г. Рециркуляция.
Д. Фагоцитарная Активность.
Вопрос № 67
Функции Кроветворных Стволовых Клеток Не Контролируют:
А. Тимус.
Б. Т-Систему Иммунитета.
В. В-Систему Иммунитета.
Г. Гипофиз-Адреналовую Систему.
Д. Систему Комплемента.
Е. Систему Мононуклеарных Фагоцитов.

Вопрос № 68
Иммуногенетика — Раздел Иммунологии:
А. О Созревании Иммунной Системы.
Б. О Генетическом Контроле Иммунного Ответа.
В. О Значении Инволюции Иммунологических Функций В Процессе Старения.
Вопрос № 69
Антигены Главного Комплекса Гистосовместимости Класса Ii Человека Обеспечивают:
А. Презентацию Чужеродных Агентов Экзогенного Происхождения.
Б. Презентацию Чужеродных Агентов Эндогенного Происхождения В. Подавление Иммунного Ответа.
Вопрос № 70
Антигены Главного Комплекса Гистосовместимости Класса I Человека Обеспечивают:
А. Презентацию Чужеродных Агентов Экзогенного Происхождения.
Б. Презентацию Чужеродных Агентов Эндогенного Происхождения.
В. Подавление Иммунного Ответа.
Вопрос № 71
Антигены Главного Комплекса Гистосовместимости Человека (Hla) Презентируют Для Иммунного Распознавания:
А. Бактерии.
Б. Вирусы.
В. Иммунодоминантные Пептиды.
Вопрос № 72
Гены Иммунного Ответа Человека Локализованы:
А. Внутри Главного Комплекса Гистосовместимости (Mhc).
Б. Внутри Неустановленной Генетической Структуры.
В. Вне Главного Комплекса Гистосовместимости (Mhc).
Вопрос № 73
Дочь Наследует От Матери:
А. Половину Специфичностей Главного Комплекса Гистосовместимости (Mhc).
Б. Полный Набор Специфичностей Mhc.
В. То Или Иное Количество Специфичностей Mhc.
Вопрос № 74
Главный Комплекс Генов Гистосовместимости (Mhc) Человека Был Открыт:
А. В. Xix Веке.
Б. В Первой Половине Xx Века.
В. Во Второй Половине Xx Века.
Вопрос № 75
Индивидуальный Набор Всех Специфичностей Главного Комплекса Гистосовместимости Человека (Hla) Называют:
А. Hla-Фенотипом.
Б. Hla-Генотипом.
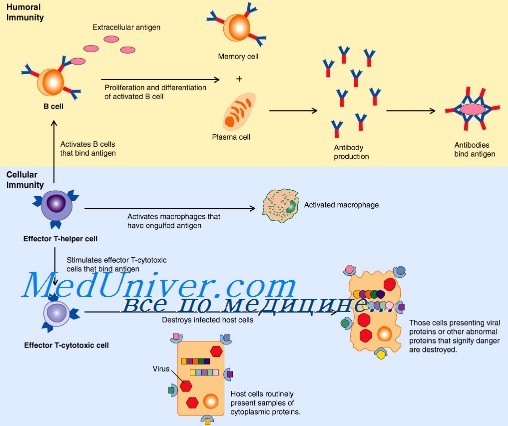
Активация врожденного иммунитета. Стадия активации врожденного иммунитетаВрожденная иммунная защита первично нацелена на распознавание и элиминацию чужеродных структур. Инфекционные агенты располагают многими факторами вирулентности, воздействие которых может быть разрушительным для защитных механизмов врожденного иммунитета. Организм хозяина выработал уникальные стратегии распознавания патогенных структур микроорганизмов, процессинга их и презентации антигенов Т-лимфоцитам. Активация врожденного иммунитета, обеспечивающая оптимальное развитие специализированных эффекторных механизмов, может быть концептуально разделена на две стадии: 1 — фаза детекции, в течение которой комбинация поверхностных рецепторов распознает присутствие чужеродных структур при вторжении микрорганизмов, и 2 — фаза трансмиссии этой сенсорной информации на язык, понятный для клеток адаптивной иммунной системы, например, через продукцию хемокинов и цитокинов. Универсальная стратегия распознавания микроорганизмов эффекторами врожденного иммунитета основана на детекции доменных структур, которые называются патоген-ассоциированными молекулярными образами — PAMPs (pathogen-associated mollecular patterns), а распознающие их рецепторы врожденной иммунной системы — образраспознающими рецепторами — PRRs (pattern-recognition receptors). PAMPs — консервативные (неспецифические, невариабельные) структуры микроорганизмов общие для разных патогенов, их нет у млекопитающих, поэтому они распознаются иммунной системой как «чужое» с помощью паттерн-распознающих рецепторов (PRRs), включая семейство сигнальных Toll-подобных рецепторов (TRL). Существуют еще и альтернативные рецепторы врожденного иммунитета, такие как нуклеотид-связывающий олигомеризующийся домен (nucleotide-binding oligomerization domain — NOD), локализующийся внутриклеточно. NOD распознают РАМР независимо от участия TLR, активируют ядерный фактор KB (NF-kB) и усиливают продукцию IFN-y.
Эти эволюционно законсервированные рецепторы распознают PAMPs, включающие различные компоненты бактериальной стенки, среди которых наиболее известные — это липополисахариды, пептидогликан, липотейхоевые кислоты, маннаны, флагеллин, бактериальная ДНК, вирусные двуспиральные РНК, глюканы. До недавнего времени рассматривалось, что PAMPs обычно экспрессируются на поверхностях микробов и отсутствуют на клетках организма хозяина, однако в последнее время появляются работы, демонстрирующие наличие паттернов хозяина, распознаваемых рецепторами этого класса. В настоящее время известно два типа рецепторов врожденного иммунитета, обеспечивающих информирование организма о проникновении патогена. К первому типу относятся растворимые рецепторы для патогенов: C1q комплемента, ЛПС-связывающий белок, маннозосвязывающий лектин, С-рективный белок. Второй тип рецепторов для патогенов — рецепторы, экспрессирующиеся клетками врожденного иммунитета. Закодированные в геноме, рецепторы врожденной иммунной системы имеют ряд отличий от рецепторов лимфоцитов. Они экспресси-руются на эффекторных клетках врожденной иммунной системы, осуществляющих первую линию защиты, а также на профессиональных антигенпрезентирующих клетках (макрофагах, дендритных клетках и В-лимфоцитах). — Также рекомендуем «Варианты образраспознающих рецепторов PRRs. Toll-подобные рецепторы» Оглавление темы «Врожденный иммунитет»:
|
Распознавание PAMP подготавливает клетки врожденного иммунитета к выполнению их основной функции — удалению чужеродных агентов из внутренней среды организма. При этом происходит экспрессия ряда генов, появляются отсутствовавшие на покоящихся клетках молекулы, участвующие в выполнение клетками своих эффекторных функций. Переход клетки в состояние, обеспечивающее выполнение ею своих функций, обозначают термином «активация».
При активации происходит экспрессия определенных наборов инду- цибельных генов. Различия эффекторных функций разных типов клеток обусловлены экспрессией различных наборов генов. При активации для большинства клеток врожденного иммунитета характерны: появление новых молекул на поверхности клеток (в частности молекул адгезии и разнообразных рецепторов), секреция цитокинов и других гуморальных продуктов, усиление метаболизма.
Источник активации клеток врожденного иммунитета — связывание рецепторами своих лигандов с последующей передачей в клетку активационного сигнала, траснформируемого в сигнал, индуцирующий экспрессию генов. Для индукции генов необходимо образование в клетке ядерных (транскрипционных) факторов, обладающих сродством к определенным последовательностям ДНК и связывающихся с регуляторным (промоторным) участком соответствующих генов. В покоящихся клетках наборы транскрипционных факторов, необходимых для индукции этих генов, отсутствуют. Появление факторов транскрипции достигается разными путями: активацией предсуществующих неактивных факторов с их перемещением в ядро, синтезом этих факторов de novo или разрушением их инактиваторов. Факторы, необходимые для реализации этих процессов, должны быть в свою очередь индуцированы при активации клеток. Именно поэтому между мембранным рецептором, поставляющим активационный сигнал, и генами с их регуляторными участками расположена цепь передаточных (сигнальных) молекул. В процесс активации вовлечено несколько сигнальных путей, приводящих к образованию разных транскрипционных факторов. В состав внутриклеточных сигнальных путей входят ферменты — киназы (фосфорилируют белки или липиды, переводя их в активное состояние) и адапторные белки (передают промежуточные продукты активации между звеньями сигнальной цепи.
Основные факторы, вызвающие активацию клеток врожденного иммунитета — PAMP, узнаваемые патогенраспознающими рецепторами (в первую очередь — TLR). Передача сигнала по сигнальным путям проиллюстрирована на рис. 2.12 и 2.13. При связывании PAMP с мембранным TLR возникают конформационные изменения внеклеточной части рецептора, передающиеся на внутриклеточный домен TIR. В передаче активационного сигнала от TIR-домена ^R участвует несколько адапторных белков (MyD88, TIRAP, TRIF, TRAM), активирующих 2 основных сигнальных пути — MyD88-зависимый и TRIF-зависимый. MyD88-зависимый путь участвует в передаче сигнала от всех ^R, кроме TLR-3, использущего TRIF-зависимый путь. Передача сигнала от TLR-4 происходит с участием обоих сигнальных путей. MyD88 (при участии TIRAP) играет роль «мостика» между активным димером TLR и первой сигнальной киназой — серин- треониновой киназой IRAK-4. Активированная IRAK-4 запускает каскад реакций активации сигнальных ферментов: киназы IRAK-1, убиквитин- лигазы TRAF6 и киназы ТАК1.
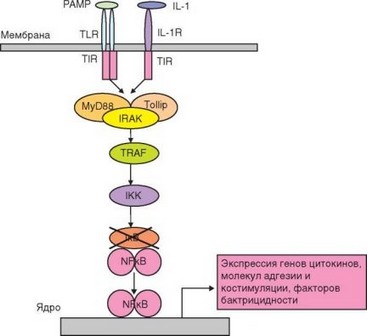
Рис. 2.12. Основной сигнальный путь, активируемый при связывании лигандов Toll-подобными рецепторами и приводящий к экспрессии транскрипционного фактора NF-kB и активации провоспалительных генов
На этом этапе передача сигнала может идти по двум путям. Один из них — активация тирозинфосфатазы IKK. Активация IKK происходит также при поступлении сигналов от эндолизосомального TLR-3 при посредстве адапторного белка TRIF и киназы RIP1. Основная мишень IKK — IkB (ингибирующая цепь неактивного комплекса, содержащего транскрипционный фактор NF-kB). Фосфорилирование IkB вызывает ее связывание с убиквитином, после чего она подвергается расщеплению в протеасоме. Освобожденный от IkB комплекс содержит активный димер NF-kB, миг- рирущий в ядро и связывающийся с промоторными участками многих провоспалительных генов (цитокинов, молекул адгезии, бактерицидных пептидов, ферментов и т.д.). Таким образом достигается главная цель активации — превращение клеток в эффекторы, обеспечивающие развитие воспалительной реакции и реализацию защитных функций врожденного иммунитета.
Второй путь передачи сигнала, раздваивающийся на уровне киназы ТАК1, состоит в активации MAP-каскада (MAP — от mitogen-activated proteinkinase) — серии последовательных активаций серинтреониновых
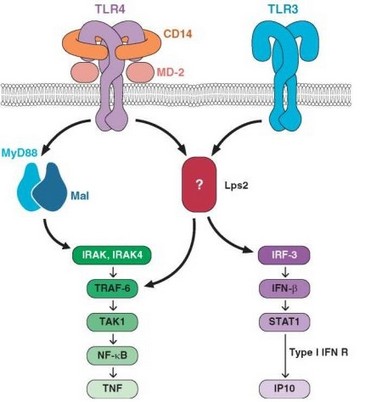
протеинкиназ от MAP-киназ 3-го (ТАК1) до 1-го уровня (JNK и p38). MAP-киназы 1-го уровня обеспечивают образование транскрипционного фактора АР-1 (Activation protein 1). АР-1 участвует в активации многочисленных генов, имеющих отношение к развитию не только воспаления, но и адаптивного иммунного ответа (см. раздел 3.5.2.1).
Передача сигнала от TLR, локализованных в эндолизосомах, происходит другим способом. От TLR-7, TLR-8, TLR-9 сигнал передается с участием адапторного белка MyD88 путем последовательной активации IRAK4, IRAK1, TRAF6 и ТАК1. Следующие за этим пути передачи сигнала также расходятся (рассмотрены выше). Они приводят к образованию транскрипционных факторов NF-kB и AP-1. Однако, в отличие от мембранных TLR, при передаче сигнала от эндолизосомальных TLR формируется дополнительная сигнальная ветвь. При формировании околорецепторного мультимолекулярного комплекса, включающего MyD88, IRAK4, IRAK1, TRAF3,
TRAF6, неактивный IRF7 (IRF — Interferone-responding factor) и некоторые другие факторы, происходит активация IRF7. Активированный IRF7 мигрирует в ядро и, соединяясь с последовательностью ISRE (Interferon-stimulated response element), играет роль транскрипционного фактора, ответственного за «включение» гена интерферона a (IFNa) (см. рис. 2.13).
Передача сигнала от рецепторов TLR-3 и TLR-4 (при его экспрессии в эндолизосомах) происходит иным путем, но приводит к тем же результатам. Прежде всего в сигнальной цепи отсутствует MyD88. Роль первого адаптор- ного белка при этом играет TRIF (для TLR-4 — также TRAM). TRIF имеет участки связывания с белками RIP1 и TRAF3, инициирующими 2 пути передачи сигнала. Один из них состоит в активации киназы RIP1, активации IKK и формированию транскрипционного фактора NF-kB. Активация убиквитин-лигазы TRAF3 приводит (через промежуточную стадию с участием факторов TBK1 и IKKe) к активации фактора IRF3. Этот транскрипционный фактор индуцирует экспрессию генов интерферонов, причем в большей степени IFNp, чем IFNa.
Суммируя рассмотренные выше данные о сигнальных путях (см. рис. 2.13), можно констатировать образование 4 транскрипционных факторов, участвующих в развитии воспаления и проявлений врожденного иммунитета: NFkB (ключевой транскрипционный фактор провоспалительных генов), АР-1 (транскрипционный фактор для включения различных иммунологически значимых генов), IRF7 и IRF3 (транскрипционные факторы, ответственные за включение генов интерферонов — соответственно IFNa и IFNp). При этом мембранные TLR (TLR-5 и функциональный комплекс TLR-1/TLR-2/TLR-6) участвуют в активации NF-kB и АР-1, эндолизосомальные TLR (TLR-7, TLR-8 и TLR-9) ответственны за включение этих факторов и дополнительно IRF7, а мембранные рецепторы (TLR-3 и TLR-4) — за включение NF-kB и АР-1 и дополнительно IRF3. Таким образом, TLR, распознающие внеклеточные патогены, передают сигналы, приводящие к экспрессии провоспалительных генов, а TLR, распознающие внутриклеточные патогены (в частности вирусы), помимо провоспалительных, индуцируют гены интерферонов, обеспечивающих противовирусную защиту.
После взаимодействия мембранных TLR с лигандом происходит их интернализация и отделение от фактора MyD88. Это служит одним из факторов, обусловливающих временную «неотвечаемость» на повторное действие того же агента — толерантность, проходящую только через 2—3 сут. Реакция, развивающаяся при связывании TLR-4 с лигандом, отличается от описанной выше: TLR-4 интернализуется и теряет связь с MуD88, но сохраняет связь с фактором TRIF, что обусловливает его функционирование в составе эндолизосомы, о чем говорилось выше.
Изучение передачи сигнала от цитозольных паттернраспознающих рецепторов семейства NLR—NOD1/2 показало, что по результатам она сходна с передачей сигнала от мембранных TLR. Связывание с NLR их лигандов (мурамилпептидов) приводит к активации (при участии фактора RICK) комплекса IKK с последующим формированием фактора NF-kB и активацией каскада MAP-киназ c образованием транскрипционного фактора АР-1. При этом активации генов интерферонов не происходит.
Как уже сказано, к основным генам, активируемым под влиянием NF-kB, относят гены провоспалительных цитокинов. При экспрессии генов семейства IL-1 для синтеза функционально активного продукта (прежде всего IL-1P) необходим процессинг синтезированной молекулы- предшественницы, состоящий в ее расщеплении каспазой 1. В процессинге задействованы рецепторы NALP (цитозольные рецепторы семейства NLR), формирующие вместе с другими факторами и прокаспазой (все они содержат домен CARD) надмолекулярный комплекс инфламмосому, в которой и происходит активация каспазы 1.
Из приведенных выше данных следует, что PAMP-распознающие рецепторы, относящиеся к TLR и NLR, — главные факторы активации миелоид- ных клеток, задействованных в реакциях врожденного иммунитета. Другие паттернраспознающие рецепторы ответственны за выполнение функций, не требующих активации клеток, однако они могут участвовать в этом процессе в качестве корецепторов. Пример таких рецепторов — молекулы адгезии интегрины. Они связаны с тирозинкиназами и молекулами, имеющими активационные мотивы ITAM. Таким образом, интегрины способны активировать факторы, общие для нескольких путей активации ^м. 2.3.1.2), что способствует образованию транскрипционных факторов NF-kB и AP-1. Один из С-лектиновых рецепторов — дектин-1 имеет в своей цитоплазматической части последовательность ITAM, участвующую в передаче активационных сигналов. Связывание дектина-1 с р-глюканами дрожжевых форм грибов приводит к индукции провоспалительных генов, в том числе циклооксигеназы-2 и цитокинов, в частности TNFa, IL-6, IL-23, что определяет роль дектина-1 в защите от грибковой инфекции. Другие лектиновые рецепторы самостоятельно не участвуют в активации клеток, хотя и могут способствовать TLR-зависимой активации клеток.
Анализ сигнальных путей, активируемых при связывании провоспалительных цитокинов, выявляет очень высокую степень их сходства с MyD88-зависимой передачей сигнала (см. раздел 2.5.5.3). Для IL-1 эти пути идентичны сигнальным путям, запускаемым при связывании TLR, поскольку внутриклеточная часть рецептора для IL-1 представляет TIR-домен (что отражено в названии этого домена — Toll/IL-1 receptor and resistance domain). При образовании TNFa в передачу сигнала вовлечены факторы TRAF2 и TRAF3, что обусловливает наличие перекрестов с сигнальными путями TLR и TNFR. Результат сходства этих путей передачи сигнала — явление, называемое амплификацией ответа на PAMP. Оно заключается в том, что эффект, достигаемый при прямом действии патогенов и их продуктов в очаге инфицирования, дистантно воспроизводится полностью и даже в значительно большем масштабе за счет действия провоспалительных цитокинов на клетки врожденного иммунитета. Таким образом, амплифи- цирующие факторы —продукты PAMP-индуцированной активации.
Выше детально рассмотрен классический путь активации клеток врожденного иммунитета (прежде всего макрофагов), на котором основано вовлечение этих клеток в иммунную защиту и воспалительные реакции. Однако резидентным макрофагам и дендритным клеткам свойственны и другие формы ответа, направленные на осуществление гомеостатических функций, регенерацию тканей, а также ограничение воспалительных процессов. В их основе лежат иные пусковые факторы и сигнальные механизмы. Альтернативные пути активации миелоидных клеток на примере макрофагов представлены в табл. 2.12.
Таблица 2.12. Варианты активации макрофагов под влиянием различных сигналов
| Показатель | Варианты активации | ||
| Классический | Альтернативный | Активация II типа | |
| Активирующий сигнал | INFy + TNF (TLR) | IL-4, IL-13 | IgG-комплексы + TLR, CD40 или CD44 |
| Секреторные продукты | t TNF, t IL-12, IL-1, IL-6 | t IL-1RA IL-10 | t IL-10, i IL-12, TNF, IL-1, IL-6 |
| Поверхностные маркеры | t MHC-II, t CD86, i Маннозо-связы- вающий рецептор, i Fcy-RII | t Маннозосвязывающий рецептор, t Рецепторы-мусорщики, t CD23, i CD14 | t MHC II класса, t CD86 |
| Ферменты | t NO-синтаза, i Аргиназа | t Аргиназа, i NO-синтаза | i NO-синтаза |
| Секретируемые хемокины | IP-10 (CXCL10), MIP-1a (CCL3), MCP-1 (CCL2), | PARC-1 (CCL18), MDC (CCL22), TARC (CCL17) | Неизвестно |
| Биологические эффекты | Повышение бактерицидной и тумороцидной активности, презентация антигена | Ускорение регенерации, подавление пролиферации Т-клеток, уменьшение бактери- цидности | Противовоспалительная активность, усиление антителопродукции |
Таким образом, при действии разнообразных чужеродных (патогены) и эндогенных (цитокины) лигандов на рецепторы клеток врожденного иммунитета запускается весь комплекс процессов, необходимых для осуществления защиты — эндоцитоз (поглощение) чужеродных агентов и активация, приводящая к мобилизации защитных механизмов и секреции активных факторов защиты.