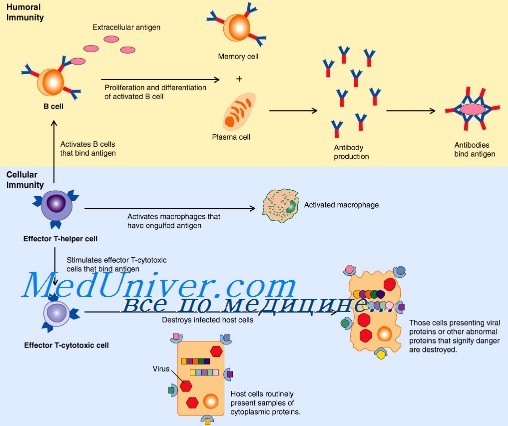
Активация клеток врожденного иммунитета

Активация врожденного иммунитета. Стадия активации врожденного иммунитетаВрожденная иммунная защита первично нацелена на распознавание и элиминацию чужеродных структур. Инфекционные агенты располагают многими факторами вирулентности, воздействие которых может быть разрушительным для защитных механизмов врожденного иммунитета. Организм хозяина выработал уникальные стратегии распознавания патогенных структур микроорганизмов, процессинга их и презентации антигенов Т-лимфоцитам. Активация врожденного иммунитета, обеспечивающая оптимальное развитие специализированных эффекторных механизмов, может быть концептуально разделена на две стадии: 1 — фаза детекции, в течение которой комбинация поверхностных рецепторов распознает присутствие чужеродных структур при вторжении микрорганизмов, и 2 — фаза трансмиссии этой сенсорной информации на язык, понятный для клеток адаптивной иммунной системы, например, через продукцию хемокинов и цитокинов. Универсальная стратегия распознавания микроорганизмов эффекторами врожденного иммунитета основана на детекции доменных структур, которые называются патоген-ассоциированными молекулярными образами — PAMPs (pathogen-associated mollecular patterns), а распознающие их рецепторы врожденной иммунной системы — образраспознающими рецепторами — PRRs (pattern-recognition receptors). PAMPs — консервативные (неспецифические, невариабельные) структуры микроорганизмов общие для разных патогенов, их нет у млекопитающих, поэтому они распознаются иммунной системой как «чужое» с помощью паттерн-распознающих рецепторов (PRRs), включая семейство сигнальных Toll-подобных рецепторов (TRL). Существуют еще и альтернативные рецепторы врожденного иммунитета, такие как нуклеотид-связывающий олигомеризующийся домен (nucleotide-binding oligomerization domain — NOD), локализующийся внутриклеточно. NOD распознают РАМР независимо от участия TLR, активируют ядерный фактор KB (NF-kB) и усиливают продукцию IFN-y.
Эти эволюционно законсервированные рецепторы распознают PAMPs, включающие различные компоненты бактериальной стенки, среди которых наиболее известные — это липополисахариды, пептидогликан, липотейхоевые кислоты, маннаны, флагеллин, бактериальная ДНК, вирусные двуспиральные РНК, глюканы. До недавнего времени рассматривалось, что PAMPs обычно экспрессируются на поверхностях микробов и отсутствуют на клетках организма хозяина, однако в последнее время появляются работы, демонстрирующие наличие паттернов хозяина, распознаваемых рецепторами этого класса. В настоящее время известно два типа рецепторов врожденного иммунитета, обеспечивающих информирование организма о проникновении патогена. К первому типу относятся растворимые рецепторы для патогенов: C1q комплемента, ЛПС-связывающий белок, маннозосвязывающий лектин, С-рективный белок. Второй тип рецепторов для патогенов — рецепторы, экспрессирующиеся клетками врожденного иммунитета. Закодированные в геноме, рецепторы врожденной иммунной системы имеют ряд отличий от рецепторов лимфоцитов. Они экспресси-руются на эффекторных клетках врожденной иммунной системы, осуществляющих первую линию защиты, а также на профессиональных антигенпрезентирующих клетках (макрофагах, дендритных клетках и В-лимфоцитах). — Также рекомендуем «Варианты образраспознающих рецепторов PRRs. Toll-подобные рецепторы» Оглавление темы «Врожденный иммунитет»:
|
Распознавание PAMP подготавливает клетки врожденного иммунитета к выполнению их основной функции — удалению чужеродных агентов из внутренней среды организма. При этом происходит экспрессия ряда генов, появляются отсутствовавшие на покоящихся клетках молекулы, участвующие в выполнение клетками своих эффекторных функций. Переход клетки в состояние, обеспечивающее выполнение ею своих функций, обозначают термином «активация».
При активации происходит экспрессия определенных наборов инду- цибельных генов. Различия эффекторных функций разных типов клеток обусловлены экспрессией различных наборов генов. При активации для большинства клеток врожденного иммунитета характерны: появление новых молекул на поверхности клеток (в частности молекул адгезии и разнообразных рецепторов), секреция цитокинов и других гуморальных продуктов, усиление метаболизма.
Источник активации клеток врожденного иммунитета — связывание рецепторами своих лигандов с последующей передачей в клетку активационного сигнала, траснформируемого в сигнал, индуцирующий экспрессию генов. Для индукции генов необходимо образование в клетке ядерных (транскрипционных) факторов, обладающих сродством к определенным последовательностям ДНК и связывающихся с регуляторным (промоторным) участком соответствующих генов. В покоящихся клетках наборы транскрипционных факторов, необходимых для индукции этих генов, отсутствуют. Появление факторов транскрипции достигается разными путями: активацией предсуществующих неактивных факторов с их перемещением в ядро, синтезом этих факторов de novo или разрушением их инактиваторов. Факторы, необходимые для реализации этих процессов, должны быть в свою очередь индуцированы при активации клеток. Именно поэтому между мембранным рецептором, поставляющим активационный сигнал, и генами с их регуляторными участками расположена цепь передаточных (сигнальных) молекул. В процесс активации вовлечено несколько сигнальных путей, приводящих к образованию разных транскрипционных факторов. В состав внутриклеточных сигнальных путей входят ферменты — киназы (фосфорилируют белки или липиды, переводя их в активное состояние) и адапторные белки (передают промежуточные продукты активации между звеньями сигнальной цепи.
Основные факторы, вызвающие активацию клеток врожденного иммунитета — PAMP, узнаваемые патогенраспознающими рецепторами (в первую очередь — TLR). Передача сигнала по сигнальным путям проиллюстрирована на рис. 2.12 и 2.13. При связывании PAMP с мембранным TLR возникают конформационные изменения внеклеточной части рецептора, передающиеся на внутриклеточный домен TIR. В передаче активационного сигнала от TIR-домена ^R участвует несколько адапторных белков (MyD88, TIRAP, TRIF, TRAM), активирующих 2 основных сигнальных пути — MyD88-зависимый и TRIF-зависимый. MyD88-зависимый путь участвует в передаче сигнала от всех ^R, кроме TLR-3, использущего TRIF-зависимый путь. Передача сигнала от TLR-4 происходит с участием обоих сигнальных путей. MyD88 (при участии TIRAP) играет роль «мостика» между активным димером TLR и первой сигнальной киназой — серин- треониновой киназой IRAK-4. Активированная IRAK-4 запускает каскад реакций активации сигнальных ферментов: киназы IRAK-1, убиквитин- лигазы TRAF6 и киназы ТАК1.
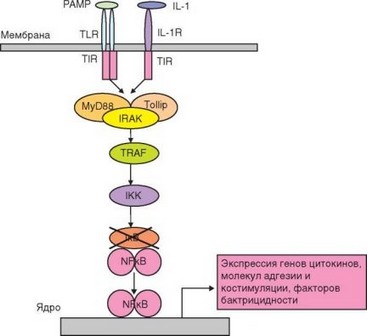
Рис. 2.12. Основной сигнальный путь, активируемый при связывании лигандов Toll-подобными рецепторами и приводящий к экспрессии транскрипционного фактора NF-kB и активации провоспалительных генов
На этом этапе передача сигнала может идти по двум путям. Один из них — активация тирозинфосфатазы IKK. Активация IKK происходит также при поступлении сигналов от эндолизосомального TLR-3 при посредстве адапторного белка TRIF и киназы RIP1. Основная мишень IKK — IkB (ингибирующая цепь неактивного комплекса, содержащего транскрипционный фактор NF-kB). Фосфорилирование IkB вызывает ее связывание с убиквитином, после чего она подвергается расщеплению в протеасоме. Освобожденный от IkB комплекс содержит активный димер NF-kB, миг- рирущий в ядро и связывающийся с промоторными участками многих провоспалительных генов (цитокинов, молекул адгезии, бактерицидных пептидов, ферментов и т.д.). Таким образом достигается главная цель активации — превращение клеток в эффекторы, обеспечивающие развитие воспалительной реакции и реализацию защитных функций врожденного иммунитета.
Второй путь передачи сигнала, раздваивающийся на уровне киназы ТАК1, состоит в активации MAP-каскада (MAP — от mitogen-activated proteinkinase) — серии последовательных активаций серинтреониновых
протеинкиназ от MAP-киназ 3-го (ТАК1) до 1-го уровня (JNK и p38). MAP-киназы 1-го уровня обеспечивают образование транскрипционного фактора АР-1 (Activation protein 1). АР-1 участвует в активации многочисленных генов, имеющих отношение к развитию не только воспаления, но и адаптивного иммунного ответа (см. раздел 3.5.2.1).
Передача сигнала от TLR, локализованных в эндолизосомах, происходит другим способом. От TLR-7, TLR-8, TLR-9 сигнал передается с участием адапторного белка MyD88 путем последовательной активации IRAK4, IRAK1, TRAF6 и ТАК1. Следующие за этим пути передачи сигнала также расходятся (рассмотрены выше). Они приводят к образованию транскрипционных факторов NF-kB и AP-1. Однако, в отличие от мембранных TLR, при передаче сигнала от эндолизосомальных TLR формируется дополнительная сигнальная ветвь. При формировании околорецепторного мультимолекулярного комплекса, включающего MyD88, IRAK4, IRAK1, TRAF3,
TRAF6, неактивный IRF7 (IRF — Interferone-responding factor) и некоторые другие факторы, происходит активация IRF7. Активированный IRF7 мигрирует в ядро и, соединяясь с последовательностью ISRE (Interferon-stimulated response element), играет роль транскрипционного фактора, ответственного за «включение» гена интерферона a (IFNa) (см. рис. 2.13).
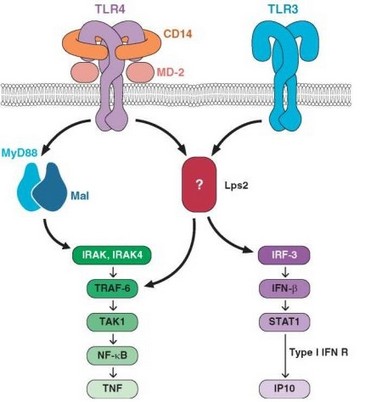
Передача сигнала от рецепторов TLR-3 и TLR-4 (при его экспрессии в эндолизосомах) происходит иным путем, но приводит к тем же результатам. Прежде всего в сигнальной цепи отсутствует MyD88. Роль первого адаптор- ного белка при этом играет TRIF (для TLR-4 — также TRAM). TRIF имеет участки связывания с белками RIP1 и TRAF3, инициирующими 2 пути передачи сигнала. Один из них состоит в активации киназы RIP1, активации IKK и формированию транскрипционного фактора NF-kB. Активация убиквитин-лигазы TRAF3 приводит (через промежуточную стадию с участием факторов TBK1 и IKKe) к активации фактора IRF3. Этот транскрипционный фактор индуцирует экспрессию генов интерферонов, причем в большей степени IFNp, чем IFNa.
Суммируя рассмотренные выше данные о сигнальных путях (см. рис. 2.13), можно констатировать образование 4 транскрипционных факторов, участвующих в развитии воспаления и проявлений врожденного иммунитета: NFkB (ключевой транскрипционный фактор провоспалительных генов), АР-1 (транскрипционный фактор для включения различных иммунологически значимых генов), IRF7 и IRF3 (транскрипционные факторы, ответственные за включение генов интерферонов — соответственно IFNa и IFNp). При этом мембранные TLR (TLR-5 и функциональный комплекс TLR-1/TLR-2/TLR-6) участвуют в активации NF-kB и АР-1, эндолизосомальные TLR (TLR-7, TLR-8 и TLR-9) ответственны за включение этих факторов и дополнительно IRF7, а мембранные рецепторы (TLR-3 и TLR-4) — за включение NF-kB и АР-1 и дополнительно IRF3. Таким образом, TLR, распознающие внеклеточные патогены, передают сигналы, приводящие к экспрессии провоспалительных генов, а TLR, распознающие внутриклеточные патогены (в частности вирусы), помимо провоспалительных, индуцируют гены интерферонов, обеспечивающих противовирусную защиту.
После взаимодействия мембранных TLR с лигандом происходит их интернализация и отделение от фактора MyD88. Это служит одним из факторов, обусловливающих временную «неотвечаемость» на повторное действие того же агента — толерантность, проходящую только через 2—3 сут. Реакция, развивающаяся при связывании TLR-4 с лигандом, отличается от описанной выше: TLR-4 интернализуется и теряет связь с MуD88, но сохраняет связь с фактором TRIF, что обусловливает его функционирование в составе эндолизосомы, о чем говорилось выше.
Изучение передачи сигнала от цитозольных паттернраспознающих рецепторов семейства NLR—NOD1/2 показало, что по результатам она сходна с передачей сигнала от мембранных TLR. Связывание с NLR их лигандов (мурамилпептидов) приводит к активации (при участии фактора RICK) комплекса IKK с последующим формированием фактора NF-kB и активацией каскада MAP-киназ c образованием транскрипционного фактора АР-1. При этом активации генов интерферонов не происходит.
Как уже сказано, к основным генам, активируемым под влиянием NF-kB, относят гены провоспалительных цитокинов. При экспрессии генов семейства IL-1 для синтеза функционально активного продукта (прежде всего IL-1P) необходим процессинг синтезированной молекулы- предшественницы, состоящий в ее расщеплении каспазой 1. В процессинге задействованы рецепторы NALP (цитозольные рецепторы семейства NLR), формирующие вместе с другими факторами и прокаспазой (все они содержат домен CARD) надмолекулярный комплекс инфламмосому, в которой и происходит активация каспазы 1.
Из приведенных выше данных следует, что PAMP-распознающие рецепторы, относящиеся к TLR и NLR, — главные факторы активации миелоид- ных клеток, задействованных в реакциях врожденного иммунитета. Другие паттернраспознающие рецепторы ответственны за выполнение функций, не требующих активации клеток, однако они могут участвовать в этом процессе в качестве корецепторов. Пример таких рецепторов — молекулы адгезии интегрины. Они связаны с тирозинкиназами и молекулами, имеющими активационные мотивы ITAM. Таким образом, интегрины способны активировать факторы, общие для нескольких путей активации ^м. 2.3.1.2), что способствует образованию транскрипционных факторов NF-kB и AP-1. Один из С-лектиновых рецепторов — дектин-1 имеет в своей цитоплазматической части последовательность ITAM, участвующую в передаче активационных сигналов. Связывание дектина-1 с р-глюканами дрожжевых форм грибов приводит к индукции провоспалительных генов, в том числе циклооксигеназы-2 и цитокинов, в частности TNFa, IL-6, IL-23, что определяет роль дектина-1 в защите от грибковой инфекции. Другие лектиновые рецепторы самостоятельно не участвуют в активации клеток, хотя и могут способствовать TLR-зависимой активации клеток.
Анализ сигнальных путей, активируемых при связывании провоспалительных цитокинов, выявляет очень высокую степень их сходства с MyD88-зависимой передачей сигнала (см. раздел 2.5.5.3). Для IL-1 эти пути идентичны сигнальным путям, запускаемым при связывании TLR, поскольку внутриклеточная часть рецептора для IL-1 представляет TIR-домен (что отражено в названии этого домена — Toll/IL-1 receptor and resistance domain). При образовании TNFa в передачу сигнала вовлечены факторы TRAF2 и TRAF3, что обусловливает наличие перекрестов с сигнальными путями TLR и TNFR. Результат сходства этих путей передачи сигнала — явление, называемое амплификацией ответа на PAMP. Оно заключается в том, что эффект, достигаемый при прямом действии патогенов и их продуктов в очаге инфицирования, дистантно воспроизводится полностью и даже в значительно большем масштабе за счет действия провоспалительных цитокинов на клетки врожденного иммунитета. Таким образом, амплифи- цирующие факторы —продукты PAMP-индуцированной активации.
Выше детально рассмотрен классический путь активации клеток врожденного иммунитета (прежде всего макрофагов), на котором основано вовлечение этих клеток в иммунную защиту и воспалительные реакции. Однако резидентным макрофагам и дендритным клеткам свойственны и другие формы ответа, направленные на осуществление гомеостатических функций, регенерацию тканей, а также ограничение воспалительных процессов. В их основе лежат иные пусковые факторы и сигнальные механизмы. Альтернативные пути активации миелоидных клеток на примере макрофагов представлены в табл. 2.12.
Таблица 2.12. Варианты активации макрофагов под влиянием различных сигналов
| Показатель | Варианты активации | ||
| Классический | Альтернативный | Активация II типа | |
| Активирующий сигнал | INFy + TNF (TLR) | IL-4, IL-13 | IgG-комплексы + TLR, CD40 или CD44 |
| Секреторные продукты | t TNF, t IL-12, IL-1, IL-6 | t IL-1RA IL-10 | t IL-10, i IL-12, TNF, IL-1, IL-6 |
| Поверхностные маркеры | t MHC-II, t CD86, i Маннозо-связы- вающий рецептор, i Fcy-RII | t Маннозосвязывающий рецептор, t Рецепторы-мусорщики, t CD23, i CD14 | t MHC II класса, t CD86 |
| Ферменты | t NO-синтаза, i Аргиназа | t Аргиназа, i NO-синтаза | i NO-синтаза |
| Секретируемые хемокины | IP-10 (CXCL10), MIP-1a (CCL3), MCP-1 (CCL2), | PARC-1 (CCL18), MDC (CCL22), TARC (CCL17) | Неизвестно |
| Биологические эффекты | Повышение бактерицидной и тумороцидной активности, презентация антигена | Ускорение регенерации, подавление пролиферации Т-клеток, уменьшение бактери- цидности | Противовоспалительная активность, усиление антителопродукции |
Таким образом, при действии разнообразных чужеродных (патогены) и эндогенных (цитокины) лигандов на рецепторы клеток врожденного иммунитета запускается весь комплекс процессов, необходимых для осуществления защиты — эндоцитоз (поглощение) чужеродных агентов и активация, приводящая к мобилизации защитных механизмов и секреции активных факторов защиты.
Нейтрофильные гранулоциты в иммунной системе
Активация и распознавание образов нейтрофильными гранулоцитами (часто обозначаемые ПЯЛ — полиморфноядерные лейкоциты) способны непосредственно распознавать и фагоцитировать многие бактерии, но не самые важные полисахаридно-капсулированные патогены. Эти агенты распознаются и фагоцитируются после опсонизации комплементом через рецепторы комплемента на нейтрофиле (рис.1). Как нейтрофилы находят свой путь из крови к месту их действия? С места инфицирования множество молекул диффундируют во всех направлениях, в конечном итоге достигая эндотелиальных клеток соседних сосудов. Эти молекулы включают LPS (липополисахарид) бактерий, C3a, C4a, C5a и сигнальные молекулы из первых локальных макрофагов,  например хемокин IL-8, TNF и лейкотриен B4. Эндотелиальные клетки быстро реагируют на эти сигналы изменением картины экспрессии новых белков, таких как ICAM-1 и ICAM-2, на их мембранах, которые затем жестко связываются с контактными белками нейтрофилов и других лейкоцитов. Нейтрофилы обычно перекатываются вдоль эндотелия динамическими контактами между углеводами сиалированного антигена Lex и белками селектинами на плазматической мембране эндотелия. Связывание ICAM с помощью ПЯЛ-интегринов приводит к внезапной остановке нейтрофилов (рис.1). Они протискиваются между двумя эндотелиальными клетками и по хемотаксическому градиенту перемещаюся к очагу инфекции. Там нейтрофилы фагоцитируют и убивают бактерии. В процессе фагоцитоза они быстро умирают, поскольку суровые условия, необходимые для уничтожения бактерий, приводят к непоправимому повреждению клеток.(Кл) Их апоптотические тела поглощаются макрофагами.
например хемокин IL-8, TNF и лейкотриен B4. Эндотелиальные клетки быстро реагируют на эти сигналы изменением картины экспрессии новых белков, таких как ICAM-1 и ICAM-2, на их мембранах, которые затем жестко связываются с контактными белками нейтрофилов и других лейкоцитов. Нейтрофилы обычно перекатываются вдоль эндотелия динамическими контактами между углеводами сиалированного антигена Lex и белками селектинами на плазматической мембране эндотелия. Связывание ICAM с помощью ПЯЛ-интегринов приводит к внезапной остановке нейтрофилов (рис.1). Они протискиваются между двумя эндотелиальными клетками и по хемотаксическому градиенту перемещаюся к очагу инфекции. Там нейтрофилы фагоцитируют и убивают бактерии. В процессе фагоцитоза они быстро умирают, поскольку суровые условия, необходимые для уничтожения бактерий, приводят к непоправимому повреждению клеток.(Кл) Их апоптотические тела поглощаются макрофагами.
Тучные клетки в иммунной системе
Активация тучных клеток (ТК). Тучные клетки при активации дегранулируют и высвобождают гистамин с помощью широкого спектра раздражителей: механического напряжения, включая царапины или разрывы, тепло, холод и, как следствие активации комплемента, C5a. Позже, после включения адаптивного иммунного ответа, ТК могут дегранулировать в ответ на сшивание рецепторов антителами типа IgE.
Эндотелиальные клетки и тромбоциты в иммунной системе
Пути активации эндотелия и тромбоцитов. как Кл врожденного иммунитета. Эндотелиальные (ЭКл) представляют собой мезенхимальные Кл, костномозгового происхождения. Таким образом, предшественники ЭКл покидают костный мозг и попадают в места капиллярного роста или восстановления тканей. Их контроль осуществляет фактор VEGF (фактор роста сосудов). Обращенная в просвет сосудов поверхность ЭКл в нормальном состоянии предотвращает прилипание тромбоцитов и лейкоцитов, в то время как в активированном состоянии способствует свертыванию крови и экстравазации лейкоцитов (рис.1).
Покоящиеся ЭКл покрыты густым гликокаликсом гликопротеинов и протеогликанов. Протеогликаны несут длинные боковые цепи гликозаминогликанов, такие как гепарансульфат. Их обильные полярных групп они связывают огромное количество воды, создавая скользящий слой для Кл и тромбоцитов. Общий объем гидратированного эндотелиального гликокаликса в нашем организме оценивается в 1,7 литра. Этот гель защищает Кл крови от механических повреждений. Кроме того, многочисленные отрицательные электрические заряды, присутствующие как на гликокаликсе, так и на поверхности клеток крови, помогают предотвратить прилипание тромбоцитов и клеток крови.
Активация ЭКл (рис.1). ЭКл реагируют как на механические, так и на химические сигналы. Хотя точные механизмы все еще обсуждаются, ЭКл способны ощущать деформацию напряжения сдвига, напряжения стенки сосуда или мышечную активность. Они также экспрессируют рецепторы для множества растворимых сигнальных молекул, включая гистамин, VEGF, TNFα, и реагируют на наибольшую опасность, связанную с их функцией, гипоксию.
Активация макрофагов и дендритных клеток через рецепторы распознавания образов
Чтобы ощущать присутствие патогенов, макрофаги и дендритные клетки экспрессируют гораздо более широкий спектр рецепторов, чем нейтрофилы. Это рецепторы распознавания образов (PRR), которые распознают характерные для патогенов молекулярные структуры (PAMPS), которые они экспрессируют на своей поверхности.
 Многие из рецепторов распознавания образов находятся на плазматической мембране:
Многие из рецепторов распознавания образов находятся на плазматической мембране:
- Одна группа рецепторов, лектины С-типа, распознает определенные единицы сахаров, которые обычно расположены в терминальном положении углеводных цепей на поверхностях патогенов. Лектины C-типа включают маннозный рецептор, а также DC-SIGN и лангерин, они характерны для дендритных клеток. «Маннозный рецептор» распознает терминальную маннозу, N-ацетиглюкозамин или фукозу, параллельно с маннан-связывающим лектином.
- Большая группа Toll-подобных рецепторов (TLRs) включает рецепторы для очень разных молекулярных структур патогенов (PAMPS). Так, TLR4 распознаёт бактериальный липополисахарид, TLR1/TLR2 и TLR2/TLR6 — бактериальные липопептиды и пептидогликаны; TLR5 связывает флагеллин, TLR9 — бактериальную ДНК, которая содержит метильные группы, отличные от человеческой ДНК. TLR3 активируется двухцепочечной РНК, типичной для вирусов, TLR7 и TLR8 — одноцепочечной РНК; полинуклеотидсвязывающий TLR распознаёт эндосомы бактерий.
Два других семейства рецепторов распознают PAMPS тогда, когда патогены попадают в цитоплазму.
- NOD-подобные рецепторы (NLR): NOD1 и NOD2, например, распознают компоненты пептидогликанов из клеточной стенки бактерий. При активации NLR образуют большой цитоплазматический комплекс инфламмасому, Инфламмасома способствует активации клеток и играет важную роль в образовании IL-1 и других цитокинов из их неактивных предшественников. В дополнение к PAMPs, некоторые продукты NLR воспринимают продукты, полученные из умирающих Кл, такие как кристаллы мононатриевого урата, метаболиты пурина, образующиеся в результате разрушения ДНК.
- RIG-подобные геликазы (RLH): цитоплазматическая РНК-геликаза RIG-I и родственные белки действуют как вирусные рецепторы. Они экспрессированы клетками всех типов, связывают двунитевую вирусную РНК свободным 5′-трифосфатным концом.
Рецепторы распознавания образов появились на ранней стадии эволюции. В течение длительных периодов времени они, похоже, были основным инструментом конкуренции многоклеточных организмов с бактериями. Например, геном морского ежа содержит более 200 генов для Toll-подобных и NOD-подобных рецепторов.
В дополнение к этим рецепторам распознавания образов (PRR), рецепторам комплемента, например, например, CR3 (CD11b / CD18) и CR4 (CD11c / CD18), иммунные клетки активируются C3-производными, депонированными на вторгающихся патогенах.
Активация этих рецепторов на макрофагах приводит к фагоцитозу и в большинстве случаев приводит к гибели и разрушению проглоченных бактерий. Кроме того, индуцируется глубокое изменение в программе экспрессии генов макрофагов, что приводит к высвобождению коктейля из цитокинов, включая IL-1, TNF, IL-6, IL-8 и IL-12, которые привлекают и активируют другие Кл системы обороны. Через кровоток эти цитокины попадают в печень, где запускают еще один инструмент неспецифической защиты — синтез белков острой фазы. При активации макрофаги и дендритные клетки также экспрессируют определенные, связанные с мембраной белки, например, B7-молекулы (CD80 и CD86), которые необходимы для инициирования адаптивного иммунного ответа.
Дендритные клетки в иммунной системе
В чем разница между макрофагами и дендритными клетками (ДК)? Макрофаги больше связаны с неадаптивной стороной защиты. Они представляют собой «оборудование для земляных работ», как следует из их названия, способные фагоцитировать большие количества твердых частиц.
ДК  в основном находятся на адаптивной стороне защиты:
в основном находятся на адаптивной стороне защиты:
- их главная цель — собрать все виды антигенных материалов, доставить их в лимфатический узел и представить их Т-клеткам. Они способны фагоцитировать, но не делают тяжелую работу.
- Многие антигены поглощаются макропиноцитозом («пить много»), механизмом приема больших глотков окружающих жидкостей со всеми растворимыми антигенами.
- Третий способ ДК собирать антигены — это заражение вирусами, что важно для начала адаптивного противовирусного иммунного ответа.
Многие из наших ДК довольно долговечны, возникли на стадиях развития до рождения из гемопоэтических клеток в стенке желточного мешка или печени плода. Позднее дендритные клетки образуются в костном мозге. Дендритные клетки имеют две стадии жизни: функционально молодые, незрелые, бродят по периферии, собирают антигены, но не имеют инструментов для активации Т-клеток. Куда они идут, определяется хемокиновыми рецепторами, хемокины ведут в периферические ткани. Когда все благополучно, они целыми годами сидят в своих тканях-мишенях, но при инфекции макрофаги тотчас распознают её и освобождают хемокины, которые способствуют экспресии на ДК хоминг-рецептора CCR7,(В7). Теперь это зрелая ДК, способными перемещаться в ближайший лимфатический узел и представлять антигены Т-клеткам. Зрелые дендритные клетки утрачивают способность собирать антигены, но имеют все необходимое для продуктивной связи с Т-клеткам — много молекул МНС и В7. Секретируя хемокин CCL18, эти дендритные клетки привлекают в лимфатические узлы молодые, наивные Т-клетки
Врожденные лимфоидные клетки
Наша врожденная система защиты содержит Кл, которые выглядят так же, как B или T-лимфоциты в микроскопе, но не экспрессируют ни рецепторы B, ни Т-клеток. Их называют врожденными лимфоидными клетками. Эти клетки могут быть активированы цитокинами, высвобождаемыми макрофагами или ДК, и способствуют немедленной защите. Наиболее изучены из этих типов клеток естественные киллерные клетки (NK клетки).
NK- клетки в иммунной системе
NK-клетки представляют собой лимфоциты врожденной иммунной системы, которые могут убивать массив клеток-мишеней и секретировать цитокины, которые участвуют в формировании адаптивного иммунного ответа и восстановлении тканей. Особенность NK-клеток заключается в их способности отличать измененные Кл (такие как опухолевые, инфицированные микробами, клетки, которые подверглись физическим или химическим повреждениям ) от нормальных клеток.
Как NK-клетки узнают мишени
 Природные киллерные (NK) Кл сходны по внешнему виду и функционированию с цитотоксическими Т-лимфоцитами, но у них отсутствую рецепторы Т- клеток.. Как NK распознают клетки, которые должны быть убиты? Убиваю не моё!
Природные киллерные (NK) Кл сходны по внешнему виду и функционированию с цитотоксическими Т-лимфоцитами, но у них отсутствую рецепторы Т- клеток.. Как NK распознают клетки, которые должны быть убиты? Убиваю не моё!
Известно, что в организме все моё отмечено молекулами МНС I класса определенной структуры. NK -клетки экспрессируют два типа рецепторов: активирующие и ингибирующие. Ингибирующие рецепторы определяют присутствие нормальных молекул MHC-I на патрулирумых ими клетках. Клетка с нормальным MHC-I останются в покое. Если на клетке не содержится MHC-I или он видоизменен, то включается механизм активации NK-клетки и унижтожение «не моеЙ» (рис.)
Кроме того, NK-клетки могут быть активированы альтернативными механизмами. В условиях клеточного стресса многие клетки экспрессируют такие белки, которые действуют как лиганды для активирующего NK-рецептора. В некоторых клетках это происходит в результате онкогенной трансформации. Высокие уровни экспрессии белка-лиганда активируют NK-клетки! NK-клетки могут быть активированы цитокинами, особенно IL-12. В свою очередь, NK-клетки секретируют цитокины в первую очередь интерфероны, которые действуют как стимул макрофагам.
такие белки, которые действуют как лиганды для активирующего NK-рецептора. В некоторых клетках это происходит в результате онкогенной трансформации. Высокие уровни экспрессии белка-лиганда активируют NK-клетки! NK-клетки могут быть активированы цитокинами, особенно IL-12. В свою очередь, NK-клетки секретируют цитокины в первую очередь интерфероны, которые действуют как стимул макрофагам.
Хотя NK-клетки являются частью неадаптивной иммунной системы, они также могут быть направлены на чужое антителами, и разрушать его с использованием механизма, называемом антителозависимой клеточной цитотоксичностью.