Антипротозойный иммунитет что это

Иммуниитет при поражении простейшими. Естественный иммунитет против протозойных инфекцийКак и при всех других инфекциях, при болезнях, вызываемых простейшими (Protozoa), инфекционный процесс и развивающийся по ходу его приобретенный иммунитет формируются на основе взаимоотношений хозяина и паразита. Судьба возбудителя инфекции, проникающего в организм животного или человека, в первую очередь зависит от иммунологического состояния хозяина, которое Ш. Д. Мошковский характеризует как совокупность свойств макроорганизма, определяющих его взаимоотношения с данным возбудителем. Состояние организма хозяина до встречи с антигенами возбудителя (а также с антигенами неживой природы) обозначается Ш. Д. Мошковским как первичное, после встречи — как вторичное иммунологическое. Принципиальное различие между обоими формами иммунологического состояния заключается в том, что при вторичном иммунологическом состоянии к комплексу неспецифических факторов защиты присоединяются факторы специфической защиты — антитела. Абсолютный иммунитет обусловлен полным несоответствием условий в организме хозяина для развития и размножения возбудителей инфекции.
Одним из важнейших факторов, определяющих напряженность относительного иммунитета, является возраст. При ряде протозойных инфекций резистентность организма хозяина с возрастом значительно меняется. Некоторые инфекции у детей и молодых животных протекают тяжело, часто со смертельным исходом, в то время как у взрослых наблюдается более легкое, иногда бессимптомное течение. Примером может служить американский трипаносомоз (болезнь Шагаса). Инфекция Plasmodium berghei, смертельная для молодых крысят, у большинства взрослых крыс протекает доброкачественно. При некоторых инфекциях наблюдаются обратные отношения. Так, например, при бабезиозе (Meitz, 1956) жеребята, ягнята, козлята, поросята до 3-месячного возраста проявляют высокую степень резистентности к соответствующим видам бабезий. Щенята, наоборот, очень чувствительны к этой инфекции. Предполагается, что эти различия обусловлены разной быстротой обратного развития тимуса, которому в последнее время приписывается значительная роль в формировании иммунитета. У щенят атрофия зобной железы наступает через несколько дней после рождения, у других животных — через несколько месяцев. Большая роль в иммунитете к протозойным инфекциям принадлежит селезенке. Skrabolo и Deanovic (1957) описали у человека с удаленной селезенкой тяжелый пироплазмоз со смертельным исходом, вызванный Babesia bovis. Лица, не лишенные этого органа, к пироплазмозу невосприимчивы. Garnham и Вгау (1959) и Вгау и Garnham (1961) наблюдали тяжелую инфекцию Babesia divergans у шимпанзе только после спленэктомни. Хорошо изучена роль селезенки при малярии — экстирпация этого органа у людей, а также у обезьян в латентной (после серии первичных приступов) фазе инфекции приводит к развитию тяжелого, часто смертельного рецидива. Известна различная степень восприимчивости у разных пород животных одного вида к одному и тому же возбудителю: у крупного рогатого скота породы зебу высокая чувствительность к Trypanosoma vivax и значительно меньшая у карликовой породы рогатого скота — ндама. Беспородные белые мыши, а также мыши разных линий высоко чувствительны к Plasmodium berghei, вызывающему у них острую смертельную инфекцию. Но у одной породы мышей — NMRI, наблюдается выраженная резистентность к данному паразиту — инфекция протекает легко и заканчивается выздоровлением (Kretschmar, 1962). Простейшие, как и возбудители других инфекций и инвазий, для своего нормального развития и размножения в организме зараженного хозяина нуждаются в витаминах и других веществах, исключение которых из раниона больного или животного способствует более легкому течению и даже выздоровлению. Taк Maegraith и др., Hawking (1953, 1954) в опытах с Р. bеrghei показали, что у зараженных крыс, содержавшихся исключительно на маточной диете, инфекция не развивается. При добавлении парааминобензойной кислоты инфекция у крыс развивалась нормально. То же установлено и при некоторых формах малярии обезьян — P. knowlesi (Singh и др., 1953), P. cynomolgi (Вгау и Garnham, 1953; Hawking, 1954). — Также рекомендуем «Роль питания в развитии протозойных инфекций. Преодоление иммунитета простейшими» Оглавление темы «Противопротозойный иммунитет. Малярия»: |
Противобактериальный иммунитет направлен как против бактерий, так и против их токсинов (антитоксический иммунитет). Бактерии и их токсины нейтрализуются антибактериальными и антитоксическими антителами. Комплексы бактерия (антигены)-антитела активируют комплемент, компоненты которого присоединяются к Fc-фрагменту антитела, а затем образуют мембраноатакующий комплекс, разрушающий наружную мембрану клеточной стенки грамотрицательных бактерий. Пептидогликан клеточных стенок бактерий разрушается лизоцимом. Антитела и комплемент (СЗЬ) обволакивают бактерии и «приклеивают» их к Fc- и СЗЬ-рецепторам фагоцитов, выполняя роль опсонинов вместе с другими белками, усиливающими фагоцитоз (С-реактивным белком, фибриногеном, маннан-связывающим лектином, сывороточным амилоидом).
Основным механизмом антибактериального иммунитета является фагоцитоз. Фагоциты направленно перемещаются к объекту фагоцитоза, реагируя на хемоаттрактанты: вещества микробов, активированные компоненты комплемента (С5а, СЗа) и цитокины (рис. 7.21). Противобактериальная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с бактериями, препятствуют их адгезии на эпителиоцитах.

Рис. 33 Схема противобактериального иммунитета
Противовирусный иммунитет. Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом, уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспеци- фическим белкам инфицированной клетки (рис. 7.22). Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так называемый «выделительный иммунитет»). Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме этого, интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов главного комплекса гистосовместимости (МНС). Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их адгезии на эпителиоцитах.
Противогрибковый иммунитет. Антитела (IgM, IgG) при микозах выявляются в низких титрах. Основой противогрибкового иммунитета является клеточный иммунитет. В тканях происходит фагоцитоз, развивается эпителиоидная гранулематозная реакция, иногда тромбоз кровеносных сосудов. Микозы, особенно оппортунистические, часто развиваются после длительной антибактериальной терапии и при иммунодефицитах. Они сопровождаются развитием гиперчувствительности замедленного типа. Возможно развитие аллергических заболеваний после рес
пираторной сенсибилизации фрагментами условно-патогенных грибов родов Aspergillus, Penicillium, Mucor, Fusarium и др.
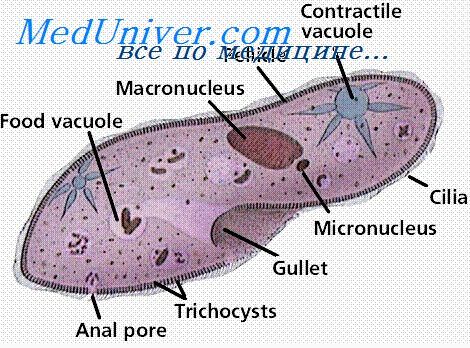
Противопротозойный иммунитет. Антитела (IgM, IgG) против простейших действуют на внеклеточные формы паразитов. Часто иммунитет является стадиоспецифическим, т. е. против различных форм, стадий развития паразита появляются соответствующие антитела. Паразит, имеющий различные стадии развития в организме (например, плазмодии малярии), как бы «ускользает», отклоняется от ранее образовавшихся антител. Фагоцитоз может быть незавершенным, например, при лейшманиозах. Выявление гиперчувствительности замедленного типа используют при диагностике токсоплазмоза, лейшманиоза и некоторых других протозойных инфекций.
Противоопухолевый иммунитет* основан на Thl-зависи- мом клеточном иммунном ответе, активирующем цитотоксические Т-лимфоциты, макрофаги и NK-клетки. Роль гуморального (антительного) иммунного ответа невелика, поскольку антитела, соединяясь с антигенными детерминантами на опухолевых клетках, экранируют их от цитопатогенного действиях иммунных лимфоцитов. Опухолевый антиген распознается антиген-презентирующими клетками (дендритными клетками и макрофагами) и непосредственно или через Т-хелперы (Thl) представляется цитотоксическим Т-лимфоцитам, разрушающим опухолевую клетку-мишень.
Кроме специфического противоопухолевого иммунитета, иммунный надзор за нормальным составом тканей реализуется за счет неспецифических факторов. Неспецифические факторы, повреждающие опухолевые клетки: 1) NK-клетки, система мононуклеарных клеток, противоопухолевая активность которых усиливается под воздействием интерлейкина-2 (ИЛ-2) и а-, (i-интерферонов; 2)ЛАК-клетки (мононуклеарные клетки и NK-клетки, активированные ИЛ-2); 3) цитокины (α- и β-интерфероны, ФНО-а и ИЛ-2).

Рис. 7.22. Противовирусный иммунитет
Макроорганизм имеет широкий спектр факторов иммунной защиты, однако для минимизации энергетических и пластических затрат в каждом конкретном случае используются лишь наиболее эффективные механизмы.
8.5.1. ОСОБЕННОСТИ ИММУНИТЕТА ПРИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЯХ
Различают иммунитет антибактериальный (против структурных компонентов бактериальной клетки) иантитоксический. Основными факторами специфической защиты являются АТ и фагоциты. АТ маркируют и инактивируют бактерии и их продукты (токсины, ферменты агрессии и др.) и запускают бактериолиз и иммунный фагоцитоз. Важная роль в борьбе с бактериями принадлежит лизоциму и комплементу. Напряженность специфического антибактериального иммунитета оценивают по титру или динамике титра специфических АТ, а также по состоянию клеточной иммунореактивности (по кожно-аллергической пробе).
Для запуска продуктивной реакции и формирования гуморального иммунитета микроорганизм должен обладать выраженными свойствами агрессора (вызывать некроз тканей организма) и высокой иммуногенностью. Если иммуногенность микроорганизма невысока, он является факультативным внутриклеточным паразитом (микобактерии, иерсинии, бруцеллы, сальмонеллы и некоторые другие), устойчивым к действию комплемента, лизоцима, фагоцитозу и внутриклеточному перевариванию, при этом также имеется врожденный дефект иммунной системы. У пациента может сформироваться вялотекущая реакция с переходом в хронический рецидивирующий процесс. При этом основные защитные функции начинает выполнять фагоцитарная система либо вокруг интервентов образуются гранулемы.
8.5.2. ОСОБЕННОСТИ ПРОТИВОВИРУСНОГО ИММУНИТЕТА
Особенности иммунной защиты макроорганизма при вирусных инфекциях обусловлены двумя формами существования вируса: внеклеточной и внутриклеточной. Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические АТ, Т-киллеры, интерферон и сывороточные ингибиторы вирусных частиц.
Противовирусные АТ способны взаимодействовать только с внеклеточным вирусом. Они нейтрализуют вирусные адгезины и NA и препятствуют адсорбции вирусов на клетках-мишенях и их инфицированию.
Клетки, инфицированные вирусом, изменяют на своей ЦПМ структуру HLA I класса. Это служит сигналом для Т-киллеров, которые распознают зараженные вирусом клетки и уничтожают их.
Интерферон подавляет все биосинтетические процессы в зараженной вирусом клетке.
Сывороточные ингибиторы неспецифически связываются с вирусной частицей и нейтрализуют ее (опсонизация), тем самым препятствуя адсорбции вируса на клетках-мишенях.
Напряженность противовирусного иммунитета оценивают по нарастанию титра специфических АТ в парных сыворотках в течение болезни.
8.5.3. ОСОБЕННОСТИ ПРОТИВОГРИБКОВОГО ИММУНИТЕТА
АГ грибов имеют низкую иммуногенность, практически не индуцируют антителообразование, но стимулируют клеточное звено иммунитета — макрофаги. При микозах наблюдается ГЗТ. Напряженность противогрибкового иммунитета оценивается по кожноаллергическим пробам.
8.5.4. ОСОБЕННОСТИ ИММУНИТЕТА ПРИ ПРОТОЗОЙНЫХ ИНВАЗИЯХ
Характер противопаразитарного иммунитета определяется биологическими особенностями паразита. Многие из них обладают высокой антигенной изменчивостью, что позволяет им избегать действия факторов иммунитета. Например, каждой стадии развития малярийного плазмодия соответствуют свои специфические АГ.
Паразитарная инвазия сопровождается формированием в макроорганизме гуморального и клеточного иммунитета. В организме появляются специфические АТ классов M и G и активированные макрофаги, что сопровождается ГЗТ.
Напряженность противопаразитарного иммунитета оценивается в серологических тестах по титру специфических АТ и по кожноаллергическим пробам с протозойным АГ.
8.5.5. ОСОБЕННОСТИ ПРОТИВОГЛИСТНОГО ИММУНИТЕТА
Ведущую роль в иммунной защите макроорганизма от глистной инвазии играют эозинофилы и тучные клетки. Эозинофилы атакуют паразитов, отмеченных специфическими IgE или IgA, выделяя ряд токсических субстанций. Тучные клетки вызывают интенсивную перистальтику, удаляющую паразита или его останки из просвета кишки. Глистная инвазия сопровождается аллергизацией по типу ГЗТ.
8.6. ИММУННЫЙ СТАТУС ЧЕЛОВЕКА. ПАТОЛОГИЯ ИММУННОЙ СИСТЕМЫ
8.6.1. ИММУННЫЙ СТАТУС
Иммунный статус — комплекс клинических и лабораторных иммунологических показателей, который характеризует анатомо-функциональное состояние иммунной системы индивидуума в месте и времени.
Практически любое внешнее воздействие на организм человека ведет к изменению состояния иммунной системы: климатогеографические, социальные, экологические, медицинские (лекарственные вещества, хирургические вмешательства, стресс и т. д.) факторы.
Иммунный статус можно оценить путем постановки комплекса лабораторных тестов, включающих оценку состояния факторов неспецифической резистентности, гуморального (В-система) и клеточного (Т-система) иммунитета.
При общем клиническом обследовании учитывают жалобы пациента, анамнез, клинические симптомы, общий анализ крови (включая абсолютное количество лимфоцитов), данные биохимического исследования (включая определение СРБ, ревматоидного фактора и др.).
При оценке состояния факторов естественной резистентности определяют активность фагоцитоза, комплемента и лизоцима, колонизационную резистентность.
Состояние гуморального иммунитета характеризуют по уровню Ig классов G, M, A, E в сыворотке крови, определению специфических АТ, количества В-лимфоцитов в периферической крови и др.
Состояние клеточного иммунитета оценивают по количеству Т-лимфоцитов и их субпопуляций в периферической крови, пролиферативной активности лимфоцитов и кожным пробам с аллергенами.
Организационно определение иммунного статуса разделено на два уровня.
— Тесты I уровня выполняются в любой клинической иммунологической лаборатории первичного звена здравоохранения и направлены на первичное выявление лиц с иммунопатологией. К ним относят определение лейкоцитарных популяций в периферической крови (абс. и %), сывороточных Ig классов M, G, A, E, активности комплемента и лизоцима, фагоцитарной активности лейкоцитов, постановку кожно-аллергических проб.
— Тесты II уровня применяют для более точной диагностики: используют гистохимический анализ лимфоидных органов, анализ лимфоидных субпопуляций и их поверхностных маркеров, пролиферативной и ферментативной активности лимфоцитов, определение содержания цитокинов в сыворотке крови, гистосовместимости тканей донора и реципиента и др.
8.6.2. ИММУНОДЕФИЦИТЫ
Иммунодефициты — расстройства иммунной системы, обусловленные дефектом одного или нескольких механизмов иммунной защиты. Различают первичные (врожденные) и вторичные (приобретенные) иммунодефициты, которые могут быть органическими и функциональными.
Клиническая картина иммунодефицитов сходная. Они сопровождаются инфекционными осложнениями, гематологическими нарушениями, желудочно-кишечными расстройствами, аутоиммунными процессами, опухолями, аллергическими реакциями, врожденными пороками развития. Диагностику иммунодефицитов проводят по анамнезу (частые инфекционные заболевания, аллергия и др.), клиническим симптомам (опухоли, аутоиммунные процессы, состояние лимфатических узлов, пороки развития и др.) и показателям иммунного статуса.
Первичные иммунодефициты
Первичные иммунодефициты — довольно редкие врожденные состояния, при которых наблюдается нарушение функционирования того или иного звена иммунитета. Причинами врожденных иммунодефицитов являются ферментопатии, аномалии хромосом, недоразвитие органов и тканей. Первичные иммунодефициты проявляются на ранних этапах постнатального периода и имеют различный характер наследования. Расстройства иммунной системы могут затрагивать как основные специфические звенья в функционировании иммунной системы, так и факторы, определяющие неспецифическую резистентность. Возможны комбинированные и селективные варианты иммунных расстройств. В зависимости от уровня и характера нарушений различают гуморальные, клеточные, комбинированные иммунодефициты.
— Недостаточность фагоцитоза обусловлена уменьшением количества фагоцитов или их функциональной неполноценностью, нарушением синтеза перекисных радикалов.
— Недостаточность клеточного иммунитета обусловлена нарушением функциональной активности Т-лимфоцитов и отчасти В-клеток. Описаны изолированные Т-клеточные иммунодефициты, такие как синдром ДиДжорджи (врожденная аплазия тимуса), иммунодефицит при карликовом росте. У людей с Т-клеточным иммунодефицитом нарушен противовирусный, противогрибковый, противоопухолевый, трансплантационный иммунитет.
— Недостаточность гуморального иммунитета проявляется в виде дис- и агаммаглобулинемии. Агаммаглобулинемия обусловлена нарушением синтеза Ig или их ускоренным распадом. При этом в крови больных отсутствуют Ig и нарушен антитоксический и антибактериальный иммунитет.
— Комбинированные иммунодефициты развиваются при сочетании нарушений Т- и В-звеньев иммунной системы в результате дефекта на уровне стволовой клетки. Это наиболее тяжело протекающие иммунодефициты. Комбинированные формы встречаются чаще, чем селективные. Как правило, они связаны с нарушением центральных органов иммунной системы.
У пациентов с врожденными иммунодефицитами выражена предрасположенность к инфекционным заболеваниям, что в раннем возрасте приводит к смерти.
Вторичные иммунодефициты
Вторичные иммунодефициты могут развиваться у лиц с нормально функционирующей от рождения иммунной системой после перенесенных инфекций (особенно вирусных) и инвазий (протозойных и гельминтозных), при опухолях, нарушении обмена веществ и истощении, поражении печени и почек, тяжелых травмах и обширных хирургических операциях, облучении, действии химических веществ, приеме некоторых лекарственных препаратов. Эти состояния встречаются значительно чаще, чем первичные. При вторичных иммунодефицитах могут поражаться Т- и В-системы иммунитета, факторы неспецифической резистентности, возможны их сочетания. Они могут быть органическими и функциональными. Функциональные сдвиги восстанавливаются.
Аутоиммунные болезни
Аутоиммунные болезни — патологические состояния, в основе которых лежит срыв естественной иммунологической толерантности: появление доступа к забарьерным АГ, перекрестное реагирование, появление клонов аутореактивных лимфоцитов.
Различают органоспецифические и органонеспецифические аутоиммунные заболевания. Приорганоспецифических процессах реакция направлена к одному или нескольким конкретным АГ,органонеспецифические процессы носят системный характер. Аутоиммунные болезни встречаются достаточно редко. К болезням с установленной иммунопатологической природой относят гемолитическую анемию, тиреоидит Хашимото, симпатическую офтальмию, системную красную волчанку, ревматоидный артрит и др.
Иммунокоррекция
Иммунокоррекция — раздел клинической иммунологии, изучающий способы и методы профилактики и лечения болезней или состояний (иммунодефицитов), связанных с нарушением функции иммунной системы. Цель иммунокоррекции — восстановление с помощью препаратов-иммуномодуляторов адекватного функционирования иммунной системы, в зависимости от показаний — ее активация или подавление. Например, для создания активного иммунитета к возбудителям инфекционных болезней применяют вакцины, а для пассивного иммунитета — иммунные сыворотки или Ig. Для иммуносупрессии чаще всего используют неспецифические средства — цитостатики, гормоны, антиметаболиты, лучевую терапию. Препараты иммуноцитокинов можно применять как для неспецифической стимуляции, так и для супрессии иммунной системы.
При иммунодефицитах применяют заместительную терапию — введение препаратов Ig, пересадку эмбрионального тимуса и костного мозга. Для профилактики возникающих инфекционных болезней используют химиотерапию.