Цитокины в противоопухолевом иммунитете
Гены цитокинов применяются в экспериментах по вакцинации опухолевых клеток
для повышения противоопухолевого иммунитета. В экспериментах с вакциной из
опухолевых клеток проводится
трансфекция
этих клеток in vitro наряду с переносчиком инфекции, выделяющим
представляющий интерес цитокиновый ген. Трансфектируемые опухолевые клетки
облучались, чтобы предупредить последующее их деление, но опухолевые клетки
могут продолжать образовывать цитокины еще в течение нескольких дней, пока
не погибнут. Эти трансфектированные облученные опухолевые клетки затем
вводили в мышей. Через несколько недель после вакцинации опухоли мышам
вводились дикие (не мутантные, нетрансфектированные и необлученные)
опухолевые клетки, чтобы можно было оценить образование иммунитета,
специфического для данной опухоли. Наиболее впечатляющие результаты были
получены с опухолевыми клетками, трансфектируемыми при помощи
гранулоцит-макрофагального колониестимулирующего фактора (
GM-CSF
),
IL-2
,
IL-4
,
IL-6
и
IL-12
.
Экспериментальное лечение уже укоренившихся опухолей, обеспечивают более
строгую, клинически более важную оценку генной терапии рака, чем
эксперименты с применением вакцинации. Мышам вводились «дикие»
(не мутантного типа, немодифицированные) опухолевые клетки, которым
позволялось расти до тех пор, пока не образовывалась опухоль умеренных
размеров (от 7 до 14 дней). После этого мышам вводилась вакцина, содержащая
опухолевые клетки, для оценки ее действия на регрессию опухоли. При данных
условиях некоторые цитокиновые гены проявляли эффективность против
небольших укоренившихся опухолей, в том числе
IL-2
,
IL-4
,
IL-6
,
IL-12
и
GM-CSF
.
Ни один из этих цитокинов не проявил эффективность против большой опухоли,
что вызывает некоторые сомнения относительно конечной пользы такого вида
генной терапии для лечения рака у человека с большими опухолями. Причиной
отсутствия эффективности против больших опухолей, возможно, является
недостаточно мощный противоопухолевый иммунитет, неспособность эффекторных
клеток продвигаться в незначительно оснащенные сосудами громоздкие опухоли
или неспособность большой растущей опухоли преодолеть высокую степень
периферической иммунной толерантности. В некоторых случаях отсутствие
эффективности может быть связано с кинетикой роста опухоли. Во многих
экспериментальных опухолях у мышей быстрый рост опухоли просто опережает
развитие иммунной реакции. Поэтому циторедукция громоздких опухолей может
оказаться полезной, если ее провести до начала цитокинновой генной
терапии.
Производилась оценка экзогенных клеток почек зеленой мартышки («веро-
клеток»), трансфектированных вместе с человеческим IL-2-геном для
лечения
злокачественной меланомы
собак и
фибросаркомы
кошек. Животных сначала лечили хирургически и лучевой терапии, чтобы
уменьшить размеры опухоли до микроскопического заболевания. Затем пациентам
наугад делали повторные инъекции веро-клеток, трансфектированных вместе с
человеческой ДНК IL-2, или не проводили дальнейшего лечения. Через 16
месяцев после лечения у 69% контрольных кошек возник рецидив фибросаркомы,
в отличие от 31% в группе, где вводились веро-клетки. Через 12 месяцев
после лечения 6% контрольных собак все еще были живы, по сравнению с 37% из
группы с веро-клетками.
При введении экзогенных трансфектированных клеток вместе с человеческим
IL-2 в опухоль вызывалась
воспалительная реакция
против инородных клеток, и местная экспрессия IL-2 усиливала
воспалительную реакцию. Результат, очевидно, был следствием активации
NK-клеток
. В настоящее время в Швеции и во Франции в стадии разработок находится
фаза I испытаний на людях для оценки этого метода генной терапии рака.
Гены, кодирующие цитокины, также могут вводиться in vivo непосредственно в
опухоль с использованием одной из нескольких систем доставки, включая
липосомы
, синтетические конъюгаты,
аденовирусные векторы
и
генную пушку
. Преимуществом метода является то, что экспрессия представляющего интерес
иммуностимулирующего гена производится непосредственно в окружение опухоли,
благодаря чему нет необходимости устанавливать опухолевые клеточные линии и
производить трансфекцию опухолевых клеток in vitro. Для противоопухолевого
эффекта обычно необходимо многократное введение цитокинового гена.
Доказано, что осуществленная с помощью генной пушки доставка ДНК IL-2 в
укоренившиеся кожные опухоли у мышей вызывала полную регрессию опухолей (
RENCA-карцинома
,
b5178Y-лимфома
), частичную регрессию опухолей (
MethA-саркома
,
SA-1-саркома
) или уменьшение роста опухолей (
Р815-мастоцитома
,
В16-меланома
). Это выдающиеся результаты, поскольку впервые было доказано, что
инъекция ДНК вызывает устойчивую регрессию укоренившихся опухолей у мышей.
В добавление к регрессии опухолей у принимавших лечение мышей развивался
системный противоопухолевый иммунитет
, что приводило к отсрочке начала метастаз, и у большинства мышей
увеличилась продолжительность жизни.
Есть сообщения о предварительных результатах лечения
собак с оральной злокачественной меланомой
, которым вводили серии внутриопухолевых инъекций
плазмидной ДНК
в комплексе с формулой катионных липидов. Злокачественная меланома у
собак является крайне активным заболеванием. Хирургическое вмешательство
увеличивает продолжительность жизни у собак с небольшими опухолями
(диаметром < 2 см), в то время как большинство собак с обширными
опухолями во время диагностики становятся жертвами метастаз в лимфатических
узлах и метастаз в легкие в течение 6 месяцев лечения. Лучевая терапия
бывает паллиативной для собак с запущенной формой опухоли. Химиотерапия не
дает значительного успеха в лечении меланомы у собак.
При генетических иммунотерапевтических исследований
меланомы
, проводимых на собаках, применялись в комбинации два иммуностимулирующих
гена: бактериальный суперантигенный ген (
Staphylococcus энтеротоксин В (SEB)
) плюс цитокиновый ген (или ген
GM-CSF
или ген
IL-2
). SEB является мощным активатором
CD4+ Т-лимфоцитов
и
CD8+ Т-лимфоцитов
и способствует выделению лимфоцитов из нескольких цитокинов, включая
интерферон-гамма (
IFN-гамма
),
TNF-aльфа
,
IL-2
и
IL-12
. SEB-активированные лимфоциты также развивают сильную противоопухолевую
цитолитическую активность и могут вызвать регрессию опухоли при переносе на
опухоли мышей. В исследованиях на собаках, цитокиновый ген увеличивал
противоопухолевое действие, вызванное суперантигенным геном. Лечение
животных производилось внутриопухолевыми инъекциями плазмидной ДНК в
комплексе с катионными липидами два раза в месяц, всего 12 и более сеансов
лечения.
Производилась оценка пациентов на вызванную лечением токсичность, реакцию
на опухоль и продолжительность жизни. Бактериальные суперантигены
представляют собой чрезвычайно мощные молекулы, и даже очень низкие их
концентрации (до 1 мг) способны вызывать токсичный шоковый синдром у людей
и у других млекопитающих, включая собак. Однако побочные эффекты
наблюдались лишь у 50 собак, которых лечили внутриопухолевыми инъекциями
суперантигена плюс ДНК цитокином. Такое отсутствие токсичности, вероятнее
всего, объясняется тем, что местная выработка суперантигенов в опухолевых
тканях была достаточной для того, чтобы вызвать местные Т-клеточные
реакции, но не достаточна для системной токсичности.
Лечение внутриклеточным
SEB
и цитокинами давало большой процент реакций опухолей у животных,
подвергшихся лечению. Степень реакции (полная или частичная ремиссия)
составляла 45% у собак с
III стадией опухолей (метастазы лимфоузлов)
. Биопсия опухолей, производимая после инъекции ДНК и оцениваемая по
иммуиогистохимическому анализу, показала значительный инфильтрат
CD4+ Т-клеток
и
CD8+ Т-клеток
и
макрофагов
. Таким образом, реакция суперантигена и цитокиновых генов была
достаточной для притягивания Т-клеток и макрофагов в окружение опухоли и
активации их. Предварительные исследования также выявили очевидность
Т-клеточной активации в осушении лимфоузлов у принимавших лечение собак.
У пролеченных собак оценивалась системная противоопухолевая реакция.
Степень противоопухолевой цитотоксичной Т-клеточной активности в
периферической крови у пролеченных животных на стадии III была высокой по
сравнению с теми же данными у не подвергавшихся лечению или не
восприимчивых к нему животных. Еще более важно, что продолжительность жизни
у принимавших лечение собак была значительно выше, чем у контрольных
животных. Таким образом, непосредственная внутриопухолевая экспрессия
мощных иммуностимулирующих генов позволяла не только обеспечивать местный
контроль над опухолью у собак со спонтанной и высокозлокачественной
опухолью, но обеспечить и системные противоопухолевые реакции. Можно
ожидать, что прогресс в генной инженерии в дальнейшем улучшит реакцию на
этот вид генетической иммунотерапии.
Ссылки:
- ПРИМЕНЕНИЕ ГЕННОЙ ТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
ФНОа вызывает развитие геморрагического некроза в ткани опухоли. Механизм его противоопухолевого действия изучен недостаточно. Предполагают, что в противоопухолевом эффекте имеют значение следующие факторы: сосудистый — повреждение эндотелия, ведущее к тромбообразованию; прямое цитотоксическое действие на опухолевые клетки в результате связывания ФНОа с рецепторами на поверхности трансформированных клеток (полагают, что эти рецепторы могут связывать серотонин); иммуномодулирующее действие ФНОа путем стимуляции выработки макрофагами ИЛ-1, ИФНУ активации Т-киллеров и секреции ими ИЛ-2, активации NK-клеток, а также нейтрофилов и выработки последними активных форм кислорода и лизоцима; взаимодействие с клеточными онкогенами (ФНО снижает экспрессию с-тус в клетках HeLa и HL-60, что приводит к уменьшению интенсивности пролиферации клеток). При этом ИФН7 потенцирует действие ФНОа [Uhl J. et al., 1989].
Прямое цитотоксическое действие ФНОа на трансформированные клетки имеет несколько стадий: первоначально происходят активация лизосомных ферментов и их лабилизация, затем активация протеаз и усиленное образование в опухолевой клетке свободных радикалов и активных форм кислорода с последующим повреждением и лизисом клетки. Активация макрофагов с выбросом большого количества ФНОа может иметь также и неблагоприятные последствия для организма — вплоть до развития коллапса и шока. Обсуждается также роль ФНОа в патогенезе кахексии у онкологических больных. В экспериментах установлено, что ФНОа способен подавлять активность липопротеидлипазы (ключевого фермента накопления липидов), ингибирует мРНК, специфическую для дифференцировки адипозоцитов, усиливает катаболизм белка, повышает продукцию простагландинов мышечной тканью [Суслов А. П., 1990].
ИЛ-1 может оказывать прямое цитотоксическое действие на опухоль, повышать активность цитотоксических макрофагов, Т-киллеров и NK-клеток, усиливать продукцию интерферона макрофагами, Т-лимфоцитами и полиморфно-ядерными лейкоцитами, ИЛ-2 — Т-лимфоцитами, стимулирует дифференцировку опухолевых клеток при миелолейкозе, действуя как фактор роста по аутокринному механизму. Однако ИЛ-1 способен оказывать и противоположное действие на рост опухоли через потенцирование продукции ПГЕ2, супрессирующего противоопухолевые иммунные реакции [Навашин С. М., Вядро М. М., 1989].

ИФН7 вырабатывается не только макрофагами, но и Т-лимфоцитами и оказывает сложное противоопухолевое действие. Во-первых, он опосредованно, через ИНФа и ИФНр, проявляет противовирусную активность (в том числе против онковирусов), способен блокировать транскрипцию онковирусной РНК, ее соединение с рибосомами, а также синтез вирусных белков. Во-вторых, ИНФ7 оказывает прямое цитотоксическое действие на опухолевые клетки. В-третьих, он активирует моноцитарные макрофаги, NKклетки, Т- и В-лимфоциты, обладает синергизмом с ФНОа [Ковальчук Л. В., Чередеев А. Н., 1991].
Почему же иммунная система, как правило, не может эффективно защищать организм от развития опухоли? Причины следует искать в следующем.
1. Антигенность большинства спонтанных опухолей низкая, что делает их трудно распознаваемыми клетками иммунной системы.
2. На поверхности опухолевых клеток нарушена экспрессия антигенов I класса ГКГС, что отрицательно сказывается на связывании Т-киллеров с опухолевой клеткой.
3. Ряд опухолей имеет упрощенный антигенный состав.
4. Рост опухоли при связывании ею противоопухолевых антител усиливается, что маскирует ее, вероятно, от Т-киллеров и NK-клеток.
5. Имеется общая и местная иммунодепрессия.
— Читать далее «Иммунодепрессия при опухолях. Торможение иммунитета опухолями»
Оглавление темы «Склероз и онкология»:
1. Пневмосклероз как причина рака легкого. Туберкулез как причина рака легкого
2. Рак в очагах пневмосклероза. Рак в рубце
3. Нефросклероз и рак почек. Сморщивание почки как причина рака
4. Морфология нефросклероза. Иммуногистохимия рака почек
5. Микроаденомы почек. Типы клеток опухолей почек
6. Взаимодействие опухоли и организма. Влияние организма на опухоль
7. Иммунный ответ на опухоль. Реакция клеток иммунитета на опухоль
8. Цитокины противоопухолевого иммунитета. ФНО, ИФН при опухолях
9. Иммунодепрессия при опухолях. Торможение иммунитета опухолями
10. Влияние опухоли на организм. Системное воздействие опухоли
Исследование противоопухолевого иммунитета и устранение факторов, вызывающих его ухудшение, являются важными проблемами в современной медицине. Злокачественные новообразования занимают одно из лидирующих мест среди причин смертности и инвалидизации населения в развитых странах. В норме баланс количества делящихся и отмирающих клеток регулируется естественным образом. Если размножение клеток приобретает неконтролируемый характер, то возникают злокачественные опухоли. Механизм контроля этого процесса со стороны иммунной системы зависит от нескольких факторов, подавляющих или стимулирующих процесс избыточного деления.
Общее описание
Под иммунитетом принято понимать совокупность защитных механизмов живого организма от негативного воздействия чужеродных агентов. Чаще всего эти процессы связаны с инфекционными (бактериальными, вирусными, грибковыми, протозойными) заболеваниями. Однако существуют и другие способы защиты, одним из которых является противоопухолевый иммунитет.
В деятельности любого живого организма возникают моменты, когда ему необходимо быстрое деление клеток (травма, воспалительный процесс и другие). При развитии определенного иммунного ответа количество клеток, чувствительных к воздействию антигена (молекулы, связанной с антителом), увеличивается в несколько тысяч раз. При нормальном течении процесса после завершения данной реакции ускоренное деление клеток останавливается.
Для злокачественной опухоли характерно нарушение этого механизма. Размножение клеток продолжается постоянно и имеет независимый характер. Постепенно происходит замещение нормальных тканей в пораженном органе и прорастание опухоли в окружающие области. Перемещаясь по кровяному руслу, клетки опухоли продолжают делиться и в другой локализации, что приводит к появлению метастаз. Этот дефект непрерывного деления наследуется всеми потомками опухолевых клеток. Их мембраны изменены таким образом, что человеческий организм воспринимает объекты как чужеродные.
С другой стороны, в организме имеется способ, который может остановить этот процесс, – противоопухолевый иммунитет. В иммунологии возникновение опухолей является свидетельством того, произошли нарушения естественного защитного механизма.
История открытия
Еще в 18 веке было замечено, что у некоторых больных, перенесших инфекционные болезни, исчезали злокачественные опухоли. В конце 19 века американский хирург-онколог Вильям Коли выявил взаимосвязь между заражением гемолитических стрептококком Streptococcus pyogenes и уменьшением (а в некоторых случаях – и полным исчезновением) опухолей злокачественного характера. Им была разработана противораковая вакцина на основе этих бактерий для лечения пациентов с саркомой. В то время еще не были известны механизмы противоопухолевого иммунитета в иммунологии, поэтому его работы подвергались сильной критике, а впоследствии были забыты почти на 100 лет.
В середине XX века было открыто, что введение макромолекул липосахарида, из которых состоят оболочки клеток микробов, может приводить к отмиранию опухолей. Однако в 70-е гг. XX в. ученые установили, что этот процесс вызывает не сам липосахарид, а белковый фактор (фактор некроза опухоли, или ФНО), вырабатываемый следующими типами клеток иммунной системы при контакте с микробами:
- активированные макрофаги;
- нейтрофилы;
- Т-лимфоциты;
- тучные клетки;
- астроциты;
- NK-клетки (натуральные киллеры).
Взаимосвязь иммунитета и образования опухолей
В пользу наличия связи между состоянием иммунитета и развитием злокачественных опухолей свидетельствуют следующие факты:
- увеличенная распространенность таких новообразований у пациентов с иммунодефицитным состоянием, а также в пожилом возрасте (что связано со снижением защитных сил организма);
- выявление у больных специфических антител и Т-клеток, чувствительных к антигенам опухолей;
- возможность формирования противоопухолевого иммунитета и иммунопролиферативных заболеваний (при искусственном введении антител и подавлении иммунитета соответственно).
Защитная функция иммунитета заключается не только в уничтожении чужеродных агентов (вирусов, грибков и бактерий), но и клеток-мутантов, из которых образуются опухоли. Для них характерна антигенная специфичность, которая зависит от причины появления новообразования:
- вирусы (папилломы, лейкоза и другие);
- химические канцерогены (метилхолантрен, бензопирен, афлотоксины и другие);
- эндокринные нарушения (метаболическая иммунодепрессия);
- физические факторы окружающей среды (все виды излучений).
Естественный противоопухолевый иммунитет очень слабо влияет на уже сформировавшееся злокачественное новообразование. Это связывают со следующими факторами:
- быстрый рост опухоли, опережающий активизацию иммунных сил;
- выделение опухолевыми клетками антигенов, которые связывают соответствующие рецепторы на поверхности лимфоцитов-киллеров;
- подавление клеточного иммунитета со стороны новообразования.
Принцип действия
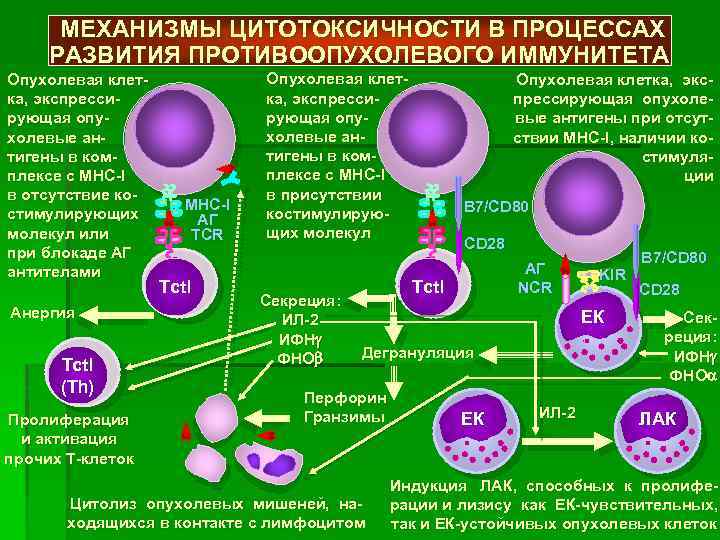
Механизм противоопухолевого иммунитета в медицинской науке еще мало изучен. Несмотря на то что выявлена его защитная функция, антитела могут отражать опухолевые антигены, не вызывая разрушения злокачественных клеток. В некоторых случаях иммунотерапия даже дает обратный эффект, способствуя увеличению новообразования.
Согласно современным представлениям, ключевую роль в данном процессе играют активизированные макрофаги и клетки-киллеры. Особенностью противоопухолевого иммунитета является то, что он характеризуется сложным механизмом взаимодействия организма-хозяина и новообразования. Выделяют 4 основные группы факторов:
- Антибластомные – гуморальные и клеточные (Т-лимфоциты, ФНО, макрофаги, ЕК- и К-клетки, специфические антитела, интерфероны, интерлейкины), подавляющие развитие опухоли и разрушающие ее клетки.
- Иммунорезистентность новообразования, или его способность противостоять противоопухолевому иммунитету.
- Пробластомные: угнетающие иммунитет (вещества-супрессоры, вырабатываемые макрофагами и лимфоцитами; гормоноподобные соединения, интерлейкин-10, циркулирующие иммунные комплексы, протеины группы TGFβ, состоящие из антигенов, антител и компонентов комплемента); усиливающие иммунитет (ФНО, вырабатываемый макрофагами; гамма-интерферон, интерлейкины 2 и 6, фактор роста эндотелия; иммунодефицитные состояния).
Эффекторные механизмы
Основной функцией эффекторных механизмов противоопухолевого иммунитета является блокирование и уничтожение патогенов. Выделяют 2 группы рецепторов, избирательно связывающиеся со специфическими антигенами. На основании этого различают также 2 типа эффекторных механизмов:
- Гуморальный, функционирующий за счет растворимых (гуморальных) факторов – антител, которые связывают и удаляют антиген.
- Клеточный (антителонезависимый), реализующийся с участием клеток иммунной системы, важнейшими из которых являются Т-лимфоциты, макрофаги, NK-клетки. Они непосредственно разрушают чужеродные, инфицированные и опухолевые клетки.
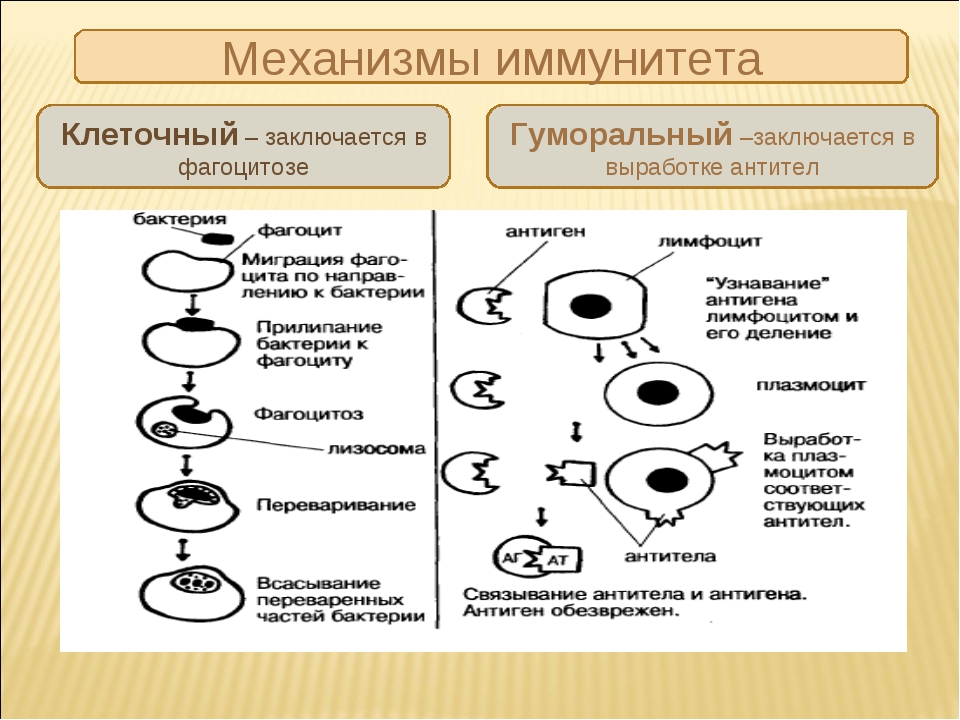
Если патологически измененная клетка избежала гибели при воздействии эффекторных механизмов, то может наступить период равновесия между ее делением и подавляющим влиянием иммунитета. При прогрессировании злокачественного процесса происходит выход опухолевой ткани из-под контроля иммунных механизмов.
Важнейшую роль в подавлении деления клеток играют 2 типа лимфоцитов, запускающих процесс некроза – Т-лимфоциты и NK-клетки, распознающие стрессорные молекулы, которые выделяет новообразование. Т-лимфоциты формируются в течение более длительного времени, а их предшественники распознают опухолевые антигены. Th1-лимфоциты запускают механизм воспаления, что приводит к активизации макрофагов. Продукты секреции последних способствуют нарушению местного кровоснабжения тканей, что также влечет гибель тканей опухоли.
Участие Т-лимфоцитов проявляется в пропитывании злокачественного новообразования лимфоидными клетками, которые разрушают его клетки путем растворения, или цитолиза. Активизация лимфоцитов происходит под действием цитокинов – белковых информационных молекул, с которыми они вместе проникают в опухоль.
Большое значение среди внутренних факторов, присущих иммунной системе организма человека, имеет также гамма-интерферон. Его функции заключаются в следующем:
- Подавление деления опухолевых клеток.
- Активизация процесса их запрограммированной гибели.
- Стимулирование выработки цитокинов, которые привлекают в новообразование Т-лимфоциты.
- Активация макрофагов и развития Т-хелперов, необходимых для укрепления противоопухолевого иммунитета.
- Подавление образования новых кровеносных сосудов, что ухудшает питание опухоли и способствует более быстрой гибели ее клеток.
Противоопухолевый иммунитет: причины его низкой эффективности
Рост злокачественных новообразований и их устойчивость к иммунитету объясняются следующими причинами:
- слабая способность индуцирования иммунного ответа у опухолевых антигенов;
- выживание (естественный отбор) опухолевых клеток, устойчивых к иммунитету;
- постоянное видоизменение антигенов;
- наличие капсулы у опухоли;
- секреция опухолевых антигенов в растворимой форме, что приводит к подавлению иммунного ответа;
- расположение новообразования в местах, где возникновение антигена не приводит к воспалительному иммунному ответу (так называемая «привилегированная» локализация – костный мозг, нервная, эндокринная и половая система, тимус);
- утрата некоторых компонентов эффекторной системы в результате генетических или приобретенных (вторичных) иммунодефицитных состояний;
- производство опухолевыми клетками пробластомных факторов, подавляющих иммунитет и способствующих увеличению новообразования;
- у новорожденных – незрелость эффекторных систем, влекущее за собой нераспознавание опухолевых клеток.
Эти механизмы неэффективности противоопухолевого иммунитета приводят к тому, что новообразование становится мало иммуногенным и не воспринимается организмом как чужеродный элемент. В результате снижается защитная реакция. Иммунные механизмы не могут привести к отторжению уже сформировавшейся злокачественной опухоли.
Особенности
К особенностям противоопухолевого иммунитета относятся:
- Основную роль в иммунном ответе играют Т-лимфоциты, макрофаги и NK-клетки, разрушающие опухолевую ткань. Значение гуморального иммунитета значительно меньше.
- Раковые антигены распознаются или непосредственно макрофагами и дендритными клетками, отвечающими за врожденный и адаптивный иммунитет, или через Th1-хелперы.
- Взаимодействие организма и опухоли происходит по трем направлениям: естественная и приобретенная резистентность к злокачественным новообразованиям, иммунодепрессия со стороны опухоли. Совокупность этих факторов и составляет противоопухолевый иммунитет.
- Злокачественные клетки в процессе естественного отбора приобретают механизмы защиты против врожденного иммунитета. Формируется их новый фенотип, происходит эволюция новообразования.
Опухолеассоциированные антигены разделяют на 2 группы – первого типа (характерны для многих видов новообразований, имеют вирусное происхождение) и второго, очень специфичные и обнаруживаемые у всех пациентов, имеющих данный вид опухоли.
Одной из общих особенностей противовирусного и противоопухолевого иммунитета является то, что он носит как специфический характер, то есть направлен против определенных видов патогенов, так и неспецифический (уничтожает все чужеродное организму). Неспецифическими факторами служат мононуклеарные и NK-клетки, активизирующиеся под влиянием интерлейкина 2 и интерферонов, а также лимфокин-активированные киллерные клетки и цитокины.
Иммунодиагностика
В последние годы в медицине находит применение иммунодиагностика злокачественных новообразований. В ее основе лежит выявление в крови следующих белковых соединений:
- антигены, ассоциированные с опухолями;
- антитела;
- лимфоциты, восприимчивые к опухолевым антигенам.
Малоинвазивная иммунодиагностика позволяет выявить рак различных органов на ранней стадии развития опухоли по наличию специфических антигенов (в скобках указана локализация злокачественного новообразования):
- PSA (простата).
- P-53 (мочевой пузырь).
- SCC (легкие, пищевод, прямая кишка).
- СА-19-9 (поджелудочная железа).
- СА-125 (яичники).
- СА-15-3 (молочная железа).
Однако антитела к определенному антигену в крови пациентов с раком определяются нечасто (в 10 % случаев). Иммуноглобулины к опухолеассоциированных антигенов выявляют чаще – у 50 % больных. В настоящее время в медицинской научной среде ведутся поиски и других антигенов, помогающих в диагностике рака.
Иммунопрофилактика и лечение
Для повышения противоопухолевого иммунитета используют иммуномодуляторы, опосредованно активизирующие клетки иммунной системы:
- Интерлейкины 1 и 2. Эти белковые соединения относятся к группе провоспалительных цитокинов (информационных молекул) и являются биологически активными веществами, вырабатываемыми лейкоцитами. Интерлейкины – главные участники в процессе формирования иммунного ответа при внедрении патогенов в микробиологии. Противоопухолевый иммунитет активизируется за счет активного деления лимфоцитов (Т-киллеры, NK-клетки, Т-хелперы, Т-супрессоры и продуценты антител). Интерлейкин 2 также активизирует выработку фактора некроза опухолей.
- Препараты из группы интерферонов. Они стимулируют иммунный ответ путем представления Т-лимфоцитам антигенов, которые были захвачены макрофагами и дендритными клетками. Т-хелперы выделяют белковые информационные молекулы, активирующие работу других клеток иммунной системы. В результате происходит повышение противоопухолевого иммунитета. Отдельные виды интерферонов (гамма-интерферон) могут непосредственно воздействовать на макрофаги и киллеры.
- Адъюванты. Они вводятся вместе с основными иммунобиологическими медицинскими препаратами и служат для усиления ответа со стороны защитных сил организма. Чаще всего их используют для здоровых людей при вакцинации. Одной из особенностей противоопухолевого иммунитета в микробиологии, касающейся данного типа веществ, является то, что они могут концентрировать на своей поверхности антигены. Это обеспечивает более длительный эффект. Для целенаправленной доставки антигенов в органы лимфатической системы применяют липосомы – пузырьки с липидными биослоями. Наиболее распространенными веществами этой группы являются полный и неполный адъювант Фрейнда, гидроксид алюминия, коклюшная палочка, осажденная на алюминиевых квасцах; Полиоксидоний.
- Элементы клеток бактерий (иммуностимуляторы Продигиозан, Ликопид, Ромуртид и другие).
Проведенные на животных эксперименты показывают, что при введении опухолевых антигенов происходит формирование иммунологической памяти. В результате после этого отторгается трансплантируемая злокачественная опухоль. В последние годы в медицине ведутся активные разработки, которые дадут возможность создания противоопухолевой иммунной памяти путем вакцинации. Пока в этом направлении создан один тип прививок – для повышения иммунитета к вирусам папилломы человека, которые индуцируют возникновение рака шейки матки у женщин («Гардасил» и «Церварикс» зарубежного производства).
Виды опухолей
Иммунотерапия является эффективной в отношении следующих видов опухолей:
- меланома, возникающая из меланоцитов – пигментных клеток;
- неходжкинские лимфомы, происходящие из лимфоцитов;
- рак почек, прямой кишки, яичников;
- волосатоклеточный лейкоз (поражение В-лимфоцитов, белых клеток крови);
- глиома (опухоль мозга);
- саркома мягких тканей, происхождение которой связано с эпителиальными клетками и соединительной тканью.
