Физиология системы крови иммунитет
Лекция 11.
Физиология иммунной системы
План.
Морфофункциональная характеристика иммунной системы. Иммунный ответ, его типы и механизм. Антитела, их взаимодействие с антигеном. Иммунологическая реактивность и неспецифическая резистентность. Использование достижений иммунологии в животноводстве.
1. Морфофункциональная характеристика иммунной системы.
n Иммунная система (от лат. immunitas — освобождаться от чего-либо) — это система органов и клеток, деятельность которых обеспечивает иммунитет – это способность организма защищаться от генетически чужеродных веществ, сохранять свой генетический гомеостаз (биологическую индивидуальность).
n Чужеродные вещества могут поступать из внешней среды (бактерии, вирусы, простейшие, токсины, белки) и из внутренней (собственные клетки с искаженной генетической информацией).
n Морфологически иммунная система представляет собой совокупность всех лимфоидных органов и скоплений лимфоидных клеток тела, коммуникация между которыми осуществляется через кровоток и лимфоток. Главной клеточной формой иммунной системы является лимфоцит.
n Лимфоидные органы:
n 1. Центральные (первичные) — тимус (вилочковая железа), фабрициева бурса (у птиц) и костный мозг; в них образуются исходные стволовые клетки, осуществляется пролиферация и первичная дифференцировка иммунокомпетентных (ответственных за иммунитет) клеток — лимфоцитов.
n 2. Периферические (вторичные) — лимфатические узлы, миндалины, селезенка, пейеровы бляшки тонкого кишечника, фолликулы аппендикса, лимфоэпителиальные образования в слизистой желудочно-кишечного тракта, дыхательных и мочеполовых путей; в них происходит созревание лимфоцитов, их пролиферация в ответ на антигенную стимуляцию.
n Первичные лимфоидные органы.
n В красном костном мозгу и печени (у плодов) находятся стволовые клетки, дающие начало всем типам клеток крови. Часть стволовых клеток, запрограммированных как лимфоцитарные, мигрируют с током крови в тимус, где размножаются и дифференцируются в лимфоциты — Т-лимфоциты, или тимусзависимые.
n Другие поселяются и дифференцируется в фабрициевой бурсе птиц — дивертикуле клоаки — В-лимфоциты, или бурсозависимые. У млекопитающих эту функцию выполняет сама кроветворная ткань костного мозга или лимфатические пейеровы бляшки, расположенные в стенке тонкого кишечника. С наступлением половой зрелости тимус и фабрициева бурса уменьшаются в размерах и затем подвергаются инволюции.
n Вторичные лимфоидные органы.
n Часть лимфоцитов из тимуса и фабрициевой бурсы переносится (еще в эмбриональный период) в периферические лимфоидные органы. В лимфатических фолликулах этих образовании различают тимусзависимые зоны — где селятся Т-лимфоциты и тимуснезависимые зоны — В-лимфоциты.
n Пр., в лимфатических узлах тимуснезависимой зоной является кортикальный слой, а паракортикальный слой, прилегающий к медуллярным синусам, составляет тимусзависимый слой. Однако резкой границы между зонами нет, поскольку иммунный ответ требует, как правило, взаимодействия между Т — и В-лимфоцитами.
n В селезенке, выполняющей роль фильтра для крови, обе зоны находятся в белой пульпе. Вдоль артерий расположена тимусзависимая зона, кнаружи от нее — тимуснезависимая зона
2. Иммунный ответ, его типы и механизм.
n Иммунный ответ — это реакция организма на внедрение чуждых ему макромолекул.
n Вещество, способное вызвать специфический иммунный ответ, называется антигеном.
n Иммуногенность антигена — способность вызывать иммунный ответ. Зависит от его чужеродности, молекулярной массы (молекулы массой менее 5000 обычно не иммуногенны), структурной гетерогенности, устойчивости к разрушению ферментами, вида животных.
n Антигены могут быть животного, растительного и микробного происхождения.
n Пр., антигены гистосовместимости — распознающие и устраняющие аномальные клетки организма или трасплантированных тканей; аллергены (пыльца, чешуйки кожи, волосы, перья и др.); групповые антигены крови.
n Типы иммунного ответа:
n 1. Гуморальный — выработка антител, циркулирующих в крови и специфически связывающихся с чужеродными молекулами, ответственны В-лимфоциты
n 2. Клеточный — образование специализированных клеток, реагирующих с антигеном посредством его связывания и последующего разрушения. В основном против клеточных антигенов — бактерий, патогенных грибов, чужеродных клеток и тканей (пересаженных или опухолевых), ответственны Т-лимфоциты.
n Механизм иммунного ответа.
n В покое Т — и В-лимфоциты морфологически мало различимы. Под влиянием антигена происходят их пролиферация и дифференцировка.
n Активированные Т-клетки трансформируются в лимфобласты, которые дают начало субпопуляциям клеток:
n 1. Т-киллеры (убийцы),
n 2. Т-супрессоры (подавляющие иммунный ответ),
n 3. Т-хелперы (интегрирующие иммунный ответ путем кооперации с В-лимфоцитами при выработке антител или путем стимуляции Т-киллеров).
n Все виды Т-лимфоцитов выделяют растворимые факторы — лимфокины, которые регулируют проявление клеточного иммунитета (супрессию, кооперацию, приобретение специфических свойств Т-лимфоцитами) и активируют фагоцитарную активность макрофагов
n Пр. глюкопротеид интерлейкин, стимулирующий рост и пролиферацию Т-лимфоцитов; белок интерферон, подавляющий размножение вирусов и усиливающий фагоцитоз.
n Активированные В-лимфоциты становятся продуцентами антител. При первом контакте с антигеном происходит их начальная активация, или сенсибилизация. Превращаются в:
n 1. Клетки иммунологической памяти — не дают первичного иммунологического ответа, но при повторном контакте с тем же антигеном легко превращаются в клетки, секретирующие антитела
n 2. Плазматические клетки – образуются в периферических лимфатических органах, при участии Т-хелперов выделяют антитела в кровь.
3. Антитела, их взаимодействие с антигеном.
n Антитела — это сложные белки (глюкопротеиды), которые образуются в организме в ответ на парентеральное (в кровь) поступление антигена и способные специфически взаимодействовать с этим антигеном.
n Обеспечивают гуморальный иммунитет у животных.
n Антитела содержатся в сыворотке крови и в лимфе (циркулирующие антитела); в молозиве и секретах (секретирующие антитела); на поверхности клеток, пр. эпителии слизистых оболочек (связанные с мембраной антитела).
n Антитела принято называть иммуноглобулинами (1/5 всех сывороточных белков).
n Антитело состоит из 4-х полипептидных цепей, соединенных дисульфидными мостиками, имеются два антигенсвязывающих участка. Антигенные свойства определяет «хвостовая» область.
n В крови человека 5 классов иммуноглобулинов, имеющих определенную конформацию «хвоста», что определяет их биологические свойства:
n 1. IgG (70-80%) — активируют фагоциты и систему комплемента, могут проходить через плаценту в кровь плода;
n 2. IgA (10-15%) — основной класс антител в молозиве и секретах: слюне, слезах, слизи;
n 3. IgM (5-10%) — образуются на ранней стадии иммунного ответа. Рецепторы В-лимфоиитов. Активируют систему комплемента;
n 4. IgE (0,1%) — способствуют секреции тучными клетками и базофилами гистамина и серотонина. Эффекторы аллергии;
n 5. IgD (0,1%) — являются рецепторами для антигена на некоторых В-лимфоцитах.
n Антитела способствуют уничтожению чужеродных тел с помощью трех механизмов:
n 1. Усиления фагоцитоза (путем связывания с рецепторами макрофагов и нейтрофилов),
n 2. Активации системы комплемента — белкового комплекса сыворотки, участвующего в реакции антиген-антитело и вызывающего лизис клеток,
n 3. Стимуляции функции К-клеток (лимфоцитов без Т — или В-маркеров, обладающих цитотоксическим действием).
n Кроме того, антитела могут присоединяться к вирусам или бактериальным токсинам и предотвращать их связывание с рецепторами на клетках-мишенях.
В крови сельскохозяйственных животных (крупного рогатого скота, свиней, овец, коз и лошадей) обнаружено 3 класса иммуноглобулинов: IgG, IgA, IgM, причем IgG имеет два подкласса (IgG1 и IgG2). В молозиве содержатся преимущественно IgG, в молоке — IgA и IgM.
n Комплементарные, т. е. взаимно соответствующие друг другу антигены и антитела, образуют иммунный комплекс антиген — антитело.
n Прочность таких структур определяется высокой избирательностью и большой площадью взаимодействия по принципу «ключ-замок», благодаря гидрофобным водородным электростатическим связям и силам Ван-дер-Ваальса. Антиген при этом соединяется своей антигенной детерминантой, антитело — своим активным центром.
n Антиген, как правило, больше по размерам, чем антитело, поэтому последнее может распознавать только отдельные участки антигена, которые называются детерминантами.
n Большинство антигенов имеет на поверхности много антигенных детерминант, которые стимулируют иммунный ответ.
n Антитела могут вступать в реакцию не только с гомологичным антигеном, но и с родственными ему гетерологичными антигенами.
n Пр., на этом принципе основана предохранительная противооспенная прививка, когда человеку прививают «безобидную» коровью оспу, родственную натуральной оспе.
n Реакции специфического взаимодействия антител с антигенами проявляются в следующих формах:
n 1. Агглютинация — склеивание антигенных частиц между собой;
n 2. Преципитация — агрегация частиц с образованием нерастворимых комплексов;
n 3. Лизис — растворение клеток под влиянием антител в присутствии комплемента;
n 4. Цитотоксичность — гибель клеток под влиянием антител — цитотоксинов;
n 5. Нейтрализация — обезвреживание токсинов белковой природы;
n 6. Опсонизация — усиление фагоцитарной активности нейтрофилов и макрофагов под влиянием антител или комплемента.
n Обычно иммунный ответ выявляется через несколько дней.
n 4. Иммунологическая реактивность и неспецифическая резистентность.
n Формы нормальной иммунологической реактивности:
n 1. Иммунитет — защита при помощи антител и сенсибилизированных Т-лимфоцитов;
n 2. Иммунологическая память — способность иммунной системы специфически отвечать на повторные или последующие введения антигена. Проявляется в виде ускоренного и усиленного ответа на антиген (уменьшение латентного периода, более резкое нарастание титра антител, ускоренное отторжение трансплантата, аллергические реакции). Может быть краткосрочной, долговременной и пожизненной. Ее основными носителями являются долгоживущие сенсибилизированные В-лимфоциты, образующиеся при кооперации их с лимфобластами. Эти клетки продолжают циркулировать в кровяном и лимфатическом русле, являясь специфическими предшественниками антигенреактивных лимфоцитов. При повторном контакте с антигеном они размножаются, обеспечивая быстрое увеличение специфических В — или Т-лимфоцитов.
n 3. Иммунологическая толерантность — негативная форма иммунологической памяти. Проявляется в отсутствии или ослаблении ответа на повторное введение антигена. Лежит в основе отсутствия реакции организма на собственные антигены. В ранний период развития иммунная система потенциально способна реагировать на них, но постепенно «отвыкает» от этого. Предположительно, это обусловлено выведением (элиминацией) В — и Т-клеток с рецепторами для антигенных детерминант собственного организма или активацией Т-супрессоров, подавляющих реакцию на собственные антигены.
n Пр., телки-близнецы, имевшие в антенатальный период общую плаценту (т. е. обмен клетками крови), при взаимных пересадках кожи не отторгают трансплантат, т. е. не признают его чужеродным. При наличии же у каждого из близнецов собственной плаценты кожные трансплантаты при аналогичных пересадках отторгаются.
n Патологическими формами реактивности являются антигенспецифическая гиперчувствительность, аутоиммунные процессы, отсутствие ответа или дефектный ответ вследствие врожденного иммунодефицита.
n Неспецифическая резистентность.
n Система неспецифической защиты, или неспецифической резистентности включает следующие компоненты: непроницаемость кожных и слизистых покровов; кислотность содержимого желудка; наличие в сыворотке крови и жидкостях организма бактерицидных субстанций — лизоцима, пропердина (комплекса сывороточного белка, ионов Мg++ и комплемента), а также ферментов и противовирусных веществ (интерферона, термоустойчивых ингибиторов). Активность факторов естественной резистентности неодинакова в разные периоды онтогенеза.
n Факторы неспецифической защиты первыми включаются в борьбу при поступлении в организм чужеродных антигенов. Подготавливают почву для дальнейшего развертывания иммунных реакций, которые определяют исход.
n Особое положение среди факторов защиты занимают фагоциты (макрофаги и полиморфноядерные лейкоциты) и система белков крови — комплемент. Их можно отнести как к неспецифическим, так и к иммунореактивным факторам защиты. Связывание антител с антигеном облегчает поглощение антигена фагоцитами и часто активирует систему комплемента, хотя выработка комплемента и явление фагоцитоза не являются сами по себе специфическими реакциями в ответ на введение антигена.
5. Использование достижений иммунологии в животноводстве.
n По времени проявления в онтогенезе различают иммунитет врожденный и приобретенный, а по способу возникновения — активный и пассивный.
n Приобретенный активный иммунитет возникает при переболевании животного или при его активной иммунизации (вакцинации).
n Вакцинация — парентеральное введении препарата из живых, ослабленных или убитых микроорганизмов. В ответ на это у животных образуется иммунитет гуморального или клеточного типа, специфичный по отношению к данному возбудителю.
n Массовая вакцинация проводится в обязательном порядке (против особо опасных инфекций), либо при угрожающей эпизоотологической ситуации.
n Метод генной инженерии позволяет получать синтетические вакцины против вирусных болезней животных, которые состоят из коротких полипептидов, соответствующих антигенным детерминантам вирусов. Такие вакцины свободны от балластного материала, эффективны и не обладают побочным действием.
n Пассивная иммунизация осуществляется путем введения животному специфических антибактериальных, антитоксических или антивирусных сывороток, содержащих готовые антитела. Продолжительность возникающего пассивного гуморального иммунитета обычно невелика, определяется периодом биологической полужизни антидн.).
n Пассивный колостральный иммунитет (от лат. colostrum — молозиво) у новорожденных возникает за счет иммуноглобулинов матери, передаваемых через молозиво. Новорожденные животные не обладают иммунитетом вследствие недоразвитости лимфоидной ткани и отсутствия иммунокомпетентных клеток. Плацентарный барьер не пропускает иммуноглобулины матери в кровь плода.
n Иммуноглобулины проходят, не разрушаясь, через стенку кишечника новорожденного, так как протеолитическая активность пищеварительных соков ингибируется специальным ферментом, содержащимся в молозиве. Интенсивность всасывания иммуноглобулинов резко снижается со временем.
n Так, у телят сразу после рождения абсорбируется 50% антител молозива, через 20 ч — 15%, через 36 ч — ничтожное количество (у ягнят — 24-40 ч). Наряду с этим снижается концентрация иммуноглобулинов в молозиве: через 3-5 ч после отела — в 1,5 раза, через 12 ч — в 3, через 3 сут. — в 5, через 5 сут. — в 10 раз. Поэтому возможно более ранняя (в первые часы) дача молозива и обильное его выпаивание в последующем позволяют значительно снизить отход молодняка.
n Колостральный иммунитет непродолжителен (10-14 дн.). Уровень иммунноглобулинов в крови постепенно снижается и лишь с 4-5-й нед. снова возрастает вследствие функционального созревания собственной лимфомиелоидной системы. Полноценный иммунный ответ, характерный для взрослых, формируется у поросят и телят примерно к 2-3 мес.
Источник
Состав крови
Кровеносная, она же сердечно-сосудистая система обеспечивает циркуляцию крови и лимфы в организме человека. Среди всех органов тела только поверхность глаз может получать кислород непосредственно из воздуха. Все остальные органы и ткани, даже кожа, получают кислород с током крови.
Кровь относится к соединительной ткани, клетки в ней занимают гораздо меньший объем, чем межклеточное вещество. Кровь состоит из жидкости с растворенными веществами (плазмы) и форменных элементов: лейкоцитов, эритроцитов и тромбоцитов. Плазма крови образует внутреннюю среду организма: жидкость из крови «выдавливается» в ткани и становится тканевой жидкостью, избыток тканевой жидкости попадает в лимфатические сосуды, становясь лимфой. Лимфа в итоге попадает в кровоток, возвращая жидкость в кровь.
Плазма крови содержит 0,9% хлорида натрия (поваренная соль), поэтому для внутривенных вливаний используют водный 0,9% раствор NaCl («физиологический», или изотонический раствор). Другие соли и органические вещества в сумме занимают около 9% массы плазмы. Большую роль играют белки плазмы, особенно альбумины.
Для поддержания постоянной кислотности в плазме присутствуют буферные системы. Водородный показатель крови человека (pH) в среднем равен 7,4. При его смещении в кислотную или основную сторону происходят химические реакции в буферных системах, которые уравновешивают изменения кислотности.
Поддерживать постоянство внутренней среды (гемостаз) необходимо для нормальной жизни клеток. Клеточная мембрана проницаема для молекул воды, поэтому если снаружи концентрация раствора повышается (гипертонический раствор), вода стремится выйти из клетки по закону осморегуляции. Клетка при этом скукоживается, становится неправильной формы, многие ее органеллы перестают правильно работать.
Если же концентрация соли в окружающем растворе слишком мала (гипотонический раствор), вода стремится внутри клетки, чтобы «разбавить» ее содержимое. В этом случае клетки разбухают, мембрана может не выдержать и лопнуть. Таким образом, изменение солености крови может привести к необратимым изменениям в организме.
Клетки составляют около 45% объема крови. Выделяют «белую» кровь – лейкоциты и «красную» кровь – эритроциты. Эритроциты имеют небольшой размер и двояковогнутую дисковидную форму. Такая форма дает большую площадь поверхности при минимальном объеме, что повышает эффективность газообмена. Эритроциты человека не имеют ядра, они теряют его в процессе созревания.
Эритроциты
В 1 мл крови содержится 4-6 млн эритроцитов. Их главная функция – перенос кислорода, за это отвечает крупный белок – гемоглобин. Одна молекула гемоглобина состоит из четырех полипептидных цепей (глобина) и железосодержащих групп (гема). Каждая молекула гемоглобина может перенести четыре молекулы кислорода, причем способность связывать и отдавать кислород зависит от условий среды: в более щелочной среде (легких) гемоглобин лучше связывает кислород, в то время как в более кислой среде (тканях), он лучше отдает его.
Механизм действия гемоглобина
Помимо кислорода с гемоглобином могут связываться другие газы, самым опасным из которых является угарный (СО). Он образуется при неполном сгорании органики в условиях нехватки кислорода и не имеет цвета и запаха. Сродство гемоглобина к угарному газу гораздо выше, чем к кислороду, поэтому, однажды связавшись с гемоглобином, угарный газ будет еще долго циркулировать в крови. При этом свободных сайтов связывания кислорода станет меньше и ткани начнут страдать от его нехватки. Тяжелое отравление угарным газом требует немедленной специализированной помощи.
Клетки крови
Лейкоциты
Лейкоциты являются основой клеточного иммунитета, это сферические клетки с достаточно крупным ядром. 1 мл крови содержит 4-11 тысяч лейкоцитов. Из всех клеток организма они наиболее уязвимы к действию радиации.
В зависимости от свойств лейкоциты делятся на несколько типов: содержащие гранулы, или гранулоциты (эозинофилы, нейтрофилы, базофилы) и не содержащие – агранулоциты.
Тромбоциты
Также кровь содержит тромбоциты, которые представляют собой отшнуровавшиеся куски гигантской клетки. Сами тромбоциты клетками не являются, они выглядят как мелкие пластинки неправильной формы и содержат только цитоплазму с гранулами. В гранулах находятся ферменты свертывающей системы, которые активируются при повреждении сосуда: образуется сгусток крови (тромб), который закупоривает поврежденный участок. 1 мл крови содержит 200-500 тысяч тромбоцитов.
Начало всем форменным элементам крови дают стволовые клетки красного костного мозга. Клетки крови постоянно обновляются, но у разных типов клеток обновление происходит с разной периодичностью. Эритроциты могут циркулировать 120-130 суток, в то время как лейкоциты и тромбоциты обычно живут не дольше 5-7 суток.
Иммунитет
Иммунная система защищает организм от воздействия бактерий, вирусов, грибов и паразитов, вредных веществ. В случае сбоя в работе иммунитета могут возникать аутоиммунные заболевания, в организме человека есть несколько механизмов, чтобы их предотвратить.
Органы, участвующие в формировании иммунитета
Основными органами иммунной системы являются селезенка, тимус (вилочковая железа) и костный мозг, где появляются и начинают созревать иммунные клетки. Клетки иммунитета циркулируют с кровью, располагаются в лимфоузлах и тканях, особенно много их в местах контакта с внешней средой (кожа, ЖКТ, дыхательные пути). Некоторые органы защищены от иммунного ответа барьерами, они называются иммунологически привилегированными органами. Это мозг, камеры глаза, семенники, плацента и плод и т.д. При травмах иммунологически привилегированных органов, когда нарушается целостность барьера, могут возникнуть аутоиммунные реакции.
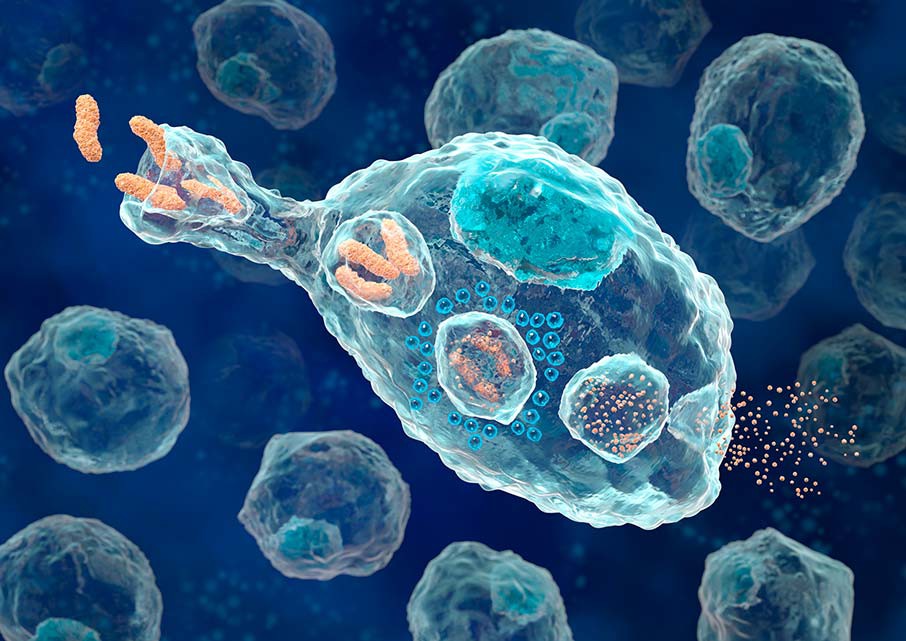
Макрофаги
Другие клетки неспецифического иммунитета, которые первыми отвечают на воздействие, – макрофаги. Это крупные клетки, которые способны к активному передвижению и фагоцитозу, они пожирают бактерии и инородные тела. Самостоятельно распознавать чужеродные белки макрофаги не способны, их действие не избирательно. «Ориентируют» макрофагов на уничтожение конкретных клеток антитела.
Макрофаг, фагоцитирующий бактерии.
Другими клетками иммунитета являются нейтрофилы и эозинофилы. Они, как и макрофаги, являются фагоцитами (то есть способны к фагоцитозу). Кроме того, в их цитоплазме есть гранулы с едкими веществами, которые высвобождаются при активации клетки. Запускается каскад химических реакций, в ходе которых образуются активные формы кислорода, это называется кислородным взрывом. Нейтрофилы и эозинофилы, а также окружающие здоровые клетки тоже погибают в результате кислородного взрыва, их остатки фагоцитируют макрофаги. Эозинофилы играют основную роль в развитии аллергий.
Нейтрофил, эозинофил, базофил
Фагоциты способны к направленному движению (хемотаксису), их можно обнаружить во многих тканях и органах, даже на поверхности кожи. Благодаря их постоянной активности большая часть атакующих агентов не вызывает инфекции, то есть системного ответа организма. Инфекция возникает в том случае, если иммунитет ослаблен (переутомление, переохлаждение, голодание и т.д.) или если инфекционный агент не был вовремя распознан фагоцитами.
Различают два вида иммунитета: клеточный и гуморальный. Гуморальный иммунитет – это система комплемента и циркулирующие с плазмой крупные молекулы – антитела. Белки системы комплемента «помечают» чужеродные агенты, вызывая направленное движение клеток иммунитета. Также система комплемента может формировать поры в мембране бактерий, что будет вести к их разрушению.
Антитела
Каждое антитело имеет на конце вариабельные домены (участки), комплементарные к чужеродному белку и специфические для конкретного возбудителя. Они прикрепляются к комплементарным участкам белков, «помечая» их для других клеток иммунного ответа, например, для фагоцитов. Также антитела могут слипаться между собой, что вызывает агглютинацию возбудителя. Особенно эффективны антитела против бактерий.
На рисунке изображены молекулы антител. Каждая состоит из двух пар цепей, синим цветом нарисованы тяжелые цепи, коричневым – легкие.
Клеточный иммунитет состоит из Т и В-лимофцитов. Т-лимофоциты могут быть двух видов: Т-хелперы и Т-киллеры. Т-киллеры клетки-убийцы, они запускают процессы апоптоза, то есть запрограммированной гибели клеток, их самоуничтожения. Это необходимо, если клетки организма заражены вирусами или бактериями или если при делении в геноме появились мутации (то есть Т-киллеры борются также с раковыми клетками).
В-лимфоциты синтезируют антитела и таким образом управляют гуморальным иммунитетом. При миграции В-клеток из крови в ткань они дифференцируются в плазматические клетки.
Лимфоциты действуют избирательно, они «настроены» на уничтожение возбудителя с конкретными антигенами. Чтобы правильно «настроить» лимфоциты, нужны антиген-презентирующие клетки (АПК). АПК фагоцитируют чужеродных агентов и выставляют на своей поверхности участки их молекул в комплексе с МНС II (главный комплекс гистосовместимости II). Т-хелперы способны распознавать чужие молекулы на поверхности АПК и активировать иммунный ответ.
Специфический иммунитет очень эффективен, но требует времени на развертывание. От попадания возбудителя в кровь до выработки антител может пройти несколько дней.
К неспецифическому иммунитету относят в основном фагоциты, которые пытаются поглотить или разрушить любое инородное тело или подозрительную клетку, которую встречают.
Немаловажную роль в иммунной защите организма играет воспаление. Это сложный стадийный процесс, который имеет следующие признаки: отек, местное повышение температуры, покраснение, боль и утрата функции органа. Благодаря отеку затрудняется распространение возбудителей по организму, место проникновения ограничивается. При повышении температуры повышается активность некоторых белков гуморального иммунитета, в то время как активность бактерий и скорость их размножения снижаются. Воспалительный процесс особенно эффективен против паразитов.
N-киллеры (натуральные киллеры), как и Т-киллеры могут запускать процессы клеточной гибели. Однако они, в отличии от Т-клеток, не требуют специальной подготовки – презентации антигена и активации. N-киллеры хорошо борются с опухолями.
Интерфероны – белки крови, которые составляют основу противовирусного гуморального иммунитета. Вирусы проникают в клетки организма, после чего здоровые клетки перестают синтезировать необходимые белки и начинают воспроизводить белки и генетическую информацию вирусов. Чтобы остановить распространение вирусных частиц и выиграть время на формирование специфического иммунитета, интерфероны замедляют или даже останавливают синтез белка в зараженных клетках.
Неспецифический иммунитет не требует времени на развертывание, его действие начинается уже в первые минуты после воздействия. Однако и точность неспецифического иммунитета низкая, при развитии иммунного ответа могут страдать здоровые клетки.
Синтез клеток специфического иммунитета (лимфоцитов) включает в себя элемент случайности, только так можно достигнуть неимоверного разнообразия иммунных клеток. Чтобы в кровоток не выходили клетки, которые способны атаковать собственный организм, они проходят строгий отбор в органах иммунной системы, где происходит созревание лимфоцитов (тимус, лимфоузлы). Если в результате отбора оказывается, что юный лимфоцит распознает клетки своего организма в качестве «врагов», в нем запускается процесс апоптоза, самоуничтожения.
Группы крови. Гемотрансфузия.
На поверхности эритроцитов могут находиться белки-агглютиногены А и В. В зависимости от того, какие агглютиногены есть в организме, выделяют: I группу крови (без агглютиногенов), II (только А), III (только В) и IV (оба агглютиногена).
При гемотрансфузии (переливании крови) необходимо учитывать группу, чтобы избежать возникновения иммунного конфликта. Если человеку с I группой крови перелить любую другую, клетки его иммунитета распознают чужеродные белки-агглютиногены и выработают антитела. В результате все чужие эритроциты «слипнутся» (агглютинируют), что может быть очень опасно для организма хозяина. Поэтому людям с I группой крови можно переливать только кровь такой же группы.
Если же перелить кому-нибудь эритроциты I группы крови, не имеющие белков-агглютиногенов, реакции иммунитета не последует. Можно сказать, что обладатели I группы самые «щедрые», потому что могут поделиться своей кровью со всеми. Также их называют универсальными донорами.
Обратная ситуация с IV группой: в крови таких людей нет антител ни к агглютиногену А, ни к агглютиногену В, поэтому им можно перелить кровь любой группы. Однако при попадании эритроцита группы IV в организм с другой группой произойдет агглютинация, поэтому обладателей IV группы крови можно назвать самыми «жадными» или универсальными реципиентами. Соответственно, II группу крови нельзя перелить обладателю III и наоборот.
Помимо агглютиногенов А и В существует много других белков, которые могут привести к возникновению иммунного конфликта. Международное общество трансфузиологов в настоящее время признает всего 36 систем деления крови на группы. Наиболее часто применяют систему АВО, в которой также учитывают резус-фактор. Впервые этот белок был описан у макак-резусов, за что и получил свое название.
Большая часть людей резус-положительна (Rh+), то есть имеет на эритроцитах белок-резус. Им можно переливать кровь с любым резусом. Людям же с резус-отрицательной кровью (Rh-) можно переливать только резус-отрицательную кровь.
Резус-фактор может стать причиной резус-конфликта между матерью и плодом. Если у резус-отрицательной матери будет резус-положительный ребенок, то при попадании крови плода в кровоток матери сформируются антитела к Rh+ белку. Чаще всего смешение крови происходит при родах и не несет опасности для ребенка. Если же антитела каким-то образом появились до родов, они могут проникнуть через плаценту и вызвать агглютинацию эритроцитов плода, что приведет к его гибели. Такая опасность часто возникает при повторной беременности резус-отрицательных женщин.
Распространенность групп крови варьирует в разных популяциях. На картинке приведена частота встречаемость разных групп по системе АВО в мире.
Распространенность групп крови
Источник
