Функция железа в иммунитете
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 июля 2017;
проверки требуют 28 правок.
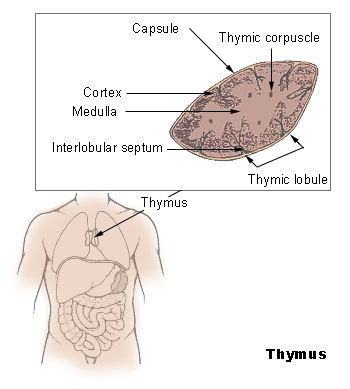
Ти́мус (ви́лочковая железа) — орган лимфопоэза человека и многих видов животных, в котором происходит созревание, дифференцировка и иммунологическое «обучение» T-клеток иммунной системы.
Внешний вид[править | править код]
Вилочковая железа — небольшой орган розовато-серого цвета, мягкой консистенции, поверхность её дольчатая. У новорождённых его размеры составляют в среднем 5 см в длину, 4 см в ширину и 6 мм в толщину, масса — около 15 граммов. Рост органа продолжается до начала полового созревания (в это время его размеры максимальны — до 7,5—16 см в длину, а масса достигает 20—37 граммов). С возрастом тимус подвергается атрофии и в старческом возрасте едва отличим от окружающей его жировой ткани средостения; в 75 лет средняя масса тимуса составляет всего 6 граммов. По мере инволюции он утрачивает белый цвет и за счёт увеличения в нём доли стромы и жировых клеток становится более жёлтым[2].
Тимус (Thymus) в центре. Изображение 1906 г.
Топография[править | править код]
Тимус расположен в верхней части грудной клетки, сразу за грудиной (верхнее средостение). Спереди к нему прилежит рукоятка и тело грудины до уровня IV реберного хряща; сзади — верхняя часть перикарда, покрывающего начальные отделы аорты и лёгочного ствола, дуга аорты, левая плечеголовная вена; с боков — медиастинальная плевра.
Отдельные группы долек тимуса встречаются вокруг или в толще ткани щитовидной железы, в мягких тканях шеи, в области миндалин, в жировой клетчатке переднего, реже заднего средостения. Частота выявления аберрантного тимуса достигает 25 %. Такие аномалии чаще наблюдаются у женщин, в основном с левой стороны шеи и средостения. В литературе имеются единичные сообщения об эктопии ткани тимуса у детей грудного возраста. Такая патология сопровождалась у них одышкой, дисфагией, дыхательной недостаточностью. По данным P. Nowak и соавт., из 91 случая эктопии вилочковой железы в 76 определяется шейная локализация, преимущественно у лиц мужского пола и слева. Отмечается также связь эктопии тимуса со врождёнными пороками сердца в 71 % случаев[3].
Тимус новорождённого: топография. Иллюстрация из «Анатомии» Грея
Строение[править | править код]
У человека тимус состоит из двух долей, которые могут быть сращены или же просто плотно прилегать друг к другу. Нижняя часть каждой доли широкая, а верхняя узкая; таким образом, верхний полюс может напоминать двузубую вилочку (отсюда и название).
Орган покрыт капсулой из плотной соединительной ткани, от которой в глубину отходят перемычки, делящие его на дольки.
У животных (зобная железа) развита у плодов и молодых животных. Она состоит из непарного грудного отдела, лежащего впереди сердца, и парного шейного отдела, проходящего в виде выростов по бокам трахеи. С возрастом железа начинает рассасываться, а затем исчезает.
Кровоснабжение, лимфоотток и иннервация[править | править код]
Кровоснабжение тимуса происходит из тимических, или тимусных ветвей внутренней грудной артерии, (rami thymici arteriae thoracicae internae), тимических ветвей дуги аорты и плечеголовного ствола и ветвей верхней и нижней щитовидных артерий. Венозный отток осуществляется по ветвям внутренних грудных и плечеголовных вен.
Лимфа от органа оттекает в трахеобронхиальные и парастернальные лимфатические узлы.
Иннервирована вилочковая железа ветвями правого и левого блуждающих нервов,[4] а также симпатическими нервами, происходящими из верхнего грудного и звездчатого узлов симпатического ствола, находящимися в составе нервных сплетений, которые окружают питающие орган сосуды[5][6].
Гистология[править | править код]
Микроскопическое строение вилочковой железы
Строма тимуса имеет эпителиальное происхождение, происходит из эпителия передней части первичной кишки. Два тяжа (дивертикула) берут начало из третьей жаберной дуги и прорастают в переднее средостение. Иногда строма тимуса формируется также добавочными тяжами из четвёртой пары жаберных дуг. Лимфоциты происходят из стволовых клеток крови, мигрирующих в тимус из печени на ранних стадиях внутриутробного развития. Первоначально в ткани тимуса происходит пролиферация различных клеток крови, но вскоре его функция сводится к образованию Т-лимфоцитов.
Вилочковая железа имеет дольчатое строение, в ткани дольки различают корковое и мозговое вещество. Корковое вещество расположено на периферии дольки и в гистологическом микропрепарате выглядит тёмным (в нём много лимфоцитов — клеток с крупными ядрами). В корковом веществе расположены артериолы и кровеносные капилляры, имеющие гемато-тимусный барьер, препятствующий заносу антигенов из крови.
Корковое вещество содержит клетки:
- эпителиального происхождения:
- опорные клетки: формируют «каркас» ткани, образуют гемато-тимусный барьер;
- звездчатые клетки: секретируют растворимые тимические (или тимусные) гормоны — тимопоэтин, тимозин и другие, регулирующие процессы роста, созревания и дифференцировки Т-клеток и функциональную активность зрелых клеток иммунной системы.
- клетки-«няньки»: имеют инвагинации, в которых развиваются лимфоциты;
- гематопоэтические клетки:
- лимфоидного ряда: созревающие T-лимфоциты;
- макрофагального ряда: типичные макрофаги, дендритные и интердигитирующие клетки.
Непосредственно под капсулой в клеточном составе преобладают делящиеся Т-лимфобласты. Глубже находятся созревающие Т-лимфоциты, постепенно мигрирующие к мозговому веществу. Процесс созревания занимает примерно 20 суток. В ходе созревания их происходит реаранжировка генов и формирование гена, кодирующего TCR (Т-клеточный рецептор).
Далее они претерпевают положительную селекцию: во взаимодействии с эпителиальными клетками отбираются «функционально пригодные» лимфоциты, которые способны взаимодействовать с HLA; в ходе развития лимфоцит дифференцируется в хелпер или киллер, то есть на его поверхности остаётся либо CD4, либо CD8. Далее в контакте с эпителиальными клетками стромы отбираются клетки, способные к функциональному взаимодействию: CD8+ лимфоциты, способные к рецепции HLA I, и CD4+ лимфоциты, способные к рецепции HLA II.
Следующий этап — отрицательная селекция лимфоцитов — протекает на границе с мозговым веществом. Дендритные и интердигитирующие клетки — клетки моноцитарного происхождения — отбирают лимфоциты, способные к взаимодействию с антигенами собственного организма, и запускают их апоптоз.
В мозговом веществе в основном содержатся дозревающие Т-лимфоциты. Отсюда они мигрируют в кровоток венул с высоким эндотелием и расселяются по организму. Предполагается также наличие здесь зрелых рециркулирующих Т-лимфоцитов.
Клеточный состав мозгового вещества представлен опорными эпителиальными клетками, звездчатыми клетками, макрофагами. Имеются также выносящие лимфатические сосуды и тельца Гассаля.
Функции[править | править код]
Основная роль тимуса — дифференцировка и клонирование Т-лимфоцитов. В тимусе Т-лимфоциты проходят селекцию, в результате чего в кровоток и ткани выходят клетки, которые могут вовлекаться в иммунный ответ против определённых чужеродных антигенов, но не собственного тела. Вырабатывает гормоны: тимозин, тимулин, тимопоэтин, инсулиноподобный фактор роста-1 (ИФР-1), тимусный гуморальный фактор — все они являются белками (полипептидами). При гипофункции тимуса — снижается иммунитет, так как снижается количество Т-лимфоцитов в крови.
Рядом исследований продемонстрирован мнемотропный эффект пептидов тимуса: показано активирующее влияние интраназального введения тактивина и тимозина фракции 5 на процесс формирования условного рефлекса активного избегания, их стресспротекторные свойства и ноотропный эффект от введения в экспериментах на крысах[7]. Влияние пептидов тимуса на функциональную активность центральной нервной системы также заключается в снижении тревожности и увеличении исследовательской активности крыс[8].
Развитие[править | править код]
Размеры тимуса максимальны в детском возрасте, но после начала полового созревания тимус подвергается значительной атрофии и инволюции. Дополнительное уменьшение размеров тимуса происходит при старении организма, с чем отчасти связывают понижение иммунитета у пожилых людей.
Регуляция[править | править код]
Секреция тимических гормонов и функция тимуса регулируется глюкокортикоидами — гормонами коры надпочечников, а также растворимыми иммунными факторами — интерферонов, лимфокинов, интерлейкинов, которые вырабатываются другими клетками иммунной системы. Глюкокортикоиды угнетают иммунитет, а также многие функции тимуса, и приводят к его атрофии.
Пептиды шишковидной железы замедляют инволюцию тимуса[9]. Аналогичным образом действует её гормон мелатонин, способный даже вызывать «омоложение» органа[10]. «Омоложению» тимуса также может способствовать лимфопоэтический фактор роста короткоцепочечный цитокин интерлейкин 7[11], что в будущем может быть использовано для разработки методов восстановления иммунной функции у пожилых людей с помощью лечения рекомбинантным интерлейкином 7[12][13].
Заболевания тимуса[править | править код]
- Синдром MEDAC
- Синдром Ди Георга
- Миастения — может быть самостоятельным заболеванием, но часто ассоциирована с патологией тимуса и тимомой
Опухоли[править | править код]
- Тимома — из эпителиальных клеток вилочковой железы
- Т-клеточная лимфома — из лимфоцитов и их предшественников
- Пре-Т-лимфобластные опухоли в ряде случаев имеют первичную локализацию в тимусе и выявляются как массивный инфильтрат в средостении с последующей быстрой трансформацией в лейкоз.
- нейроэндокринные опухоли
- более редкие опухоли (сосудистого и нервного происхождения)
Опухоли вилочковой железы могут быть проявлением синдрома множественной эндокринной неоплазии I типа.[14]
См. также[править | править код]
- Гемато-тимусный барьер
Примечания[править | править код]
- ↑ 1 2 Foundational Model of Anatomy
- ↑ Gray, H. 4c. The Thymus // (bartleby.com) Anatomy of the Human Body (неопр.). — Philadelphia: Lea & Febiger (англ.)русск., 1918.
- ↑ Щербина В.И., Банина В.Б., Бородулина Л.Г., Полянская З.И., Степанова Е.А. ШЕЙНАЯ ЛОКАЛИЗАЦИЯ АБЕРРАНТНОЙ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ // Детская хирургия.. — 2009. — № 1. — С. 52. — ISSN 1560-9510.
- ↑ Parasympathetic innervation of the thymus: a histochemical and immunocytochemical study
- ↑ Noradrenergic and peptidergic innervation of lymph… [J Immunol. 1985] — PubMed — NCBI
- ↑ Innervation of the Human Thymus and Spleen — an Overview
- ↑ Мнемотропный эффект интраназального введения пептидов тимуса. cyberleninka.ru. Дата обращения 21 июня 2017.
- ↑ Medline.ru — Биомедицинский журнал | Влияние интраназального введения пептидов тимуса на поведение и обучение крыс. medline.ru. Дата обращения 21 июня 2017.
- ↑ SpringerLink — Advances in Gerontology, Volume 1, Number 3 (недоступная ссылка)
- ↑ Rejuvenation of degenerative thymus by oral mel… [J Pineal Res. 2001] — PubMed — NCBI
- ↑ Aspinall, R., Pido-Lopez, J., Imami, N., Henson, S. M., Ngom, P. T., Morre, M., … & Heeney, J. L. (2007). Old rhesus macaques treated with interleukin-7 show increased TREC levels and respond well to influenza vaccination. Rejuvenation research, 10(1), 5-18. doi:10.1089/rej.2006.9098 PMID 17378748
- ↑ Aspinall, R., & Lang, P. O. (2018). Interventions to restore appropriate immune function in the elderly. Immunity & Ageing, 15(1), 5. doi:10.1186/s12979-017-0111-6 PMC 5785902
- ↑ Aspinall, R., & Lang, P. O. (2018). Interleukin-7 and Immunorejuvenation In: Fulop T., Franceschi C., Hirokawa K., Pawelec G. (eds) Handbook of Immunosenescence. Springer, Cham. https://doi.org/10.1007/978-3-319-64597-1_72-1
- ↑ Simultaneous double thymic carcinoids: a rare initial manifestation of multiple endocrine neoplasia type 1 — Springer. Дата обращения 29 марта 2013. (недоступная ссылка)
Источники[править | править код]
- Гистология, цитология и эмбриология (учебник для вузов). Кузнецов С. Л., Мушкамбаров Н. Н. — М.: МИА, 2007.
- Анатомия человека. В двух томах. Т.2/Авторы: М. Р. Сапин, В. Я. Бочаров, Д. Б. Никитюк и др./Под редакцией М. Р. Сапина. — 5-е издание, переработанное и дополненное. — М.: Медицина, 2001. — 640 с.: ил. ISBN 5-225-04586-3
- Курс лекций по патологической анатомии. Частный курс. Часть II, книги 1,2. / Под ред. академика РАН и РАМН, профессора М. А. Пальцева. — М.: ООО «Издательский дом „Русский врач“», 2003. — 210 с.
- Горлова А. В., Павлов Д. А., Ольховик А. Ю., и др. Мнемотропный эффект интраназального введения пептидов тимуса // Здоровье и образование в XXI веке. — 2016. — Т. 18. — № 1. — С. 1—5. [Gorlova AV, Pavlov DA, Olkhovik AYu, et al. Mnemotropic effect of intranasal administration of thymus peptides. Health and Education Millennium. — 2016. — 18(1): 1—5.]
- Ольховик А. Ю., Новоселецкая А. В. Влияние интраназального введения пептидов тимуса на поведение и обучение крыс // Medline.ru. — 2015. — Т. 16. — С. 1106—1117.
Как устроен иммунитет: Объясняем по пунктам
Наш организм непрерывно меняется, но при этом очень «любит» постоянство и может нормально работать только при определенных параметрах своей внутренней среды. Например, нормальная температура тела колеблется между 36 и 37 градусами по Цельсию. Вспомните последнюю простуду и то, как плохо вы себя чувствовали, стоило температуре подняться всего на полградуса. Такая же ситуация и с другими показателями: артериальным давлением, рН крови, уровнем кислорода и глюкозы в крови и другими. Постоянство значений этих параметров называется гомеостазом, а поддержкой его стабильного уровня занимаются практически все органы и системы организма: сердце и сосуды поддерживают постоянное артериальное давление, легкие — уровень кислорода в крови, печень — уровень глюкозы и так далее.
Иммунная же система отвечает за генетический гомеостаз. Она помогает поддерживать постоянство генетического состава организма. То есть ее задача — уничтожать не только все чужеродные организмы и продукты их жизнедеятельности, проникающие извне (бактерии, вирусы, грибки, токсины и прочее), но также и клетки собственного организма, если «что-то пошло не так» и, например, они превратились в злокачественную опухоль, то есть стали генетически чужеродными.
Как клетки иммунной системы уничтожают «врагов»?
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
Иммунитет бывает врожденным (он же неспецифический) и приобретенным (он же адаптивный, или специфический). Врожденный иммунитет одинаков у всех людей и идентичным образом реагирует на любых «врагов». Реакция начинается немедленно после проникновения микроба в организм и не формирует иммунологическую память. То есть, если такой же микроб проникнет в организм снова, система неспецифического иммунитета его «не узнает» и будет реагировать «как обычно». Неспецифический иммунитет очень важен — он первым сигнализирует об опасности и немедленно начинает давать отпор проникшим микробам.
Однако эти реакции не могут защитить организм от серьезных инфекций, поэтому после неспецифического иммунитета в дело вступает приобретенный иммунитет. Здесь уже реакция организма индивидуальна для каждого «врага», поэтому «арсенал» специфического иммунитета у разных людей различается и зависит от того, с какими инфекциями человек сталкивался в жизни и какие прививки делал.
Специфическому иммунитету нужно время, чтобы изучить проникшую в организм инфекцию, поэтому реакции при первом контакте с инфекцией развиваются медленнее, зато работают гораздо эффективнее. Но самое главное, что, один раз уничтожив микроба, иммунная система «запоминает» его и в следующий раз при столкновении с таким же реагирует гораздо быстрее, часто уничтожая его еще до появления первых симптомов заболевания. Именно так работают прививки: когда в организм вводят ослабленных или убитых микробов, которые уже не могут вызвать заболевание, у иммунной системы есть время изучить их и запомнить, сформировать иммунологическую память. Поэтому, когда человек после вакцинации сталкивается с реальной инфекцией, иммунная система уже полностью готова дать отпор, и заболевание не начинается вообще или протекает гораздо легче.
Кто отвечает за работу различных видов иммунитета?
- Костный мозг. Это центральный орган иммуногенеза. В костном мозге образуются все клетки, участвующие в иммунных реакциях.
- Тимус (вилочковая железа). В тимусе происходит дозревание некоторых иммунных клеток (Т-лимфоцитов) после того, как они образовались в костном мозге.
- Селезенка. В селезенке также дозревают иммунные клетки (B-лимфоциты), кроме того, в ней активно происходит процесс фагоцитоза — когда специальные клетки иммунной системы ловят и переваривают проникших в организм микробов, фрагменты собственных погибших клеток и так далее.
- Лимфатические узлы. По своему строению они напоминают губку, через которую постоянно фильтруется лимфа. В порах этой губки есть очень много иммунных клеток, которые также ловят и переваривают микробов, проникших в организм. Кроме того, в лимфатических узлах находятся клетки памяти — это специальные клетки иммунной системы, которые хранят информацию о микробах, уже проникавших в организм ранее.
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.
- Т-лимфоциты. Названы так, потому что после образования в костном мозге дозревают в вилочковой железе — тимусе. Разные подвиды Т-лимфоцитов отвечают за разные функции. Например, Т-киллеры могут убивать зараженные вирусами клетки, чтобы остановить развитие инфекции, Т-хелперы помогают иммунной системе распознавать конкретные виды микробов, а Т-супрессоры регулируют силу и продолжительность иммунной реакции.
- B-лимфоциты. Название их происходит от Bursa fabricii (сумка Фабрициуса) — особого органа у птиц, в котором впервые обнаружили эти клетки. В-лимфоциты умеют синтезировать антитела (иммуноглобулины). Это специальные белки, которые «прилипают» к микробам и вызывают их гибель. Также антитела могут нейтрализовывать некоторые токсины.
- Натуральные киллеры. Эти клетки находят и убивают раковые клетки и клетки, пораженные вирусами.
- Нейтрофилы и макрофаги умеют ловить и переваривать микробов — осуществлять фагоцитоз. Кроме того, макрофаги выполняют важнейшую роль в процессе презентации антигена, когда макрофаг знакомит другие клетки иммунной системы с кусочками переваренного микроба, что позволяет организму лучше бороться с инфекцией.
- Эозинофилы защищают наш организм от паразитов — обеспечивают антигельминтный иммунитет.
- Базофилы — выполняют главным образом сигнальную функцию, выделяя большое количество сигнальных веществ (цитокинов) и привлекая этим другие иммунные клетки в очаг воспаления.
Как клетки иммунной системы отличают «своих» от «чужих» и понимают, с кем нужно бороться?
В этом им помогает главный комплекс гистосовместимости первого типа (MHC-I). Это группа белков, которая располагается на поверхности каждой клетки нашего организма и уникальна для каждого человека. Это своего рода «паспорт» клетки, который позволяет иммунной системе понимать, что перед ней «свои». Если с клеткой организма происходит что-то нехорошее, например, она поражается вирусом или перерождается в опухолевую клетку, то конфигурация MHC-I меняется или же он исчезает вовсе. Натуральные киллеры и Т-киллеры умеют распознавать MHC-I рецептор, и как только они находят клетку с измененным или отсутствующим MHC-I, они ее убивают. Так работает клеточный иммунитет.
Но у нас есть еще один вид иммунитета — гуморальный. Основными защитниками в этом случае являются антитела — специальные белки, синтезируемые B-лимфоцитами, которые связываются с чужеродными объектами (антигенами), будь то бактерия, вирусная частица или токсин, и нейтрализуют их. Для каждого вида антигена наш организм умеет синтезировать специальные, подходящие именно для этого антигена антитела. Молекулу каждого антитела, также их называют иммуноглобулинами, можно условно разделить на две части: Fc-участок, который одинаков у всех иммуноглобулинов, и Fab-участок, который уникален для каждого вида антител. Именно с помощью Fab-участка антитело «прилипает» к антигену, поэтому строение этого участка молекулы зависит от строения антигена.
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
Рассмотрим этот процесс на примере развития бактериальной инфекции. Например, вы поцарапали палец. При повреждении кожи в рану чаще всего попадают бактерии. При повреждении любой ткани организма сразу же запускается воспалительная реакция. Поврежденные клетки выделяют большое количество разных веществ — цитокинов, к которым очень чувствительны нейтрофилы и макрофаги. Реагируя на цитокины, они проникают через стенки капилляров, «приплывают» к месту повреждения и начинают поглощать и переваривать попавших в рану бактерий — так запускается неспецифический иммунитет, но до синтеза антител дело пока еще не дошло.
Расправляясь с бактериями, макрофаги выводят на свою поверхность разные их кусочки, чтобы познакомить Т-хелперов и B-лимфоцитов со строением этих бактерий. Этот процесс называется презентацией антигена. Т-хелпер и B-лимфоцит изучают кусочки переваренной бактерии и подбирают соответствующую структуру антитела так, чтобы потом оно хорошо «прилипало» к таким же бактериям. Так запускается специфический гуморальный иммунитет. Это довольно длительный процесс, поэтому при первом контакте с инфекцией организму может понадобиться до двух недель, чтобы подобрать структуру и начать синтезировать нужные антитела.
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
