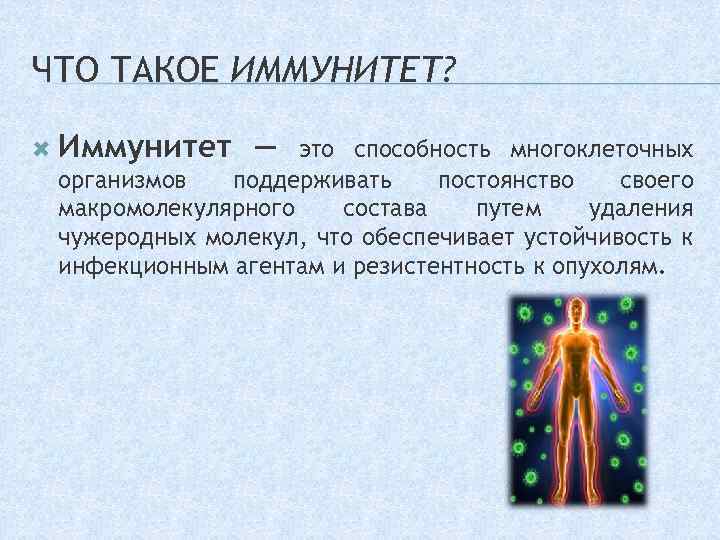
Иммунитет это способность многоклеточных организмов
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 мая 2020;
проверки требуют 8 правок.
Иммуните́т (лат. immunitas — освобождение) человека и животных — способность организма поддерживать свою целостность и биологическую индивидуальность путём распознавания и удаления чужеродных веществ и клеток[1] (в том числе болезнетворных бактерий и вирусов). Характеризуется изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Назначение[править | править код]
Простейшие защитные механизмы, имеющие своей целью распознавание и обезвреживание патогенов, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые препятствуют заражению бактерии вирусом[2]. Одноклеточные эукариотные организмы применяют токсичные пептиды, чтобы предотвратить проникновение бактерий и вирусов в свои клетки[3].
По мере эволюции сложно организованных многоклеточных организмов у них формируется многоуровневая иммунная система, важнейшим звеном которой становятся специализированные клетки, противостоящие вторжению генетически чужеродных объектов[4].
У таких организмов иммунный ответ происходит при столкновении данного организма с самым различным чужеродным в антигенном отношении материалом, включая вирусы, бактерии и другие микроорганизмы, обладающие иммуногенными свойствами молекулы (прежде всего белки, а также полисахариды и даже некоторые простые вещества, если последние образуют комплексы с белками-носителями — гаптены[5]), трансплантаты или мутационно изменённые собственные клетки организма. Как отмечает В. Г. Галактионов, «иммунитет есть способ защиты организма от всех антигенно чужеродных веществ как экзогенной, так и эндогенной природы; биологический смысл подобной защиты — обеспечение генетической целостности особей вида в течение их индивидуальной жизни»[6]. Биологическим смыслом такой защиты является обеспечение генетической целостности особей вида на протяжении их индивидуальной жизни, так что иммунитет выступает как фактор стабильности онтогенеза[7].
Характерные признаки иммунной системы[8]:
- способность отличать «своё» от «чужого»;
- формирование памяти после первичного контакта с чужеродным антигенным материалом;
- клональная организация иммунокомпетентных клеток, при которой отдельный клеточный клон способен, как правило, реагировать лишь на одну из множества антигенных детерминант.
Классификации[править | править код]
Иммунная система исторически описывается состоящей из двух частей — системы гуморального иммунитета и системы клеточного иммунитета. В случае гуморального иммунитета защитные функции выполняют молекулы, находящиеся в плазме крови, а не клеточные элементы. В то время как в случае клеточного иммунитета защитная функция связана именно с клетками иммунной системы.
Иммунитет также классифицируют на врождённый и адаптивный.
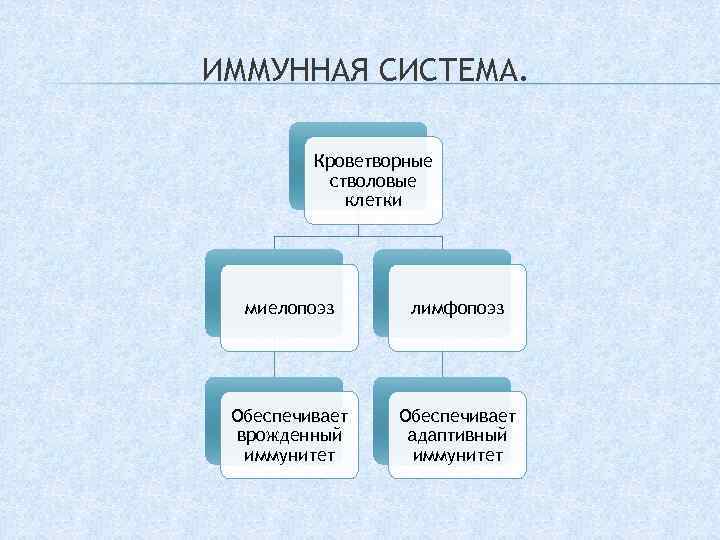
Врождённый (неспецифический, наследственный[9]) иммунитет обусловлен способностью идентифицировать и обезвреживать разнообразные патогены по наиболее консервативным, общим для них признакам, дальности эволюционного родства, до первой встречи с ними. В 2011 году была вручена Нобелевская премия в области медицины и физиологии за изучение новых механизмов работы врождённого иммунитета (Ральф Стайнман, Жюль Хоффман и Брюс Бётлер)[10].
Осуществляется большей частью клетками миелоидного ряда, не имеет строгой специфичности к антигенам, не имеет клонального ответа, не обладает памятью о первичном контакте с чужеродным агентом.
Адаптивный (устар. приобретённый, специфический) иммунитет имеет способность распознавать и реагировать на индивидуальные антигены, характеризуется клональным ответом, в реакцию вовлекаются лимфоидные клетки, имеется иммунологическая память, возможна аутоагрессия.
Классифицируют на активный и пассивный.
- Приобретённый активный иммунитет возникает после перенесённого заболевания или после введения вакцины.
- Приобретённый пассивный иммунитет развивается при введении в организм готовых антител в виде сыворотки или передаче их новорождённому с молозивом матери или внутриутробным способом.
Другая классификация разделяет иммунитет на естественный и искусственный.
- Естественный иммунитет включает врождённый иммунитет и приобретённый активный (после перенесённого заболевания), а также пассивный иммунитет при передаче антител ребёнку от матери.
- Искусственный иммунитет включает приобретённый активный после прививки (введение вакцины) и приобретённый пассивный (введение сыворотки).
Органы иммунной системы[править | править код]
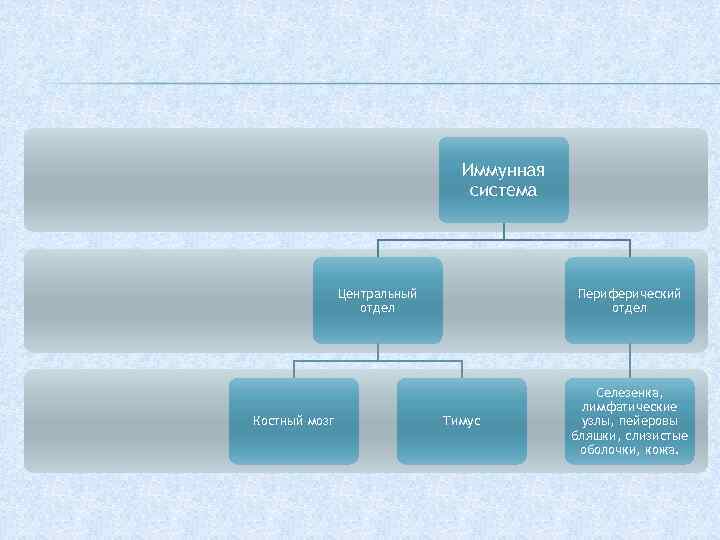
Выделяют центральные и периферические органы иммунной системы. К центральным органам относят красный костный мозг и тимус, а к периферическим — селезёнку, лимфатические узлы, а также местноассоциированную лимфоидную ткань: бронхассоциированную (БАЛТ), кожноассоциированную (КАЛТ), кишечноассоциированную (КиЛТ, пейеровы бляшки).
Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Тимус — центральный орган иммунной системы. В нём происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга.
Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из плотной соединительной ткани, которая содержит гладкомышечные клетки, позволяющие ей при необходимости сокращаться. Паренхима представлена двумя функционально различными зонами: белой и красной пульпой. Белая пульпа составляет 20 %, представлена лимфоидной тканью. Здесь имеются В-зависимые и Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %. Она выполняет следующие функции:
- Депонирование зрелых форменных элементов крови.
- Контроль состояния и разрушения старых и повреждённых эритроцитов и тромбоцитов.
- Фагоцитоз инородных частиц.
- Обеспечение дозревания лимфоидных клеток и превращение моноцитов в макрофаги.
Иммунокомпетентные клетки[править | править код]
К иммунокомпетентным клеткам относят макрофаги и лимфоциты. Эти клетки совместно участвуют в инициации и развитии всех звеньев адаптивного иммунного ответа (система трёхклеточной кооперации).
Клетки, участвующие в иммунном ответе[править | править код]
T-Лимфоциты[править | править код]
Субпопуляция лимфоцитов, отвечающая главным образом за клеточный иммунный ответ. Включает в себя субпопуляции Т-хелперов (дополнительно разделяются на Th1, Th2, а также выделяют Treg, Th9, Th17, Th22,), цитотоксических Т-лимфоцитов,NKT. Включает в себя эффектор, регуляторы и долгоживущие клетки-памяти. Функции разнообразны: как регуляторы и администраторы иммунного ответа (Т-хелперы), так и киллеры (цитотоксические Т-лимфоциты).
B-Лимфоциты[править | править код]
Субпопуляция лимфоцитов, синтезирующая антитела и отвечающая за гуморальный иммунный ответ.
Натуральные киллеры[править | править код]
Натуральные киллеры (NK-клетки) — субпопуляция лимфоцитов, обладающая цитотоксичной активностью, то есть они способны: контактировать с клетками-мишенями, секретировать токсичные для них белки, убивать их или отправлять в апоптоз. Натуральные киллеры распознают клетки, поражённые вирусами и опухолевые клетки.
Нейтрофилы[править | править код]
Нейтрофилы — это неделящиеся и короткоживущие клетки. Они составляют 65-70 % от гранулоцитов. Нейтрофилы содержат огромное количество антибиотических белков, которые содержатся в различных гранулах. К этим белкам относятся лизоцим (мурамидаза), липопероксидаза и другие антибиотические белки. Нейтрофилы способны самостоятельно мигрировать к месту нахождения антигена, так как у них есть рецепторы хемотаксиса (двигательная реакция на химическое вещество). Нейтрофилы способны «прилипать» к эндотелию сосудов и далее мигрировать через стенку к месту нахождения антигенов. Далее проходит фагический цикл, и нейтрофилы постепенно заполняются продуктами обмена. Далее они погибают и превращаются в клетки гноя.
Эозинофилы[править | править код]
Эозинофилы составляют 2—5 % от гранулоцитов. Способны фагоцитировать микробы и уничтожать их. Но это не является их главной функцией. Главным объектом эозинофилов являются гельминты. Эозинофилы узнают гельминтов и экзоцитируют в зону контакта вещества — перфорины. Эти белки встраиваются в билипидный слой клеток гельминта. В них образуются поры, внутрь клеток устремляется вода, и гельминт погибает от осмотического шока.
Базофилы[править | править код]
Базофилы составляют 0,5-1 % от гранулоцитов. Существуют две формы базофилов: собственно базофилы, циркулирующие в крови, и тучные клетки, находящиеся в ткани. Тучные клетки располагаются в различных тканях, лёгких, слизистых и вдоль сосудов. Они способны вырабатывать вещества, стимулирующие анафилаксию (расширение сосудов, сокращение гладких мышц, сужение бронхов). При этом происходит взаимодействие с иммуноглобулином Е (IgE). Таким образом они участвуют в аллергических реакциях. В частности, в реакциях немедленного типа.
Моноциты[править | править код]
Моноциты превращаются в макрофаги при переходе из кровеносной системы в ткани, существуют несколько видов макрофагов в зависимости от типа ткани, в которой они находятся, в том числе:
- Некоторые антигенпредставляющие клетки, в первую очередь дендритные клетки, роль которых — поглощение микробов и «представление» их Т-лимфоцитам.
- Клетки Купфера — специализированные макрофаги печени, являющиеся частью ретикулоэндотелиальной системы.
- Альвеолярные макрофаги — специализированные макрофаги лёгких.
- Остеокласты — костные макрофаги, гигантские многоядерные клетки позвоночных животных, удаляющие костную ткань посредством растворения минеральной составляющей и разрушения коллагена.
- Микроглия — специализированный класс глиальных клеток центральной нервной системы, которые являются фагоцитами, уничтожающими инфекционные агенты и разрушающими нервные клетки.
- Кишечные макрофаги и т. д.
Функции их разнообразны и включают в себя фагоцитоз, взаимодействие с адаптивной иммунной системой и инициацию и поддержание иммунного ответа, поддержание и регулирование процесса воспаления, взаимодействие с нейтрофилами и привлечение их в очаг воспаления, выделение цитокинов, регуляция репарации, регуляция процессов свертывания крови и проницаемости капилляров в очаге воспаления, синтез компонентов системы комплемента.
Макрофаги, нейтрофилы, эозинофилы, базофилы и натуральные киллеры обеспечивают прохождение врождённого иммунного ответа, который является неспецифичным (в патологии неспецифичный ответ на альтерацию называют воспалением, воспаление является неспецифической фазой последующих специфических иммунных).
Иммунно привилегированные области[править | править код]
В некоторых частях организма млекопитающих и человека появление чужеродных антигенов не вызывает иммунного ответа. К таким областям относятся мозг и глаза, семенники, эмбрион и плацента. Нарушение иммунных привилегий может становиться причиной аутоиммунных заболеваний.
Иммунные заболевания[править | править код]
Аутоиммунные заболевания[править | править код]
При нарушении иммунной толерантности или повреждении тканевых барьеров возможно развитие иммунных реакций на собственные клетки организма. Например, патологическая выработка антител к ацетилхолиновым рецепторам собственных мышечных клеток вызывает развитие миастении[11].
Иммунодефицит[править | править код]
См. также[править | править код]
- Иммунная система
- Врождённый иммунитет
- Приобретенный иммунитет
- Иммунотерапия рака
- Иммунитет растений
- Химера (биология)
Примечания[править | править код]
- ↑ ИММУНИТЕТ • Большая российская энциклопедия — электронная версия. bigenc.ru. Дата обращения 8 апреля 2020.
- ↑ Bickle T. A., Krüger D. H. Biology of DNA restriction // Microbiological Reviews. — 1993. — Vol. 57, no. 7. — P. 434—450. — PMID 8336674.
- ↑ Черешнев В.А. Черешнева М.В. Иммунологические механизмы локального воспаления. Медицинская иммунология 2011 т.13 №6 стр.557-568 РО РААКИ. cyberleninka.ru. Дата обращения 16 мая 2020.
- ↑ Travis J. On the Origin of the Immune System // Science. — 2009. — Vol. 324, no. 5927. — P. 580—582. — doi:10.1126/science.324_580. — PMID 19407173.
- ↑ Genetics of the Immune Response / Ed. by E. Möller and G. Möller. — New York: Plenum Press, 2013. — viii + 316 p. — (Nobel Foundation Symposia, vol. 55). — ISBN 978-1-4684-4469-8. — P. 262.
- ↑ Галактионов В.Г. Проблемы эволюционной иммунологии. cyberleninka.ru. Медицинская иммунология 2004 т.6 №3-5 РО РААКИ. Дата обращения 16 мая 2020.
- ↑ Галактионов, 2005, с. 8.
- ↑ Галактионов, 2005, с. 8, 12.
- ↑ Иммунитет // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2.
- ↑ Нобелевская премия по физиологии и медицине 2011 (англ.). www.nobelprize.org.
- ↑ Галактионов, 2005, с. 392.
Литература[править | править код]
- Галактионов В. Г. . Эволюционная иммунология. — М.: Академкнига, 2005. — 408 с. — ISBN 5-94628-103-8.
- Хаитов Р. М. . Иммунология. — М.: ГЕОТАР, 2006. — 320 с. — ISBN 978-5-9704-1288-6.
- Ярилин А. А. . Иммунология. — М.: ГЕОТАР, 2010. — 737 с. — ISBN 978-5-9704-1319-7.

ЧТО ТАКОЕ ИММУНИТЕТ? Иммунитет — это способность многоклеточных организмов поддерживать постоянство своего макромолекулярного состава путем удаления чужеродных молекул, что обеспечивает устойчивость к инфекционным агентам и резистентность к опухолям.
ИММУННАЯ СИСТЕМА. Кроветворные стволовые клетки миелопоэз лимфопоэз Обеспечивает врожденный иммунитет Обеспечивает адаптивный иммунитет
Иммунная система Центральный отдел Костный мозг Периферический отдел Тимус Селезенка, лимфатические узлы, пейеровы бляшки, слизистые оболочки, кожа.

МОЛЕКУЛЫ- МИШЕНИ ИММУНИТЕТА И РАСПОЗНАЮЩИЕ ИХ РЕЦЕПТОРЫ. Образы патогенности, или патогенассоциированные молекулярные паттерны- группы молекул, как правило, отсутствующие в организмехозяине, но характерные для патогенов (вирусов, бактерий, грибов, простейших, паразитов). Антигены — высокомолекулярные соединения, способные специфически стимулировать иммунокомпетентные лимфоидные клетки и обеспечивать тем самым развитие иммунного ответа. Стрессорные молекулы — собственные молекулы организма, экспрессируемые на мембране при клеточном стрессе и сигнализирующие преимущественно об опасности эндогенного происхождения. Они распознаются рецепторами некоторых разновидностей лимфоцитов (например, естественными киллерами).

Рецепторы, распознающие патогены – предназначены для распознования патогенассоциированных молекулярных паттентов. К этой группе относят мембранные и внутриклеточные толл-подобные рецепторы. Наибольшее количество и наиболее широкий спектр патогенраспознающих рецепторов экспрессируют миелоидные клетки врожденного иммунитета. Антигенраспознающие рецепторы представлены только на В- и Тлимфоцитах. Важная особенность этих рецепторов — гигантская вариабельность их антигенраспознающих доменов. Выделяют 3 разновидности антигенраспознающих рецепторов. — На В-клетках представлены В-клеточные рецепторы имеющие иммуноглобулиновую природу. — Т-клеточные рецепторы существуют в двух вариантах. По названию входящих в их состав полипептидных цепей, эти рецепторы обозначают как αβТ- клеточные рецепторы и γδT- клеточные рецепторы.
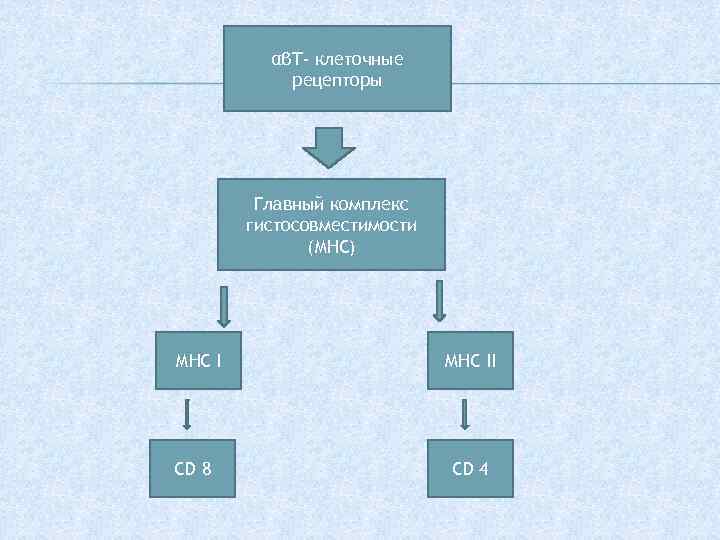
αβТ- клеточные рецепторы Главный комплекс гистосовместимости (МНС) МНС I CD 8 MHC II CD 4

РАСПОЗНАЮЩИЕ РЕЦЕПТОРЫ ПРОДОЛЖЕНИЕ… Рецепторы, распознающие стрессорные молекулы, представлены преимущественно на естественных киллерах (NK-клетках), однако их выявляют также на γδT-клетках, реже — на других субпопуляциях Тлимфоцитов. Естественные киллеры экспрессируют также группу рецепторов, распознающих молекулы MHC, независимо от связанного с ними антигенного пептида.

ИСТОРИЯ ОТКРЫТИЯ ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ. 1920 -1930 г. — первые описания первичных иммунодефицитов. 1950 г. — Э. Гланцман, П. Риникер описали аутосомно- рецесивный синдром с отсутствием лимфоцитов. 1952 г. — О. С. Брутон описал Х- сцепленную агаммаглобулинемию. 1999 г. — эксперты ESID (Европейское общество иммунодефицитных заболеваний) PAGID (Американская группа иммунодефицитов) систематизировали знания по первичным иммунодефицитам и сформировали лечебно- диагностические протоколы их ведения. Создание протоколов ведения и лечение ПИД. 2000 г. — расширение списка ПИД. 2003 г. — разработана классификация.

КЛАССИФИКАЦИЯ…. У АНИ…

ЭПИДЕМИОЛОГИЯ ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ. ПИД четко коррелируют 1) Уровень системы здравоохранения в государстве 2) Эффективность работы системы охраны материнства и детства т. е чем выше уровень оказания медицинской помощи, тем больше пациентов страдающих ПИД выявляется и наблюдается в стране. Распространенность ПИД обычно составляет 1: 10 — 100 тыс. новорожденных. Селективный дефицит Ig A- 1: 700 у европейской расы Х- сцепленная агаммаглобулинемия-1: 25 -50 тыс. новорожденных.

Х- СЦЕПЛЕННАЯ АГАММАГЛОБУЛИНЕМИЯ. Частота 1 -5: 1000000 Клинические критерии: — Рецидивирующие гнойно- восполительные инфекции преимущественно со 2 полугодия жизни у пациентов мужского пола — Рецидивирующие бактериальные инфекции бронхолегочной и верхних дыхательных путей — Инвазивные инфекции: сепсис, остеомиелит — Рецидивирующие гнойные инфекции кожи — Персистирующие вирусные (энтеровирусные), паразитарные (лямблиоз) инфекции — Гипоплазия лимфатических узлов, миндалин — Упорный диарейный синдром
ИММУНОЛОГИЧЕСКИЕ КРИТЕРИИ. Количество В- клеток

ЛЕЧЕНИЕ. Переливание в/в иммуноглобулинов: 2 раза в неделю в дозе 0, 1 -0, 2 г/кг веса больного в месячной дозе до 1, 2 г/кг веса больного. Затем 0, 1 -0, 2 г/кг 1 раз в месяц пожизненно. Поддерживающая антибактериальная терапия, при наличии частых рецидивов хронических очагов инфекции. Непрерывный курс АБ широкого спектра действия. Препаратом выбора является триметоприм/ сульфаметоксазол.
ПРОФИЛАКТИКА. Выявление дефектных генов у женщин- носительниц Пренатальная обследование у плодов мужского пола, выявляют наличие Влимфоцитов и дефектных генов.

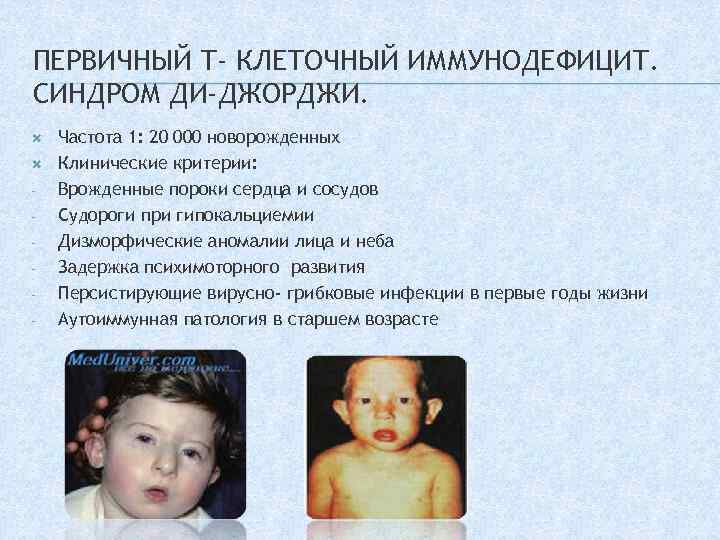
ПЕРВИЧНЫЙ Т- КЛЕТОЧНЫЙ ИММУНОДЕФИЦИТ. СИНДРОМ ДИ-ДЖОРДЖИ. — Частота 1: 20 000 новорожденных Клинические критерии: Врожденные пороки сердца и сосудов Судороги при гипокальциемии Дизморфические аномалии лица и неба Задержка психимоторного развития Персистирующие вирусно- грибковые инфекции в первые годы жизни Аутоиммунная патология в старшем возрасте
ЛАБОРАТОРНЫЕ КРИТЕРИИ. Лимфопения в общем анализе крови Снижение количества CD 3 (меньше 500 в мкл) Гипокальциемия на протяжении 3 недель и больше, которая требует проведения коррекции уровня кальция Делеция хромосомы 22 q 11. 2

ЛЕЧЕНИЕ. Коррекция гипокальциемии препаратами кальция и витамина Д Вторичная профилактика вирусных и грибковых инфекций Исключение из календаря вакцинации живых вакцин Профилактика не разработана
