Иммунитет как у слона
Риск онкологических заболеваний дамокловым мечом висит над многоклеточными организмами на протяжении всей их эволюции. Любая клетка может приобрести мутации, которые помогут ей выйти из-под контроля и дать начало злокачественной опухоли. Особенно остро эта проблема стоит перед большими животными — ведь в их организме больше клеток, выше и вероятность генетических ошибок. В этой статье мы поговорим о парадоксе Пето, а также о том, чему современные онкологи могут поучиться у слонов, китов и некоторых других млекопитающих.
Если посмотреть на многоклеточный организм глазами отдельных клеток (пофантазируем и представим, что у клеток есть глаза), мы получим государство, в котором царит довольно жесткий тоталитарный режим. Место и функции каждой клетки детерминированы многочисленными регуляторными механизмами. Каждый «гражданин» многоклеточного государства получает четкие указания, когда ему производить те или иные вещества, какие гены должны работать, а какие «молчать», когда размножаться, когда умирать.
Возможно, по отношению к отдельным клеткам это и жестоко. Но благодаря слаженной работе системы в целом организм довольно неплохо функционирует, приспосабливается к окружающей среде и даже успевает получать от жизни удовольствие.
Впрочем, как некогда заметил великий классик Иван Андреевич Крылов, в семье не без урода. В организме регулярно появляются клетки с генетическими дефектами. Многие из них становятся жертвой апоптоза, но некоторые таки выживают и начинают работать вне системы. По сути, в организме появляется одноклеточный паразит: он не считается с интересами соседей, смеется над регуляторными механизмами, успешно обманывает иммунную систему . Он быстро размножается и создает колонию себе подобных. С этой проблемой сталкиваются все многоклеточные организмы, и эволюционно они вынуждены были выработать некоторые механизмы защиты [1].
Размер не имеет значения?
Логично предположить, что частота мутаций должна увеличиваться пропорционально размерам тела животного (больше размер — больше клеток — чаще ошибки) и продолжительности жизни. Но на практике такой корреляции не наблюдается [5].
В 1977 году Ричард Пето, профессор медицинской статистики и эпидемиологии из Оксфордского университета, опубликовал работу под названием «Эпидемиология, многоступенчатые модели и краткосрочные тесты мутагенности» (Epidemiology, multistage models, and short-term mutagenicity tests), в которой писал:
У человека в 1000 раз больше клеток, чем у мыши…и мы обычно живем минимум в 30 раз дольше, чем мыши. Один организм должен подвергаться риску карциномы в 30 раз больше, чем другой, и это дало бы 304 или 306-кратный (то есть миллионы и миллиарды) риск злокачественного перерождения каждой эпителиальной клетки. Однако, похоже, вероятность возникновения карцином у мышей и у людей существенно не различается… Это биологически неправдоподобно; если человеческая ДНК не более устойчива к мутагенезу in vitro, чем ДНК мыши, почему мы не умираем от множественных карцином в пожилом возрасте?
Не менее странные закономерности можно обнаружить, если сравнивать человека с более крупными животными. Некоторые из них, например, слоны, страдают раком очень редко [7].
Это явление — отсутствие корреляции между размерами тела, продолжительностью жизни и риском онкологических заболеваний — было названо парадоксом Пето. Обычно два «фактора риска» имеют место одновременно: крупные животные живут дольше, чем мелкие. И это еще больше усложняет проблему (рис. 1) [1].
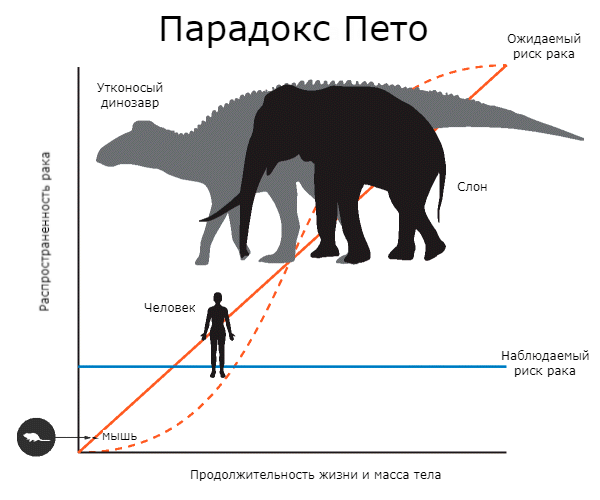
Рисунок 1. Суть парадокса Пето. Сплошная красная линия показывает, как должен расти риск рака в зависимости от продолжительности жизни и размеров тела животного. Пунктирная красная линия демонстрирует ожидаемую частоту рака. Синяя линия показывает, что на самом деле никакой корреляции не обнаруживается. Риск рака у человека в течение жизни составляет 11–25%, практически столько же — у мыши. У слона он намного ниже — всего 5%. Утконосые динозавры весили примерно как слоны, но они, видимо, были более восприимчивы к онкологическим заболеваниям и имели более короткую продолжительность жизни.
В пределах одного биологического вида «закон размеров и возраста» вполне себе работает. Так, известно, что люди более высокого роста страдают раком чаще, у них он протекает более агрессивно и чаще приводит к смерти. Винить в этом нужно не только количество клеток. Имеют значение и генетические факторы. Более 100 генов таких белков, как p53, c-Myc, ERα, HNF4A и SMAD, влияют не только на размеры тела, но и на риск рака [8], [9]. Сложно сказать, насколько большую лепту вносит общее количество клеток, тем не менее корреляция есть [1], [10].
Парадокс Пето представляет огромный интерес для онкологов. Знания о том, как крупные животные защищаются от рака, могут помочь в лечении и профилактике онкологических заболеваний у человека.
Не существует одного решения
Эволюция любит большие размеры: на протяжении многих миллионов лет она не раз создавала гигантов [11]. Великаны животного мира имеют много преимуществ: они успешнее защищаются от хищников, побеждают в битвах за половых партнеров, отбивают ресурсы у конкурентов, противостоят изменениям климата. Большие размеры тела независимо возникали в 10 из 11 отрядов млекопитающих [12], [13]. Существует даже специальный термин, который обозначает тенденцию к увеличению массы и роста — правило Коупа [11], [13].
Очевидно, для того чтобы пользоваться преимуществами больших размеров, животные должны были выработать защиту против «взбунтовавшихся» клеток. Существует ли универсальное решение этой проблемы? Нет. Парадокс Пето — уравнение с большим числом переменных, и, видимо, многие из них неизвестны [13].
Согласно выводам ученых из Института биоинформатики Вирджинии (Virginia Bioinformatics Institute, США) и Белостоцкого государственного университета (Uniwersytet w Białymstoku, Польша), клетки больших животных «неповоротливые»: они имеют более крупные размеры, реже делятся, в них замедлен обмен веществ. Это и защищает гигантов животного мира от онкологических заболеваний [15], [16]:
- Медленно размножающиеся клетки действуют по принципу «кто ничего не делает — тот не ошибается». Генетические дефекты, способные привести к злокачественному перерождению, возникают в клетке во время деления. Меньше делений — меньше рисков. Но в таких рассуждениях есть слабое место: ведь для того чтобы тело животного могло вырасти таким, как у китов, наоборот, требуется много клеточных делений. Значит, напротив, риск рака должен возрастать.
- В клетках крупных животных медленнее протекают обменные процессы, и это дает некоторые преимущества в плане защиты от рака. Например, образуется меньше «отходов» — свободных радикалов. Организму приходится тратить меньше ресурсов на различные функции, поэтому он может поддерживать нормальную работу иммунной системы, которая, в свою очередь, обеспечивает более надежную защиту от рака.
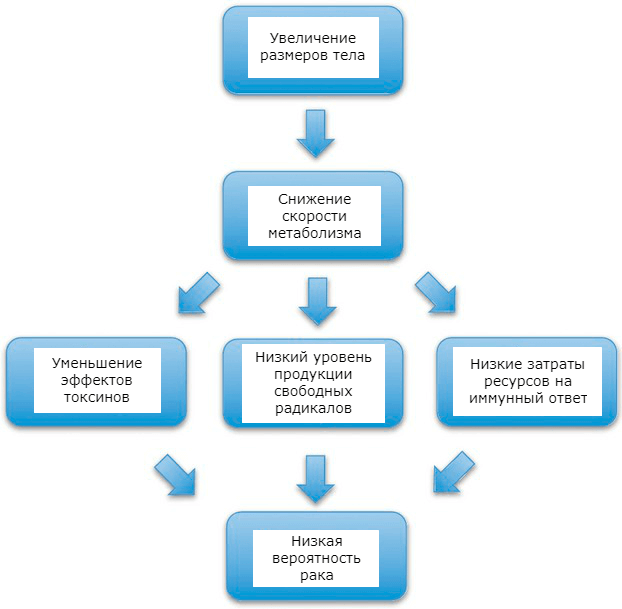
Рисунок 2. Механизмы влияния низкой скорости метаболизма на риск онкологических заболеваний
Есть интересная гипотеза, согласно которой внутри опухоли может возникать гиперопухоль (англ. hypertumor). Иными словами, это «опухоль опухоли», которая, предположительно, повреждает и разрушает первоначальное новообразование. Для того чтобы злокачественная опухоль могла причинить ощутимый вред крупному организму, она должна сама достигнуть достаточно больших размеров. А для этого нужно много времени — его как раз хватает для того, чтобы могла развиться гиперопухоль.
Если это предположение верно, то парадокса Пето не существует. Крупные животные могут болеть раком чаще, чем мелкие, но для них это не смертельно, благодаря гиперопухолям [5], [17]. Гипотеза гиперопухоли нуждается в экспериментальной проверке, пока еще не совсем понятно, может ли такое происходить в реальности, и если может — каким образом [26].
Существуют и другие гипотезы. Может быть, иммунная система крупных животных научилась успешнее обнаруживать и уничтожать «неправильные клетки». Может быть, в их клетках короче теломеры и сильно ограничено количество делений. Все это пока на уровне догадок [13], [18].
Впрочем, некоторые защитные механизмы голиафов животного мира ученым всё же известны.
Сорок стражей генома
Ключевую роль в защите от рака играет ген TP53, который кодирует белок p53 (рис. 3). Его называют «стражем генома». Мутация в гене TP53 обнаруживается при большинстве типов злокачественных опухолей у человека. Если «страж» перестает нормально работать, клетки становятся неуязвимы к апоптозу, усиливается их пролиферация, повышается нестабильность хромосом [18], [20].
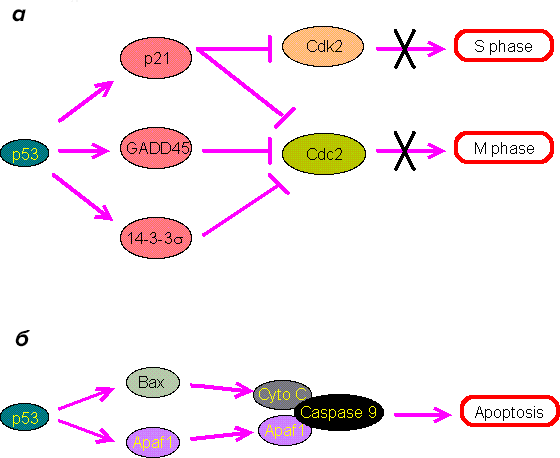
Рисунок 3. Роль белка p53 в остановке размножения клеток (а) и апоптозе (б)
В клетках человека ген TP53 представлен одной копией или двумя аллелями. Утрата хотя бы одного из них приводит к синдрому Ли-Фраумени. У людей с таким дефектом сильно повышен риск развития злокачественных опухолей: вероятность получить онкологическое заболевание в течение жизни составляет более 90% [20].
Два стражника — хорошо, а сорок — еще лучше. Именно столько аллелей гена TP53 обнаружено в клетках африканского слона. Причем, только два из них, как и у человека, «правильные». У остальных отсутствуют интроны. Это наводит на мысль о том, что добавочные копии гена возникли путем ретротранспозиции — явления, когда в ходе транскрипции образуется РНК, затем на ее матрице с участием обратной транскриптазы синтезируется ДНК, которая встраивается в новый локус [20], [21]. В геноме азиатских слонов обнаруживают от 15 до 20 таких копий (30–40 аллелей) [20].
В итоге слоновьи клетки с поврежденной ДНК в два раза сильнее склонны к апоптозу, чем клетки человека. Интересно, что эти животные пошли не по пути восстановления ДНК, а по пути p53-зависимого апоптоза. Возможно, именно этот механизм обеспечивает шансы заболеть раком в течение жизни менее 5%, в то время как у человека они составляют 11–25% [20]. Ну и кто тут теперь венец природы?
Вероятно, геном слонов таит и другие интересные особенности. Более активный апоптотический ответ, конечно, защищает от злокачественных опухолей, но он грозит потерей стволовых клеток, ранним старением. Нужны механизмы, которые помогали бы справиться с этой проблемой [18], [22].
Репарация по-гренландски
Слоны — самые крупные наземные животные в современном мире. Но им с их тремя тоннами не сравниться с абсолютными рекордсменами среди всех млекопитающих — китами. Так, гренландские киты в среднем весят сто тонн и могут жить до 211 лет . Такой размах требует более надежной противоопухолевой защиты. Однако секвенирование генома не выявило у морских гигантов дополнительных копий TP53 [22].
Механизмы противоопухолевой защиты у китообразных пока еще остаются загадкой, но кое-что уже известно, и есть некоторые предположения. Сравнительные геномные и транскриптомные исследования выявили у гренландского кита положительный отбор некоторых генов, влияющих на риск рака и процесс старения, а также специфические изменения в экспрессии генов, в частности, связанных с сигнальными путями инсулина.
Так, обнаружили положительный отбор генов ERCC1 (кодирует фермент, участвующий в эксцизионной репарации ДНК путем удаления нуклеотидов) и UCP1 (кодирует термогенин — разобщающий белок, который присутствует в митохондриях бурой жировой ткани и участвует в продукции тепла у маленьких детей и животных, впадающих в спячку), а также дублирование гена PCNA, кодирующего ядерный антиген пролиферирующих клеток, который повышает процессивность (способность осуществлять химические реакции) репарационной ДНК-полимеразы дельта.
Напрашивается вывод о том, что в клетках гренландского кита работают мощные механизмы репарации ДНК. Возможно, именно они защищают самое крупное млекопитающее от рака. В дополнительных копиях TP53 попросту нет необходимости. Но пока это лишь предположения [22].
Мышиная жизнь утконосых динозавров
Онкологические заболевания — не самая большая проблема, с которой приходится сталкиваться мелким животным. Они чаще погибают в зубах хищников, из-за наводнений и прочих прихотей природы. Лишь везунчики доживают до преклонного по мышиным меркам возраста, когда, наконец, можно заболеть раком. Эволюция решила, что мощные механизмы противоопухолевой защиты таким животным не нужны. Их организм тратит энергию и ресурсы на другие процессы [13].
То ли дело крупные животные — те же слоны. Они медленно растут, нескоро достигают половой зрелости и оставляют не так много потомков — а ведь их еще нужно вырастить и защитить от хищников. С соперниками наиболее успешно конкурируют самые крупные особи, а до таких размеров еще надо дорасти, на что уходят десятилетия. В этих условиях развитие механизмов противоопухолевой защиты приобретает особое значение.
Но обратимся к другим крупным животным — динозаврам. Известно, что потомки гигантских ящеров — птицы — страдают раком, а значит, с аналогичной проблемой сталкивались и далекие прапрадедушки из мезозоя. Это подтверждается палеонтологическими находками. Например, в позвонках эдмонтозавров, относящихся к группе утконосых динозавров (гадрозавров), обнаружили признаки гемангиомы, метастатического рака, десмопластической фибромы и остеобластомы. При этом ученые не отрицают семейный характер онкологических заболеваний у гигантских ящеров, влияние наследственной предрасположенности и генетических мутаций [13], [24].
У других динозавров рак тоже встречался, но утконосые, видимо, болели намного чаще. Тем не менее это не помешало гадрозаврам существовать как роду в течение достаточно долгого времени. Каким образом эволюции удалось создать такое исключение из парадокса Пето? Ученые считают, что гадрозавры, несмотря на крупные размеры, частично пошли по «мышиному пути». Они откладывали много яиц, достигали скелетной зрелости всего за 8 лет, а после этого быстро старели. Возможно, из-за быстрого размножения и короткой продолжительности жизни утконосые так и не выработали специальных механизмов противоопухолевой защиты, в то время как у других динозавров они все же появились [13].
Интересный факт: в то время как утконосые гиганты, видимо, пошли по «мышиному пути», среди мелких животных нашлись такие, которые, подобно гигантам, обзавелись мощными механизмами противоопухолевой защиты. Самый знаменитый пример — голый землекоп. Длина этих животных всего 8–10 см, но живут они по меркам грызунов долго — до 30 лет. В геноме их стволовых клеток выявлен активный продолжительный синтез одного из продуктов локуса INK4 — Arf, — и «молчание» гена ERas, фактора онкогенности мышиных стволовых клеток. Эти гены связаны с сигнальными путями, которые влияют на продолжительность жизни и, видимо, обеспечивают защиту от рака [9].
Непраздный интерес
Ученые исследуют механизмы противоопухолевой защиты у разных животных отнюдь не из пустого любопытства. Онкологические заболевания ежегодно убивают миллионы людей. За последние десятилетия технологии шагнули далеко вперед, но до полной победы над раком пока еще очень далеко — если она вообще возможна .
Защитные механизмы животных потенциально можно воспроизвести на людях. Это открывает возможности для создания новых лекарств, которые помогут в лечении и профилактике рака.
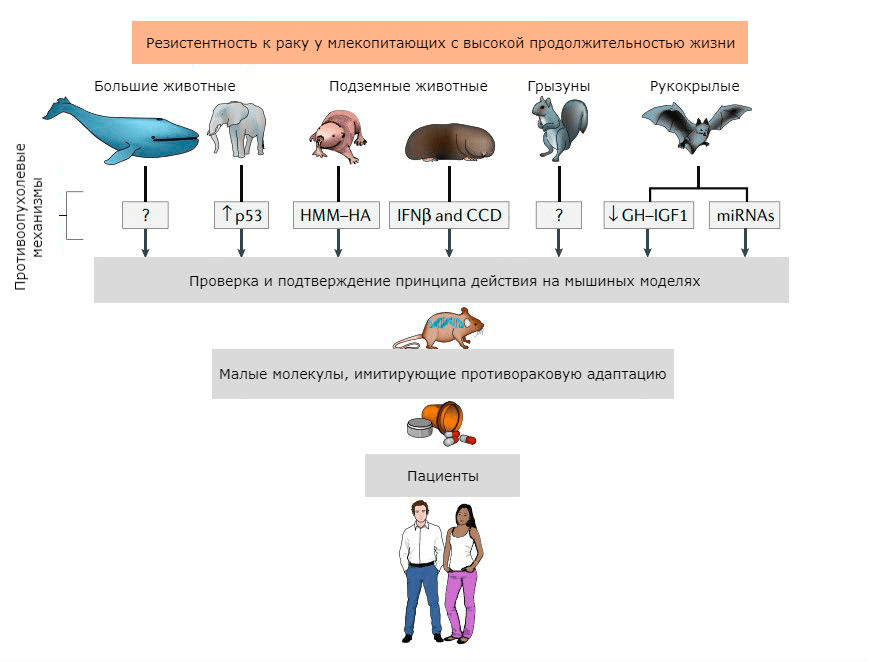
Нам есть чему поучиться не только у гигантов. На рисунке 4 показаны животные, которые наиболее успешно защищаются от рака, и молекулярные механизмы, которые, возможно, в будущем найдут применение в клинической практике.

Рисунок 4. Механизмы противоопухолевой защиты у разных млекопитающих и возможное их практическое применение. Сокращения: HMM-HA — высокомолекулярная гиалуроновая кислота, которая активирует синтез Arf; IFNβ — интерферон-β; CCD — согласованная гибель клеток, опосредованная интерфероном; GH–IGF1 — сигнальный путь гормон роста — инсулиноподобный фактор роста 1; miRNAs — микроРНК.
В этой «Басне о слоне, ките и раке» есть много пробелов. Несмотря на многочисленные догадки, окончательного ответа на вопрос «Как защищаются от рака киты?» нет. Существуют и такие крупные млекопитающие, как моржи и бегемоты. Помимо млекопитающих, до наших дней дожили крокодилы, акулы и другие большие животные. В качестве долгожителей прославились слоновые черепахи, а еще есть моллюски Arctica islandica, один из которых прожил целых 507 лет. Вероятно, всем этим животным тоже приходится противостоять раку, но об их механизмах защиты ничего не известно. Кто знает, может быть, и слоны еще преподнесут сюрпризы, помимо сорока стражей генома. Тем интереснее продолжить поиски новых решений парадокса Пето.
- Benjamin Roche, Michael E Hochberg, Aleah F Caulin, Carlo C Maley, Robert A Gatenby, et. al.. (2012). Natural resistance to cancers: a Darwinian hypothesis to explain Peto’s paradox. BMC Cancer. 12;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Метастазирование опухолей;
- J. D. Nagy, E. M. Victor, J. H. Cropper. (2007). Why don’t all whales have cancer? A novel hypothesis resolving Peto’s paradox. Integrative and Comparative Biology. 47, 317-328;
- Richard Peto. (2016). Epidemiology, multistage models, and short-term mutagenicity tests. Int. J. Epidemiol.. 45, 621-637;
- Aleah F. Caulin, Carlo C. Maley. (2011). Peto’s Paradox: evolution’s prescription for cancer prevention. Trends in Ecology & Evolution. 26, 175-182;
- Romina Tripaldi, Liborio Stuppia, Saverio Alberti. (2013). Human height genes and cancer. Biochimica et Biophysica Acta (BBA) — Reviews on Cancer. 1836, 27-41;
- Голый землекоп и рак: кто кого?;
- Sara Wirén, Christel Häggström, Hanno Ulmer, Jonas Manjer, Tone Bjørge, et. al.. (2014). Pooled cohort study on height and risk of cancer and cancer death. Cancer Causes Control. 25, 151-159;
- Joel G. Kingsolver, David W. Pfennig. (2004). INDIVIDUAL-LEVEL SELECTION AS A CAUSE OF COPE’S RULE OF PHYLETIC SIZE INCREASE. Evolution. 58, 1608-1612;
- Joanna Baker, Andrew Meade, Mark Pagel, Chris Venditti. (2015). Adaptive evolution toward larger size in mammals. Proc Natl Acad Sci USA. 112, 5093-5098;
- Marc Tollis, Amy M. Boddy, Carlo C. Maley. (2017). Peto’s Paradox: how has evolution solved the problem of cancer prevention?. BMC Biol. 15;
- Морские животные в ходе эволюции становятся крупнее;
- Sebastian Maciak, Pawel Michalak. (2015). Cell size and cancer: a new solution to Peto’s paradox?. Evol Appl. 8, 2-8;
- Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить;
- J NAGY. (2004). Competition and natural selection in a mathematical model of cancer. Bulletin of Mathematical Biology. 66, 663-687;
- Старение — плата за подавление раковых опухолей?;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Lisa M. Abegglen, Aleah F. Caulin, Ashley Chan, Kristy Lee, Rosann Robinson, et. al.. (2015). Potential Mechanisms for Cancer Resistance in Elephants and Comparative Cellular Response to DNA Damage in Humans. JAMA. 314, 1850;
- Stephen J Gaughran, Evlyn Pless, Stephen C Stearns. (2016). How elephants beat cancer. eLife. 5;
- Andrei Seluanov, Vadim N. Gladyshev, Jan Vijg, Vera Gorbunova. (2018). Mechanisms of cancer resistance in long-lived mammals. Nat Rev Cancer;
- Древний, как акула: в арктических водах нашли рыбу возрастом 400 лет;
- B. M. Rothschild, D. H. Tanke, M. Helbling, L. D. Martin. (2003). Epidemiologic study of tumors in dinosaurs. Naturwissenschaften. 90, 495-500;
- Нерешаемые проблемы биологии: нельзя создать два одинаковых организма, нельзя победить рак, нельзя картировать организм на геном;
- Andriy Marusyk, Doris P. Tabassum, Philipp M. Altrock, Vanessa Almendro, Franziska Michor, Kornelia Polyak. (2014). Non-cell-autonomous driving of tumour growth supports sub-clonal heterogeneity. Nature. 514, 54-58.
