Иммунитет после чумы людей
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 января 2020;
проверки требуют 4 правки.
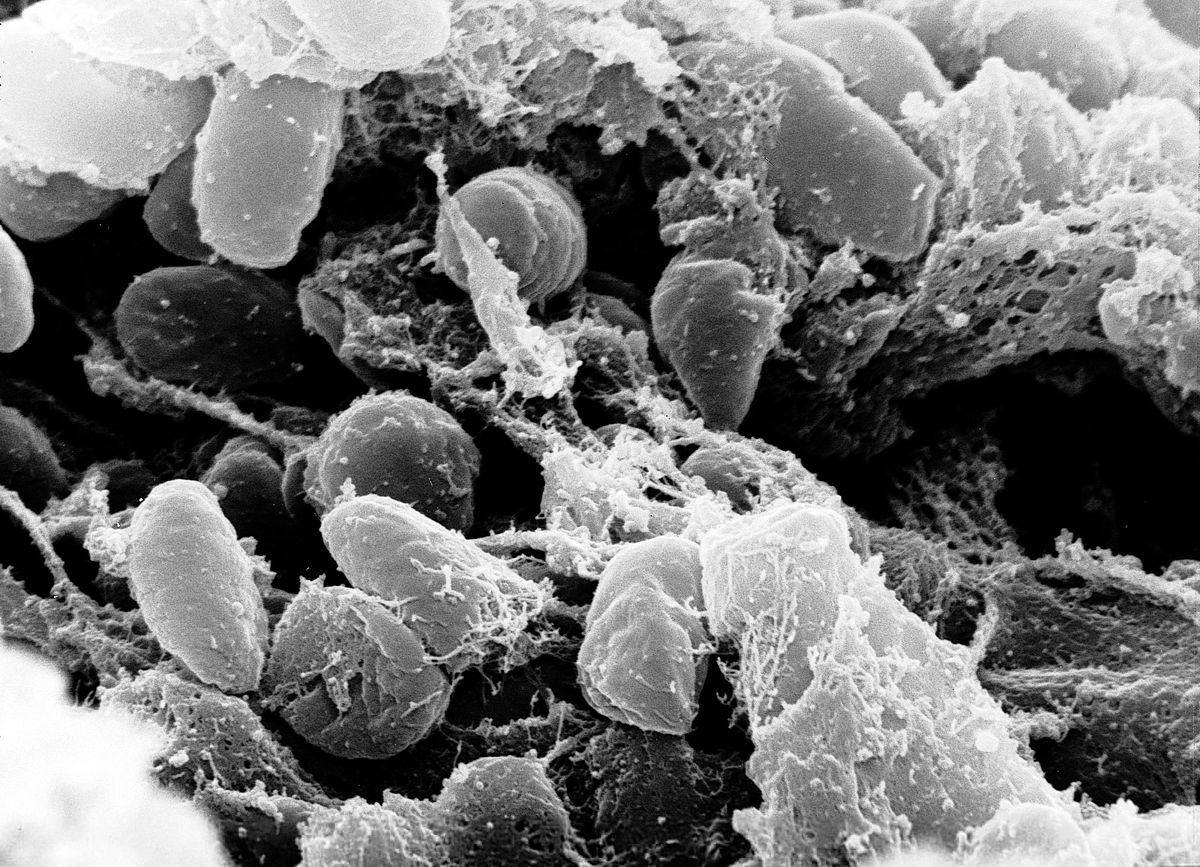
Чумна́я па́лочка (лат. Yersinia pestis) — вид грамотрицательных бактерий из семейства Yersiniaceae порядка Enterobacterales.
Инфекционный агент бубонной чумы, также может вызывать чумную пневмонию и септическую чуму. Все три формы ответственны за высокий уровень смертности в эпидемиях, имевших место в истории человечества, например таких как «Юстинианова чума» (100 миллионов жертв) и «Чёрная смерть», на которой — смерть трети населения Европы за промежуток с 1347 по 1353 годы.
Роль Yersinia pestis в «Чёрной смерти» дискутируется. Некоторые утверждают, что «Чёрная смерть» распространилась слишком быстро, чтобы быть вызванной Yersinia pestis[2]. ДНК этой бактерии найдены в зубах умерших от «Чёрной смерти», тогда как тестирование средневековых останков людей, умерших по другим причинам, не дало положительной реакции на Yersinia pestis[3][4]. Это доказывает, что Yersinia pestis является как минимум сопутствующим фактором в некоторых (возможно, не во всех) европейских эпидемиях чумы. Возможно, что устроенный чумой отбор мог повлиять на патогенность бактерии, отсеяв индивидуумов, которые были наиболее ей подвержены. По последним исследованиям «Юстинианова чума» была вызвана сразу несколькими штаммами бактерии, а не одной разновидностью[5].
Род Yersinia — грамотрицательные, биполярные коккобациллы размером примерно 1.5 микрона. Обладают ферментативным метаболизмом. Y. pestis производит антифагоцитарную слизь. Подвижная в культуре бактерия становится неподвижной, попав в организм млекопитающего.
История[править | править код]
Бубонная чума. Изображение 1411 года
Y. pestis была открыта в 1894 году швейцарско-французским медиком и бактериологом Пастеровского института Александром Йерсеном во время эпидемии чумы в Гонконге. Йерсен был сторонником школы Пастера. Прошедший подготовку в Германии японский бактериолог Китасато Сибасабуро, практиковавший метод Коха, также в это время был привлечён к поискам агента, являющегося возбудителем чумы. Однако именно Йерсен фактически связал чуму с Y. pestis. Долгое время возбудителя чумы относили к роду Bacterium, позже — к роду Pasteurella. В 1967 году род бактерий, к которому относился возбудитель чумы, был переименован в честь Александра Йерсена.
В результате сравнения древних штаммов генов Yersinia pestis и её вероятного предка Yersinia pseudotuberculosis (псевдотуберкулезная палочка) было выявлено, что Yersinia pestis мутировала из сравнительно безвредного микроорганизма около 10 тысяч лет назад. Выяснилось, что обитающая в почве Y. pseudotuberculosis, вызывающая легкое заболевание желудочно-кишечного тракта, приобрела тогда несколько генов, позволивших ей проникать в легкие человека. Далее, в ключевом гене Pla произошла замена одной аминокислоты, в результате чего микроорганизм смог с повышенной силой разлагать белковые молекулы в легких и размножаться по всему организму через лимфатическую систему.
Исследователи подозревают, что ген Pla чумная палочка позаимствовала у другого микроба в результате горизонтального обмена генами[6][7]. Это подтверждают и исследования датских и британских ученых, которые провели исследования молекул ДНК, извлеченных из зубов 101 человека бронзового века, обнаруженных на территории Евразии (от Польши до Сибири). Следы бактерии Y. pestis нашли в ДНК семерых, возрастом до 5783 лет, при этом в шести из этих образцов отсутствовали «ген вирулентности» ymt и мутации в «гене активации» pla. В дальнейшем, на рубеже второго и первого тысячелетия до нашей эры, из-за демографических условий, выразившихся в увеличении плотности населения, возникла более летальная «бубонная» мутация бактерии[8][9].
Известны три биовара бактерии; полагают, что каждый соответствует одной из исторических пандемий чумы. Биовар antiqua считают ответственным за «Юстинианову чуму». Неизвестно, был ли этот биовар причиной более ранних, меньших эпидемий, или же эти случаи вообще не были эпидемиями чумы. Биовар medievalis полагают связанным с «Чёрной смертью». Биовар orientalis связывают с Третьей пандемией и большинством современных вспышек чумы.
В настоящее время только в России с 2001 по 2006 год зафиксировано 752 штамма возбудителя чумы[10].
Патогенность и иммунитет[править | править код]
Патогенность Yersinia pestis заключается в двух антифагоцитарных антигенах, называемых F1 и VW, оба существенны для вирулентности[11]. Эти антигены производятся бактерией при температуре 37 °C. Кроме этого, Y. pestis выживает и производит F1 и VW антигены внутри кровяных клеток, таких, например, как моноциты, исключением являются полиморфно-ядерные нейтрофильные гранулоциты[12].
Некоторое время назад в США инактивированная формалином вакцина была доступна для взрослых, находящихся под большим риском заражения, однако затем продажи были прекращены по указанию FDA, специального агентства министерства здравоохранения США, по причине низкой эффективности и вероятности серьёзного воспаления. Ведутся перспективные эксперименты в генной инженерии по созданию вакцины, основанной на антигенах F1 и VW, хотя бактерии не имеющие антигена F1 сохраняют достаточную вирулентность, а антигены V достаточно изменчивы, так что вакцинация, основанная на этих антигенах может не давать достаточно полной защиты[13].
В России доступна живая вакцина на основе невирулентного штамма чумы[14].
Вакцинация не защищает от легочной чумы. Во время эпидемии 1910—1911 года применение прочумных сывороток (лимфы Хавкина и сыворотки Йерсена) лишь продлевало течение болезни на несколько дней, но не спасло жизнь ни одному больному[15]. Впоследствии ученым окончательно стало ясно, что гуморальный иммунитет при аэрогенном инфицировании возбудителем чумы значения не имеет[16].
После перенесенного заболевания остается прочный продолжительный иммунитет.[17]
Геном[править | править код]
Доступны полные генетические последовательности для различных подвидов бактерии: штамма KIM (из биовара Medievalis)[18], штамма CO92 (из биовара Orientalis, полученного из клинического изолятора в США)[19], штамма Antiqua, Nepal516, Pestoides F. Хромосомы штамма KIM состоят из 4 600 755 парных оснований, в штамме CO92 — 4 653 728 парных оснований. Как и родственные Y. pseudotuberculosis и Y. enterocolitica, бактерия Y. pestis содержит плазмиды pCD1. Вдобавок, она также содержит плазмиды pPCP1 и pMT1, которых нет у других видов рода Yersinia. Перечисленные плазмиды и остров патогенности, названный HPI, кодируют белки, которые и являются причиной патогенности бактерии. Помимо всего прочего эти вирулентные факторы требуются для бактериальной адгезии и инъекции белков в клетку «хозяина», вторжения бактерии в клетку-хозяина, захвата и связывания железа, добытого из эритроцитов.
Древняя ДНК[править | править код]
В 2018 году в останках женщины из шведского местонахождения Frälsegården, умершей около 4900 лет назад (неолит) была обнаружена ДНК Yersinia pestis. Геном штамма из шведского захоронения выделился около 5700 лет назад, две ветви существующих сегодня штаммов Y. pestis выделились 5100 и 5300 лет назад[20].
ДНК Yersinia pestis найдена в останках двух человек из Самарской области, связанных со срубной культурой (около 3800 лет назад) и в останках человека из Капана (Армения), жившего в железном веке около 2900 лет назад[21].
Лечение[править | править код]
С 1947 года традиционным средством первого этапа лечения от Y. pestis были стрептомицин[22][23], хлорамфеникол или тетрациклин[24]. Также есть свидетельства положительного результата от использования доксициклина или гентамицина[25].
Надо заметить, что выделены штаммы, устойчивые к одному или двум перечисленным выше агентам и лечение по возможности должно исходить из их восприимчивости к антибиотикам. Для некоторых пациентов одного лишь лечения антибиотиками недостаточно, и может потребоваться поддержка кровоснабжения, дыхательная или почечная поддержка.
Примечания[править | править код]
- ↑ Genus Yersinia : [англ.] // LPSN[en]. (Проверено 9 декабря 2018).
- ↑ Ал Бухбиндер. Между чумой и эболой Архивная копия от 11 января 2018 на Wayback Machine — в статье, напечатанной в журнале «Знание—Сила» № 2 за 2002 год приводятся размышления, критикующие связь бактерии с чумой.
- ↑ Drancourt M., Aboudharam G., Signolidagger M., Dutourdagger O., Raoult D. Detection of 400-year-old Yersinia pestis DNA in human dental pulp: An approach to the diagnosis of ancient septicemia (англ.) // Proceedings of the National Academy of Sciences : journal. — National Academy of Sciences, 1998. — Vol. 95, no. 21. — P. 12637—12640.
- ↑ Drancourt M., Raoult D. Molecular insights into the history of plague (неопр.) // Microbes Infect.. — 2002. — Т. 4. — С. 105—109.
- ↑ Researchers discover bacterial diversity in Justinianic Plague. Дата обращения 6 июня 2019.
- ↑ Чума возникла благодаря случайной мутации. Lenta.ru. Дата обращения 23 октября 2015.
- ↑ Daniel L. Zimbler, Jay A. Schroeder, Justin L. Eddy & Wyndham W. Lathem. Early emergence of Yersinia pestis as a severe respiratory pathogen. nature.com. Дата обращения 13 февраля 2016.
- ↑ Древняя форма чумы оказалась неизвестным виновником катастроф бронзового века. Lenta.ru. Дата обращения 23 октября 2015.
- ↑ Simon Rasmussen. Early Divergent Strains of Yersinia pestis in Eurasia 5,000 Years Ago. cell.com. Дата обращения 13 февраля 2016.
- ↑ Приказ территориального управления Роспотребнадзора по МО от 02.05.2006 N 100 «Об организации и проведении мероприятий по профилактике чумы на территории Московской области»
- ↑ Collins F. M. Pasteurella, Yersinia, and Francisella. In: Barron’s Medical Microbiology (Barron S et al, eds.) (неопр.). — 4th ed.. — Univ of Texas Medical Branch, 1996.
- ↑ Salyers A. A., Whitt D. D. Bacterial Pathogenesis: A Molecular Approach (англ.). — 2nd ed.. — ASM Press (англ.)русск., 2002. — P. 207—212.
- ↑ Welkos S . et al. Determination of the virulence of the pigmentation-deficient and pigmentation-/plasminogen activator-deficient strains of Yersinia pestis in non-human primate and mouse models of pneumonic plague (англ.) // Vaccine (англ.)русск. : journal. — Elsevier, 2002. — Vol. 20. — P. 2206—2214.
- ↑ Вакцина чумная живая сухая (Vaccine plague).
- ↑ Супотницкий М. В., Супотницкая Н. С. Очерки истории чумы. Очерк XXXI. Эпидемия легочной чумы в Манжурии и забайкалье (1910—1911). — 2006.
- ↑ Супотницкий М. В., Супотницкая Н. С. Очерки истории чумы. Очерк XXXV. Эпидемии чумы в Маньчжурии в 1945—1947 гг. — перелом в лечении и в профилактике чумы. — 2006.
- ↑ «Профилактика чумы» Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека — федеральная служба Российской Федерации
- ↑ Deng W. et al. Genome Sequence of Yersinia pestis KIM (англ.) // American Society for Microbiology (англ.)русск.. — American Society for Microbiology (англ.)русск., 2002. — Vol. 184, no. 16. — P. 4601—4611.
- ↑ Parkhill J . et al. Genome sequence of Yersinia pestis, the causative agent of plague (англ.) // Nature : journal. — 2001. — Vol. 413. — P. 523—527.
- ↑ Nicolás Rascovan et al. Emergence and Spread of Basal Lineages of Yersinia pestis during the Neolithic Decline, 2018
- ↑ Derbise, A; Chenal-Francisque, V; Pouillot, F; Fayolle, C; Prévost, MC; Médigue, C; Hinnebusch, BJ; Carniel, E. A horizontally acquired filamentous phage contributes to the pathogenicity of the plague bacillus (англ.) // Mol Microbiol : journal. — 2007. — Vol. 63, no. 4. — P. 1145—1157. — doi:10.1111/j.1365-2958.2006.05570.x. — PMID 17238929.
- ↑ Wagle PM. Recent advances in the treatment of bubonic plague (неопр.) // Indian J Med Sci. — 1948. — Т. 2. — С. 489—494.
- ↑ Meyer KF. Modern therapy of plague (англ.) // JAMA. — 1950. — Vol. 144. — P. 982—985.
- ↑ Kilonzo B.S., Makundi R.H., Mbise TJ. A decade of plague epidemiology and control in the Western Usambara mountains, north-east Tanzania (англ.) // Acta Tropica : journal. — 1992. — Vol. 50. — P. 323—329.
- ↑ Mwengee W., Butler T., Mgema S., et al. Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania (англ.) // Clin Infect Dis : journal. — 2006. — Vol. 42. — P. 614—621.
Литература[править | править код]
- Козлов М. П. Чума (природная очаговость, эпизоотология, эпидемические проявления). — М.: Медицина, 1979. — 192 с.
- Кошель Елена Ивановна. Образование биопленки штаммами Yersinia pestis разных подвидов и их взаимодействие с членами почвенных биоценозов : Автореферат диссертации на соискание учёной степени кандидата биологических наук. — Саратов, 2014. — 22 с.
- Кутырев В. В.; Ерошенко Г. А.; Попов Н. В.; Видяева Н. А.; Коннов Н. П. Молекулярные механизмы взаимодействия возбудителя чумы с беспозвоночными животными // Молекулярная генетика, микробиология и вирусология. — 2009. — № 4. — С. 6—13 : 6 рис. — Библиогр.: с. 12—13 (39 назв.). — ISSN 0208-0613.
Ссылки[править | править код]
- Сложный паразитарный биоценоз: молекулярно-генетические основы взаимодействия возбудителя чумы с организмами хладнокровных и теплокровных животных.
- Молекулярные основы экологии возбудителя чумы.
https://ria.ru/20190603/1555180659.html
Почему чуму не удается полностью уничтожить
Российские ученые разрабатывают синтетические вакцины нового поколения против чумного микроба. Эту смертельно опасную инфекцию считают возрождающейся. Ее… РИА Новости, 03.06.2019
2019-06-03T08:00
2019-06-03T16:36
гонконг
республика алтай
риа наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn21.img.ria.ru/images/155520/71/1555207124_0:0:1024:576_1400x0_80_0_0_168ca11b0fc5d71a47ea61c056a7e457.jpg
https://ria.ru/20180609/1522414913.html
https://ria.ru/20190528/1554982872.html
https://ria.ru/20180320/1516791545.html
гонконг
республика алтай
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn21.img.ria.ru/images/155520/71/1555207124_0:0:1024:576_1400x0_80_0_0_168ca11b0fc5d71a47ea61c056a7e457.jpg
https://cdn25.img.ria.ru/images/155520/72/1555207293_0:0:1024:768_1400x0_80_0_0_84c98ba458b5c9908f5d2055771224ab.jpg
https://cdn22.img.ria.ru/images/155513/63/1555136369_252:0:900:648_1400x0_80_0_0_850842934b45d0ffc5f37ee9a5b26bc1.jpg
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
гонконг, республика алтай
08:00 03.06.2019 (обновлено: 16:36 03.06.2019)
МОСКВА, 3 июн — РИА Новости, Татьяна Пичугина. Российские ученые разрабатывают синтетические вакцины нового поколения против чумного микроба. Эту смертельно опасную инфекцию считают возрождающейся. Ее спорадические вспышки случаются в разных уголках мира, 45 природных очагов чумы расположены на территории СНГ. В чем причина живучести «черной смерти» — в материале РИА Новости.
Микроб из крысиных нор
Чума известна с глубокой древности. Подсчитано, что эта смертельная болезнь, очень быстро распространяющаяся среди людей, унесла жизни более двухсот миллионов человек. Во время третьей пандемии в 1894 году в Гонконге французский бактериолог Александр Йерсен выявил возбудителя — бактерию, позже названую Yersinia pestis. Чуму так и не удалось уничтожить полностью, в отличие, например, от черной оспы. Вспышки и отдельные случаи заражения по-прежнему фиксируются в Старом и Новом Свете.
Чумной микроб циркулирует в популяциях норовых грызунов — сурков, сусликов, песчанок, полевок, крыс и паразитирующих на них блох. Блоха заражается, когда пьет кровь больного животного. Пища поступает в преджелудок, где микроб размножается и создает пробку. Присосавшись к другой теплокровной особи, блоха срыгивает часть содержимого блокированного преджелудка со смытыми с пробки бактериями прямо в кровоток. Происходит заражение.
Человек может получить инфекцию от блох, грызунов, домашних и сельскохозяйственных животных. В степных и пустынных регионах распространена чума верблюдов: иногда люди заболевают, разделывая тушу больного животного. В России бывали случаи заражения охотников на сурков.
Попав в организм теплокровного хозяина, чумной микроб встречается с клетками иммунной системы — фагоцитами. Их задача — обнаружить опасность и удалить из организма. Для этого они буквально проглатывают чужеродные элементы.
Однако чумной микроб слишком хорошо защищен: он производит множество факторов патогенности — молекул, блокирующих попытки иммунной системы теплокровного хозяина его уничтожить, быстро размножается и разрывает фагоцит. Наружу он выходит в толстой белковой капсуле, защищающей его от клеток иммунной системы.
С кровотоком микроб стремительно распространяется по всему организму. При легочной форме, когда заражение произошло через дыхательные пути, смерть наступает в течение суток или даже нескольких часов.
При бубонной форме инфекция задерживается в лимфатических узлах, они увеличиваются, прорываются гноем. Если вовремя начать лечение антибиотиками, то прогноз благоприятный.
Сколько живет бацилла
Согласно палеогенетическим данным, люди болели чумой уже в третьем тысячелетии до нашей эры. Ученые находят ДНК этой бактерии в пульпе зубов человеческих останков. Но сам микроб уже не опасен.
Он живет в костных останках не больше полутора лет. В отличие от сибиреязвенного микроба, способного сохранять активность в останках или почве столетиями, чумной не образует споры. На воздухе и при кипячении он быстро погибает. Какое-то время может быть активным на холоде. Это выяснилось во время эпидемии в Манчжурии в 1910-1911 годах: на улицах зимой было много трупов.
Сейчас эпидемии чумы маловероятны, поскольку вспышки гасят в зародыше, соблюдая карантин, изолируя больных, не допуская их контактов со здоровыми.
В России ситуация с чумой благополучная, в отличие от Индии или Мадагаскара. В 2012 году опасный подвид чумного микроба выделили на Алтае в нескольких километрах от границы с Монголией. Это, видимо, послужило причиной единичных случаев заражения людей в Кош-Агачском районе республики в 2014-2016 годах.
Арсенал убийцы
Что делает из человека маньяка-убийцу? Наследственность или окружающая среда? Однозначного ответа нет. Так и с чумным микробом. Почему один из его штаммов столь опасен? Научное сообщество надеялось это узнать благодаря расшифровке генома — в 2001 году. Однако вопрос остается дискуссионным по сей день.
Сейчас считается доказанным, что чумная бактерия генетически родственна псевдотуберкулезной. Они разделились, вероятно, несколько десятков тысяч лет назад.
Несмотря на почти полное сходство геномов, действуют эти бактерии по-разному. Псевдотуберкулез распространяется через пищу и вызывает острые воспаления, проблемы с кишечником. От больного к здоровому не передается. Чума же приобретает смертоносный характер.
В процессе эволюции чумной микроб выработал молекулярные способы выживания в организме блохи, которые гарантировали ему попадание в кровь теплокровного животного, где он размножается.
Вероятно, большую роль играет и внешняя среда, которая регулируют активность микроба, включает его адаптивные механизмы.
Ключевой фактор — температура. Особо вирулентным чумной микроб становится при 37 градусах. У блох температура тела 26 градусов, у крыс — 38-39, поэтому они быстрее заражаются и чаще гибнут. У человека в норме температура все-таки ниже 37 градусов.
Ученые считают, что возникновению современных вспышек чумы способствует глобальное потепление климата. Уничтожить полностью микроб мы не сможем, поскольку экологическая система, в которой он циркулирует очень сложна. Придется научиться сосуществовать с ним.
В 1990-х выдвинули идею, объясняющую, почему некоторые выживали при эпидемии «черной смерти». Ученые из Национального института изучения рака обратили внимание, что примерно 700 лет назад у людей стала распространяться мутация в гене, который регулирует рецептор CCR-5 на мембране клеток иммунной системы — именно за него цепляется ВИЧ, чтобы проникнуть внутрь. Если у человека CCR-5 выключен, он не заболеет СПИДом: вирусу не за что зацепиться. Возможно, эта мутация закрепилась у людей, выживших во время средневековой эпидемии чумы. Однако экспериментально это пока не подтверждено.
В поисках новых вакцин
Тех, кто живет в зоне природного очага чумы или работает с этим микробом в лаборатории, обязательно прививают.
В России, странах СНГ и Китае применяют живую вакцину на основе ослабленного штамма чумного микроба EV, созданную в 1930-е французскими учеными в отделении Института Пастера на Мадагаскаре. В прошлом году ею привили 19 тысяч человек в Алтайском крае.
У живой вакцины есть ряд ограничений: срок действия — максимум год, повторная прививка может быть неэффективной из-за все еще активного иммунитета. Возможны побочные эффекты, например аллергия. Кроме того, не исключено, что ослабленный микроб превратится в активный, хотя такого не случалось.
На Западе долгое время использовали вакцину USP, разработанную в США в 1940-е годы. Ею прививали, в частности, воевавших во Вьетнаме солдат. В 1990-е ее пришлось снять с производства из-за неэффективности при легочной форме чумы и побочных эффектов.
Сейчас в мире активно пытаются создать рекомбинантные вакцины без недостатков и ограничений живых. Используют различные антигены — белки, вырабатываемые бактерией для борьбы с защитной системой жертвы. Эти же молекулы формируют иммунитет против чумы. Такие разработки идут, например, ФИЦ вирусологии и микробиологии.
Перспективны синтетические вакцины на основе антигенов F1 и LcrV. Клинические испытания разных ее вариантов идут в Великобритании, Китае, США, а отечественная разработка ГНЦ прикладной микробиологии и биотехнологии в Оболенске уже получила регистрационное удостоверение и производится.
