Интерферон в неспецифическом иммунитете

Еще несколько месяцев назад мир не знал о существовании
вируса, который изменит жизнь более 7,5 миллиардов человек.
Сегодня ученые всего мира пытаются найти вакцину и действенное
лекарство для борьбы с пандемией. Однако постепенно ученые узнают
больше подробностей о новом вирусе. Так, стало известно, что
SARS-CoV-2 в некоторых случаях избегает иммунного ответа и
приостанавливает выработку важной молекулы — интерферона. Как
коронавирусу это удается? Объясняет иммунолог, академик
Арег Тотолян.
Арег Артемович Тотолян — директор
Санкт-Петербургского института эпидемиологии и микробиологии
имени Пастера, доктор медицинских наук, профессор, академик
РАН.
— Как вирус SARS-CoV-2 проникает в
клетку?
— Первая и основная клетка, в которую проникает вирус —
эпителиальная. Прежде всего, речь идет об эпителиальных клетках
верхних дыхательных путей. Ведь основные ворота для проникновения
вируса — это носоглотка и ротоглотка. При дальнейшем успешном
развитии инфекции поражаются средние и нижние дыхательные
системы.
В части случаев вирус поражает и другие органы и системы человека
— желудочно-кишечный тракт и почки. Об этом свидетельствует
соответствующая симптоматика — диарейный синдром и почечная
недостаточность.
Когда в январе 2020 году инфекция стала известна широкому кругу
специалистов, считалось, что единственный путь попадания вируса в
клетку осуществляется с помощью ангиотензинпревращающего фермента
— рецептора, получившего название ACE2. Но оказалось, что
существует второй рецептор, который выполняет функцию входных
ворот для вируса в клетку — CD147. Чем он примечателен?
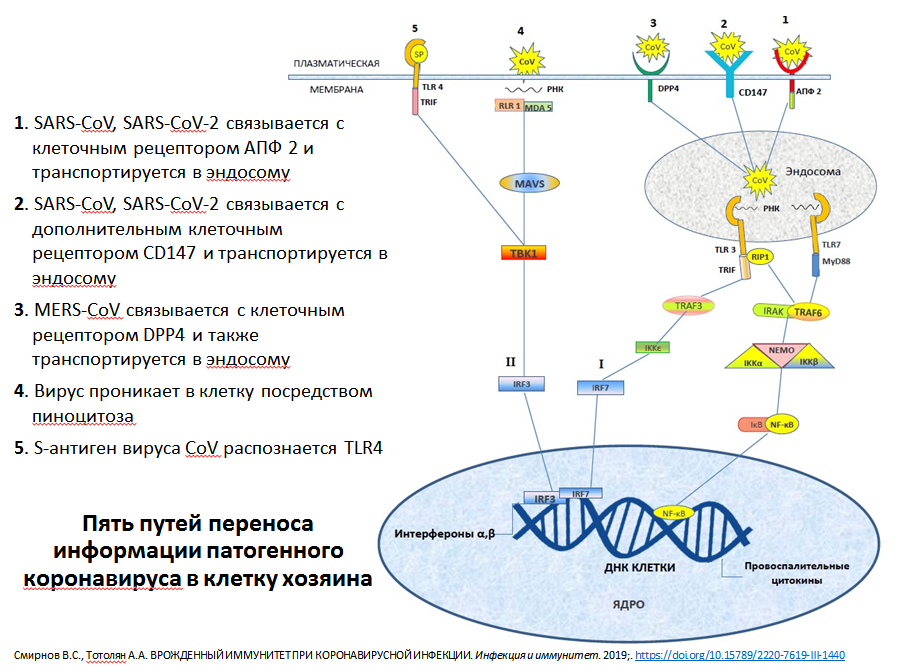
Схема путей переноса информации патогенного коронавируса в клетку хозяина. Из презентации А.А. Тотоляна
Этот белок располагается на поверхности или мембране клетки.
Против него уже существует моноклональное антитело — то есть
лекарственный препарат, который применяют при лечении некоторых
онкологических заболеваний. Поэтому в ряде зарубежных странах
были инициированы клинические исследования этого препарата как
возможного кандидата для лечения COVID-19. Исследования
продолжаются, но пока результатов нет. Если этот препарат
окажется эффективным, то это значительно упростит ситуацию, а
главное — сэкономит время.
Вернемся к вопросу. Вирус, проникая в клетку, запускает целый ряд
механизмов, которые приводят к развитию дефектов. Нормальная
клетка при проникновении чужеродного микроорганизма ведет себя
соответствующим образом. Одно из проявлений ее поведения связано
с выработкой интерферона.
— Что собой представляет интерферон и каково его
место в иммунной системе?
— Интерфероны — это семейство белковых молекул, которые
продуцируются различными клетками организма человека и
обеспечивают, в том числе, противовирусный иммунитет. При этом
интерфероны обладают неспецифической активностью, то есть
действуют не на возбудителя какого-то конкретного заболевания, а
на любые вирусные частицы в целом. На сегодняшний день известно
целое семейство интерферонов — 20 разных молекул, объединенных
одним названием.
Наиболее известными являются три интерферона: альфа, бета и
гамма. Об остальных говорить не буду. Даже если читатели запомнят
три указанных представителя семейства интерферонов, этого вполне
достаточно для общего понимания. Интерферон-альфа обладает
истинной противовирусной активностью, чуть слабее — интерферон
бета. Интерферон гамма напрямую не обладает противовирусной
активностью. У него другая функция — иммунорегулирующая. Он
принимает самое активное участие в регуляции иммунного ответа, во
взаимодействии врожденного и адаптивного иммунитета.
Поэтому, в первую очередь, нас интересует интерферон альфа. По
идее эпителиальные клетки должны были вырабатывать интерферон
альфа и гамма при встрече с коронавирусом. Но в отношении
интерферона альфа этого не происходит. Почему? Дело в том,
что у вируса SARS-CoV-2 есть определенные механизмы, с помощью
которых он подавляет не только продукцию интерферона, но и сам
синтез.
— Как ему это удается?
— Эти процессы происходят на молекулярном уровне. Они приводят к
дефекту эпителиальной клетки, после чего она не может
продуцировать интерферон альфа. Этот факт имеет множество
последствий для организма. Чтобы не допустить этого, специалисты
проводят заместительную терапию с помощью препаратов на основе
интерферона альфа, которые позволяют восполнить дефицит.
— Так мы помогаем иммунитету?
— Да, верно. Мы вводим интерферон извне, тем самым компенсируя
дефект, вызванный вирусом. Препараты на основе интерферона альфа
особенно должны быть эффективны на ранних этапах, пока инфекция
не спустилась в нижние отделы дыхательных путей.
А интерферон гамма, напротив, важен на поздних этапах, когда
инфекция сопровождается пневмонией и так называемым цитокиновым
штормом.
Дело в том, что клетки иммунной системы «общаются» между собой с
помощью самых разных молекул, которые называются цитокинами. В
ответ на инфекцию они, естественно, синтезируются более активно.
Поначалу эти молекулы выполняют защитную функцию, привлекая в
очаг воспаления всё больше иных молекул и клеток. Но наступает
момент, когда ситуация выходит из под контроля, и цитокины
продуцируются в огромном количестве, тем самым нанося вред самому
организму. И именно здесь важную роль играет интерферон гамма,
который как раз запускает синтез целого ряда цитокинов. Поэтому
целесообразно применять терапию с помощью антицитокиновых
препаратов, чтобы нормализовать этот процесс.
Если цитокинового шторма нет, применять препараты для
антицитокиновой терапии нельзя. Ведь так мы добьемся диаметрально
противоположного результата. Выключение любого нормально
функционирующего компонента иммунной системы приводит к развитию
иммуносупрессии — дефекта иммунной системы.
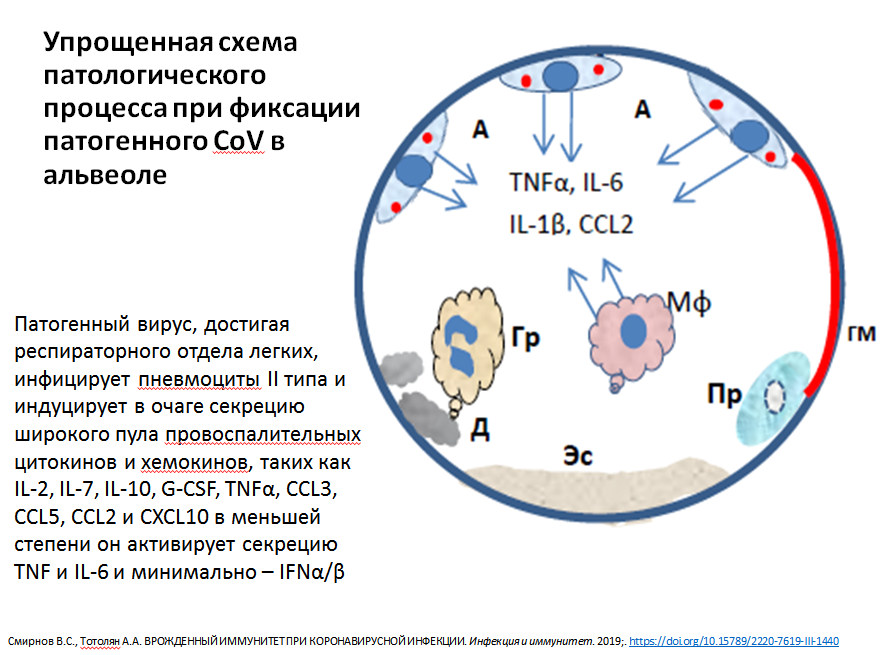
Схема патологического процесса при фиксации вируса в альвеоле. Из презентации А.А. Тотоляна
Другие схемы представлены в презентации академика
Арега Тотоляна.
— Давайте поговорим об особенностях протекания
болезни COVID-19. Почему она поражает именно легкие? Вирусу
комфортнее в этой среде или есть какие-то другие
объяснения?
— Просто вирусу проще попасть в организм через нос или рот, а
затем в легкие. А в ряде случаев, как я уже упоминал, он попадает
в желудочно-кишечный тракт.
Иммунная система очень многогранна и распространена по всему
организму, имея «представительства» практически во всех органах и
тканях. Если иммунная система желудочно-кишечного тракта не
справляется с ситуацией, значит, вирус с большей вероятностью там
поселится. Такая же ситуация обстоит с почками. Скажем, если
пациент страдает сахарным диабетом, то его почки также находятся
в поврежденном состоянии. Следовательно, вирус может задержаться
именно в почках.
— Сейчас многие научные коллективы ищут вакцину и
лекарство против нового коронавируса. На чем они будут
основаны?
— Начнем с вакцин. Сегодня как минимум 8 коллективов в России
занимаются разработкой вакцины. Если ее удастся создать, то она
поможет нам со второй волной пандемии. По разным оценкам, вирус
может приобрести сезонный характер.
Я не думаю, что мы успеем использовать вакцину в нынешней
ситуации. Скорее всего, пандемия завершится до того, как вакцина
получит путевку в жизнь. Это работа, прежде всего, на
перспективу. По сути, вакцина — это долгосрочная профилактика. Ее
появление позволит нам быстро сформировать иммунизированную
прослойку, которая будет защищать остальных.
Ведь мы не можем иммунизировать всех подряд. Существуют
определенные ограничения, которые не позволяют использовать одну
и ту же вакцину для всех. Есть также пациенты с иммунодефицитом,
приобретенным или врожденным. Для таких групп пациентов некоторые
вакцины просто противопоказаны. Именно поэтому 100%-я вакцинация
не достигается. Но она, по существу, и не нужна. Согласно теории
коллективного иммунитета, достаточно 70% населения с иммунитетом
к вирусу, чтобы избежать пандемии.
Если говорить о лечении, то наиболее эффективными специфичными
против вируса иммунопрепаратами должны стать терапевтические
моноклональные антитела — антитела, вырабатываемые иммунными
клетками, принадлежащими к одному клеточному клону, то есть
произошедшими из одной плазматической клетки-предшественницы.
Пока таких препаратов в нашем распоряжении нет, клиницисты идут
другим путем: переливают плазму реконвалесцентов, то есть
выздоравливающих людей. В крови выздоровевших имеются
специфические антитела. Их плазму крови вводят тем, кто наиболее
тяжело переносит заболевание.
— Какие препараты, разрабатываемые сегодня, будут
наиболее перспективными?
— На первое место я бы поставил терапевтические антитела.
Моноклональные антитела, как я уже говорил, это препараты,
которые обладают высокой селективностью в отношении молекулярной
мишени. Антитела обладают способностью точно связываться с
антигеном благодаря специальным антигенсвязывающим участкам,
имеющим к нему высокую специфичность. Это определяет
селективность лекарств на основе антител в отношении конкретной
мишени.
Вторые по значимости — пептиды, которые могут обладать
активностью против вируса. В своих исследованиях мы решили пойти
как раз по этому пути. Как нам кажется, результаты могут
оказаться весьма перспективными.
Это то, что касается перспектив иммунотерапии. Пациенты, особенно
с тяжелыми формами заболевания, получают самое разнообразное
лечение и в части применяемых препаратов, и в части медицинских
технологий. В этом вопросе «карты в руки» клиницистам, которые
непосредственно ведут этих пациентов, прежде всего,
реаниматологам и пульмонологам.
Интервью осуществлено при поддержке Министерства науки и
высшего образования РФ и Российской академии наук
Из всех вскрывшихся в результате пандемии COVID-19 проблем одна из самых масштабных – непонимание большинством пациентов, как работает иммунная система. Напуганные, уставшие сидеть дома люди пытаются выяснить, как повысить иммунитет против коронавируса SARS-CoV-2 и других инфекций. Что им сделать, чтобы эта проблема перестала их беспокоить?
Задача настоящего материала – обосновать, почему не стоит раззадоривать иммунитет (а то ведь может и получиться) и чем в действительности следует заниматься в период самоизоляции и после отмены ограничений для наилучшей иммунной защиты.

Вниманию коллег предлагаем некоторые данные, которые позволят дополнить профессиональный взгляд на проблему в следующих аспектах:
- механизмы противовирусного иммунитета,
- механизмы вирусных «уловок» против иммунитета,
- основные причины блокировки нормальной иммунной защиты.
Статья подготовлена по материалам ведущего российского иммунолога, невролога К. А. Шляпникова и сооснователя Академии UniProf врача-педиатра, нутрициолога, рефлексотерапевта И. Б. Юзуп.
Механизмы противовирусного иммунитета
Отличие вируса от большинства видов организмов в том, что он не способен к размножению вне чужой живой клетки. Вирусов известно много: Rabies Virus, Adenovirus, Ebola Virus, HIV, Hepatitis B и C, Papillomaviridae, Herpes Viridae, Influenza Virus и мн. др.
Они предпочитают разные клетки, атакуют нас по-разному, но всем им присуще нечто общее – структура жизненного цикла:
01Проникновение в клетку с помощью присоединения к какому-либо типу рецепторов,
02Транскрипция вирусной ДНК / РНК (в зависимости от вида вируса),
03Встраивание в клеточный аппарат репликации генома,
04Репликация вируса и его распространение за пределы клетки.
Врождённый иммунитет человека, формирующийся ещё до рождения, знает этот механизм. Ещё до первых контактов с патогенами мы имеем представление, как с ними бороться, и врождённые инструменты борьбы.
 Как неспецифический иммунитет борется с инфекциями?
Как неспецифический иммунитет борется с инфекциями?
В распоряжении неспецифического иммунитета имеются естественные клетки-киллеры, запрограммированные уничтожать всё, что не отвечает критерию биологической идентичности геному организма хозяина.
В течение жизни эти клетки занимаются проверкой каждой клетки, каждого микроорганизма, который они встречают. Чтобы пройти контроль, клетки предъявляют молекулярный «паспорт» – главный комплекс гистосовместимости (ГКГС). Считывая его, как штрихкод, киллер отпускает здоровую клеточку – на свободу с извинениями.

Такие проверяющие клетки не умеют определять, инфицирована клетка или нет. Но когда вирус проникает в клетку и встраивает чужеродный геном в её реплицирующий комплекс, ГКГС нарушается и клетка не проходит контроль. Киллер впрыскивает в неё ферменты клеточного «пищеварения» и разрушает, а её остатки, как и остатки вирусов, подъедают фагоциты.
При этом имеет место и иммунологическая толерантность, например, к компонентам нормального микробиома человека – при условии, что он найден в соответствующем месте. Так, кишечной палочке ничего не угрожает со стороны иммунитета хозяина в кишечнике, но, обнаружив её где-то ещё, клетка-киллер уничтожит эту бактерию как условный патоген. И будет права.
 Как работает специфический иммунитет человека?
Как работает специфический иммунитет человека?
Специфический, или адаптивный, иммунитет человека работает на распознавание инфекций. В том числе новых. Ещё до первого контакта с возбудителем, до появления первых заражённых клеток и запуска соответствующего сигналинга иммунные клетки могут распознать патоген по т. н. паттернам патогенности – молекулярным (чаще всего белковым) комплексам, которые свойственны в принципе – вирусам, в принципе – бактериям, в принципе – грибам и т. д.
Когда патоген проник и развернул атаку, специфический иммунитет приступает к сложному мероприятию по его улавливанию и обезвреживанию. В его распоряжении имеются альфа-, бета- и гамма-интерфероны, которые:
- тормозят репликацию ДНК и РНК в клетке, не давая вирусу размножаться,
- запускают апоптоз – самоубийство заражённой клетки на благо организма.
В момент проникновения вируса клетка распознаёт инфицирование и успевает вывесить на мембране «флажки», которые привлекут внимание Т-хелперов, Т-киллеров, В-лимфоцитов и другие войска специфического иммунитета.
Т-хелперы обеспечат исследование и запоминание патогена, В-лимфоциты займутся выработкой антител, которые обклеят (опсонизируют) вирусные фрагменты, сделав их неспособными к репликации. А фагоциты соберут остатки патогена и погибшей клетки. Затем «осколки» вируса затем попадут через кровь в лимфу, где отфильтруются в лимфоузлах и будут тщательно изучены. Затем молодым, т. н. наивным клеткам-лимфоцитам будут предъявлены антигены, и они смогут распознавать угрозы, которые «лично» никогда не встречали. Таким образом тренируется иммунная память.
 Что ещё делает интерфероновый сигналинг? Интерфероны присоединяются к оболочкам здоровых клеток, не давая вирусу присоединиться и проникнуть сквозь клеточную мембрану.
Что ещё делает интерфероновый сигналинг? Интерфероны присоединяются к оболочкам здоровых клеток, не давая вирусу присоединиться и проникнуть сквозь клеточную мембрану.
Они же разрешают общие провоспалительные реакции, которые сопровождаются хорошо знакомыми клиническими симптомами усталости, разбитого состояния, высокой температуры, ломоты в суставах, сонливости, мышечной боли и т. п.

Всё это говорит о том, что красный костный мозг получил чёткий, конкретный сигнал – продуцировать больше специальных, «профессиональных» клеток: моноцитов, дендритных клеток, лимфоцитов, лейкоцитов и др.
Повышенные лимфо- и лейкоциты мы увидим в общем анализе крови – если, конечно, сам вирус не вызывает лейкоцито— или лимфоцитопению, поразив органы и клетки иммунной системы.
Таким образом, интерфероны оказывают аутокринный, паракринный и эндокринный эффект. И это, с одной стороны, хорошо, а с другой не очень, потому что военную мощь нашего иммунитета вирусы учатся обманывать и даже обращать против нас. И со стимуляцией иммунного ответа следует быть очень аккуратными.
Вирусные уловки против иммунитета человека: как вирусы обходят иммунную защиту?
 На каждом этапе противовирусной защиты человека вирусы находят лазейки, чтобы эту защиту обойти. Как они это делают?
На каждом этапе противовирусной защиты человека вирусы находят лазейки, чтобы эту защиту обойти. Как они это делают?
Основных принципов борьбы с возбудителями вирусной инфекции у человеческого иммунитета два: это проверка гистосовместимости и целенаправленный поиск инфекций. Первое соответствует специфическому (врождённому) иммунитету, второе – неспецифическому (адаптивному).
К каждому из этих подходов вирусы пытаются найти ключик. В первом случае вирусы учатся отменять проверку ГКГС, чтобы заражённая клетка не попала под уничтожающий залп естественного киллера. На это, в частности, способны вирусы гепатита B и C, и именно поэтому их так трудно подавить.
Во втором случае вирусы проявляют больше фантазии:
- блокируют выработку интерферонов, препятствуя эффективному иммунному ответу,
- мутируют быстрее, чем Т-хелперы успевают собирать антигены и менять «ориентировки» В-лимфоцитов и Т-киллеров,
- подавляют функцию костного мозга – выработку лимфоцитов, моноцитов и др. иммунных клеток,
- провоцируют реакции иммунной гиперчувствительности.
О последнем хотелось бы остановиться чуть подробнее, поскольку именно с этим механизмом связано явление цитокинового шторма, который ассоциируют и с коронавирусом SARS-CoV-2 в том числе.
Всего типов реакций иммунной гиперчувствительности четыре: анафилактический, цитотоксический, иммунокомплексный и замедленного типа. Вирусы, как правило, вызывают реакции II и III типа, вплоть до тяжёлых жизнеугрожающих состояний.

Когда вирус предъявляет клеткам антигены, похожие на собственные антигены организма, то под перекрёстный огонь иммунитета, подогретого вирусной атакой, начинают попадать ни в чём не повинные клетки организма хозяина.
Наши же собственные клетки связываются противовирусными антигенами и уничтожаются в ходе дальнейшей реакции иммунного ответа. Это может стать дебютом хронического аутоиммунного процесса.
А может положить начало порочному кругу цитокинового шторма. Запустилось воспаление,→ произошёл выброс цитокинов, → те усилили воспаление, → оно спровоцировало ещё больший выброс цитокинов, и так либо до момента, пока не будет применена контролируемая иммуносупрессия, либо без лечения всё кончится летальным исходом.
При этом пациент погибает не от вирусной инфекции как таковой, а от разбушевавшегося иммунитета, который вышел из-под контроля и применил к организму тактику выжженной земли.
Также встречается антирецепторный вариант реакции иммунной гиперчувствительности II типа, когда антитела присоединяются к рецепторам клеток и блокируют определённые нейроэндокринные реакции.
Например, такую картину мы наблюдаем при тиреотоксикозе, когда антитела не дают тиреотропному гормону ингибировать функцию щитовидной железы, и начинается её неконтролируемый разгон. Сходная картина наблюдается при миастении.

Реакция III типа характеризуется присоединением больших иммунокомплексов IgG и IgM не к иммунным клеткам, а, например, к клеткам сосудов, после чего элиминируются с повреждением наших собственных тканей.
Чтобы подобных вещей не происходило, пациентам, конечно же, не следует заниматься попытками раззадорить и подбодрить иммунитет без наблюдения врача.
Даже пониженная функция иммунной системы не всегда указывает на необходимость иммуностимуляции. Порой с иммунитета просто нужно снять тормоза, навешанные нездоровым образом жизни пациента, чтобы система заработала нормально.
Для этого давайте разберёмся, на что уходят ресурсы иммунной системы. Чем она оказывается занята и какой ценой ей даётся приведение организма в порядок после наших отнюдь не человеколюбивых экспериментов над собой.
Блокировка иммунной защиты: что мешает иммунитету человека работать нормально?
Каждый мыслящий врач подтвердит: нет такого понятия, как сильный или слабый иммунитет. Есть норма и ненорма. Второе всегда плохо, как мы увидели на примере бесконтрольной реакции иммунного ответа, называемой гиперцитокинемией, или цитокиновым штормом.
Стремясь оптимизировать естественный противовирусный иммунитет, мы должны заниматься его нормализацией и проверять, нет ли в образе жизни – нашем или пациента – факторов, которые отвлекают иммунитет от его реальных задач: борьбы с генетически чужеродными элементами (инфекциями, раковыми клетками и т. д.).

Какие факторы чаще всего снижают и блокируют естественную иммунную защиту?
- Дефицит ночного сна и/или его низкое качество
- Избыток низкомолекулярных углеводов
- Антигенная перегрузка
- Продолжительные стрессы
- Алкогольная и иная интоксикация
Сразу оговорим: список не исчерпывающий, в него не включены врождённые иммунодефициты, иммуносупрессии, вызванные врачебным вмешательством и т. п. Это топ-5 самых распространённых причин истощения иммунной системы и некорректного иммунного ответа.

Почему дефицит глубокого ночного сна на первом месте? Потому что фаза глубокого сна в альфа-ритме – это то единственное время в сутках, когда иммунная система работает активнее. Связано это с аденозиновым сигналингом, который мы привыкли воспринимать в контексте энергетического обмена, но который также связан с иммунной системой.
Об этом факте пока не слишком хорошо известно в широких медицинских кругах, но тем не менее, аденозин активно нарабатывается в течение светового дня, и его уровень резко падает, когда мы переходим в фазу глубокого сна. Это сигнал к активации иммунных процессов. Если по какой-то причине уровень аденозина не опускается, иммунная система такого сигнала не получает. Это одна из причин, почему у людей, страдающих бессонницей, апноэ, расстройствами инициации засыпания
и другими инсомническими нарушениями, иммунитет серьёзно снижен.
 Почему избыток низкомолекулярных, или «быстрых», углеводов блокирует иммунитет человека?
Почему избыток низкомолекулярных, или «быстрых», углеводов блокирует иммунитет человека?
Потому что они провоцируют активный рост дрожжевой микрофлоры в различных средах организма, и существенный объём иммунных клеток оказывается брошен на подавление микробиома, вышедшей из под контроля.
Антигенная перегрузка – при продолжительном контакте с аллергенами, при хронических воспалениях, при использовании иммуностимуляторов (!) может возникнуть чрезмерная выработка антигенов B-лимфоцитами. И куда их, спрашивается, организму девать? Патоген уехал, маркеры остались: хорошо это или плохо?
Если слишком много, то плохо: запускается реакция иммунной гиперчувствительности III типа, опасность которой состоит ещё и в том, что она часто носит бессимптомный, скрытый для пациента характер.
Такую нагрузку вызывают не только вирусы, но и пища. В частности, это касается белков коровьего молока и бобов, глютена, кофеина, танинов, содержащихся в чае и кофе – целых кластеров привычных нам пищевых продуктов, которые нагружают иммунную систему, а пациент об этом не подозревает.

Несмотря на распространённое мнение, что алкоголь поддерживает иммунитет, это не так. Алкоголь препятствует переходу в фазу глубокого сна, поскольку вместо выработки иммунная система оказывается занята борьбой с метаболитами алкоголя – свободными радикалами, которые вызывают повреждения клеток и тот самый похмельный синдром по утрам.
Продолжительные стрессы как фактор снижения иммунитета непосредственно связаны с дефицитом глубокого сна. При этом по часам сон пациента может быть вполне нормальным, но его качество будет далёким от идеала.
Эволюционно поверхностный сон был необходим: если бы мы спали глубоко в условиях опасности, мы бы не выжили. Однако состояние тревожности, вызванное не смертельной угрозой, а какими-то иными причинами, ко времени сна необходимо стараться нейтрализовывать.

В этом помогут физические упражнения, позволяющие отработать гормоны стресса, выброшенные в кровь. Поможет фитотерапия, дыхательные практики, техники точечного массажа против бессонницы и другие мягкие методы терапевтического воздействия.


Получить полное практикоориентированное представление о том, как пациенту подружиться с иммунитетом, а врачу – эффективно использовать иммунологические знания в любом направлении клинической практики, можно в рамках интенсива «Коронный иммунитет».
Лекции читают ведущие российский иммунологи и спикеры Академии UniProf. Регистрируйтесь на обучение, получайте актуальные и необходимые экспертные знания, чтобы вести пациентов на принципиально новом профессиональном уровне.
